2. 拉瓦尔大学土壤与农业食品工程学院, 魁北克 拉瓦尔 G1V 0A6;
3. 加拿大农业与农业食品部魁北克研究与发展中心, 魁北克 拉瓦尔 G1V 2J3
2. Department of Soils and Agri-Food Engineering, Laval University, Laval Quebec G1V 0A6, Canada;
3. Quebec Research and Development Center, Agriculture and Agri-Food Canada, Laval Quebec, G1V 2J3, Canada
磷是各种生命活动所必需的营养元素之一,是植物生长代谢不可或缺的元素[1]。此外,磷肥是农业产量的重要保证,磷肥供应不足直接关系到世界粮食供应和地区安全稳定[2]。目前,磷肥主要来自磷矿。磷矿石开采后约有80%用于生产磷肥[3]。随着世界人口数量的持续增加,导致对粮食的需求不断增加。而要满足粮食需求,需要施入更多的肥料提高粮食产量。全球现存的磷储量可能在60a内枯竭[4]。因此,寻找一条能够实现磷循环利用的途径是十分必要的。
生活污水是一种高富含磷的资源。每立方生活污水中含有5~20g磷[5]。当前,污水处理厂主要采用生物除磷,也就是聚磷菌在厌氧阶段释放体内的磷和好氧阶段吸收污水中的磷,最终磷以污泥形式存在于微生物絮状体内[6]。据报道,约90%的生活污水中的磷最终转移到污泥中。由于污泥中含有有毒有害物质,污泥也不适合直接农用,这样就造成磷资源的严重浪费[7]。近年来,鸟粪石法回收污泥中的磷已经得到了广泛的研究[8-9]。但是回收磷的前提是需要将污泥中的磷以无机磷形式释放出来。国内外针对污泥中磷释放的研究主要集中在酸碱、加热和超声波预处理并结合厌氧和好氧环境下的磷释放等[10-11]。但是这些方法存在明显缺点:第一,由于试剂使用或者需要外部能源,成本较高;第二,污泥中磷释放周期过长。这些缺点严重制约了污泥中磷的大规模回收及利用。
研究发现,高浓度的游离氨能通过扩散作用进入细胞而导致细胞质子失衡和/或钾缺乏,进而引起污水中微生物细胞的破裂,使其体内的磷快速释放到水体中。研究表明,189.4mg N/L氨氮处理后的污泥上清液中的正磷酸盐质量浓度从15.1mg P/L上升到101.6mg P/L[12]。此外,提高污水的pH也能促进污泥中磷酸盐的释放[13]。水解尿液中含有大量的游离态氨氮,其pH也较高,约为9.3[14]。在污泥厌氧过程中添加微生物所需能源有利于污泥磷释放,例如添加葡萄糖给聚磷菌提供碳源,可极大提高聚磷菌细胞内磷酸盐的释放[15]。微波能提升厌氧污泥的温度,提高聚磷菌的活性,从而促进微生物体内磷酸盐的释放[10]。本研究比较3种不同处理方法(尿液、葡萄糖和超声波)对污泥中磷释放的影响,并考察鸟粪石沉淀法回收尿液处理后的污泥上清液中磷的可行性,研究结果可为研发低成本污泥磷回收技术提供依据。
1 材料与方法 1.1 污泥中磷释放实验实验所用尿液为脱磷尿液,即水解尿液经过鸟粪石沉淀法去除磷酸盐的尿液,其中采用氯化镁作为尿液脱磷剂,主要参数为:镁磷摩尔比为1.1:1、搅拌速度180r/min、沉淀时间30min。脱磷尿液的理化性质见表 1,其中pH为9.3,NH4-N质量浓度为4383mg N/L,PO3-P质量浓度为4.5mg P/L。实验所用城市污水取自北京市北小河污水处理厂初沉池。收集的污水储存于4℃冰箱中备用。污水的主要理化性质见表 1,其中pH为6.8。上清液中PO3-P和NH4-N质量浓度分别为12.4mg P/L和34.3mg N/L。污水总磷质量浓度为177.9mg P/L。
|
|
表 1 实验所用尿液和城市污水的理化性质 Table 1 Characteristics of urine and municipal sewage used in this study |
实验处理包括空白,尿液(尿液和污水体积比为0.2和0.4),葡萄糖(0.5g/L污水),以及微波(1min)。实验前,取20L污水,在搅拌速率为200r/min条件下,曝气5h。实验步骤如下:1)空白实验:取1L污水装入3L发酵罐(型号:BLBIO-XM 1~10L,上海百仑生物科技有限公司)并进行密封处理;2)微波处理:取1L污水,搅拌均匀后放入微波炉(型号:格兰仕G70D20CN1P-D2),微波加热1min。微波功率为200W。微波处理后的液体装入3L发酵罐并进行密封处理;3)葡萄糖:取1L污水,加入0.5g葡萄糖,随后装入3L发酵罐密封处理;4)尿液:取1L污水装入3L发酵罐,分别取0.2和0.4L脱磷尿液注入发酵罐。所有发酵罐搅拌速率均为200r/min,采样时间为1、2、4、8、12、16、20、30h。每个处理设4个重复。
1.2 鸟粪石沉淀实验将上述处理的污水,经转速4000r/min离心10min后取上清液,用于鸟粪石沉淀实验。以氯化镁溶液(浓度为1mol/L)为镁源,设置Mg/P摩尔比1.1:1,搅拌速率180r/min,反应30min。鸟粪石沉淀反应结束后静置10min,随后经过4000r/min离心,0.45μm滤膜(Whatman)过滤,收集上清液用于测定氮磷浓度。沉淀经48℃烘48h,用X射线衍射(XRD; X’Pert Pro PANalytical B.V., the Neterlands)和扫描电镜(SEM; S-4300, Hitachi, Japan)定性测定其化学组成和形态特征。
1.3 样品分析实验前,污水经过4000r/min离心10min后,分别测定上清液和沉淀污泥的理化性质。上清液经过0.45μm滤膜过滤后,滤液总氮采用过硫酸钾氧化-紫外分光光度法测定,水杨酸次氯酸钠光度法测定NH4-N, 无机磷含量采用钼蓝比色法测定,总磷采用ICP-OES(Leeman Prodigy, USA)测定[14]。污泥经过风干,磨碎,过1mm筛供分析。污泥总氮用凯氏定氮法测定,污泥中总磷采用钼蓝比色法测定[16]。污水总氮浓度计算方法如下(总磷浓度计算类似):
| $ \begin{array}{l} \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;总氮\left( {{\rm{mg}}/{\rm{L}}} \right) = \\ \frac{{上清液总氮浓度 \times 体积 + 污泥总氮浓度 \times 体积 }}{污水的总体积}。\end{array} $ |
实验前后所有水样经过0.45μm滤膜过滤后,总氮采用过硫酸钾氧化-紫外分光光度法测定,水杨酸次氯酸钠光度法测定水样中NH4-N, 无机磷含量采用钼蓝比色法测定。金属离子和总磷采用ICP-OES测定[17]。污泥磷的释放率计算如下:
| $ \begin{array}{l} \;\;\;\;\;\;\;\;\;\;\;\;\;污泥磷的释放率\left( \% \right) = \\ \frac{{反应前污泥中总磷 - 反应后污泥中的总磷}}{反应前污泥中总磷} \times 100\% 。\end{array} $ |
鸟粪石沉淀分析:取0.1g鸟粪石沉淀溶于50mL,1mol/L HCl溶液中。总氮采用过硫酸钾氧化-紫外分光光度法测定。总磷及金属离子采用ICP-OES测定。另外,鸟粪石沉淀经过烘干后,取少量(0.1g左右)用于XRD和SEM分析。XRD数据通过Jade 6.5物相分析定性测定沉淀的化学组成。采用SEM对沉淀物表面进行扫描测定沉淀物形态特征。本研究所用化学试剂,包括氯化镁和葡萄糖等,均为分析纯,购自北京化工厂。
1.4 数据处理与分析本研究中处理之间的差异显著性用SAS 9.4 Proc Mixed分析。图表分别用Sigmaplot 13.0和Office 2013制作。
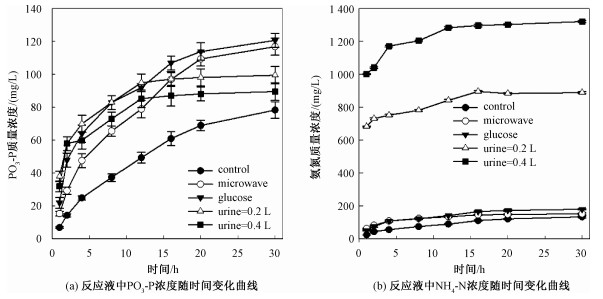
2 结果与讨论 2.1 不同处理对污泥中氮磷释放的影响研究发现,在厌氧过程的第1h内,所有处理下的反应液中磷酸盐的浓度相对于实验前略有降低(表 1和图 1),这是因为在实验前期,厌氧发酵罐中尚存空气,好氧微生物仍然发挥主要作用。随着实验的进行,反应液中磷酸盐浓度逐步增加(图 1)。在实验结束时,不同处理下的反应液中磷酸盐的浓度差异显著(p=0.03)。葡萄糖处理的反应液中磷酸盐质量浓度达到最大值120.75mg P/L,是空白处理的1.5倍,这主要和反应液中生物群落有很大关系[18]。一般情况,较高的氮浓度有助于中和厌氧细菌产生的各种挥发性酸,维持溶液pH的相对稳定,有益于细菌的生长。但是当氮浓度过高,会导致过量的氨氮形成,进而对微生物产生毒性作用[19]。微波处理相对于空白来说,也显著增加了污泥中磷的释放(p=0.03)。一方面,微波处理能够提高水溶液的温度,促使水溶液中微生物的活性;另一方面,微波处理能够促进污泥中蛋白质和碳水化合物的释放,这些有机物也是厌氧细菌的营养来源[20]。尿液处理同样促进了污泥中磷的释放,但是随着尿液量的增加,反应液中磷酸盐浓度在减小(图 1)。尿液能够促进污泥中磷释放主要归于两个方面原因:1)脱磷尿液的pH较高(表 1),尿液的加入提高了废水的pH值。高pH不仅能破坏污泥的絮体,还可能破坏微生物结构,进而分解微生物细胞的糖类,使氮磷释放出来[21-22];2)尿液的添加带入了大量的自由态氨氮。研究表明,无论是pH的增大还是自由态氨氮浓度的增加,都能够促成聚磷菌等生物体细胞破裂,进而使得细菌体内的磷酸盐释放到水体中[13]。相对于葡萄糖和微波处理,尿液处理后的溶液中磷酸盐浓度较低,这主要是由尿液稀释所引起的。在不同处理下,污泥磷释放率分别为(40.77±1.21)%(空白),(64.57±1.92)%(微波),(66.93±2.20)%(葡萄糖),(65.63±1.69)%(尿液0.2L),(68.78±1.51)%(尿液0.4L)。尿液处理下的污泥磷释放率高于葡萄糖和微波处理下的污泥磷释放率。
|
Download:
|
| control,空白;microwave,微波;glucose,葡萄糖;urine,尿液。 图 1 不同处理下的反应液中PO4-P和NH4-N的浓度 Fig. 1 Concentrations of phosphate and ammonium in reaction liquid with different treatments | |
随着厌氧的进行,不同处理方法均能使得反应液中氨氮浓度逐渐上升(图 1(b))。微波和葡萄糖处理相对于空白来说,氨氮增加幅度并不大,这些氨氮主要来自厌氧过程中污泥中含氮物质的释放[13]。但是尿液处理能够快速增加废水中氨氮的含量,主要是由脱磷尿液本身的高氨氮浓度引起的(表 1)。
2.2 不同处理对污泥上清液中金属离子的影响污水中金属离子含量是影响磷去除和回收的鸟粪石质量的重要因素。因此,本实验研究了不同处理对反应液中金属离子浓度的影响。经过30h厌氧发酵后,反应液中金属离子浓度见表 2。对比表 1中污水的离子浓度,单独的厌氧处理以及微波或者葡萄糖+厌氧均能增加反应液中金属离子浓度。在厌氧过程中,污泥中细菌的细胞分解,将使金属离子随着碳氮磷一起释放到上清液中[13]。在厌氧过程中,大量的挥发性脂肪酸释放到上清液,使得污水pH逐渐降低[23]。在这种情况下,从污泥中释放出来的离子很难再次沉淀到污泥中。尿液处理虽然也能使得污泥中细菌的细胞分解,将污泥中的金属离子释放出来,但是脱磷尿液的高pH值使得反应液的pH较高,这样释放到上清液的金属离子又和其他离子发生反应重新形成沉淀。另外,溶液中金属离子的浓度也与其对应的化合物的溶度积有关。例如,鸟粪石的溶度积常数为10-13.26[24],而磷酸钙和磷酸镉的溶度积常数为10-33 [25],这说明在磷酸盐充足的情况下,相对于镁离子而言,钙离子和镉离子更容易与磷酸根形成沉淀。
|
|
表 2 不同处理下的反应液中金属离子质量浓度 Table 2 Concentrations of metal ions in reaction liquids with different treatments |
以鸟粪石法回收上述不同处理下的反应液中磷的实验结果表明:空白、微波以及葡萄糖处理下的反应液加入氯化镁以后并没有明显的沉淀形成,可能是由于在厌氧过程中释放的挥发性脂肪酸降低溶液pH值,进而阻止了鸟粪石的形成[26]。但是,经过尿液处理的反应液加入氯化镁之后有明显的絮状沉淀产生。因此,在本研究中仅对尿液处理下的沉淀的化学组成和形态进行分析。结果显示:经过0.2和0.4L尿液处理的反应液的析出物中磷的含量分别为10.2%和11.8%,略低于纯净鸟粪石中磷的含量12.6%,这主要是因为在厌氧过程中注入了碱性尿液,提高了溶液的pH值(表 2)。再者,脱磷尿液中高浓度的氨氮也是一种缓冲液,阻止了污水厌氧过程中pH值的大幅度变化。研究指出,鸟粪石形成条件为碱性环境[26]。在这种情况下,经过尿液处理的反应液更适合鸟粪石的回收。对比两种不同比例的尿液处理后反应液的析出物SEM和XRD图(图 2),结果发现0.4L尿液处理后的析出物形状更加规则,杂质更少(表 3),这可能是0.4L尿液处理下的反应液的pH略高于0.2L尿液处理的反应液,较高的pH值有助于溶液中的磷以鸟粪石形式沉淀[14]。因此,用较高比例的脱磷尿液来处理厌氧污泥,能够促进污泥中磷酸盐快速释放到上清液中,并且在以鸟粪石法回收上清液中磷的过程中,析出的沉淀具有较高的纯度。因此,以鸟粪石法回收经过尿液处理后的厌氧污泥上清液中的磷是一种比较方便、环境友好的可行方法。

|
Download:
|
| 图 2 磷回收过程中析出物的特征 Fig. 2 Characteristics of the precipitates in the phosphorus recovery | |
|
|
表 3 尿液处理后污泥上清液析出物的化学组成 Table 3 Chemical composition of precipitation recovered from the sludge supernatant with urine treatment |
微波、葡萄糖以及尿液处理均能促进厌氧状态下污泥中磷的释放。尿液能快速促进污泥中磷的释放,主要是因为脱磷尿液具有较高pH和自由态氨氮浓度,能加快聚磷菌细胞的分解,使其体内的磷酸盐快速释放到水体中。
微波和葡萄糖处理后的污泥上清液加入氯化镁后没有明显沉淀形成,主要是由于厌氧过程导致溶液pH值过低。而尿液处理后的污泥上清液加入氯化镁后,形成了高质量的鸟粪石沉淀。因此,采用尿液处理厌氧污泥,随后以鸟粪石法回收污泥上清液中的磷是一种切实可行的污泥磷回收技术。
| [1] |
Ruttenberg K C. The global phosphorus cycle[J]. Treatise on Geochemistry, 2003, 8: 682. |
| [2] |
Dawson C J, Hilton J. Fertiliser availability in a resource-limited world:production and recycling of nitrogen and phosphorus[J]. Food Policy, 2011, 36(1): S14-S22. |
| [3] |
Ronteltap M. Phosphorus recovery from source-separated urine through the precipitation of struvite[D]. Zurich: Swiss Federal Institute of Technology Zurich, 2009.
|
| [4] |
Driver J, Lijmbach D, Steen I. Why recover phosphorus for recycling, and how?[J]. Environmental Technology, 1999, 20(7): 651-662. Doi:10.1080/09593332008616861 |
| [5] |
Li W W, Yu H Q, Rittmann B E. Chemistry:reuse water pollutants[J]. Nature News, 2015, 528: 29-31. Doi:10.1038/528029a |
| [6] |
Blackall L L, Crocetti G R, Saunders A M, et al. A review and update of the microbiology of enhanced biological phosphorus removal in wastewater treatment plants[J]. Antonie van Leeuwenhoek, 2002, 81: 681-691. Doi:10.1023/A:1020538429009 |
| [7] |
Balmér P. Phosphorus recovery:an overview of potentials and possibilities[J]. Water Science & Technology, 2004, 49: 185-190. |
| [8] |
Egle L, Rechberger H, Krampe J, et al. Phosphorus recovery from municipal wastewater:an integrated comparative technological, environmental and economic assessment of P recovery technologies[J]. Science of the Total Environment, 2016, 571: 522-542. Doi:10.1016/j.scitotenv.2016.07.019 |
| [9] |
Ye Y, Ngo H H, Guo W, et al. Insight into chemical phosphate recovery from municipal wastewater[J]. Science of the Total Environment, 2017, 576: 159-171. Doi:10.1016/j.scitotenv.2016.10.078 |
| [10] |
Liao P H, Wong W T, Lo K V. Release of phosphorus from sewage sludge using microwave technology[J]. Journal of Environmental Engineering and Science, 2005, 4(1): 77-81. Doi:10.1139/s04-056 |
| [11] |
Stark K, Plaza E, Hultman B. Phosphorus release from ash, dried sludge and sludge residue from supercritical water oxidation by acid or base[J]. Chemosphere, 2006, 62: 827-832. Doi:10.1016/j.chemosphere.2005.04.069 |
| [12] |
Belmonte M, Hsieh C F, Figueroa C, et al. Effect of free ammonia nitrogen on the methanogenic activity of swine wastewater[J]. Electronic Journal of Biotechnology, 2011, 14(3): 1-9. |
| [13] |
Xu Q, Liu X, Wang D, et al. Free ammonia-based pretreatment enhances phosphorus release and recovery from waste activated sludge[J]. Chemosphere, 2018, 213: 276-284. Doi:10.1016/j.chemosphere.2018.09.048 |
| [14] |
Wen G, Hu Z, Liu X, et al. Improvement of the quality of struvite crystals recovered from a mixture of human urine and municipal sewage via a novel two-step precipitation method[J]. Environmental Technology & Innovation, 2018, 12: 80-90. |
| [15] |
Gebremariam S Y, Beutel M W, Christian D, et al. Effects of glucose on the performance of enhanced biological phosphorus removal activated sludge enriched with acetate[J]. Bioresource Technology, 2012, 121: 19-24. Doi:10.1016/j.biortech.2012.06.086 |
| [16] |
Carter M R. Soil sampling and methods of analysis[M]. London: Lewis Publishers, 1993.
|
| [17] |
American Public Health Association. Standard methods for the examination of water and wastewater. 19th edition[M]. Washington DC: Water Environment Federation, 1998.
|
| [18] |
Hills D J. Effects of carbon:nitrogen ratio on anaerobic digestion of dairy manure[J]. Agricultural Wastes, 1979, 1(4): 267-278. Doi:10.1016/0141-4607(79)90011-8 |
| [19] |
Marchaim U. Biogas processes for sustainable development[M]. Rome: Food & Agriculture Organization (FAO) Rome, 1992.
|
| [20] |
Guo L, Li X M, Bo X, et al. Impacts of sterilization, microwave and ultrasonication pretreatment on hydrogen producing using waste sludge[J]. Bioresource Technology, 2008, 99(9): 3651-3658. Doi:10.1016/j.biortech.2007.07.026 |
| [21] |
Chen H Z, Wang H, Zhang A, et al. Biogasification of steam-exploded wheat straw by a two-phased digestion system[J]. Transactions of The Chinese Society of Agricultural Engineering, 2005, 21: 116-120. |
| [22] |
Neves L, Ribeiro R, Oliveira R, et al. Enhancement of methane production from barley waste[J]. Biomass and Bioenergy, 2006, 30: 599-603. Doi:10.1016/j.biombioe.2005.12.003 |
| [23] |
Wang D, Liu Y, Ngo H, et al. Approach of describing dynamic production of volatile fatty acids from sludge alkaline fermentation[J]. Bioresource Technology, 2017, 238: 343-351. Doi:10.1016/j.biortech.2017.04.054 |
| [24] |
Ohlinger K N, Young T M, Schroeder E D. Predicting struvite formation in digestion[J]. Water Research, 1998, 32: 3607-3614. Doi:10.1016/S0043-1354(98)00123-7 |
| [25] |
Hayne W M. CRC handbook of chemistry and physics:a ready-reference book of chemical and physical data[M]. 93rd ed. Boca Raton, Florida: CRC Press, 2012.
|
| [26] |
Doyle J D, Parsons S A. Struvite formation, control and recovery[J]. Water Research, 2002, 36: 3925-3940. Doi:10.1016/S0043-1354(02)00126-4 |
 2020, Vol. 37
2020, Vol. 37 


