随着全球工农业经济的高速发展,许多国家都面临着严峻的铬污染问题[1]。铬(Cr)及其化合物是金属加工、皮革制造、电镀等行业所必需的基本原料之一。这些涉Cr产业在作业过程中排放大量含铬废气、废水和废渣,导致大气、水体和土壤均不同程度地受到Cr的污染[2-3]。环境中Cr主要以Cr(Ⅲ)和Cr(Ⅵ)两种形态存在,其中Cr(Ⅵ)的毒性远高于Cr(Ⅲ),约是Cr(Ⅲ)毒性的100多倍[4-5]。同时Cr(Ⅵ)具有明显的致畸、致癌、致突变等危害。虽然近年来,国家严格管控产业“三废”的排放并投入大量资源进行污染治理,但是由于Cr污染具有长期性、潜在性和隐蔽性等特点,其污染问题仍不容小觑。在土壤中,Cr可以通过植物富集作用,经过食物链,最终可能累积到人体内,给人体造成严重危害[3, 6]。Cr污染会给动植物和人体带来很大的生态风险和健康风险[7],因此Cr已经成为许多国家和地区优先控制的污染物之一[8]。
蚯蚓慢性和急性毒性实验是最早开发和最为成熟的研究生态毒性的方法之一[9]。目前,关于Cr(Ⅲ)和Cr(Ⅵ)对蚯蚓的急性毒性影响研究居多[5, 10]。而在生态毒理研究中,许多研究者偏向采用新加入Cr的土壤模拟Cr污染,利用蚯蚓作为指示生物进行生态风险评价[11-12]。然而重金属在进入土壤这个复杂介质中后,其迁移转化会受到多种多样的物理和生化作用的影响,最后完成固-液分配以达到其吸附热力学平衡,因此其生物有效性和毒性可能会随时间延长而降低[8, 13-14]。因此老化作用获得的人工污染土壤的重金属生物有效性或毒性与田间污染土壤的生物有效性或毒性之间存在较大的差异[15]。
蚯蚓在受到污染物胁迫时,体内会被诱发产生大量的活性自由基,这会造成膜脂脱脂或膜脂过氧化,进而使其膜系统的结构和功能受到损伤[16]。而蚯蚓体内的抗氧化酶可以将蚯蚓体内的活性自由基转化为水和氧气,从而维持生物体内自由基的代谢平衡,进而可以增强其对污染物的抵抗能力[17]。其体内抗氧化酶主要包括:过氧化物酶(POD)、氧化氢酶(CAT)、超氧化物歧化酶(SOD)等。目前多数关于蚯蚓体内抗氧化酶的研究都侧重于土壤中不同重金属对其活性的影响[18-19],但关于土壤种类和不同Cr(Ⅵ)含量老化土壤对蚯蚓抗氧化酶系的影响研究缺乏系统性。
本研究以赤子爱胜蚓为受试生物,选取黑龙江、山西、江苏3个省份的土壤,并进行不同Cr(Ⅵ)污染浓度的一定时间的老化。探究在不同土壤及不同Cr(Ⅵ)含量老化土壤中,赤子爱胜蚓受污染物胁迫后其体内SOD、CAT和POD的活性变化。
1 材料和方法 1.1 蚯蚓饲养实验所用的蚯蚓是赤子爱胜蚓,购买自江苏省句容市某蚯蚓养殖基地。新购置的蚯蚓以牛粪作为饲养基质,于25 ℃、自然光照条件下进行饲养和繁殖。受试对象的选择标准是:500 mg左右、体色鲜亮、行为活跃、有明显生殖环。
1.2 土壤理化性质选取的黑龙江、江苏和山西3种土壤的pH值之间有显著差异,分别为5.8、7.4和8.4 (表 1);同时,有机质含量也有显著差异,其质量比分别为54.7、22.6和21.6 g·kg-1。
|
|
表 1 黑龙江、山西、江苏土壤理化性质 Table 1 Properties of the tested soils from Heilongjiang, Shanxi, and Jiangsu Provinces |
老化过程中,选择7个组进行,Cr(Ⅵ)添加量分别为0、10、20、30、50、70和140 mg·kg-1。先用K2Cr2O7配制成500 mg·kg-1的母液,然后将母液稀释成所需各种质量比的Cr(Ⅵ)溶液。然后量取50 mL的目标Cr(Ⅵ)溶液分别加入到500 g的干燥土壤中,充分混匀。随后用超纯水将土壤湿度调节至田间持水量的70%。最后将配置好的土壤移入1 L的一次性塑料盒中,每个塑料盒用注射器均匀扎孔50个以保证其透气性。同时,每天定时向土壤中喷洒定量超纯水以维持土壤湿度,老化40天。
1.4 抗氧化酶活性的测定将选取的受试蚯蚓分成10条一组,然后分别放于已老化土壤表面。待蚯蚓钻入土壤中后,在土壤表面撒上5 g燕麦片作为蚯蚓的食物,实验过程中,每周添加1次燕麦,并喷洒适量超纯水维持其湿度。然后将一次性塑料盒移入人工气候箱中,并设置光暗比16 h:8 h,光照强度600~1 000 lux、温度25 ℃、湿度75%。每组设置4个平行。
抗氧化酶活性测定:选取第1、7、14、28天实验的蚯蚓各2条,将蚯蚓清肠后称重,加入9倍蚯蚓的匀浆缓冲液(Tris 50 mmol·L-1,DTT 1 mmol·L-1,EDTA 1 mmol·L-1,蔗糖250 mmol·L-1,pH=7.6),快速将蚯蚓剪成数段。随后移入匀浆器进行匀浆,最后制成10%的组织匀浆液,于离心管中3 000 r·min-1离心10 min,提取上清液。以上操作均在4 ℃条件下进行,样品提取液需置于-20 ℃进行冷冻保存用于测蛋白质含量和抗氧化酶活性。
SOD、CAT、POD活性测定均采用上海茁彩生物科技有限公司的试剂盒,根据说明书进行操作。CAT活性的测定采用紫外分光光度法;SOD活性的测定采用黄嘌呤氧化酶法;POD活性采用可见光法[1]。
1.5 统计分析所有数据统计均采用SPSS 20.0、Sigma Plot 13.0和Excel 2016软件进行处理和分析。
2 结果与讨论 2.1 不同土壤对SOD活性影响赤子爱胜蚓体内SOD活性在不同理化性质的土壤中差异显著(P < 0.05) (图 1和表 2)。蚯蚓在黑龙江土中,其SOD活性显著低于在山西和江苏土壤中,这可能与土壤的理化性质有关。相对于山西和江苏土壤,黑龙江土壤偏酸性且有机质含量较高,与另外两种土壤有明显区别。土壤污染物毒性不仅与土壤固有的性质(pH、有机质含量、阳离子交换量等)有关,还受到污染时间、气候条件等因素的影响[15, 20]。土壤pH=6左右时,土壤中Cr(Ⅵ)主要以HCrO4-的形态存在,碱性土壤中Cr(Ⅵ)主要以CrO42-的形态存在[5],这可能是导致黑龙江土壤中蚯蚓SOD活性低于山西和江苏土壤的主要原因。

|
Download:
|
| 图 1 Cr(Ⅵ)对赤子爱胜蚓体内SOD活性的影响 Fig. 1 Effect of Cr(Ⅵ) on SOD activity of E. fetida | |
|
|
表 2 显著性差异分析结果 Table 2 Results of the significance analysis |
不同Cr(Ⅵ)含量对蚯蚓SOD活性影响差异极显著(P < 0.01) (图 1和表 2)。SOD活性在不同土壤内均呈现先逐渐上升然后缓慢下降最终趋于平缓的趋势。由于Cr是生物必需的微量元素之一,在低Cr(Ⅵ)环境中,外源添加Cr(Ⅵ)可以补充赤子爱胜蚓体内的缺失,从而促进蚯蚓的生长发育[21]。在高Cr(Ⅵ)污染土壤中,高浓度的Cr(Ⅵ)会引起蚯蚓体内蛋白质变性,同时会造成核酸、核蛋白沉淀,体内酶系统也会受到干扰,最终导致蚯蚓中毒[22]。不同暴露时间对蚯蚓SOD活性影响差异极显著(P < 0.01)。蚯蚓暴露于黑龙江老化土壤初期(1周左右),其抗氧化酶活性变化差异不显著。暴露1 d和7 d的蚯蚓体内SOD活性随Cr(Ⅵ)质量比增大而逐渐增加随后趋于平衡,平衡时SOD含量约为1 100 U·g-1,其活性大约为对照组活性的1.1倍。随暴露时间增加至14 d (图 1(c)),SOD含量在Cr(Ⅵ)质量比为50 mg·kg-1时出现显著增加,为1 150 U·g-1左右,其活性大约为对照组的1.25倍。当暴露28 d (图 1(d))时,SOD含量降低至1 000 U·g-1左右,其活性与对照组中SOD活性无显著差异。暴露初期时,污染胁迫突然增加,蚯蚓会产生较多的SOD酶以应对污染胁迫。随着暴露时间的延长,蚯蚓体内产生金属螯合蛋白[23],从而减少了Cr(Ⅵ)的毒性。当蚯蚓暴露于山西老化土壤时,蚯蚓体内的SOD活性趋于平衡。暴露期间,所有处理与对照组比较,均无显著差异。这表明SOD对山西土壤中Cr(Ⅵ)不敏感,Cr(Ⅵ)质量比低于140 mg·kg-1的老化土壤对蚯蚓体内SOD没有产生显著影响。蚯蚓暴露于老化江苏土壤1~7 d时,蚯蚓体内SOD活性随Cr(Ⅵ)质量比升高先呈现逐渐升高的趋势。在Cr(Ⅵ)质量比为30 mg·kg-1处理中SOD活性最高,其含量为1 400 U·g-1左右,随后SOD活性降低,其含量为940 U·g-1左右,这大约为对照组的67.14%。然后SOD活性逐渐升高最终达到平衡,其含量为1 400 U·g-1左右,这一数值与对照组含量差异不显著。SOD能在没有小分子电子传递基质的情况下,催化超氧离子自由基O2-·与H+发生歧化反应生成过氧化氢与氧气,从而清除O2-·[24]。但当蚯蚓体内O2-·含量远远超过SOD的歧化能力时,多种细胞功能被破坏,细胞生理代谢受到影响,从而导致SOD活力下降[25]。
2.2 不同土壤中蚯蚓体内CAT活性变化赤子爱胜蚓体内CAT活性在不同类型土壤中差异显著(P < 0.05) (图 2和表 2)。黑龙江土壤中CAT活性明显低于山西和江苏土壤中CAT活性,这一现象在暴露时间长的实验组中更为明显。暴露时间和Cr(Ⅵ)含量对CAT活性影响差异极显著(P < 0.01) (图 2和表 2)。黑龙江老化土中,当蚯蚓暴露于老化土壤28 d (图 2(d))时,蚯蚓体内CAT活性逐渐趋于平衡,平衡含量为589 U·g-1左右,与对照组中无显著差异。在1~28 d暴露期间,CAT活性没有表现出显著的变化,这说明低于140 mg·kg-1的Cr(Ⅵ)老化土壤对CAT没有产生显著影响。在山西老化土中暴露1~28 d时,蚯蚓体内CAT基本随土壤中Cr(Ⅵ)质量比升高而逐渐升高。在50 mg·kg-1 Cr(Ⅵ)老化的土壤实验组中,CAT活性达到最高,约为对照组的1.35倍;140 mg·kg-1实验组中CAT活性约为对照组的1.17倍。在江苏老化土中,蚯蚓体内的CAT活性基本处于稳定状态。暴露期间内,所有处理组与对照组比较,均无显著差异。这表明CAT活性对老化土壤中Cr(Ⅵ)不敏感,低于140 mg·kg-1的Cr(Ⅵ)老化土壤对蚯蚓体内CAT活性没有产生显著影响。
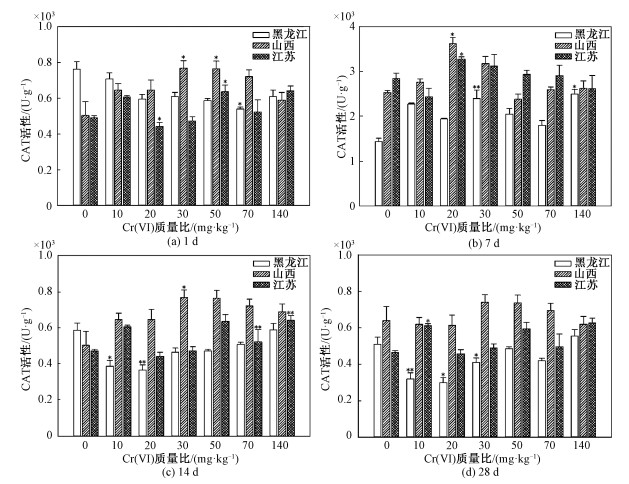
|
Download:
|
| 图 2 Cr(Ⅵ)对赤子爱胜蚓体内CAT活性的影响 Fig. 2 Effect of Cr(Ⅵ) on CAT activity of E. fetida | |
赤子爱胜蚓体内POD活性在不同类型土壤中差异极显著(P < 0.01) (图 3和表 2);在不同Cr(Ⅵ)含量土壤中差异显著(P < 0.05),不同暴露时间对蚯蚓体内POD活性影响差异极显著(P < 0.01) (图 3和表 2)。通过分析,在黑龙江土中,当蚯蚓暴露于老化土壤中1~7 d时,蚯蚓体内抗氧化酶活性差异不显著。暴露1 d和7 d的蚯蚓体内POD活性随Cr(Ⅵ)质量比增大而逐渐增加随后趋于平衡,平衡时POD含量约为2 800 U·g-1,其活性大约为对照组活性的2.12倍。随暴露时间增加至14 d (图 3(c)),POD在Cr(Ⅵ)质量比为30 mg·kg-1时出现大幅度波动,其含量降为1 700 U·g-1左右,其活性大约为对照组活性的1.29倍。随后,当暴露时间为28 d (图 3(d))时,POD含量逐渐增加为2 500 U·g-1,其活性大约为对照组中POD活性的2.03倍。
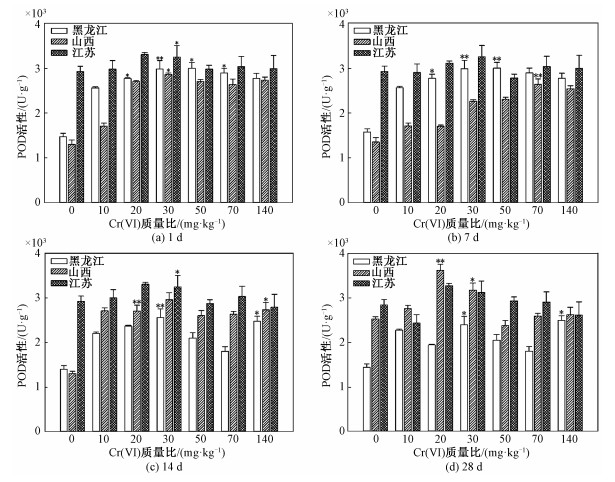
|
Download:
|
| 图 3 Cr(Ⅵ)对赤子爱胜蚓体内POD活性的影响 Fig. 3 Effect of Cr(Ⅵ) on POD activity of E. fetida | |
山西老化土中,当蚯蚓暴露于老化土壤中1 d (图 3(a))时,随Cr(Ⅵ)质量比增大,蚯蚓体内POD活性逐渐增加,在Cr(Ⅵ)质量比为50 mg·kg-1的实验组中,蚯蚓体内POD含量大约为2 900 U·g-1,大约为对照组POD浓度的2.20倍,随后蚯蚓体内POD含量逐渐达到平衡。当蚯蚓暴露于老化土壤中7 d时,随Cr(Ⅵ)质量比增大,蚯蚓体内POD活性逐渐增加,最终在Cr(Ⅵ)质量比为70 mg·kg-1之后达到平衡,平衡含量为2 500 U·g-1左右。当蚯蚓暴露于老化土壤中14 d (图 3(c))时,随Cr(Ⅵ)质量比增大,蚯蚓体内POD活性逐渐增加,最终在Cr(Ⅵ)质量比为50 mg·kg-1之后达到平衡,平衡含量为2 600 U·g-1左右。当蚯蚓暴露于老化土壤中28 d (图 3(d))时,随Cr(Ⅵ)质量比增大,蚯蚓体内POD活性呈现先上升后下降最终趋于平衡的状态,平衡状态时POD活性大约为对照组的2.11倍。环境污染物诱发蚯蚓体内产生大量的活性氧自由基[23, 26],随后蚯蚓体内产生大量的POD等抗氧化酶清除过多的自由基[27-28],以减轻污染物对生物体的损害。其中,H2O2在POD的作用下可以转化为H2O和O2。
图 3中,当蚯蚓暴露于江苏老化土壤1、7、14 d时,总体上,蚯蚓体内POD活性随土壤中Cr(Ⅵ)质量比升高呈现先升高后降低随后逐渐平衡的趋势。POD活性在Cr(Ⅵ)质量比为20~30 mg·kg-1时最高,大约为3 300 U·g-1,是对照组的1.14倍。平衡时POD含量大约为2 800 U·g-1,与对照组相当,差异不显著。而当蚯蚓暴露于江苏老化土壤28 d时,在Cr(Ⅵ)质量比为10 mg·kg-1实验组中,POD含量最低,为2 300 U·g-1左右,占对照组的79.3%。
3 结论1) SOD活性在不同类型土壤中差异显著(P < 0.05);在不同Cr(Ⅵ)含量土壤中差异极显著(P < 0.01);不同暴露时间内,其活性差异极显著(P < 0.01)。由于黑龙江土壤理化性质与山西、江苏土壤的差异性,黑龙江老化土中SOD活性明显低于其余两种土中SOD活性。黑龙江老化土与江苏老化土暴露过程中,暴露初期,SOD活性显著升高,随着暴露时间的延迟,其酶活均受到显著抑制。
2) CAT活性在不同类型土壤中差异显著(P < 0.05),CAT活性在不同Cr(Ⅵ)含量和不同暴露时间中差异极显著(P < 0.01)。CAT活性在山西老化土中随暴露时间和Cr(Ⅵ)含量变化明显。所以,此实验结果可以为山西铬污染土壤的生物标志物选择提供依据。
3) POD活性在不同类型土壤中差异极显著(P < 0.01);在不同Cr(Ⅵ)含量土壤中差异显著(P < 0.05);在不同暴露时间的处理中差异极显著(P < 0.01)。POD活性随着暴露时间的延迟和Cr(Ⅵ)含量变化在3种土壤中均发生显著变化。
| [1] |
王婉华, 陈丽红, 方征, 等. 土壤铬(Ⅵ)对赤子爱胜蚓的生态毒性效应[J]. 环境科学研究, 2013, 26(6): 653-657. |
| [2] |
COLEMAN R N. Chromium toxicity: effects on microorganisms with special reference to the soil matrix[M]//NRIAGU J O, NIEBOERE. Chromiun in natural and human environments. New York: Wiley-Interscience, 1988: 335-350.
|
| [3] |
Richard F C, Bourg A C M. Aqueous geochemistry of chromium:a review[J]. Water Research, 1991, 25(7): 807-816. Doi:10.1016/0043-1354(91)90160-R |
| [4] |
Athalye V V, Ramachandran V, D'souza T J. Influence of chelating agents on plant uptake of 51 Cr, 210 Pb and 210 Po[J]. Environmental Pollution, 1995, 89(1): 47-53. |
| [5] |
Sivakumar S, Subbhuraam C V. Toxicity of chromium(Ⅲ) and chromium(Ⅵ) to the earthworm Eisenia fetida[J]. Ecotoxicology and Environmental Safety, 2005, 62(1): 93-98. |
| [6] |
Molnar L, Fischer E, Kállay M. Laboratory studies on the effect, uptake and distribution of chromium in Eisenia foetida (Annelida, Oligochaeta)[J]. Zoologischer Anzeiger, 1989, 223: 57-66. |
| [7] |
Bruus P M, Van Gestel C A. Toxicity of copper to the collembolan Folsomia fimetaria in relation to the age of soil contamination[J]. Ecotoxicology and Environmental Safety, 2001, 49(1): 54-59. |
| [8] |
Smolders E, Oorts K, Sprang P V, et al. Toxicity of trace metals in soil as affected by soil type and aging after contamination:using calibrated bioavailability models to set ecological soil standards[J]. Environmental Toxicology and Chemistry, 2010, 28(8): 1633-1642. |
| [9] |
Pan L Q, Ren J, Liu J. Responses of antioxidant systems and LPO level to benzo(a)pyrene and benzo(k)fluoranthene in the haemolymph of the scallop Chlamys ferrari[J]. Environmental Pollution, 2006, 141(3): 443-451. |
| [10] |
Soni R. Stress-induced enhancement of reproduction in earthworm exposed to chromium (ⅵ) and mercury (ⅱ)-implications in environmental management[J]. Internjenvironstudies, 1983, 22(1): 43-47. |
| [11] |
Arillo A, Melodia F. Reduction of hexavalent chromium by the earthworm Eisenia foetida (savigny)[J]. Ecotoxicology and Environmental Safety, 1991, 21(1): 92. Doi:10.1016/0147-6513(91)90011-D |
| [12] |
Fent K. Ecotoxicological problems associated with contaminated sites[J]. Toxicology Letters, 2003, 140(7): 353-365. |
| [13] |
Ma Y B, Uren N C. Effect of aging on the availability of zinc added to a calcareous clay soil[J]. Nutrient Cycling in Agroecosystems, 2006, 76(1): 11-18. Doi:10.1007/s10705-006-9036-8 |
| [14] |
Oorts K, Ghesquiere U, Smolders E. Leaching and aging decrease nickel toxicity to soil microbial processes in soils freshly spiked with nickel chloride[J]. Environmental Toxicology and Chemistry, 2010, 26(6): 1130-1138. |
| [15] |
Lock K, Janssen C R. Test designs to assess the influence of soil characteristics on the toxicity of copper and lead to the oligochaete enchytraeus albidus[J]. Ecotoxicology, 2001, 10(3): 137-144. |
| [16] |
Khan A G. Relationships between chromium biomagnification ratio, accumulation factor, and mycorrhizae in plants growing on tannery effluent-polluted soil[J]. Environment International, 2001, 26(5/6): 417-423. |
| [17] |
Król E, Krejpcio Z. Chromium(Ⅲ) propionate complex supplementation improves carbohydrate metabolism in insulin-resistance rat model[J]. Food and Chemical Toxicology (An International Journal Published for the British Industrial Biological Research Association), 2010, 48(10): 2791-2796. Doi:10.1016/j.fct.2010.07.008 |
| [18] |
伍曼娇, 吴湘江, 罗能, 等. 原子吸收法测定污泥蚯蚓中的镉、铜、铬、锌、铅[J]. 化学分析计量, 2008, 17(1): 55-56. Doi:10.3969/j.issn.1008-6145.2008.01.018 |
| [19] |
易鹏, 勾昕, 樊云龙, 等. 施肥与接种蚯蚓对农田土壤中镉、铬、铜、铅元素的影响[J]. 贵州师范学院学报, 2015, 31(12): 26-31. Doi:10.3969/j.issn.1674-7798.2015.12.008 |
| [20] |
Beyer W N, Cromartie E J. A survey of Pb, Cu, Zn, Cd, Cr, As, and Se in earthworms and soil from diverse sites[J]. Environmental Monitoring and Assessment, 1987, 8(1): 27. |
| [21] |
Blankenship L J, Manning F C R, Orenstein J M, et al. Apoptosis is the mode of cell death caused by carcinogenic chromium[J]. Toxicology and Applied Pharmacology, 1994, 126(1): 75. Doi:10.1006/taap.1994.1092 |
| [22] |
D'agostini F, Izzotti A, Bennicelli C, et al. Induction of apoptosis in the lung but not in the liver of rats receiving intra-tracheal instillations of chromium(Ⅵ)[J]. Carcinogenesis, 2002, 23(4): 587. Doi:10.1093/carcin/23.4.587 |
| [23] |
Son Y O, Hitron J A, Wang X, et al. Cr(Ⅵ) induces mitochondrial-mediated and caspase-dependent apoptosis through reactive oxygen species-mediated p53 activation in JB6 Cl41 cells[J]. Toxicology and Applied Pharmacology, 2010, 245(2): 226-235. Doi:10.1016/j.taap.2010.03.004 |
| [24] |
Baran S, Bielinska J E, Oleszczuk P. Enzymatic activity in an airfield soil polluted with polycyclic aromatic hydrocarbons[J]. Geoderma, 2004, 118(3/4): 221-232. |
| [25] |
窦晶晶. Cd、Cr单一及复合污染对赤子爱胜蚓的毒理研究[D].陕西咸阳: 西北农林科技大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10712-1015333725.htm
|
| [26] |
Bagchi D, Hassoun E A, Bagchi M, et al. Chromium-induced excretion of urinary lipid metabolites, DNA damage, nitric oxide production, and generation of reactive oxygen species in Sprague-Dawley rats[J]. Comparative Biochemistry and Physiology Part C:Pharmacology, Toxicology and Endocrinology, 1995, 110(2): 177-187. Doi:10.1016/0742-8413(94)00093-P |
| [27] |
Farber J L. Mechanisms of cell injury by activated oxygen species[J]. Environmental Health Perspectives, 1994, 102(Suppl 10): 17-24. Doi:10.1289/ehp.94102s1017 |
| [28] |
Tang C F, Liu Y G, Zeng G M, et al. Effects of exogenous spermidine on antioxidant system responses of Typha latifolia L. under Cd2+ stress[J]. Journal of Integrative Plant Biology, 2005, 47(4): 428-434. Doi:10.1111/j.1744-7909.2005.00074.x |
 2020, Vol. 37
2020, Vol. 37 


