癌症是现代人类健康的头号威胁之一,据统计,全国2013年新发恶性肿瘤病例约368.2万例,死亡222.9万例,0~74岁累积发病率为21.60%,累积死亡率为12.33%[1]。目前癌症治疗的主要手段依次是手术、放疗和化疗,然而这些传统的治疗方法面临诸多问题,如:癌症的复发与转移,耐药与耐辐照,副作用严重等等[2]。而随着纳米技术的发展,纳米材料由于其独特的生物效应为肿瘤治疗提供了新的工具,许多利用纳米材料增强传统肿瘤治疗效果的研究引起科学家与医疗工作者广泛的关注。
贵金属纳米材料(如:金[3-4],银[5-6],铂[7],钯[8]等)由于其具有制备方法成熟、易于表面修饰、生物相容性良好以及表面等离子体共振[9]等特性,是纳米材料领域研究最为深入的材料之一。相对于最为常见的纳米金,最近有研究表明,纳米银在与兆伏级X射线作用时对神经胶质瘤具有更强的杀伤能力[5],另有研究证实其对放疗主要的增敏方式是产生ROS并诱导癌细胞自噬[6]。铋基纳米材料由于具有较好的X射线与红外线吸收能力以及良好的生物安全性,是新兴的生物纳米材料之一。众多研究工作表明,硫化铋[10-11]、硒化铋[12-13]、硫铋铜[14-15]等一系列纳米材料都具有一定的光热治疗与放疗增敏作用。
至今有关AgBiS2纳米材料的研究报道较少,且主要方向为热电转换[16]与光伏电池材料[17-18]。本文首次将AgBiS2作为一种生物纳米材料进行研究,探索其在光热治疗、放射治疗以及活体成像中的应用。我们制备了经聚乙二醇单油酸酯(OA-PEG)修饰的水溶性AgBiS2纳米颗粒,并研究其:1)细胞层次的生物安全性;2)将808 nm光转化为热杀伤癌细胞;3)与X射线作用产生ROS与DNA损伤;4)作为光声成像与CT成像造影剂的能力。证明PEG修饰的AgBiS2纳米颗粒在光热治疗、放射治疗与活体成像领域具有一定的研究价值与应用前景。
1 材料与方法 1.1 PEG修饰的AgBiS2纳米颗粒的制备与表征采用经改良的热注入法[19]制备溶于有机相的AgBiS2纳米颗粒:取0.5 mmol乙酸银,15 mL油胺,四氟乙烯包裹的磁力搅拌子加入烧瓶中,在氩气鼓泡下,缓慢加热至180 ℃,保持30 min,溶液颜色逐渐从黄色透明到深红色不透明,取样发现生成大量的Ag纳米颗粒;降温至120 ℃,加入0.5 mmol乙酸铋,保持30 min;加热至180 ℃,迅速将5 mL,0.3 mmol/mL的S单质油胺溶液注入到液面下,保持1 h,冷却至室温。用乙醇洗涤3次,分散在环己烷中。
AgBiS2纳米颗粒修饰PEG:取5 mL约10 mg/mL的AgBiS2环己烷溶液,加入50 mg聚乙二醇单油酸酯(polyethylene glycol mono oleate),超声振荡30 min,80 ℃水浴加热,待环己烷基本挥发干净后加入10 mL去离子水与搅拌子,继续挥发12 h,离心取沉淀,使用去离子水洗涤3次,得到PEG修饰的AgBiS2纳米颗粒,简称:PEG-ABS。
材料表征:PEG-ABS的基本形貌使用JEOL, JEM-2100Plus透射电镜进行拍摄,加速电压为200 kV;水合粒径分布由Malvern, Zetasizer Nano-ZS90激光粒度仪测得;物相表征使用Rigaku, D/max-2500 X射线粉末衍射仪,以铜靶Kα为辐射源(λ=0.154 18 nm),扫描速率为4(°)/min;紫外漫反射吸收光谱由Agilent, Cary5 000分光光度计,使用积分球进行测量;红外光谱由Bruker, EQUINOX55傅里叶变换红外光谱仪,采用KBr压片法进行测量。
1.2 材料的光热性能PEG-ABS的光热性能参考Roper[20]的方法,各取1 mL不同浓度的PEG-ABS水溶液于比色皿中,比色皿盖玻璃片,放置在塑料泡沫上,从上方照射808 nm激光,功率为1 W/cm2,使用Thermal CAM, FLIR E40热成像仪,每10 s记录一次溶液温度的平均值。本文实验中所有的808 nm光源均使用Connet, VLSM-800-B-060激光器,并用Thorlabs, PM310D-S310C功率计校准。
1.3 细胞活力与光热杀伤细胞活力的测定:取对数生长期的HUVEC或BEL-7402细胞,以每孔10 000的密度种植在96孔板中,培养24 h,加入不同浓度的PEG-ABS培养基溶液(n=6),继续培养24 h,PBS洗3次,加入10% CCK-8,避光孵育2 h,离心取上清,使用Thermo Multiskan MK3酶标仪测量其在450 nm处的吸光度。
光热杀伤测定:取对数生长期的BEL-7402细胞,以20 000/孔的密度种植在48孔板上互不相邻的6个孔中,培养24 h,加入不同浓度的PEG-ABS培养基溶液(n=6),继续培养12 h,PBS洗2次,使用0.5 W/cm2的808 nm光照射10 min或不使用光照(n=3),换液,继续培养12 h,PBS洗2次,加入10% CCK-8,避光孵育2 h,离心取上清,使用Thermo Multiskan MK3酶标仪测量其在450 nm处的吸光度。
1.4 细胞平板克隆实验取对数生长期的BEL-7402细胞,以每孔2 000的密度种植在4块6孔板上,分为8组(n=3):(a)control组(b)ABS(c)X-ray 0.5 min(d)X-ray 0.5 min+ABS(e)X-ray 1 min(f)X-ray 1 min+ABS(g)X-ray 2 min(h)X-ray 2 min+ABS,培养24 h后,加入50 μg/mL的PEG-ABS或完全培养基,孵育12 h后照射X-ray(50 kV, 25 μA),PBS小心洗2次,加入完全培养基,10 d后,使用4%多聚甲醛室温下固定15 min,使用PBS洗3次,用10%Giemsa染色液染色。本文实验中所有X-ray均由AMPTEK, Mini-X-OEM X-ray tube产生。
1.5 ROS水平检测与DNA损伤观察体外ROS水平检测:将10 μL, 10 μmol/L的DCFH-DA的DMSO溶液与40 μL, 0.01 mol/L的氢氧化钠溶液在避光的条件下反应30 min,加入200 μL的PBS (25 mmol/L, pH=7.2)终止反应。将50 μg/mL的PEG-ABS与人工水解生成的DCFH溶液混合,X-ray (50 kV, 75 μA)照射10 min,使用荧光分光光度计Horiba,Fluorolog-3测量其在480 nm激发下525 nm处发射光的荧光光强度。
细胞内ROS水平检测:在6孔板中以200 000/孔的密度种植4孔BEL-7402细胞,分为4组:(a)control (b)PEG-ABS (c)X-ray (d) PEG-ABS+X-ray,培养24 h,加入50 μg/mL的PEG-ABS的培养基溶液或完全培养基,孵育12 h后,用PBS洗去多余材料,每孔加入1 mL以无血清培养基稀释1000倍的DCFH-DA,浓度为10 μmol/L,在37 ℃培养箱中避光孵育30 min,使用PBS清洗2遍,加入无血清培养基,在X-ray(50 kV, 75 μA)照射10 min。使用胰蛋白酶将细胞消化,4 ℃离心重悬在1 mLPBS溶液中,保存在冰上使用BD, Accuri C6流式细胞仪,每组上10 000个细胞测荧光强度分布。
细胞DNA损伤观察:将BEL-7402细胞以50 000/孔的密度种植在4个放置了细胞爬片的6孔板中,分为8组:(a)control组(b)ABS(c)NIR(d)X-ray(e)ABS+NIR(f)ABS+X-ray(g)ABS+NIR+X-ray(h)ABS+X-ray+NIR(n=3),培养24 h,加入50 μg/mL的PEG-ABS的培养基溶液或完全培养基,孵育12 h后,用PBS洗去多余材料,加入无血清培养基照射808 nm光(1 W/cm2,10 min)或X-ray(50 kV,75 μA,10 min),3 h后用4%多聚甲醛进行固定15 min,PBS清洗,加入triton-X 100处理10 min,PBS清洗。加入200 μL 1:1 000稀释后的兔源抗磷酸化组蛋白γ-H2AX单克隆抗体一抗,4 ℃过夜,回收一抗,PBS清洗,加入1:1 000稀释的Cy3标记的二抗,室温孵育1 h,PBS清洗,最后使用Hoechest-33342在室温条件下对细胞核进行染色,5 min后用PBS清洗,将细胞爬片小心取出,使用Nikon A1 confocal显微镜分别对细胞核与DNA损伤进行观察。
1.6 光声成像与CT成像光声成像实验使用iTheraMedical, MOST invision光声成像仪,对经尾静脉注射200 μL, 15 mg/mL PEG-ABS的小白鼠在不同时间点进行全身扫描。CT成像实验使用PerkinElmer, Quantum GX micro CT Imaging System小动物活体CT成像仪,对经灌胃500 μL, 20 mg/mL PEG-ABS的小白鼠在不同时间点,用CT成像系统分3段对小鼠全身进行成像。
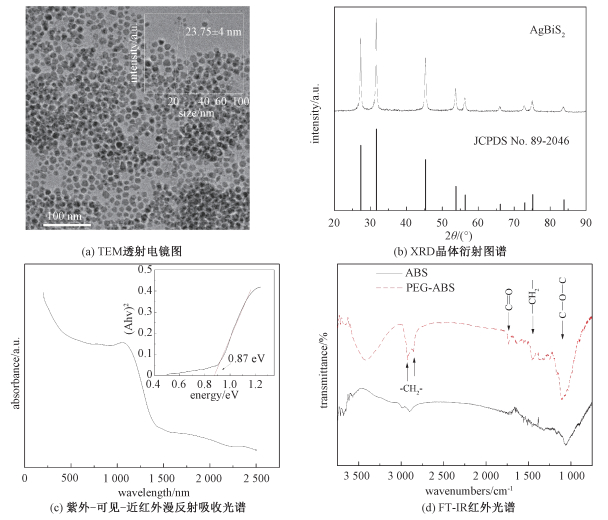
2 结果与讨论 2.1 修饰硫铋银纳米颗粒表征从透射电镜照片(图 1(a))可以看出,经PEG修饰后的AgBiS2纳米颗粒几乎为球形,统计得到粒径为(10.9±2.8) nm较为均一且分散性良好。图 1(a)中的插图为其DLS水合粒径统计图,由于表面吸附的原因粒径为(23.75±4) nm,合理增大约1倍。其X射线衍射图谱(图 1(b))与编号为89-2046的PDF卡片完全吻合,说明其为纯相的AgBiS2,没有Ag、Ag2S、Bi2S3等杂质。值得注意的是在第一步反应中产生的Ag纳米颗粒已经完全消失,说明Ag纳米颗粒作为反应物参与了反应。
|
Download:
|
| (a)中插图为动态光散射水合粒径分布图;(c)中插图为Tauc piot。 图 1 PEG-ABS纳米颗粒的表征结果 Fig. 1 Characterization of PEG-ABS nanoparticle | |
从漫反射光谱(图 1(c))可以看出其对800~1 100 nm的近红外光具有较为强烈的吸收,预示了对近红外光的转化能力,做Tauc plot得禁带宽度为0.87 eV,与文献[19]报道的0.9 eV基本一致。对比PEG修饰前后AgBiS2纳米颗粒的红外光谱(图 1(d)),修饰后明显增强的有C-O-C伸缩振动(1 110 cm-1)、-CH2-的对称和反对称伸缩振动(2 855和2 925 cm-1),另外增强较弱的有脂肪酸脂C=O的伸缩振动(1 734 cm-1)与烷烃的弯曲振动(1 465 cm-1),表明聚乙二醇单油酸酯(OA-PEG)已被成功地修饰到AgBiS2纳米颗粒表面上。
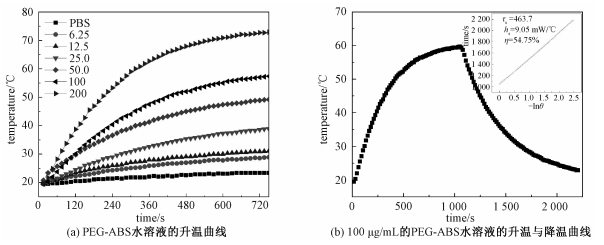
2.2 材料的光热转换性能为了研究PEG-ABS的光热转化性能,测量不同浓度的PEG-ABS水溶液(6.25, 12.5, 25, 50, 100, 200 μg/mL)在1 W/cm2的808 nm激光的照射下的温度变化情况(图 2(a)),从图中可以看出其中50 μg/mL的PEG-ABS溶液最高温度已经达到51.8 ℃,满足热消融治疗要求(大于50 ℃)。
|
Download:
|
| (b)中插图为由降温曲线拟合的T-(-lnθ)直线,其斜率为体系的特征时间常数τs。 图 2 PEG-ABS纳米颗粒的光热性能测试结果 Fig. 2 Photothermal properties of PEG-ABS | |
参考Roper的方法[20]由100 μg/mL的PEG-ABS升降温曲线(图 2(b))计算PEG-ABS对808 nm光的光热转换效率η
| $ \eta =\frac{{{h}_{\text{s}}}\left( {{T}_{\max }}-{{T}_{\text{amb}}} \right)-{{Q}_{\text{dis}}}}{I\left( 1-{{10}^{-{{A}_{808}}}} \right)}, $ |
引入温度驱动力θ
| $ \theta =\frac{T-{{T}_{\text{amb }}}}{{{T}_{\text{max }}}-{{T}_{\text{amb }}}}, $ |
与特征时间常数τs
| $ {{\tau }_{\text{s}}}=\frac{\sum{_{i}{{m}_{i}}}{{C}_{\text{p}, i}}}{{{h}_{\text{s}}}}, $ |
在降温过程中有
| $ t=-{{\tau }_{\text{s}}}\text{In}\theta . $ |
对降温曲线进行转化,Tmax为最大升温,Tamb为环境温度,拟合直线得到体系的特征时间常数τs=463.7,通过计算得到体系的传热系数hS=9.05 mW/℃,代入体系最大温度Tmax与纯溶剂的产热Qdis最终算得材料对于808 nm光的光热转换效率为54.75%。
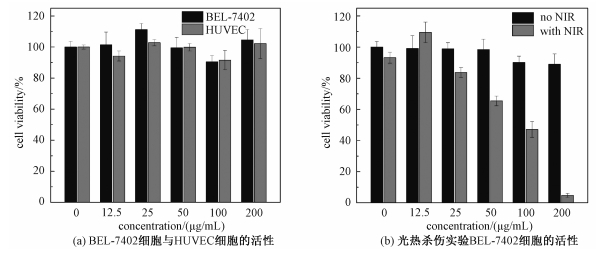
2.3 细胞层次的光热治疗效果在PEG-ABS纳米材料进一步应用于生物治疗前,首先需要对其生物安全性进行测试。试验采用标准的CCK-8试剂盒,选用不同浓度的PEG-ABS纳米颗粒对HUVEC与BEL-7 402两种细胞进行细胞毒性测试。评估结果如图 3(a)所示,两种细胞与最大浓度为200 μg/mL的PEG-ABS共孵育24 h后存活率仍维持在较高水平,表明PEG-ABS具有较低的生物毒性,在一定的剂量范围内可以用于生物治疗与成像的实验。
|
Download:
|
| 图 3 细胞活力与光热杀伤数据 Fig. 3 Cytotoxicity and photothermal therapy data | |
在测试材料对BEL-7402肝癌细胞的光热杀伤能力时,将BEL-7402细胞与同浓度PEG-ABS孵育12 h后,洗去未摄入的材料,以0.5 W/cm2的功率密度照射808 nm近红外光10 min,继续培养12 h以待光热杀伤的效果显现,使用CCK-8试剂盒测试其细胞活力。从图 3(b)中可以看出当有近红外光照射时,细胞的存活率随材料浓度的增加而显著降低,100 μg/mL的材料可使癌细胞死亡50%,而在材料浓度为200 μg/mL时,细胞几乎全部死亡,表明PEG-ABS纳米材料在近红外光的照射下对肿瘤细胞具有一定的光热杀伤能力,可以作为一种潜在的光热治疗增敏剂。
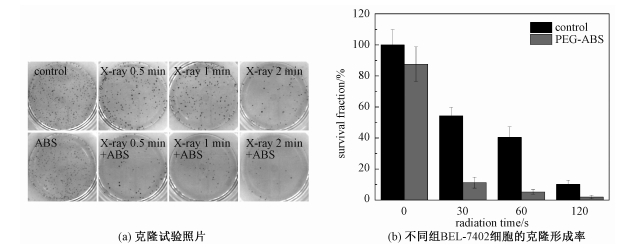
2.4 细胞层次的放疗增敏效果使用平板细胞克隆形成试验,测试PEG-ABS纳米材料在细胞水平上的放疗增敏效果,结果如图 4所示。使用X-ray tube分别对6孔板内密度为2 000/孔的BEL-7402细胞进行30, 60, 120 s的照射,10 d后细胞的克隆形成率随辐照时间的增加明显降低,分别为54.3%,40.5%和10.2%。而当细胞与50 μg/mL的PEG-ABS孵育12 h后再接受相同时间与强度的X射线的照射时,克隆的形成率分别降到11.3%,5.26%和1.99%,且未经照射的PEG-ABS组的克隆形成率为87.6%。从试验数据可以看出,单纯放射治疗组需要120 s的辐射使细胞克隆形成率降低到约10%,而在PEG-ABS的作用下,只需要30 s即可达到几乎相同的效果,所需时间缩短了3/4。这意味着,当PEG-ABS存在时只需使用较低的辐射剂量,即可达到与较高辐射剂量相同的治疗效果。表明PEG-ABS纳米材料具有一定的放疗增敏效果。
|
Download:
|
| 图 4 平板克隆形成试验结果 Fig. 4 Results of clone assay | |
为了解释PEG-ABS纳米材料的放疗增敏效果,我们评估了PEG-ABS纳米材料在X射线照射下产生ROS的能力与对DNA的损伤情况。
体外实验首先需要将DCFH-DA水解,水解后的DCFH-DA会形成DCFH,而DCFH可以与ROS反应生成DCF从而发出荧光。将水解后的DCFH-DA探针与50 μg/mL的PEG-ABS混合,在X射线照射后测量其荧光强度。从图 5(a)可以看出,未经X射线照射的PEG-ABS的荧光强度与control组几乎一致,而经过X射线照射的PEG-ABS溶液与X射线照射过的PBS相比,前者的荧光强度几乎为后者的2倍。说明PEG-ABS在X射线的照射下有增加ROS生成的能力。
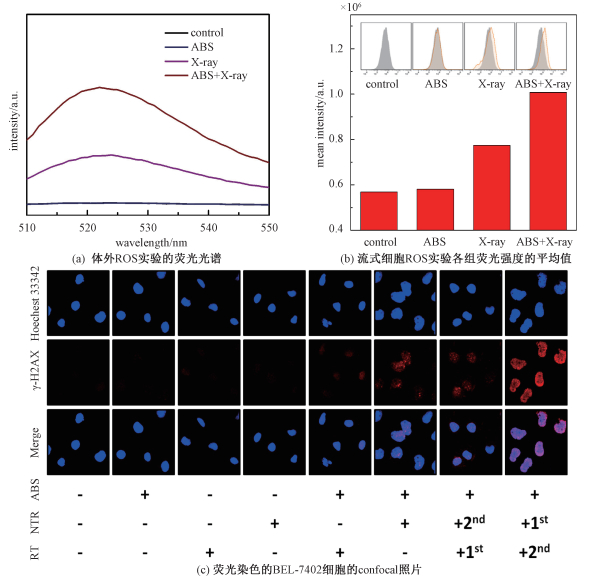
|
Download:
|
| (b)中插图为各组的荧光强度分布。 图 5 ROS水平测试与DNA损伤confocal显微镜观察 Fig. 5 ROS level test and DNA damage observation by confocal microscope | |
我们进一步在细胞内证明了这种效果,将DCFH-DA荧光探针装载入与PEG-ABS孵育12 h后的BEL-7402细胞,对其进行X射线辐照后,使用流式细胞仪对细胞荧光强度的分布进行测量。从图 5(b)的统计结果可以看出,在PEG-ABS存在时接受X射线辐照的细胞的平均荧光强度为control组的2倍,其平均荧光强度的增加量是单纯的X射线组的2倍。由此可见PEG-ABS可以提高癌细胞接受X射线时的ROS水平,从而增强X射线对癌细胞的损伤。
通常高能量的射线对细胞产生杀伤作用的靶点主要DNA分子,磷酸化的H2AX(γ-H2AX)是细胞DNA双链损伤或断裂的一个关键标志物,通过对其进行免疫荧光染色,利用confocal荧光倒置显微镜成像,可以简单地判断DNA双链的损伤程度。如图 5(c)所示,其红色焦点越多,代表DNA损伤的越严重。从图中可以看出对照组、单独材料组与单纯红外线(NIR)组没有明显的DNA损伤,少量的DNA损伤出现在单纯X射线组,而在材料加X-ray组观察到较为明显的DNA损伤,说明纳米材料可以增加X-ray对DNA的损伤效果。当存在PEG-ABS时依次使用NIR加X射线或X射线加NIR处理细胞,DNA损伤可进一步增多,特别是在先使用NIR照射后进行X-ray照射时DNA损伤极大加剧。由此表明PEG-ABS纳米材料可以增加X射线对癌细胞DNA的损伤,并可以结合热疗与放疗进一步增强对癌细胞的杀伤,且先进行热疗后进行放疗的效果更加明显,而其原因还有待进一步研究。
2.6 小鼠光声与CT成像对通过尾静脉注射PEG-ABS的小白鼠进行全身光声成像(图 6(a)),从图中可以看到明显的PEG-ABS光声信号,信号主要集中在肝组织附近,且在注射180 min时达到最强随后逐渐降低,8 h后信号几乎完全消失,说明材料主要通过肝代谢途径排出小鼠体外。

|
Download:
|
| 图 6 小鼠成像数据 Fig. 6 Mouse imaging data | |
图 6(b)为小鼠灌胃注射PEG-ABS后的全身CT成像图,可以看到小鼠体内产生明显的CT信号。通过灌胃的方式可以较为清晰地看出小鼠的胃肠道结构,特别是对于传统胃肠道造影剂难以显示的小肠结构有着较好的成像能力。在270 min时PEG-ABS已经代谢至大肠形成粪便,而在小肠与胃中没有信号残留,说明PEG-ABS具有良好的胃肠道代谢能力。
3 结论本文通过实验证明:1)使用聚乙二醇-单油酸酯修饰的AgBiS2纳米颗粒具有一定的生物安全性,在200 μg/mL时细胞毒性依然较低;2)其对808 nm光的光热转换效率为54.75%,在细胞层次具有一定增强光热治疗的能力;3)在X射线的照射下,该材料可以有效地提高细胞内外的ROS水平,对DNA造成更多的损伤,从而抑制癌细胞的增殖,实现放疗增敏;4)其增强光声成像与CT信号的能力。
综上所述,AgBiS2纳米材料作为一种新兴的纳米材料被首次应用于生物医疗领域,其在光热治疗、放射治疗与活体成像方面均展现出良好的性能,具有一定的研究价值与应用潜力。
| [1] |
陈万青, 郑荣寿, 张思维, 等. 2013年中国恶性肿瘤发病和死亡分[J]. 中国肿瘤, 2017, 26(1): 1-7. |
| [2] |
Kirkwood M K. The state of cancer care in America, 2017:a report by the American Society of Clinical Oncology[J]. Journal of Oncology Practice, 2017, 13(4): E353. Doi:10.1200/JOP.2016.020743 |
| [3] |
Jokerst J V, Thangaraj M, Kempen P J, et al. Photoacoustic imaging of mesenchymal stem cells in living mice via silica-coated gold nanorods[J]. ACS Nano, 2012, 6(7): 5920-5930. Doi:10.1021/nn302042y |
| [4] |
Alkilany A M, Thompson L B, Boulos S P, et al. Gold nanorods:their potential for photothermal therapeutics and drug delivery, tempered by the complexity of their biological interactions[J]. Advanced Drug Delivery Reviews, 2012, 64(2): 190-199. Doi:10.1016/j.addr.2011.03.005 |
| [5] |
Liu P, Jin H, Gu N, et al. Silver nanoparticles outperform gold nanoparticles in radiosensitizing U251 cells in vitro and in an intracranial mouse model of glioma[J]. International Journal of Nanomedicine, 2016, 11: 5003-5013. Doi:10.2147/IJN.S115473 |
| [6] |
Wu H, Lin J, Gu N, et al. Reactive oxygen species acts as executor in radiation enhancement and autophagy inducing by AgNPs[J]. Biomaterials, 2016, 101: 1-9. Doi:10.1016/j.biomaterials.2016.05.031 |
| [7] |
Tang S T, Shen H W, Hao Y X, et al. A novel cytosensor based on Pt@Ag nanoflowers and AuNPs/Acetylene black for ultrasensitive and highly specific detection of circulating tumor cells[J]. Biosensors & Bioelectronics, 2018, 104: 72-78. |
| [8] |
Tang S, Huang X, Zheng N. Silica coating improves the efficacy of Pd nanosheets for photothermal therapy of cancer cells using near infrared laser[J]. Chemical communications, 2011, 47(13): 3948-3950. Doi:10.1039/c1cc10451a |
| [9] |
El-Sayed M A. Some interesting properties of metals confined in time and nanometer space of different shapes[J]. Accounts of Chemical Research, 2001, 34(4): 257-264. Doi:10.1021/ar960016n |
| [10] |
Wang Y, Wu Y, Liu Y, et al. BSA-mediated synthesis of bismuth sulfide nanotheranostic agents for tumor multimodal imaging and thermoradiotherapy[J]. Advanced Functional Materials, 2016, 26(29): 5335-5344. Doi:10.1002/adfm.201601341 |
| [11] |
Ai K L, Liu Y L, Liu J H, et al. Large-scale synthesis of Bi2S3 nanodots as a contrast agent for In vivo X-ray computed tomography imaging[J]. Advanced Materials, 2011, 23(42): 4886-4891. Doi:10.1002/adma.201103289 |
| [12] |
Du J F, Gu Z J, Zhao Y L, et al. Poly (vinylpyrollidone) and selenocysteine modified Bi2Se3 nanoparticles enhance radiotherapy effacacy in tumor and promote radioprotection in normal tissues[J]. Advanced Materials, 2017, 29(34): 10. |
| [13] |
Mao F X, Wen L, Sun C X, et al. Ultrasmall biocompatible Bi2Se3 nanodots for multimodal imaging-guided synergistic radiophotothermal therapy against cancer[J]. ACS Nano, 2016, 10(12): 11145-11155. Doi:10.1021/acsnano.6b06067 |
| [14] |
Du J F, Zheng X P, Zhao Y L, et al. Design of TPGS-functionalized Cu3BiS3 nanocrystals with strong absorption in the second near-infrared window forradiation therapy enhancement[J]. Nanoscale, 2017, 9(24): 8229-8239. Doi:10.1039/C7NR02213A |
| [15] |
Li A, Li X, Yu X J, et al. Synergistic thermoradiotherapy based on PEGylated Cu3BiS3 ternary semiconductor nanorods with strong absorption in the second near-infrared window[J]. Biomaterials, 2017, 112: 164-175. Doi:10.1016/j.biomaterials.2016.10.024 |
| [16] |
Guin S N, Biswas K. Cation disorder and bond anharmonicity optimize the thermoelectric properties in kinetically stabilized rocksalt AgBiS2 nanocrystals[J]. Chemisty of Materials, 2013, 25(15): 3225-3231. Doi:10.1021/cm401630d |
| [17] |
Huang P C, Yang W C, Lee M W. AgBiS2 semiconductor-sensitized solar cells[J]. Journal of Physical Chemistry C, 2013, 117(36): 18308-18314. Doi:10.1021/jp4046337 |
| [18] |
Liang N, Ch en, W L, Dai F. Homogenously hexagonal prismatic AgBiS2 nanocrystals:controlled synthesis and application in quantum dot-sensitized solar cells[J]. Crystengcomm, 2015, 17(9): 1902-1905. Doi:10.1039/C4CE02405B |
| [19] |
Chen C, Qiu X D, Ji S L. The synthesis of monodispersed AgBiS2 quantum dots with a giant dielectric constant[J]. Crystengcomm, 2013, 15(38): 7644-7648. Doi:10.1039/c3ce41304g |
| [20] |
Roper D K, Ahn W, Hoepfner M. Microscale heat transfer transduced by surfac plasmon resonant gold nanoparticles[J]. Journal of Physical Chemistry C, 2007, 111(9): 3636-3641. Doi:10.1021/jp064341w |
 2019, Vol. 36
2019, Vol. 36 


