有机发光材料在化学生物学、材料科学以及光电传感等领域具有广泛的应用[1-5]。就传统有机发光材料而言,一般在较稀的溶液下具有较强的荧光发射,但在浓溶液或者固体状态时易发生聚集发光淬灭(aggregation-caused quenching, ACQ效应)[6]。而有机电致发光器件所用发光材料通常以薄膜的形式存在,这就常常导致荧光淬灭现象的发生,进而限制了其在诸多领域中的应用。虽然研究人员在材料设计、器件结构等方面做了大量工作以提高发光效率,但是分子之间的相互聚集是自发且不可避免的,因此开发一类在聚集态或固态下发光增强的有机发光材料是一种有效的解决方式。
2001年,唐本忠课题组[7]发现一种具有聚集诱导发光(aggregation-induced emission,AIE)效应的化合物,彻底解决了化合物在高浓度或者固态下导致的荧光淬灭现象。随后大量课题组研究这一现象并提出多种可能的AIE材料机理,包括分子内运动受限[8-10]、非紧密堆积[11-12]、分子内共平面以及形成J-聚集体[13]。目前,常见的具有AIE的分子主要有硅杂环戊二烯类[14]、四苯乙烯类[15]以及芴酮[16]类衍生物,种类并不多。因此,发现一种新型的、高效的具有AIE效应的材料成为研究人员关注的焦点。
芳香低聚酰胺折叠体一般可通过分子内氢键和芳香环的重叠堆积折叠成非常稳定的螺旋结构,它除了在生物分子模拟上的应用[17],在分子识别、药物传输、分子机器及电荷传输等方面也具有应用价值[18],但对于这类折叠体分子的发光性质还很少被研究报道。
本文设计合成两种溴苯封端且含喹啉单元的芳香低聚酰胺螺旋折叠体分子,并对其聚集荧光增强性质和机理进行研究。
1 实验部分 1.1 仪器和试剂所用实验药品均由安耐吉公司购买,药品纯度均为98%,包括对苯二甲酸单甲酯、草酰氯、氢氧化钾、对溴苯甲酸、偶氮二甲酸二异丙酯、三苯基膦、环己烷、二甲基乙炔二羧酸酯、氢氧化钠、2-硝基苯胺、异丁醇、正己醇、Pd/C(10%负载于碳)、偏钒氨酸、草酸铵、三乙胺、Ni(DPPP)Cl2(99%)。
所用实验试剂均由国药公司购买。二氯甲烷经氢化钙回流24h后,在氮气保护下常压蒸馏精制。无水乙醚(由中北林格公司购买)和四氢呋喃经金属钠回流24h后,加二苯甲酮显示蓝色后,在氮气保护下常压蒸馏精制。
核磁共振仪:JEOL 400 NMR;紫外可见分光光度仪:SHIMADZU UV-250;荧光光谱仪:Perkin Elmer LS55。
1.2 化合物合成目标化合物的结构及合成路线如图 1所示,具体合成步骤以及表征数据如下。
|
Download:
|
| 图 1 P-2a-Br和P-4b-Br的合成路线 Fig. 1 Synthesis routes of P-2a-Br and P-4b-Br | |
将化合物1[19](16.0g,64.5mmol)和三苯基膦(18.6g,71.0mmol)置于干燥250mL两口圆底烧瓶中,抽换气3次,加入R醇(6.5mL,71.0mmol),在冰浴条件下加入无水THF,搅拌至溶解,加入DIAD,在冰浴条件下搅拌30min,移除冰浴反应12h。将溶剂旋干,加入适量甲醇,在-18℃下放置12h,抽滤并用冷甲醇洗涤,得到黄色固体化合物2a和2b。
1.2.2 喹啉酰胺低聚物P-2和P-4的合成(R=异丁基、正己基)将化合物2a(7.20g,23.7mmol)放入反应瓶中,加入290mL 1, 4-二氧六环和30mL蒸馏水,将研磨好的KOH粉末(3.30g,58.9mmol)加入溶液中,并在室温下搅拌反应物约24h,TLC(CH2Cl2:CH3OH/95:5)检测反应。当反应完成时,向反应混合物中加入100mL柠檬酸水溶液(5%)。使得溶液pH=5,使用旋转蒸发仪除去1, 4-二恶烷,用CH2Cl2萃取,无水MgSO4干燥,抽滤,旋蒸,得到化合物3a。
将化合物2a(6.80g,22.4mmol)放入反应瓶中,加入150mL乙酸乙酯。然后加入Pd/C(10%)680mg,用10mL乙酸乙酯冲洗烧杯壁,随后加入偏钒酸铵340mg,将反应溶液加热至75℃,在30mL烧杯中制备甲酸铵溶液,分4次加入烧瓶中,每隔10min加1次。用硅藻土除去Pd/C。用CH2Cl2冲洗硅藻土,无水MgSO4干燥,用旋转蒸发仪除去溶剂,得到亮黄色化合物4a。
将化合物3a(6.80g,23.4mmol)放入干燥的两口烧瓶中,抽换气3次,通过注射器将45mL无水CH2Cl2加到反应瓶中,在冰浴下用注射器缓慢滴加草酰氯(10.0mL,117mmol),去除冰浴,并将反应混合物在室温下搅拌2h。随后用冷阱抽去溶剂,得到化合物5a。
向反应瓶中加入干燥的化合物4a(22.3mmol),抽换气3次,加入干燥的CH2Cl2和三乙胺(122mmol),在冰浴下缓慢滴加化合物5a(116mmol)的二氯甲烷溶液。去除冰浴,反应12h。用稀盐酸、饱和碳酸氢钠溶液和水溶液分别萃取,干燥抽滤旋蒸,加入甲醇沉析,得到化合物二聚体P-2a。按照合成P-2a的步骤可以得到相应的四聚体P-4b。
R=C6H13(P-2a) 1H NMR (400MHz,CDCl3) δ 11.88 (s,1H),9.09 (d,J=7.8Hz,1H),8.52 (d,J=8.4Hz,1H),8.19 (d,J=7.4Hz,1H),8.01 (d,J=8.3Hz,1H),7.97 (s,1H),7.69~7.61 (m,3H),4.40 (t,J=6.5Hz,2H),4.31 (t,J=6.4Hz,2H),4.23 (s,3H),2.06~1.92 (m,4H),1.63~1.53 (m,4H),1.41 (s,9H),1.21 (dd,J=21.7,9.9Hz,16H),0.94 (t,J=6.1Hz,6H)。
R=CH(CH3)2(P-4b) 1H NMR (400MHz,CDCl3) δ 12.51 (s,1H),11.98 (s,1H),11.80 (s,1H),9.07 (d,J=7.0Hz,1H),8.41 (d,J=8.1Hz,1H),8.10 (d,J=7.3Hz,1H),8.00 (d,J=13.7,7.9Hz,3H),7.85 (d,J=8.3Hz,1H),7.78 (s,1H),7.71 (t,J=8.0Hz,1H),7.59 (t,J=8.0Hz,1H),7.51 (d,J=8.2Hz,1H),7.31 (s,1H),7.29 (s,1H),7.25 (s,1H),7.02 (t,J=7.9Hz, 1H),6.98 (s,1H),6.71 (s,1H),5.99 (d,J=7.3Hz,1H),5.99 (d,J=7.3Hz,1H),5.17~5.05 (m,1H),5.01 (t,J=4.6Hz,1H),4.81~4.71 (m,1H),4.71~4.62 (m,1H),3.81 (s,2H),3.50 (s,4H),1.66 (s,14H),1.57 (s,9H),1.50 (d,J=5.5Hz,14H)。
1.2.3 目标化合物P-2a-Br和P-4b-Br的合成(R=异丁基、正己基)将二聚体P-2a(2.90g,5.31mmol)加入烧瓶中,加入340mL乙酸乙酯,然后向溶液中加入290mg Pd/C,用10mL乙酸乙酯冲洗烧杯壁,随后加入偏钒酸铵145mg,将反应溶液加热至75℃,在20mL烧杯中制备甲酸铵溶液,分4次加入烧瓶中,每隔10min加1次。用硅藻土除去Pd/C。用CH2Cl2冲洗硅藻土,无水MgSO4干燥,用旋转蒸发仪除去溶剂。得到化合物二聚胺6a。
向反应瓶中加入化合物6a(22.3mmol),抽换气3次,加入干燥的CH2Cl2和三乙胺(122mmol),在冰浴下缓慢滴加事先制备好的对溴苯甲酰氯(116mmol)的二氯甲烷溶液。去除冰浴,反应12h。用稀盐酸、饱和碳酸氢钠溶液和水溶液分别萃取,干燥抽滤旋蒸,加入甲醇沉析,得到产物P-2a-Br。按照该合成步骤可以得到相应的四聚体P-4b-Br。
R=C6H13(P-2a-Br) 1H NMR (400MHz,CDCl3) δ 12.32 (s, 1H), 10.84 (s, 1H), 9.01 (dd, J=7.8, 1.4Hz, 1H), 8.94 (dd, J=7.8, 0.9Hz, 1H), 8.01 (td, J=8.5, 1.2Hz, 2H), 7.90 (dd, J=6.9, 1.8Hz, 2H), 7.79 (s, 1H), 7.71 (t, J=8.2Hz, 1H), 7.65 (t, J=8.0Hz, 1H), 7.55 (s, 1H), 7.06 (dd, J=6.9, 1.8Hz, 2H), 4.32~4.39 (m, 4H), 3.51 (s, 3H), 1.98~2.03 (m, 5H), 1.24~1.45 (m, 11H), 0.87~0.96 (m, 6H). Ms: Calcd for C40H44BrN4O6(M+) 755.23660, Found: 755.24437.
R=CH2CH(CH3)2(P-4b-Br) 1H NMR (400MHz,CDCl3) δ 12.09 (s, 1H), 11.89 (s, 1H), 11.75 (s, 1H), 10.00 (s, 1H), 8.52 (d, J=7.8Hz, 1H), 8.42 (d, J=7.8Hz, 1H), 7.93~8.08 (m, 7H), 7.59~7.66 (m, 2H), 7.46 (d, J=8.2Hz, 2H), 7.39 (s, 1H), 7.28~7.35 (m, 2H), 7.04 (d, J=8.7Hz, 2H), 6.78 (s, 1H), 6.64 (s, 1H), 4.15~4.40 (m, 4H), 3.82~3.89 (m, 4H), 3.40 (s, 3H), 2.19~2.53 (m, 7H), 1.63 (s, 20H), 0.86 (t, J=6.9Hz, 6H) Ms: Calcd for C64H64BrN8O10(M+) 1183.38505, Found: 1183.39233.
2 结果与讨论 2.1 紫外吸收光谱和荧光光谱测试样品的制备:分别用移液器吸取5×10-4mol/L的样品溶液1mL至9个10mL的容量瓶中,再配THF-H2O的系列二元溶剂体系溶液(含水量分别为0%,10%,20%,30%,40%,50%,60%,70%,80%,90%),将其定容摇匀,用于紫外和荧光的测定,其浓度均为5×10-5mol/L。
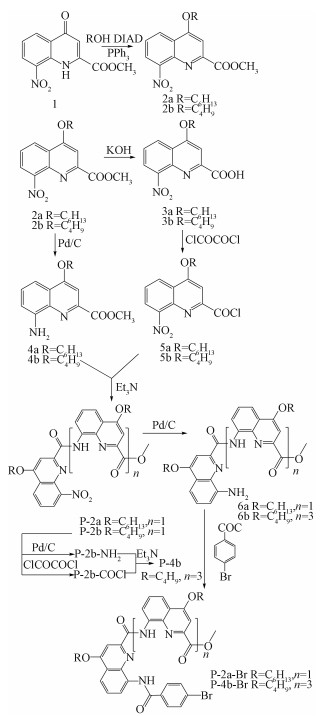
图 2(a)和2(b)分别为P-2a-Br和P-4b-Br在不同含水比例溶剂中(5×10-5mol/L)的紫外吸收光谱。在不同比例的THF-H2O混合溶剂中,目标化合物均有2个主要吸收带,分别在300~350和350~400nm处,可归结于骨架共轭体系的π-π*电子转移。对于P-2a-Br,当水的比例从0%上升至50%,溶液的吸光度没有多大变化。当水的比例增加到60%,溶液吸光度迅速下降,随着混合溶液中含水量的继续增加,体系的吸光度在不断发生变化。在含水量70%和90%时,溶液几乎没有吸收峰。在含水量达到80%时,峰强有所增加与50%之前的含水量相当,并发生明显的峰形加宽红移。对于P-4b-Br,溶液吸光度变化的节点在含水量40%。当水的比例继续增加,溶液吸光度在不断下降,直到含水量在70%达到最低。在含水量80%和90%时,峰强增加并发生明显的峰形加宽红移。这些吸光度的变化是因为水是不良溶剂,随着含水量递增,这两个化合物的溶解性越来越差,而含己基侧链的P-2a-Br的溶解度明显要优于含异丁基侧链的P-4b-Br,导致P-4b-Br吸光度变化的含水量节点(40%)要小于P-2a-Br(50%)。而超过节点后含水量的增加导致的吸光度强度的变化是由溶液中形成聚集体的光散射效应所导致的。聚集态不同,引起的光散射效应也不一样。

|
Download:
|
| 图 2 目标分子的紫外可见光谱 Fig. 2 UV-Vis spectra of the titled molecules | |
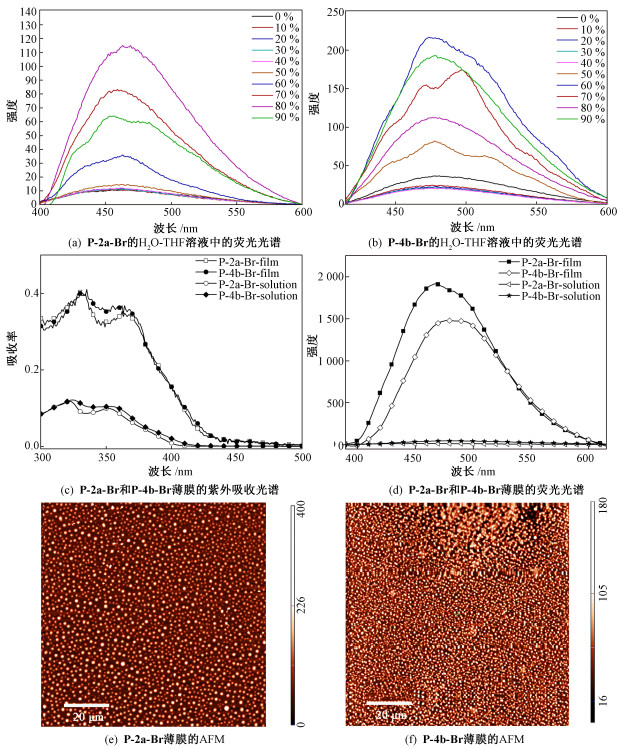
化合物P-2a-Br和P-4b-Br在不同含水比例的溶剂和薄膜状态下的荧光发射光谱如图 3所示。在THF溶液中,P-2a-Br和P-4b-Br荧光强度很弱。这是因为在THF溶剂中,这两个化合物的溶解性很好,分子与分子之间的距离较大且均匀地分散在THF中。而THF这类极性溶剂易破环分子内氢键的形成,使分子内单键更易自由旋转。特别是末端的溴苯环因不参与形成分子内氢键而能灵活转动。因此,分子内激发态的能量可以通过分子内单键的自由旋转等方式消耗。由图 3可知,两个化合物的荧光强度的变化节点与吸收光谱一致。如图 3(a)所示,P-2a-Br在含水量小于50%的情况下,该化合物的荧光强度没有明显的变化。当含水量fw=60%时,荧光强度开始明显增强,且随着含水量的继续增加,荧光强度逐渐增大。在含水量fw=80%时,其荧光强度到达最大值。这是因为在不良溶剂水的作用下,该化合物慢慢聚集,使得分子之间的距离逐步接近,分子之间相互作用力加强导致分子内单键无法自由旋转。所以阻碍了非辐射等消耗能量的方式,最终导致分子聚集体发光。由图 3(b)可知,P-4b-Br也拥有相同的规律,当含水量fw=60%时,出现最强的荧光发射峰。这两个化合物在聚集态下的荧光强度达到溶液态的数十倍。当P-2a-Br和P-4b-Br的含水量进一步增加以后,荧光强度均有不同程度的减弱,这可能是因不同的聚集态形貌所导致的。相比P-2a-Br,分子长度更长的P-4b-Br荧光强度更强。这说明分子长度的增加对荧光发射是有利的。
|
Download:
|
| 图 3 目标分子的光谱和薄膜形貌 Fig. 3 Optical spectra and thin-film morphology of the titled molecules | |
图 3(c)是P-2a-Br和P-4b-Br在薄膜(膜厚=80nm)状态下的紫外吸收光谱,图 3(d)是相应的荧光光谱。由图可知紫外最大吸收峰没有明显的位移变化,但是这两个物质的荧光强度在制备成薄膜时大幅增强,其数值达到THF-H2O二元溶剂体系中最大荧光强度的数十倍。根据文献报道的晶体结构可知,喹啉低聚酰胺化合物在固态下能通过分子内氢键形成稳定的螺旋折叠体分子,平均2.5个喹啉单元构成一个螺旋[20-22]。其中,喹啉酰胺二聚体(P-2b)以稳定的氢键形式形成平面分子,而喹啉酰胺四聚体(P-4b)形成稳定的螺旋结构。因此,可以预见,将溴苯引入喹啉酰胺二聚体和四聚体末端后,必然易形成螺旋结构。稳定螺旋结构的形成限制了分子内单键的自由旋转,而且也防止了分子间最紧密的堆积,使得非辐射跃迁的方式减弱,荧光迅速增强。而在溶液状态下,由于溶剂的极性破坏了能稳定形成螺旋结构的分子内氢键的生成,从而使该化合物并没有形成稳定的螺旋折叠体,因此在THF-H2O混合溶液中荧光强度较弱。P-2a-Br和P-4b-Br在薄膜态下的荧光量子产率分别为9.4%和12.5%。P-4b-Br的薄膜荧光量子产率比P-2a-Br高,这可能是由于P-4b-Br在固态下比P-2a-Br更容易形成稳定的螺旋结构,这种聚集态更有利于荧光发射。图 3(e)和图 3(f)分别是P-2a-Br和P-4b-Br在薄膜状态下的原子力显微镜(AFM)形貌图(20μm×20μm),由图可知这两个化合物的薄膜都形成了均匀分布的小块状聚集形貌。
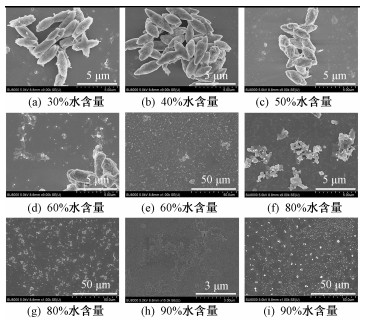
2.2 扫描电镜(SEM)在测量紫外和荧光的过程中,当含水量从30%不断增加后,P-2a-Br和P-4b-Br在THF-H2O混合溶剂中不透明且存在极其微小的颗粒,这是由化合物的溶解性下降所导致的。这些溶液中聚集态的微观结构通过扫描电镜进行观察,如图 4和图 5所示。
|
Download:
|
| 图 4 P-2a-Br在H2O-THF体系中的扫描电镜图片 Fig. 4 SEM images of P-2a-Br in THF-H2O system | |

|
Download:
|
| 图 5 P-4b-Br在H2O-THF体系中的扫描电镜图片 Fig. 5 SEM images of P-4b-Br in THF-H2O system | |
当P-2a-Br的含水量<50%和P-4b-Br的含水量<40%时,这两种化合物在混合溶剂中形成类似于纺锤体的微观结构,但是其荧光强度并没有太大的变化,这与其紫外吸收和荧光光谱是一致的。在吸光度和荧光强度变化节点之下,化合物聚集态的形貌几乎不变且侧链对形貌并不产生影响。随着含水量的逐渐增加,化合物的聚集程度增加。当P-2a-Br和P-4b-Br的含水量分别达到60%和50%时,可以看到纺锤体之间相互堆积更加紧密,恰好是从纺锤形结构形成块状结构的过渡态。荧光光谱的峰形变化反映了这一过渡态形貌的精细结构且荧光强度开始增加。当这两者的含水量分别达到80%和60%时,可以明显地看到纺锤状结构消失,出现更多的块状结构,此时的荧光强度达到最大值,说明形貌的变化主要来自于折叠体分子的堆积。随着P-2a-Br和P-4b-Br的含水量分别进一步增加到90%和70%时,聚集体的堆积再次发生变化,块状结构消失且形成大片的具有微米结构的片状结构,这说明分子之间的堆积更加紧密,荧光强度有不同程度的下降,也证明了分子之间发生荧光淬灭现象。荧光光谱的峰形也体现了这一变化。当P-4b-Br的含水量增加到90%时,纤维结构上出现无定形不规则圆球状的微观结构,其荧光强度再一次发生变化。由此可见,荧光强度的变化与聚集态的形貌密切相关。
此外,由于两个化合物之间的侧链不同导致两者之间溶解度不同,使P-4b-Br比P-2a-Br在含水量更少的情况下开始聚集,但聚集态形貌的演变并未有明显不同。而荧光强度的大小是受聚集态形貌影响的,因此,其主要与分子的长度相关。
3 结论本工作制备两个带有不同侧链和不同长度的以溴苯封端的喹啉低聚酰胺螺旋折叠体分子,并研究它们的光物理性质和AIE效应。P-2a-Br和P-4b-Br在THF-H2O二元溶剂体系中的含水量分别达到80%和60%时具有最大的荧光强度,薄膜状态下的荧光数值是THF-H2O混合溶剂中的数十倍。通过扫描电镜观察两者形貌可以发现纺锤体微观结构对荧光强度没有影响,不同的侧链对形貌影响不大,主要由分子骨架堆积导致形貌发生变化,块状结构使得荧光大幅增强。这种折叠体分子在薄膜态下的AIE效应增强是由稳定的螺旋结构所导致的。此外,溶剂对AIE效应的影响很大。可见,芳香低聚酰胺螺旋折叠体分子是一类潜在的具有优异AIE性能的新型有机发光材料。
| [1] |
Zhao Z, Chen S, Chan C Y, et al. A facile and versatile approach to efficient luminescent materials for applications in organic light-emitting diodes[J]. Chem Asian J, 2012, 7(3): 484-488. Doi:10.1002/asia.201100753 |
| [2] |
Shan X C, Zhang H B, Chen L, et al. Multistimuli-responsive luminescent material reversible switching colors via temperature and mechanical force[J]. Cryst Growth Des, 2013, 13(4): 1377-1381. Doi:10.1021/cg400027u |
| [3] |
Kim T I, Jin H, Bae J, et al. Excimer emission-based fluorescent probe targeting caspase-3[J]. Anal Chem, 2017, 89(19): 10565-10569. Doi:10.1021/acs.analchem.7b02790 |
| [4] |
Liu J, Ren J, Bao X J, et al. pH-Switchable fluorescent probe for spatially-confined visualization of intracellular hydrogen peroxide[J]. Anal Chem, 2016, 88(11): 5865-5870. Doi:10.1021/acs.analchem.6b00654 |
| [5] |
Deng H P, Su Y, Hu M, et al. Multicolor fluorescent polymers inspired from green fluorescent protein[J]. Macromolecules, 2015, 48(16): 5969-5979. Doi:10.1021/acs.macromol.5b01166 |
| [6] |
Ma X F, Sun R, Cheng J Y, et al. Fluorescence aggregation-caused quenching versus aggregation-induced emission: a visual teaching technology for undergraduate chemistry students[J]. J Chem Educ, 2015, 93(2): 345-350. |
| [7] |
Luo J D, Qiu C S, Kwok H, et al. Aggregation induced emission of 1-methyl-1, 2, 3, 4, 5-pentaphenylsilole[J]. Chem Commun, 2001, 381(18): 1740-1741. |
| [8] |
Chen J W, Charles C W, Jacky W Y, et al. Synthesis, light emission, nanoaggregation, and restricted intramolecular rotation of 1, 1-substituted 2, 3, 4, 5-tetraphenylsiloles[J]. Chem Mater, 2003, 15(7): 1535-1546. Doi:10.1021/cm021715z |
| [9] |
张双, 秦安军, 孙景志, 等. 聚集诱导发光机理研究[J]. 化学进展, 2011, 23(4): 621-636. |
| [10] |
Fan X, Sun J, Wang F, et al. Photoluminescence and electroluminescence of hexaphenylsilole are enhanced by pressurization in the solid state[J]. Chem Commun, 2008(26): 2989-2991. Doi:10.1039/b803539c |
| [11] |
Ren Y, Jacky W Y L, Dong Y Q, et al. Enhanced emission efficiency and excited state lifetime due to restricted intramolecular motion in silole aggregates[J]. J Phys Chem B, 2005, 109(3): 1135-1140. Doi:10.1021/jp046659z |
| [12] |
Xie Z Q, Yang B, Xie W J, et al. A class of nonplanar conjugated compounds with aggregation-induced emission: structural and optical properties of 2, 5-diphenyl-1, 4-distyrylbenzene derivatives with all cis double bonds[J]. J Phys Chem B, 2006, 110(42): 20993-21000. Doi:10.1021/jp064069q |
| [13] |
Zhang G, Lu J, Fraser C L. Mechanochromic lum-inescence quenching: force-enhanced singlet-to-triplet intersystem crossing for iodide-substituted difluoroboron-dibenzoylmethane-dodecane in the solid state[J]. Inorg Chem, 2010, 49(23): 10747-10749. Doi:10.1021/ic902591s |
| [14] |
Braye E H, Hubel W, Caplier I. New unsaturated heterocyclic systems[J]. J Am Chem Soc, 1961, 83(21): 4406-4413. Doi:10.1021/ja01482a026 |
| [15] |
Luo J, Song K, Gu F L, et al. Switching of non-helical overcrowded tetrabenzoheptafulvalene derivatives[J]. Chem Sci, 2011, 2(10): 2029-2034. Doi:10.1039/c1sc00340b |
| [16] |
Becker H D, Sandros K, Skelton B W, et al. Relationship between fluorescence and molecular geometry. proximity effects in fluorescence quenching by the anthrone-anthracene interaction[J]. J Phys Chem B, 1981, 85(20): 2927-2930. Doi:10.1021/j150620a015 |
| [17] |
Nyakatura E K, Rezaei A R, Mortier J, et al. An unusual interstrand H-bond stabilizes the heteroassembly of helical alphabetagamma-chimeras with natural peptides[J]. ACS Chem Biol, 2014, 9(3): 613-616. Doi:10.1021/cb4007979 |
| [18] |
Montalvo G L, Zhang Y, Young T M, et al. De novo design of self-assembling foldamers that inhibit heparin-protein interactions[J]. ACS Chem Biol, 2014, 9(4): 967-975. Doi:10.1021/cb500026x |
| [19] |
Qi T, Deschrijver T, Huc I. Large-scale and chromatography-free synthesis of an octameric quinoline-based aromatic amide helical foldamer[J]. Nat Protoc, 2013, 8(4): 693-708. Doi:10.1038/nprot.2013.029 |
| [20] |
Chen Z, Urban N D, Gao Y, et al. Covalent reinforcement of hydrogen-bonded discs into stably folded helical structures[J]. Org Lett, 2011, 13(15): 4008-4011. Doi:10.1021/ol201526g |
| [21] |
Dolain C, Jiang H, Leger J M, et al. Chiral induction in quinoline-derived oligoamide foldamers: assignment of helical handedness and role of steric effects[J]. J Am Chem Soc, 2005, 127(37): 12943-12951. Doi:10.1021/ja0527828 |
| [22] |
Jiang H, Leger J M, Dolain C, et al. Aromatic delta-peptides: design, synthesis and structural studies of helical, quinoline-derived oligoamide foldamers[J]. Tetrahedron, 2003, 59(42): 8365-8374. Doi:10.1016/j.tet.2003.08.058 |
 2019, Vol. 36
2019, Vol. 36 


