西兰花是中国特色蔬菜品种,在浙江、山东、河北、江苏、上海、福建等地广泛栽培,除满足国内消费外,还供应日本、韩国、欧盟等市场[1]。农药是保证西兰花健康生长和产量的投入品,但不恰当的使用方式可能会造成农药残留,从而影响蔬菜贸易和消费者健康。同时农药使用过程中,有相当一部分会进入土壤环境,对土壤和生态环境也带来不利影响[2]。毒死蜱、辛硫磷和茚虫威是中国蔬菜病虫害防治中的常用药物,也是蔬菜贸易中残留检出超标率较高的品种[3-5]。本研究开展不同剂量条件,以及露地和温室两种栽培模式下,毒死蜱、辛硫磷和茚虫威等3种农药在西兰花花蕾、叶片和土壤中的残留动态。参照国际食品安全风险评估方法开展膳食暴露风险评估,研究结果期望为西兰花农药的安全使用提供科学依据。
1 材料与方法 1.1 田间试验与采样 1.1.1 田间试验设计田间试验在浙江省农业科学院绍兴试验基地进行,试验基地周边地势平坦,试验田各类蔬菜轮作,前茬作物为番茄。土壤属沙壤土,肥力中上。土壤的pH值为6.64,有机质含量22.6 g/kg。
供试西兰花品种为“绿雄90”(日本TOKITA种子有限公司生产),种植方式分为露地栽培与大棚栽培。每个种植小区面积40 m2,露地栽培和大棚栽培各4个,共设有8个种植小区。按照推荐剂量,用药分为高浓度和低浓度两个剂量浓度,每种浓度喷施3个种植小区,各设空白对照小区一个,露地和大棚同时用药。西兰花于2015年9月份育苗,10月份定植,11月份施药。西兰花施药和采收均为花蕾球接近采收阶段,是西兰花生长的中后期。施药期间平均气温10~18 ℃,相对湿度35%~85%,月平均降雨量为23 mm,平均风速为1.8 m/s。供试药剂为15%茚虫威乳油,由上海杜邦农化有限公司提供。48%毒死蜱乳油,由浙江省东生农药化工有限公司提供。40%辛硫磷乳油,由安徽省海日农化有限公司提供。
1.1.2 田间试验方法采用一次喷药多次取样的设计,研究3种农药在露地和温室西兰花的残留动态。施药分为两个浓度,分别为每种农药推荐剂量的1倍和1.5倍。施药时间为2015年11月16日,用工农16型电动喷雾器细喷雾, 每667 m2兑水30 L。分别在施药后0(1 h),1,3,5,7,14,21,28 d,每小区按照对角线5点取样,取西兰花的可食部分花蕾采样。空白对照处理在喷药后0(1 h),7 d,28 d取样。每小区取样量200 g,3个重复小区共取样600 g混合样品。样品采集后立即采用搅拌器粉碎后暂存于冰箱冷冻保存(-18 ℃)。露地和温室同时取样,3种农药的用药量见表 1。
|
|
表 1 毒死蜱、辛硫磷和茚虫威的施药浓度(有效成分含量) Table 1 Application dosages of chlorpyrifos, phoxim, and indoxacarb |
岛津LCMS8050液相色谱—串联质谱仪(LC-MS/MS)采用ESI模式;江苏昆山仪器公司KQ-50B超声波清洗器;德国Thermo公司Biofuge Primo R高速离心机;德国IKA公司T-18匀浆机;美国Talboys公司数显型旋涡混合器。
毒死蜱、辛硫磷和茚虫威标准品(99%),购自农业部环境保护科研监测所;乙二胺-N-丙基硅烷(PSA),购自Varian公司;色谱纯甲醇,Merck公司;甲酸、乙腈、无水硫酸镁,均为分析纯, 购自当地分销商;试验用水均为超纯水。
1.2.2 样品的制备样品采用QuEChERS方法处理,LC-MS/MS多残留检测,土壤和西兰花花蕾及叶片的制备方法如下。
土壤:称取5.00 g (精确至0.01 g)样品于50 mL聚四氟乙烯离心管中,分别加入10 mL乙腈和5 g氯化钠,涡旋1 min,超声20 min提取,8 000 r/min离心3 min,取上清液1 mL,加入0.05 g PSA,0.05 g C18粉和0.15 g无水硫酸镁,涡旋1 min,8 000 r/min离心3 min,取上清液过0.22 μm滤膜,待LC-MS/MS检测。
西兰花叶片及花蕾:称取20.0 g(精确至0.01 g)样品于50 mL聚四氟乙烯离心管中,加入40 mL乙腈和8 g氯化钠,涡旋1 min,超声20 min提取,8 000 r/min离心3 min,取上清液1 mL,加入0.05 g PSA粉,0.05 g C18粉和0.15 g无水硫酸镁,涡旋1 min,8 000 r/min离心3 min,取上清液过0.22 μm滤膜,待LC-MS/MS检测。
1.2.3 仪器条件色谱条件:采用色谱柱为Agilent Poroshell 120 EC-C18 2.1×75 mm(2.7 μm);流动相A为0.1%甲酸水溶液溶液,流动相B为0.1%甲酸乙腈溶液。流动相比例A:B为20:80。流速0.25 mL/min;柱温30 ℃;进样量2 μL。
质谱条件:电喷雾离子(ESI)源。扫描方式:正离子(ESI)扫描,毛细管电压4.0 kV,雾化器流量3.0 L/min,加热器流量10.0 L/min,加热块温度400 ℃,脱溶剂管温度250 ℃,雾化器接口温度300 ℃,采用多反应监测(MRM)模式采集数据,以保留时间和离子对信息进行定性分析,以母离子和响应值最高的子离子进行定量分析。毒死蜱、辛硫磷和茚虫威的质谱参数见表 2。
|
|
表 2 毒死蜱、辛硫磷和茚虫威的质谱参数 Table 2 Mass spectrometry parameters of chlorpyrifos, phoxim, and indoxacarb |
将质量浓度为100 mg/kg的毒死蜱、辛硫磷和茚虫威标准品,用甲醇逐级稀释,分别配制成浓度为0.02,0.2,1.0,5.0,10.0 mg/kg的标准工作溶液。按照1.2.3的仪器条件进行测定,以3种农药标准溶液进样的质量浓度(x)对峰面积(y)绘制比标准曲线,考察方法的线性相关性。每个样品重复5次。
1.2.5 添加回收称取20.0 g空白西兰花和土壤样品,添加毒死蜱、辛硫磷和茚虫威标准溶液,添加浓度分别为0.02,0.2,1.0 mg/kg,每个浓度重复3次,混匀,静置30 min,按照1.2.2方法前处理后,用1.2.3仪器条件测定,计算方法的回收率及相对标准偏差,考察方法的准确度和精密度。
1.2.6 基质效应配制0.01~5 mg/kg的3种农药标准品,分别测量在纯溶剂条件下和按照1.2.2的样品处理方法下测定在乙腈和基质中的响应值,并按照基质效应的计算方法如下公式计算:
| $ {\rm{基质效应 = }}\mathit{A}{\rm{ / }}\mathit{B} $ |
式中:A为在土壤或西兰花基质中农药的响应值;B为在纯溶剂中农药的响应值。
若A/B=1,则表示不存在基质效应;若A/B>1,则表示基质对分析物的响应产生增强效应;若A/B<1则表示基质对分析物的响应产生抑制效应。当A/B介于0.8~1.2时,基质干扰程度较低;当0.5<A/B<0.8或1.2<A/B<1.5时,表现为中等程度的基质干扰效应;当A/B<0.5或A/B>1.5,表示基质效应的干扰强烈[6]。
2 结果与讨论 2.1 分析方法的线性相关性、准确度与灵敏度在0.02~10.0 mg/kg范围内,毒死蜱、辛硫磷和茚虫威的质量浓度与峰面积存在显著的相关性,有良好的线性关系。在0.02~5.0 mg/kg添加浓度下,毒死蜱、辛硫磷、茚虫威的添加回收率分别为85.8%~101.0%、90.8%~105.3%、86.1%~107.5%,相对标准偏差分别为3.6%~7.6%、3.5%~8.6%,4.6%~8.7%,准确度和精密度均符合农药残留分析的要求[7]。以最小添加水平色谱图中噪声信号的3倍为检出限,以最小添加水平为定量限[8]。方法的验证见表 3。
|
|
表 3 方法的线性、添加回收率和检出限 Table 3 Linearity, recovery rate, and limitation of the detection method |
考察在0.01,0.1,0.2,0.5,1,2.5,5 mg/kg等7个不同浓度的水平条件下,3种不同农药的信号差异,结果如图 1所示。结果表明,3种农药的基质效应均在0.8~1.2之间,因此本研究采用的检测方法基质干扰程度较低。相比较而言,毒死蜱在西兰花和土壤中的基质效应表现为增强效应,辛硫磷和茚虫威在西兰花中的基质效应表现为抑制效应,而在土壤中表现为增强效应或抑制效应。
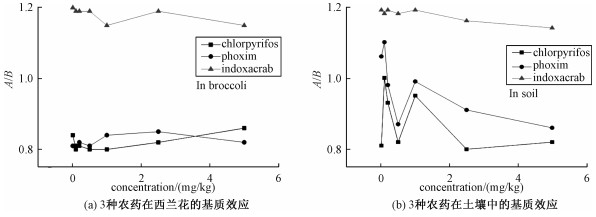
|
Download:
|
| 图 1 3种农药在不同浓度西兰花和土壤中基质效应的差异 Fig. 1 Difference in matrix effects of 3 pesticides at different concentrations in broccoli and soil | |
农药在作物上施用后,一般遵循一级动力学降解规律,施药后农药残留随时间的变化按照以下方程:
| $ \begin{array}{l} \;\;{C_t} = C_0^{ - kt}, \\ {t_{1/2}} = \ln 2/k. \end{array} $ |
式中:Ct为浓度随时间的变化;C0为农药施用后的初始浓度(一般取施药后1 h的残留浓度);t为时间,d;t1/2为农药的半衰期[9]。
不同的栽培模式和用药量下,3种农药在西兰花可食部位花蕾的残留动态见表 4。
|
|
表 4 3种农药在西兰花花球中的降解动态 Table 4 Degradation dynamics of the three pesticides in broccoli flowers |
表 4的数据显示,温室和露地两种栽培模式下,毒死蜱、辛硫磷和茚虫威在西兰花花球中的残留降解均符合一级动力学方程,线性相关性分别为0.948~0.983,0.961~0.971,0.952~0.959。推荐用药剂量下,毒死蜱在温室栽培模式下的半衰期比露地栽培模式的短,分别是5.53和7.20 d。在1.5倍推荐用药剂量下,毒死蜱在温室栽培模式下的半衰期比露地栽培模式的长,分别是6.52和5.99 d。对辛硫磷而言,温室栽培和露地栽培两种模式对半衰期的影响不是很大,在推荐剂量下的半衰期分别是3.59和3.55 d,而在1.5倍推荐剂量下的半衰期分别是3.64和3.92 d。茚虫威在推荐剂量下使用的半衰期,露地栽培模式比温室栽培模式短,分别是6.11和7.39 d,在1.5倍推荐剂量下,温室栽培模式比露地栽培模式短,分别是6.73和7.73 d。
3种农药在西兰花叶片的残留动态见表 5。
|
|
表 5 3种农药在西兰花叶片中的降解动态 Table 5 Degradation dynamics of the three pesticides in broccoli leaves |
表 5的数据显示,温室和露地两种栽培模式下,毒死蜱、辛硫磷和茚虫威在西兰花叶片中的残留降解均符合一级动力学方程,线性相关性(R2)分别为0.903~0.931,0.921~0.988,0.921~0.971。在推荐用药剂量下,毒死蜱在露地栽培模式下的半衰期均比温室栽培模式下的半衰期短,分别为4.33和6.93 d,而在1.5倍推荐用药剂量条件下,毒死蜱在温室栽培和露地栽培模式下的半衰期相当,均为5.33 d。在推荐用药剂量下,辛硫磷在露地栽培模式下的半衰期均比温室栽培模式下的半衰期短,分别为3.85和4.95 d,而在1.5倍推荐用药剂量条件下,辛硫磷在露地栽培模式下的半衰期均比温室栽培模式下的半衰期略长,分别为5.77和5.33 d。茚虫威在推荐剂量下使用的半衰期,露地栽培模式比温室栽培模式相当,均为3.85 d,在1.5倍推荐剂量下,温室栽培模式比露地栽培模式短,分别是4.95和5.33 d。
对照表 4和表 5,在同样的用药剂量和种植条件下,毒死蜱和茚虫威在西兰花叶片的半衰期平均比在花蕾中的半衰期短,说明毒死蜱和茚虫威在西兰花可食部位花蕾中的残留降解比叶片的降解慢。对辛硫磷而言,在不同用药剂量和种植条件下,在西兰花叶片中的半衰期比在花蕾上的半衰期长,说明辛硫磷在西兰花可食部位花蕾中的残留降解比叶片的降解快。
2.4 在土壤中的残留动态3种农药在土壤中的残留动态变化见表 6。
|
|
表 6 3种农药在土壤中的残留动态变化 Table 6 Degradation dynamics of the three pesticides in soil |
表 6数据资料显示,毒死蜱、辛硫磷和茚虫威在土壤中残留降解均符合一级动力学方程,R2分别为0.904~0.961,0.904~0.961和0.906~0.943。半衰期分别为23.1~34.6,23.1~34.6和17.3~23.1 d。对照温室和露地栽培模式,以及不同的用药剂量条件下,毒死蜱和辛硫磷在按照推荐剂量用药条件下,温室栽培模式的半衰期比露地栽培模式的半衰期要长,而在1.5倍推荐剂量用药条件下,两种栽培模式的半衰期相当。对茚虫威而言,按照推荐剂量的用药量,温室栽培模式的半衰期比露地栽培长,而按照1.5倍推荐剂量的用药量下,温室栽培模式的半衰期比露地栽培模式的短。
2.5 几种药物在西兰花花球的残留与风险评估西兰花一般取食鲜嫩的花球,为了解几种农药在西兰花花球的残留及通过膳食暴露对人体健康的影响,选择14和28 d的残留进行风险评估。参照联合国联农组织开展食物中有害物质膳食暴露的评估,评估方法[9-11]按照以下公式进行:
| $ \begin{array}{l} {\rm{NEDI}} = ({\rm{STMR}} \times 0.0908/60) \times 100, \\ {\rm{RQ}} = {\rm{NEDI}}/{\rm{ADI}}. \end{array} $ |
式中:NEDI为国家估计每日摄入量;STMR为农药残留试验中值,取不同施药剂量和不同的种植条件下,残留试验的中间值;0.090 8为根据《中国居民营养与健康调查》,中国居民平均每日摄入深色蔬菜的量,kg;60为中国居民的平均体重,kg;100为风险系数;ADI为农药的日允许摄入量;RQ为风险熵,一般认为风险熵大于1为不安全,风险熵小于1则表示风险可接受。
根据以上风险评估方法得到西兰花施用毒死蜱、辛硫磷和茚虫威后残留风险评估的结果见表 7。
|
|
表 7 西兰花施用毒死蜱、辛硫磷和茚虫威的风险评估 Table 7 Risk assessment of chlorpyrifos, phoxim, and indoxacarb applied in broccoli |
根据表 7的数据分析,在14 d安全间隔期下,毒死蜱、辛硫磷和茚虫威的风险评估结果表明,毒死蜱和辛硫磷的RQ数值大于1,因此认为在此用药条件和安全间隔期下,这两种农药在西兰花花蕾上使用后的风险比较高。茚虫威的RQ数值小于1,说明茚虫威的使用较为安全。在28 d安全间隔期下,毒死蜱、辛硫磷和茚虫威的风险评估结果表明,这3种农药的RQ数值均小于1。说明按照28 d的安全间隔期,3种农药在西兰花花蕾使用后,对人体健康的安全影响比较小。
3 讨论本试验采用QuEChERS方法处理,LC-MS/MS检测毒死蜱、辛硫磷和茚虫威在西兰花花蕾、叶片和土壤中的残留限量。在0.02~10.0 mg/kg范围内,毒死蜱、辛硫磷和茚虫威的质量浓度与峰面积存在显著的相关性,有良好的线性关系。在0.02~5.0 mg/kg添加浓度下,3种农药在西兰花叶片和土壤中的回收率为84.6%~105.6%,相对标准偏差在3.6%~7.6%,准确度和精密度均符合农药残留分析的要求。
残留动态结果表明,毒死蜱、辛硫磷和茚虫威在西兰花花蕾、叶片和土壤中的残留均符合一级动力学方程,在西兰花花蕾中的R2分别为0.948~0.983,0.961~0.971,0.952~0.959,在叶片的R2分别为0.903~0.931,0.921~0.988,0.921~0.971,在土壤的R2分别为0.904~0.961,0.904~0.961和0.906~0.943。对比不同种植模式和不同施药剂量下,3种农药在西兰花花蕾、叶片中的半衰期分别为4.33~7.20,3.55~5.77和3.85~7.73 d。温室和露地栽培模式对3种农药在西兰花花蕾和叶片的残留降解没有显著影响。对比不同的部位,毒死蜱和茚虫威在西兰花可食部位花蕾中的残留降解比叶片的降解慢,对辛硫磷而言,辛硫磷在西兰花可食部位花蕾中的残留降解比叶片的降解快。3种农药在土壤中的半衰期分别为23.1~34.6,23.1~34.6和17.3~23.1 d。农药施用后,在农产品中的农药残留和降解受多种因素的制约。毒死蜱、辛硫磷和茚虫威在西兰花花蕾、叶片和土壤中的残留降解规律与目前国内外研究结果基本一致[12-14]。对比不同栽培条件,温室和露地栽培模式对3种农药的残留降解影响差异不大。对比不同部位,毒死蜱和茚虫威在西兰花花蕾中的降解速度比在西兰花叶片上的降解速度快,而辛硫磷在西兰花花蕾中的降解速度比在叶片上的降解速度慢。原因除西兰花花蕾和叶片的生长规律差异外,还与不同栽培环境中的温度、湿度、太阳辐射等存在差异密切相关。3种农药在土壤中的半衰期均比在花蕾和叶片中的半衰期长,说明3种农药在土壤中的残留降解难度大。
风险评估结果表明,按照14 d安全间隔期,毒死蜱和辛硫磷的RQ数值大于1,在西兰花花蕾上使用后的风险比较高。而按照28 d安全间隔期条件下,毒死蜱、辛硫磷和茚虫威的RQ数值均小于1。说明这3种农药在试验用药剂量条件下,安全间隔期应设置为14~28 d,对人体健康的风险影响比较小。目前各国出于贸易保护和农产品质量安全的需要,分别制定农药残留在不同农产品中的最大残留限量标准(MRL)。针对本试验的3种农药在西兰花中的限量标准,中国规定毒死蜱在花椰菜MRL为1 mg/kg,辛硫磷在芸苔属蔬菜中的MRL为0.05 mg/kg,茚虫威在花椰菜MRL为1 mg/kg,3种农药均没有专门制定西兰花中的限量标准[15]。日本对毒死蜱、辛硫磷和茚虫威在西兰花的限量标准分别为1,0.02和0.2 mg/kg,欧盟分别为1,0.02和0.2 mg/kg,作为国际贸易准绳作用的国际食品法典委员会(CAC),目前制定毒死蜱和茚虫威在西兰花的限量标准分别为2和0.2 mg/kg[15-19]。考虑到西兰花是中国居民蔬菜消费的重要蔬菜品种,也是中国出口贸易的重要品种,建议结合有关风险评估资料,制定西兰花中的农药残留限量标准。
4 结论1) 采用QuEChERS方法处理,LC-MS/MS多残留检测,准确度和精密度均符合农药残留分析的要求。
2) 残留动态结果表明,毒死蜱、辛硫磷和茚虫威在西兰花花蕾、叶片和土壤中的残留均符合一级动力学方程。由于农药降解受不同因素的影响,不同的种植方式对3种农药降解的半衰期影响差异没有特定的规律,毒死蜱和茚虫威在西兰花花蕾中的降解速度比在西兰花叶片上的降解速度快,而辛硫磷在西兰花花蕾中的降解速度比在叶片上的降解速度慢。3种农药在土壤中的半衰期均比在花蕾和叶片中的半衰期长。
3) 安全间隔期是影响农药安全使用的重要因素,风险评估结果表明,毒死蜱、辛硫磷和茚虫威在试验用药剂量条件下,安全间隔期应设置为14~28 d,对人体健康的风险影响比较小。
4) 考虑到西兰花是中国居民蔬菜消费的重要蔬菜品种,也是中国出口贸易的重要品种,建议结合有关风险评估资料和国内外农产品质量安全标准,制定西兰花中的农药残留限量。
| [1] |
孙彩霞, 张棋, 徐明飞, 等. 农药及产地环境对西兰花质量安全的影响与评价[J]. 浙江农业科学, 2015, 56(11): 1708-1711. |
| [2] |
何健, 吴文铸, 孔德洋, 等. 农药风险评价技术在农药减量化中的应用[J]. 生态与农村环境学报, 2016, 32(6): 1008-1011. |
| [3] |
郑娣, 叶延东, 鲁芳. 气相色谱-三重四级杆串联质谱法测定茶叶中茚虫威、溴虫腈、啶虫脒残留[J]. 食品安全质量检测学报, 2016, 12(7): 4919-4924. |
| [4] |
刘腾飞, 魏艳, 纪茹娟, 等. 毒死蜱在不同栽培方式小白菜上的残留动态研究[J]. 中国农学通报, 2017, 33(4): 142-147. |
| [5] |
王运儒, 秦玉燕, 农耀京, 等. 高效液相色谱法测定马铃薯和土壤中的辛硫磷残留[J]. 食品安全质量检测学报, 2017, 2(8): 421-427. |
| [6] |
刘进玺, 秦珊珊, 冯书惠, 等. 高效液相色谱-串联质谱法测定食用菌中农药多残留的基质效应[J]. 食品科学, 2016, 37(18): 171-177. DOI:10.7506/spkx1002-6630-201618028 |
| [7] |
National Food Administration. Method validation and quality control procedures for pesticide residue analysis in food and feed[EB/OL].(2012-01-01)[2018-04-20]. http://www.eurl-pesticides.eu/library/docs/allcrl/AqcGuidance_Sanco_2011_12495.pdf.
|
| [8] |
Qian M R, Wu L Q, Zhang H, et al. Determination of 16 insect growth regulators in edible Chinese traditional herbs by liquid chromatography electrospray tandem mass spectrometry[J]. Analytical and bioanalytical chemistry, 2012, 402(7): 2451-2462. DOI:10.1007/s00216-011-5699-3 |
| [9] |
Chun O K, Kang H G. Estimation of risks of pesticide exposure by food intake, to Koreans[J]. Food and Chemical Toxicology, 2003, 41(8): 1063-1076. DOI:10.1016/S0278-6915(03)00044-9 |
| [10] |
Farag M, Hany M A B, Dalia A B, et al. Residue, dissipation and safety evaluation of chromafenozide in strawberry under open field conditions[J]. Food Chemistry, 2014, 152(6): 18-22. |
| [11] |
王陇德. 中国居民营养与健康状况调查报告之一(2002)[M]. 北京: 人民卫生出版社, 2005.
|
| [12] |
颜丽菊, 蒋芯, 何计龙, 等. 毒死蜱在杨梅果实中的残留及消解动态[J]. 农药学学报, 2016, 18(6): 745-751. |
| [13] |
李春, 李芹, 赵东兴, 等. 丙溴磷、辛硫磷在香蕉果实和果皮中的消解动态[J]. 果树学报, 2016(1): 66-72. |
| [14] |
朱烈, 周宏, 李旦阳, 等. 定虫隆、虫酰肼和茚虫威在花菜中的残留动态研究[J]. 湖南农业科学, 2016(5): 61-63. |
| [15] |
中华人民共和国国家卫生和计划生育委员会, 中华人民共和国农业部, 国家食品药品监督管理总局.食品安全国家标准食品中农药最大残留限量GB 2763-2016[S].北京: 中国标准出版社, 2016: 54, 191.
|
| [16] |
Zhang F, Wang L, Zhou L, et al. Residue dynamics of pyraclostrobin in peanut and field soil by QuEChERS and LC-MS/MS[J]. Ecotoxicology and Environmental Safety, 2012, 78(2): 116-122. |
| [17] |
Ministry of Health, Labour and Welfare. Positive list system for agricultural chemical residues in foods[EB/OL].(2017-01-16)[2018-04-26]. http://www.m5.ws001.squarestart.ne.jp/foundation/agrdtl.php?a_inq=22000.
|
| [18] |
European Union. EU pesticides database[DB/OL].(2017-01-12)[2018-04-26]. http://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/public/?event=download.MRL.
|
| [19] |
FAO/WHO. Pesticide residues in food and feed[EB/OL].(2017-03-12)[2018-04-26]. http://www.fao.org/fao-who-codexalimentarius/codex-texts/maximum-residue-limits/en/.
|
 2019, Vol. 36
2019, Vol. 36 


