2. 浙江省环境保护科学设计研究院工程研究中心, 杭州 310007
2. Project Research Center, Environmental Science Research and Design Institute of Zhejiang Province, Hangzhou 310007, China
高氨氮废水的治理成为污水处理领域亟待解决的一个难题。随着石油化工、制药、建材、农药、造纸、煤气、电子、纺织、染料、塑料和焦化等工业的迅速发展,高氨氮废水排放量急剧增加,逐渐成为当前水体的主要污染源之一。高氨氮废水的成分非常复杂,一旦排入水体中,不仅造成水体的富营养化,水生环境的恶化,同时也对人体健康造成严重危害。近年来,高氨氮废水的生物处理被认为是废水脱氮最具发展前景的方法之一,传统的生物脱氮是通过硝化、反硝化作用将有机氮、氨氮经过一系列反应转化为氮气从水中去除的过程。其中反硝化是脱氮中较为关键的一步,反硝化菌种在有氧条件下会优先利用氧进行呼吸,阻止硝酸盐和亚硝酸盐作为最终的电子受体,同时氧分子也对反硝化还原酶产生抑制作用[1],从而反硝化反应一直认为是严格厌氧的过程。但是硝化是需氧的过程,因此传统生物脱氮的过程通常是在两个反应池中进行而且反硝化反应单元需要严格厌氧,因此大大增加了污水处理的成本和技术难度。在20世纪80年代,Robertson和Knenen[2]报道好氧反硝化菌以及好氧反硝化酶系为解决上述问题提供了新的思路。好氧反硝化菌可直接利用硝化产物作为反硝化底物,不但提高脱氮效率,同时也降低运行成本。迄今为止,对高氨氮废水生物处理系统中好氧反硝化菌种的筛选与培养仅基于常规分离培养方法,但其最高仅能获得10%的微生物菌群,大量的潜在功能菌群因处于活的但非可培养(viable but non-culturable,VBNC)状态而未被研究[3-5]。因此复苏培养作为绝大部分微生物资源的VBNC菌群,可为寻找高效脱氮微生物资源提供新的途径,同时也可为防止脱氮菌进入VBNC状态以发挥更好的脱氮性能提供新的思路。
藤黄球菌(Micrococcus luteus)所分泌的复苏促进因子(resuscitation-promoting factor,Rpf)的发现被认为是复苏培养VBNC状态菌最重要的突破。Rpf在皮摩尔浓度下即可使自身处于VBNC状态的细胞复活,并使可培养数量增长至100倍以上,且可促进细胞的生长[6]。研究发现制药废水中对Rpf敏感的VBNC优势菌群主要有革兰氏阳性(G+)菌如Microbacterium、Gordonia和Leucobacter属等,及革兰氏阴性(G-)菌如Candidimonas、Xanthobacter和Aminobacter属等。另外,我们前期利用藤黄球菌Rpf从森林、海岛、沙漠土壤、城市和富营养化污水,以及印染、制药、农药和焦化废水等样品中复苏培养VBNC菌近60多属100余种,并已登陆至国际基因库DDBJ。而且经后期研究进一步发现Rpf蛋白不仅对亲缘关系较近的革兰氏阳性(G+)菌有较好的复苏促进功能,对亲缘关系较远的少数革兰氏阴性(G-)菌属中部分难培养菌种也有生长促进作用,且多数菌株具有脱氮、除磷、除臭、絮凝、降解持久性有机污染物(POPs)等环境功能。
鉴于此,本文利用藤黄球菌Rpf蛋白复苏培养高氨氮废水中的VBNC菌种,并通过测定反硝化液体培养基中的硝态氮、亚硝态氮、氨氮的浓度,研究VBNC菌种的好氧反硝化性能,从而为寻找高效好氧反硝化菌提供新的途径。同时也为挖掘污染环境中难培养及VBNC状态微生物的潜在环境功能提供新的研究思路。
1 材料与方法 1.1 实验材料高氨氮废水取自浙江省金华市某工业污水处理厂,其COD为500 mg/L,NH4+-N为420 mg/L,NO2--N未检出,NO3--N为10 mg/L,pH值为7.2。
1.2 仪器紫外分光光度计(UV-7504,上海欣茂仪器有限公司);恒温培养振荡器(ZHWY-100C上海智诚仪器分析制造公司);台式离心机(5417R,Eppendorf);恒温恒湿培养箱(HWS-350,宁波海曙塞富实验仪器厂);电子天平(JY3002,上海精密科学仪器有限公司);移液枪(P500,Eppendorf);电热鼓风干燥箱(DHG-9070A,上海一恒科学仪器有限公司)。
1.3 培养基1) MPN培养基(g/L):酵母提取物0.5 g,蛋白胨5 g,NaCl 2.5 g,葡萄糖5 g,苯乙醇3 mL,pH调至7.0,固体培养基需加入1.5%~2%的琼脂粉。
2) SOB培养基(g/L):胰蛋白胨20 g,酵母粉5 g,NaCl 0.5 g,250 mmol/L KCl溶液10 mL,pH调至7.0,该溶液使用前需加入2 mol/L MgCl2 5 mL。
3) 好氧反硝化培养基(g/L):葡萄糖1 g,亚硝酸钠0.98 g或硝酸钠1.21 g,KH2PO4 1 g,K2HPO4 1 g,MgSO4·7H2O 0.2 g,pH调至7.0。
4) 氨氮降解能力鉴定培养基(g/L):葡萄糖1 g,(NH4)2SO4 0.17 g,NaCl 0.3 g,K2HPO4 1 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O 0.03 g,CaCO3 7.5 g。
2 实验方法 2.1 Rpf蛋白纯化将M. luteus的rpf基因克隆在Escherichia coli BL21 (DE3)中诱导表达,经纯化后获得Rpf蛋白[7]。
具体步骤简述如下:将质粒转化的Escherichia coli BL21(DE3)接种至含有50 mg/L相应抗生素的LB液体培养基中,37 ℃,120 r/min培养至对数生长期,然后再接种至200 mL SOB培养基中扩大培养,确认转化细菌浓度为OD600=0.6时,加入IPTG诱导剂至终浓度为1 mmol/L,20 ℃,120 r/min诱导过夜。
离心(12 000 r/min,10 min)收集细胞,加入缓冲液重悬菌体,并超声破碎使得蛋白释放出来。经Ni柱吸附,100 mmol/L的咪锉洗脱液洗脱后,再利用纯化试剂盒对目的蛋白进行纯化。提纯的Rpf蛋白经0.22 μL微孔滤膜过滤后,加甘油至终浓度为50%,置于-20 ℃保存备用。同时,将Rpf蛋白高压灭活(121 ℃,20 min)用于对照组的实验研究。
2.2 Rpf蛋白对VBNC菌的复苏促进作用MPN培养体系中,吸取1 mL采自于污水处理厂的高氨氮废水加入至9 mL LB液体培养基中,而后依次稀释,连续设置10个稀释梯度,每一个梯度设立3个平行。在各处理组稀释液均添加0.25% Rpf蛋白,对照组各稀释液添加0.25%无活性Rpf蛋白上清液,将样品放置在30 ℃,120 r/min培养体系中生长。通过测定处理组与对照组培养液菌体密度(OD600)来反映Rpf对菌体生长状况的影响。同时记录样品的浊度以获得MPN值,利用MPN表计算出每个样品中可培养细菌的总数。
当细菌总数处于稳定,将处理组与对照组培养液最大稀释度分别涂布于固体平板中获得可培养细菌。对比两组涂布平板的菌落差异,仅存在于处理组的菌株则为对Rpf蛋白敏感的VBNC菌。将纯化后的的菌株扩大培养并收集至10%的甘油中,-80 ℃保存。每种稀释度的剩余培养液则放至-20 ℃保存备用。
2.3 菌株16S rRNA鉴定及系统发育树的构建将获得的VBNC菌株接种至LB液体培养基,30 ℃培养过夜。采用Ezup柱式细菌基因组抽提试剂盒提取各单菌株的DNA。然后进行菌株16S rRNA基因的扩增。PCR反应体系50 μL包括:EasyTaq SuperMix:25 μL,引物设计为8F (5′-AGAGTTTGATCATGGCTCAG-3′)和1510R (5′-GGTTACCTTGTTACGACTT-3′)各1 μL,模板DNA 2 μL,去离子水21 μL。PCR反应条件为:95 ℃预变性4 min,95 ℃变性3 min,53 ℃退火30 s,72 ℃延伸1 min,进行30个循环,72 ℃终延伸5 min,4 ℃保持。扩增片段约为1 450 bp。利用1%琼脂糖凝胶电泳检测PCR产物后送至上海生工进行16S rRNA基因测序。将得到基因序列与Genbank (http://www.ncbi.nlm.nih.gov)中相似序列进行Blast比对分析,利用MEGA 7.0软件进行序列同源性分析,采用邻接法(NJ)构建系统发育树[8]。
2.4 菌种反硝化性能测定将所获的VBNC菌株挑取单菌落接种到5 mL LB液体培养基中,30 ℃,120 r/min摇床培养至对数生长期,然后将其接种至好氧反硝化培养基中,每隔20 h取样测定培养基中的氨氮、硝态氮、亚硝态氮的浓度,数据重复测定3次。
总氮浓度测定采用碱性过硫酸钾消解紫外分光光度法[9];氨氮浓度测定采用纳氏试剂法[9];硝态氮测定采用酚二磺酸分光光度法[9];亚硝态氮测定采用N-(1-萘基)-乙二胺光度法[9-10]。
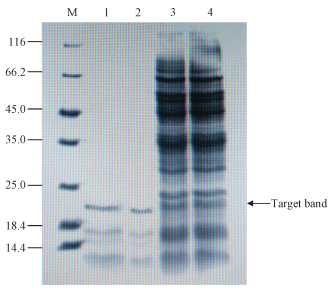
3 实验结果分析 3.1 SDS-PAGE验证Rpf蛋白M. luteus rpf基因经克隆,并在Escherichia coli BL21 (DE3)中诱导表达及系列纯化后,获得Rpf重组蛋白。结果如图 1所示,由SDS-PAGE图可知,蛋白洗脱液中含有清晰的目的条带,重组蛋白的分子量约为23 kDa,且杂条带数量相较于粗体液明显减少,说明经Ni柱洗脱后得到了纯度较高的Rpf蛋白。
|
Download:
|
| M:蛋白质标记物; 1-2条带:纯化的重组Rpf;3-4条带:来自大肠杆菌(DE3)的粗提物。 图 1 藤黄球菌rpf基因在Escherichia coli BL21 (DE3)融合表达蛋白的SDS-PAGE图 Fig. 1 SDS-PAGE results of rpf gene in the Escherichia coli BL21 (DE3) fusion expression | |
本研究中所获的重组蛋白的分子量相对于Mukamolova等[6]从藤黄球菌上清液中分离提取的Rpf蛋白(16~17 kDa)偏大,其原因为此重组蛋白未去除N端的6个His标签。同时,与Mukamolova等[4]所获的重组蛋白分子量(25 kDa)相当。
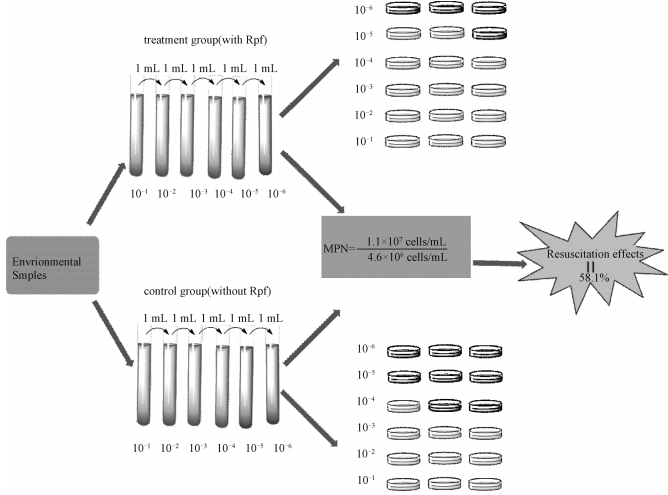
3.2 MPN值及Rpf蛋白效应每隔24 h记录MPN培养体系中处理组和对照组在600 nm处的光密度值。当数值趋于稳定后,读取MPN值。在培养体系中,处理组最后3个稀释度分别有3个,3个和2个浑浊管,对照组分别有3个,3个和1个浑浊管,透明管意味着其OD600值接近于0。在各稀释度中,处理组的菌体生长量均大于对照组,尤其是在最后的稀释度(10-5)中,这表明Rpf可促进细菌的生长。
通过查阅MPN表所得处理组细菌总数为1.1×107 cells/mL,对照组细胞总数为4.6×106 cells/mL,如图 2所示,通过添加Rpf,细菌的数量增加58.1%,此结果表明约58.1%的细胞因处于VBNC状态而无法用常规平板分离法培养获得。
|
Download:
|
| 图 2 基于MPN法计算Rpf对VBNC菌复苏的效果 Fig. 2 Effect of Rpf on the resuscitation of VBNC bacteria calculated using the MPN method | |
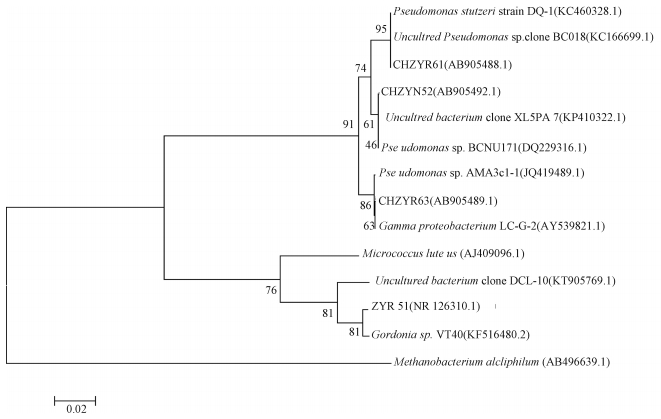
利用Rpf从高氨氮废水中复苏培养4株VBNC菌种,分别命名为ZYR51、CHZYN52、CHZYR61和CHZYR63。基于4个菌株的16S rRNA基因序列,依据Blast比对结果与Genbank数据库中已有相似度较高菌种共同构建系统发育树。结果如图 3所示,菌株ZYR51与Gordonia sp. VT40(相似性为99%)聚成一支,且与Rpf产生菌株Micrococcus luteus具有较高的同源性。CHZYN52、CHZYR61和CHZYR63菌株与假单胞菌属(Pseudomonas)具有较近的亲缘关系,稳定性较高。由此可以初步确定ZYR51菌株属于Gordonia属,CHZYN52、CHZYR61和CHZYR63菌株均属于Pseudomonas属。此结果与前期的研究结果有较好的一致性,如Jin等[11]利用Rpf蛋白从高浓度印染废水中复苏获得多株VBNC菌种,发现对Rpf蛋白敏感的优势菌种分别归属于Gordonia、Lysinibacillus、Bacillus、Pseudomonas和Moraxella属,且所获得VBNC菌种对废水中的难降解有机污染物具有较强的降解性能。同时,已有研究表明Gordonia属具有较强的脱氮、脱硫的能力[12-13]。如Chen等[14]利用Gordonia sp. JW8处理制浆造纸废水,结果显示废水中的含氮有机污染物与对照组相比可达到最佳处理效果。另外,Pseudomonas属的菌种所具有的脱氮功能也被广泛报道[15-17]。如胡朝松等[18]从海洋沉积物中分离得到1株Pseudomonas属菌株F-8-1,该菌株能通过反硝化作用有效降低硝态氮和亚硝态氮含量,在5 d内含氮污染物的去除率可达90%。本研究利用Rpf复苏VBNC菌种所获得的Gordonia属菌株ZYR51和Pseudomonas属菌株CHZYN52、CHZYR61和CHZYR63。本研究不仅为挖掘新高效好氧反硝化微生物资源提供新的途径,并为重新评价微生物在生物脱氮过程中的作用提供一定理论依据。
|
Download:
|
| 图 3 基于16S rRNA基因序列构建的复苏菌种的系统发育树 Fig. 3 A phylogenetic tree of the resuscitated strains constructed on the basis of the 16S rRNA gene sequence | |
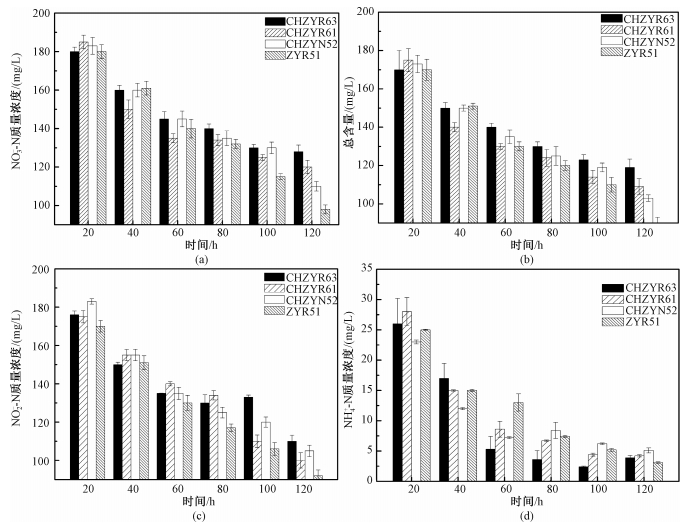
将复苏的VBNC菌株接种至好氧反硝化培养基中,每隔20 h测定培养基中各个指标的含量变化,结果如图 4(a)所示,菌株在经历一段时间的延滞期后开始迅速生长,此时培养基中的硝态氮含量明显下降,脱氮效率在此阶段达到最大值。通过对接入不同菌株的硝态氮好氧反硝化培养基中总氮的变化趋势进行分析,如图 4(b)所示,在140 h之内接入ZYR51菌株的好氧反硝化培养基相比其他实验组总氮含量较低,下降至90 mg/L,总氮去除率高达55%。一般认为生物同化作用利用的氮不会超过总氮的20%,菌种ZYR51的脱氮能力较为显著。
|
Download:
|
| 复苏的VBNC菌种在好氧反硝化培养基中测定硝态氮、总氮、亚硝态氮和氨氮的质量浓度变化:(a)为硝态氮,(b)为总氮,(c)为亚硝酸盐氮,(d)为氨氮。 图 4 好氧反硝化培养基中各指标的动态变化 Fig. 4 Dynamic changes of the indicators in aerobic denitrification medium | |
好氧反硝化培养基中的亚硝态氮含量变化如图 4(c)所示,各菌株的亚硝态氮含量呈现下降趋势。表明在该种培养基中存在好氧反硝化作用。分离的菌株既可以硝态氮也可以亚硝态氮为底物进行反硝化作用(图 4(a)和图 4(c))。这与好氧反硝化菌株能直接利用硝化产物作为反硝化底物的特性有关[19]。
为进一步研究各菌株的氨氮降解特性,将菌株接种至以(NH4)2SO4为唯一氮源的氨氮降解能力鉴定培养基中,结果如图 4(d)所示,氨氮含量在0~60 h快速下降,在60 h后含量下降趋于稳定,各个菌株的氨氮去除率维持在85%~86%,其中ZYR51的氨氮质量浓度从35 mg/L下降至4.66 mg/L,其氨氮去除率高达86.7%。孙庆花等[20]报道在海底沉积物中分离筛选获得1株克雷伯氏菌属(Klebsiella)菌株y5,在未优化条件时,其氨氮去除率为60%,但在最适条件下氨氮的去除率可达到100%。张峰峰等[21]在水产养殖环境中分离出具有较强反硝化性能的菌株DB-33,在48 h内氨氮的去除率可达到51.52%。本实验分离得到的菌株ZYR51在120 h内氨氮的去除率可达86.7%。综上可知,菌株ZYR51具有较强的氨氮去除性能。
4 结论1) 本研究表明高氨氮废水中存在大量对Rpf敏感的VBNC细菌,其数量占总菌数的58.1%。并分离纯化4株VBNC菌株,其中ZYR51归属于Gordonia属,菌株CHZYN52、CHZYR61和CHZYR63均归属于Pseudomonas属。
2) 本研究表明Pseudomonas和Gordonia属可能为高氨氮废水中存在的主要VBNC功能菌群,经Rpf复苏后具有较好的好氧反硝化性能。
3) 本研究揭示在高氨氮废水中,与藤黄球菌具有较好亲缘关系的Gordonia属菌株ZYR51的脱氮性能最强。从而为挖掘高效好氧反硝化菌提供新的思路。
| [1] |
Frette L, Gejlsbjerg B, Westermann P. Aerobic denitrifiers isolated from an alternating active sludge system[J]. FEMS Microbiology Ecology, 1997, 24(4): 363-370. |
| [2] |
Robertson L A, Kuenen J G. Aerobic denitrification:a controversy revived[J]. Archives of Microbiology, 1984, 139(4): 351-354. |
| [3] |
苏晓梅, 丁林贤, 沈超峰. 活的但非可培养功能菌群对多氯联苯降解的探索进展[J]. 微生物学报, 2013, 53(9): 908-914. |
| [4] |
Mukamolova G V, Murzin A G, Salina E G, et al. Muralytic activity of Micrococcus luteus Rpf and its relationship to physiological activity in promoting bacterial growth and resuscitation[J]. Molecular Microbiology, 2006, 59(1): 84-98. |
| [5] |
Li Y, Chen J, Zhao M, et al. Promoting resuscitation of viable but nonculturable cells of Vibrio harveyi by a resuscitation-promoting factor-like protein YeaZ[J]. Journal of Applied Microbiology, 2017, 122(2): 338-346. |
| [6] |
Mukamolova G V, Kaprelyants A S, Young D I, et al. A bacterial cytokine[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(15): 8916-8921. DOI:10.1073/pnas.95.15.8916 |
| [7] |
丁林贤, 张萍华, 洪华嫦. 藤黄微球菌Rpf活性蛋白的制取及对红球菌VBNC菌体的复苏作用[J]. 微生物学报, 2012, 52(1): 77-89. |
| [8] |
Kumar S, Stecher G, Tamura K. MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution, 2016, 33(7): 1870-1874. DOI:10.1093/molbev/msw054 |
| [9] |
国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 102-218.
|
| [10] |
王存政, 王兴春, 牛倩, 等. N-(1-萘基)-乙二胺光度法测定水中亚硝酸盐氮的测量不确定度评定[J]. 环境工程学报, 2013, 31(5): 147-150. |
| [11] |
Jin Y, Gan G, Yu X, et al. Isolation of viable but non-culturable bacteria from printing and dyeing wastewater bioreactor based on resuscitation promoting factor[J]. Current Microbiology, 2017, 74(7): 787-797. DOI:10.1007/s00284-017-1240-z |
| [12] |
Lin C L, Shen F T, Tan C C, et al. Characterization of Gordonia sp. strain CC-NAPH129-6 capable of naphthalene degradation[J]. Microbiological Research, 2012, 167(7): 395-404. DOI:10.1016/j.micres.2011.12.002 |
| [13] |
刘磊, 李习武, 刘双江, 等. 降解多环芳烃的菌株Gordonia sp. He4的分离鉴定及其在菲污染土壤修复过程中的动态变化[J]. 环境科学, 2007, 28(3): 617-622. DOI:10.3321/j.issn:0250-3301.2007.03.031 |
| [14] |
Chen J, Zhan P, Koopman B, et al. Bioaugmentation with Gordonia strain JW8 in treatment of pulp and paper wastewater[J]. Clean Technologies and Environmental Policy, 2012, 14(5): 899-904. DOI:10.1007/s10098-012-0459-4 |
| [15] |
Wang B, Wang C, Liu W, et al. Biosurfactant-producing microorganism Pseudomonas sp. SB assists the phytoremediation of DDT-contaminated soil by two grass species[J]. Chemosphere, 2017, 182: 137-142. DOI:10.1016/j.chemosphere.2017.04.123 |
| [16] |
Postnikova O A, Shao J, Mock N M, et al. Gene expression profiling in viable but nonculturable (VBNC) cells of Pseudomonas syringae pv. syringae[J]. Frontiers in Microbiology, 2015, 6: 1419. |
| [17] |
He T, Li Z, Sun Q, et al. Heterotrophic nitrification and aerobic denitrification by Pseudomonas tolaasii Y-11 without nitrite accumulation during nitrogen conversion[J]. Bioresource Technology, 2016, 200: 493-499. DOI:10.1016/j.biortech.2015.10.064 |
| [18] |
胡朝松, 李春强, 刘志昕, 等. 海洋沉积物中反硝化细菌的分离鉴定及反硝化性能研究[J]. 环境科学研究, 2009, 22(1): 114-118. |
| [19] |
Yang L, Ren Y X, Liang X, et al. Nitrogen removal characteristics of a heterotrophic nitrifier Acinetobacter junii YB and its potential application for the treatment of high-strength nitrogenous wastewater[J]. Bioresource Technology, 2015, 193: 227-233. DOI:10.1016/j.biortech.2015.05.075 |
| [20] |
孙庆花, 于德爽, 张培玉, 等. 1株海洋异养硝化-好氧反硝化菌的分离鉴定及其脱氮特性[J]. 环境科学, 2016, 37(2): 647-654. |
| [21] |
张峰峰, 谢凤行, 赵玉洁, 等. 一株反硝化细菌的分离鉴定及脱氮能力[J]. 环境工程学报, 2013, 7(11): 4415-4420. |
 2019, Vol. 36
2019, Vol. 36 


