近年来,越来越多的纳米材料被发现具有类酶活性,并且类酶活性的研究也取得了很大的进展。在各种纳米材料中,纳米CeO2因其表面存在Ce3+/Ce4+的自动再生循环而成为一种多功能的纳米酶,受到人们广泛关注。目前为止,纳米CeO2被报导具有过氧化氢酶活性[1]、过氧化物酶活性[2]、超氧化物歧化酶活性[3]、氧化酶活性[4]、磷酸三酯酶活性[5]等,因此纳米CeO2既可以用作还原型催化剂,又可以用作氧化型催化剂。类酶的催化反应通常发生在纳米粒子表面,所以由于纳米CeO2的表面修饰而导致的材料表面化学的任何变化都可以改变纳米CeO2与底物之间的相互作用,从而改变纳米CeO2的催化活性,因此研究表面修饰对其类酶活性的影响至关重要。先前的研究也表明氟离子[6]、硫酸根离子[7]、聚合物[4]、蛋白质[8]等都可以改变纳米CeO2的类氧化酶活性。在多种形貌的纳米CeO2中,纳米线由于长径比较高,比表面积较大而容易被各种分子修饰。DNA作为一种重要的生物纳米技术的核心分子被广泛用于各种纳米材料的修饰。在此,我们研究DNA对纳米CeO2线类氧化酶活性的影响。
首先用水热法合成纳米CeO2线,使用X射线衍射仪(XRD)、透射电子显微镜(TEM)和拉曼光谱仪对其进行表征。用傅里叶变换红外(FT-IR)光谱和紫外可见(UV-Vis)光谱研究DNA与纳米CeO2线的相互作用。然后以2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)为探针研究DNA对纳米CeO2线类氧化酶活性的影响。并且进行pH影响及特异性实验研究。
1 实验部分 1.1 原料和仪器小牛胸腺DNA,胃蛋白酶1:3000(Solarbio),含有20个碱基的单链DNA(Sangon Biotechnology Co.,Ltd中国上海),DNA序列为5′-ATCATCGCCTACCTACGACT-3′。Ce(NO3)3·6H2O,CH3COONa和六亚甲基四胺(国药集团化学试剂有限公司)。CH3COOCH3CH3和CH3CH2OH(北京化学工业集团有限公司)。2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),酯酶,葡萄糖氧化酶以及NaOH(Sigma Aldrich,UK)。透明质酸酶(北京百灵威科技有限公司)。纤维素酶(来自黑曲霉,东京化成工业株式会社)。所有的化学品都为分析纯的,不需要进一步纯化。实验中所用水为超纯水(18.2MΩ·cm)。
透射电子显微镜(TEM,FEI Tecnai G2);X射线衍射仪(XRD,Rigaku smartlab);拉曼光谱仪(Renishaw in Via);紫外可见分光光度计(AOE UV-560);傅里叶变换红外光谱仪(VERTEX 70);冷冻干燥机(FD-1 A-80);振荡器(IKA M3 digital)。
1.2 纳米CeO2线的合成与表征采用水热法合成纳米CeO2线[9]。首先,在搅拌条件下,迅速将40mL六水合硝酸铈(0.05mol/L)加入到40mL NaOH(10mol/L)中。搅拌约20min后,将悬浊液转移至高压釜(100mL)中并逐渐加热至373 K并在此温度下反应24h。冷却至室温,将反应后的溶液离心并洗涤。最后将沉淀物在353K条件下干燥过夜后得到CeO2纳米线。将合成的纳米CeO2线进行透射电子显微镜,X射线衍射以及拉曼光谱表征。
1.3 紫外可见吸收光谱实验将DNA溶解于一定体积的10mmol/L的乙酸钠缓冲液中,配置成10mmol/L的DNA溶液。ABTS溶解于水中也配成10mmol/L。取一定量的纳米CeO2线粉末分散于水中,搅拌,超声制成5mmol/L的CeO2纳米线悬浊液。使用前将悬浊液稀释10倍并且超声30min。实验时,首先在10mmol/L,pH 4.0乙酸钠缓冲液中加入100μL的纳米CeO2线悬浊液,然后向溶液中加入不同体积的DNA溶液,立即将混合溶液震荡0.5h以确保DNA尽可能多地吸附在纳米CeO2线上(DNA/CeO2)。最后,向混合溶液中加入100μL的ABTS溶液。最终1mL的混合溶液中含有50μmol/L的纳米CeO2线、不同浓度的DNA以及1mmol/L的ABTS。将此混合溶液继续震荡1h, 测量反应后溶液的紫外可见吸收光谱。
2 结果与讨论 2.1 纳米CeO2线的表征分析图 1(a)为XRD表征,图中的衍射峰依次对应于(111)、(200)、(220)、(311)、(222)以及(400)晶面,表明样品为典型的CeO2的萤石立方结构(JSPDS card:34-0394)。图 1(b)是TEM表征,从图中可以看出CeO2呈现良好的线状结构,并且测量结果CeO2平均直径约7nm,平均长度约140nm,表明成功合成了纳米CeO2线。图 1(c)为纳米CeO2的拉曼光谱表征,从图中可以看出在462cm-1处出现强峰,这是萤石立方结构的F2g振动模式,源于Ce-8O的对称伸缩振动;在595cm-1处产生拉曼吸收,这是纳米CeO2的氧空位的特征峰[10]。这些表征结果证明了萤石立方结构的纳米CeO2线的成功合成。

|
Download:
|
| 图 1 纳米CeO2线的表征 Fig. 1 Characterization of CeO2 nanowires | |
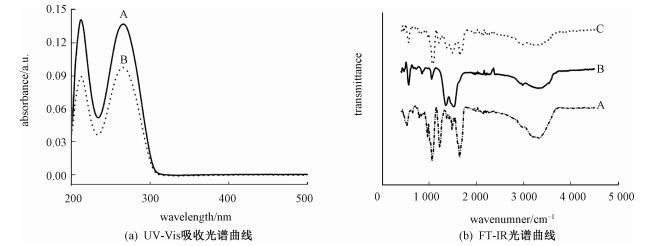
为探究纳米CeO2线与DNA之间的相互作用,纳米CeO2线与DNA作用后的溶液进行离心处理,上清液及沉淀物分别进行UV-Vis光谱(图 2(a))和FT-IR光谱(图 2(b))分析。DNA能够在260nm处产生紫外吸收(曲线A),与纳米CeO2线作用后,其上清液的紫外吸收下降(曲线B),表明DNA与纳米CeO2线之间发生了相互作用,一定量的DNA被纳米CeO2线吸附。纳米CeO2线与DNA作用后,经过离心、洗涤以及干燥处理后测定其红外光谱(曲线C)。曲线A和B分别为小牛胸腺DNA与纳米CeO2线的红外光谱。对比B、C曲线可以看出,纳米CeO2线在1070cm-1处红外吸收峰增强,表明DNA吸附在纳米CeO2线上。纳米CeO2线在1200~1600cm-1之间Ce-O伸缩振动峰[11]减弱,表明DNA吸附在纳米CeO2线表面后,使纳米CeO2线的红外吸收峰发生变化。
|
Download:
|
| (a)中实线A为DNA溶液,点线B为纳米CeO2线与DNA相互作用后的上清液;(b)中实线B为纳米CeO2线,点线C为与DNA作用后的纳米CeO2线,实线与点线间隔的线A为小牛胸腺DNA。 图 2 纳米CeO2线与DNA相互作用前后,溶液中DNA的UV-Vis以及纳米CeO2线的FT-IR分析 Fig. 2 UV-Vis absorption spectra of DNA in solution and FT-IR analysis of CeO2 nanowires, before and after interaction of CeO2 nanowires with DNA | |
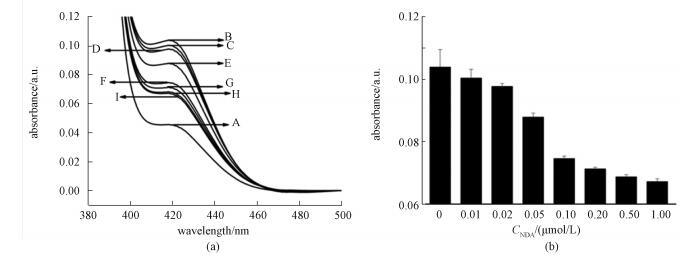
纳米CeO2线具有类氧化酶活性,能将ABTS溶液由无色氧化为绿色,在417nm处产生紫外吸收[12]。如果DNA的吸附能改变纳米CeO2的类氧化酶活性,那么417nm处的紫外吸收就会发生改变,由此可以判断出DNA对纳米CeO2线类氧化酶活性的影响,实验结果如图 3所示。曲线A为1mmol/L的ABTS的紫外吸收光谱,曲线B为50μmol/L的纳米CeO2线与1mmol/L的ABTS作用后混合溶液的紫外吸收光谱,通过对比可以看出纳米CeO2线与ABTS作用后的溶液紫外吸收上升,表明纳米CeO2线能够氧化ABTS,具有较强的氧化酶活性。曲线C为与0.01μmol/L的DNA作用后的纳米CeO2线氧化ABTS的紫外吸收光谱,从图中可以看出与DNA作用后,DNA修饰的纳米CeO2线氧化ABTS的紫外吸收下降,表明DNA抑制纳米CeO2线的类氧化酶活性,并且随着DNA浓度的逐渐增加,被氧化的ABTS的紫外吸收逐渐下降(曲线D-I),表明随着DNA浓度的增加,越来越多的DNA吸附在纳米CeO2线上;吸附的DNA越多,对纳米CeO2线的抑制作用越强。这些结果表明DNA能够抑制纳米CeO2线的类氧化酶活性。有报道指出铈是一种硬金属,磷酸根是一种硬配体,它们之间存在较强的配位能力[13],从而导致DNA能够通过磷酸盐骨架与Ce发生相互作用吸附在纳米CeO2的表面,紫外与红外的结果也证明了二者的相互作用。另外也有研究表明磷酸盐能与铈离子发生相互作用从而改变纳米CeO2的催化活性[14-15]。所以DNA中的磷酸根可能会影响Ce3+
|
Download:
|
| (a)为不同浓度的DNA修饰的纳米CeO2线催化ABTS氧化的吸收光谱曲线,各曲线中对应的DNA的浓度分别为: (B)0,(C)0.01, (D)0.02, (E)0.05, (F)0.10, (G)0.20, (H)0.50, (I)1.00μmol/L。其中曲线(A)为1mmol/L的ABTS的吸收光谱曲线;(b)为不同浓度的DNA修饰的纳米CeO2线催化ABTS氧化在417nm处的吸光度值。 图 3 不同浓度的DNA对纳米CeO2线类氧化酶活性影响的UV-Vis吸收分析 Fig. 3 UV-Vis absorption analysis of the effects of DNA of different concentrations on the oxidase mimetic activity of CeO2 nanowires | |
DNA对纳米CeO2线氧化酶活性的影响研究是在pH为4.0浓度为10mmol/L的乙酸钠缓冲液中进行的。为了研究pH对DNA修饰的纳米CeO2线氧化酶活性的影响,我们在pH为3.0~5.0,浓度均为10mmol/L的乙酸钠缓冲液条件下,探究50μmol/L的纳米CeO2线与1.00μmol/L的DNA相互作用对纳米CeO2线氧化酶活性的影响,结果如图 4所示。从图中可以看出,pH越小,纳米CeO2线氧化ABTS后溶液的紫外吸光度值越大,说明纳米CeO2线的氧化酶活性也越高,这与之前的报导[4]也是一致的。另外,pH越小,1.00μmol/L的DNA修饰的纳米CeO2线氧化ABTS后溶液的紫外吸收下降得越多,说明DNA使纳米CeO2线氧化酶活性下降越多。这些结果表明pH越小,DNA对纳米CeO2线氧化酶活性影响越大。当pH为3.0时,DNA对纳米CeO2线氧化酶活性影响最大。而当pH达到4.5以后,DNA对纳米CeO2线氧化酶活性的影响变化已经很小。但是,从图中还可以看出,当pH小于4.0时,ABTS自身吸光度值逐渐上升,并且pH越小,ABTS溶液的吸光度越大,由此可知,ABTS在pH小于4.0的条件下是不稳定的。因此,研究DNA对纳米CeO2线氧化酶活性影响的最佳pH选为4.0。

|
Download:
|
| 图 4 纳米CeO2线或DNA修饰的纳米CeO2线催化ABTS氧化在417nm处的吸光度值随pH的变化 Fig. 4 Variation in the absorbance at 417nm of ABTS oxidation catalyzed by CeO2 nanowires or DNA modified CeO2 nanowires with the pH value | |
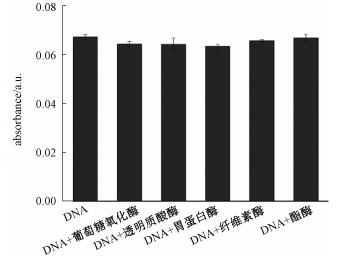
为了探究DNA分子对CeO2纳米线氧化酶活性的影响是否具有特异性,我们选择浓度为0.006mg/mL的葡萄糖氧化酶、透明质酸酶、胃蛋白酶、纤维素酶和酯酶分别与相同浓度的DNA分子同时加入到纳米CeO2线中以研究CeO2纳米线的氧化酶活性(图 5)。从图中可以看出,这几种酶的加入没有影响DNA/CeO2氧化ABTS的能力,也就是说没有干扰DNA对CeO2纳米线氧化酶活性的影响,这说明DNA中磷酸盐骨架与CeO2表面的Ce的相互作用比较强,从而避免其他生物分子对其的干扰,也表明DNA分子对纳米CeO2线氧化酶活性的影响具有特异性。
|
Download:
|
| 图 5 其他酶干扰条件下,DNA对纳米CeO2线催化氧化ABTS在417nm处的紫外吸光度值的影响 Fig. 5 Effect of DNA on the absorbance at 417nm of ABTS oxidation catalyzed by CeO2 nanowires under other enzyme interference | |
本文通过水热法成功合成纳米CeO2线,研究DNA修饰对其类氧化酶活性的影响。结果表明DNA能够抑制纳米CeO2线的类氧化酶活性,并且DNA的浓度越高,抑制作用越明显,另外这种抑制作用具有特异性。这是因为DNA上具有能与Ce3+作用的磷酸盐骨架,二者之间的相互作用影响Ce3+
| [1] |
Pirmohamed T, Dowding J M, Singh S, et al. Nanoceria exhibit redox state-dependent catalase mimetic activity[J]. Chemical Communications, 2010, 46(16): 2736-2738. DOI:10.1039/b922024k |
| [2] |
Heckert E G, Seal S, Self W T. Fenton-like reaction catalyzed by the rare earth inner transition metal cerium[J]. Environmental Science & Technology, 2008, 42(13): 5014-5019. |
| [3] |
Heckert E G, Karakoti A S, Seal S, et al. The role of cerium redox state in the SOD mimetic activity of nanoceria[J]. Biomaterials, 2008, 29(18): 2705-2709. DOI:10.1016/j.biomaterials.2008.03.014 |
| [4] |
Asati A, Santra S, Kaittanis C, et al. Oxidase-like activity of polymer-coated cerium oxide nanoparticles[J]. Angewandte Chemie International Edition, 2009, 48(13): 2308-2312. DOI:10.1002/anie.200805279 |
| [5] |
Vernekar A A, Das T, Mugesh G. Vacancy-engineered nanoceria:enzyme mimetic hotspots for the degradation of nerve agents[J]. Angewandte Chemie International Edition, 2016, 55(4): 1412-1416. DOI:10.1002/anie.201510355 |
| [6] |
Liu B W, Huang Z C, Liu J W. Boosting the oxidase mimicking activity of nanoceria by fluoride capping:rivaling protein enzymes and ultrasensitive F- detection[J]. Nanoscale, 2016, 8(28): 13562-13567. DOI:10.1039/C6NR02730J |
| [7] |
Huang L J, Zhang W T, Chen K, et al. Facet-selective response of trigger molecule to CeO2 {110} for up-regulating oxidase-like activity[J]. Chemical Engineering Journal, 2017, 330: 746-752. DOI:10.1016/j.cej.2017.08.026 |
| [8] |
Cheng H J, Lin S C, Muhammad F, et al. Rationally modulate the oxidase-like activity of nanoceria for self regulated bioassays[J]. Acs Sensors, 2016, 1(11): 1336-1343. DOI:10.1021/acssensors.6b00500 |
| [9] |
Ta na, Zhang M L, Li J, et al. Morphology-dependent redox and catalytic properties of CeO2 nanostructures:Nanowires, nanorods and nanoparticles[J]. Catalysis Today, 2009, 148(1): 179-183. |
| [10] |
Yang Y S, Mao Z, Huang W J, et al. Redox enzyme-mimicking activities of CeO2 nanostructures:Intrinsic influence of exposed facets[J]. Scientific Reports, 2016, 6: 35344. DOI:10.1038/srep35344 |
| [11] |
Sisubalan N, Ramkumar V S, Pugazhendhi A, et al. ROS-mediated cytotoxic activity of ZnO and CeO2 nanoparticles synthesized using the Rubia cordifolia L. leaf extract on MG-63 human osteosarcoma cell lines[J]. Environmental Science and Pollution Research, 2017(4): 1-11. |
| [12] |
Xu C, Liu Z, Wu L, et al. Nucleoside triphosphates as promoters to enhance nanoceria enzyme-like activity and for single-nucleotide polymorphism typing[J]. Advanced Functional Materials, 2014, 24(11): 1624-1630. DOI:10.1002/adfm.v24.11 |
| [13] |
Pautler R, Kelly E Y, Huang P J J, et al. Attaching DNA to nanoceria:regulating oxidase activity and fluorescence quenching[J]. Acs Applied Materials & Interfaces, 2013, 5(15): 6820-6825. |
| [14] |
Zhang Y, Zhou K B, Zhai Y W, et al. Crystal plane effects of nano-CeO2 on its antioxidant activity[J]. Rsc Advances, 2014, 4(92): 50325-50330. DOI:10.1039/C4RA06214K |
| [15] |
Singh S, Dosani T, Karakoti A S, et al. A phosphate-dependent shift in redox state of cerium oxide nanoparticles and its effects on catalytic properties[J]. Biomaterials, 2011, 32(28): 6745-6753. DOI:10.1016/j.biomaterials.2011.05.073 |
 2019, Vol. 36
2019, Vol. 36 


