2. 中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室, 南京 210000;
3. 湖南科技大学生命科学学院, 湖南 湘潭 411201
2. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210000, China;
3. College of Life Science, Hunan University of Science and Technology, Xiangtan 411201, Hunan, China
氮是影响陆地生态系统中植物生长最重要的营养元素之一。由于15N自然丰度是植物生理代谢和氮循环转化等一系列生物地球化学过程和环境变化影响的综合结果,因而植物组织的氮同位素组成(δ15N)能够在一定程度上记录与植物生理生态过程相联系的一系列气候环境信息,成为间接指示植物生理生态、陆地生态系统氮循环和气候环境变化的重要工具[1-15]。另一方面,古气候或古生态学者在对陆相沉积物中有机质的氮同位素所包含的气候环境信息进行解释或用于古生态环境重建时,也要涉及到陆生植物的δ15N组成问题[16-20],因而查清现代植物δ15N与气候环境的关系是正确解释陆相沉积物δ15N结果和提取可靠古环境信息的基础。目前,关于植物δ15N与气候环境关系的研究较多。在全球尺度和一些较小的区域范围内,陆生植物及其相应的土壤δ15N与其生长温度呈正相关关系,而与降水量呈负相关关系[9, 21-25],如Martinelli等[26]通过对美国、巴西、泰国、非洲以及欧洲一些国家的植物δ15N比较之后,发现热带地区森林植物的δ15N要比温带地区的平均偏正6.5‰。然而,来自中国黄土高原的结果显示,植物(含根系与植物残体)和土壤的δ15N从西北到东南均随年平均温度和年平均降水的增加而明显偏负[7];来自中国东北样带的研究也表明,植物叶片δ15N随降水量增加而显著降低,但植物δ15N对温度的响应不敏感[27];而来自中国东部地区的研究则显示,木本植物δ15N随年平均温度和年平均降水的增加呈显著线性偏正[8]。上述这些结果表明,植物δ15N与气候环境的关系可能会随不同区域气候控制因子的变化而有所差异,进而导致在全球不同区域植物/土壤δ15N对气候环境参数的响应不同。因此,广泛开展对全球不同典型区域植物/土壤δ15N与气候环境关系的研究十分必要。
北方农牧交错带是中国北方一个相对独立的自然地理单元,气候、植被、土壤等自然条件和人文要素都表现出明显的过渡性特征,生态系统地球化学循环对温湿变化所表现出的敏感性和脆弱性使得该区对气候环境变化具有明显的指示作用,加上该区气候条件特别是温度总体上存在从东北向西南变化的趋势,这为研究植物/土壤δ15N变化与气候环境之间的关系提供了较为理想的场所。尽管也有学者涉及中国北方农牧交错带植物δ15N与环境因子关系等方面的研究,但研究范围一般仅囿于一个典型地段[28],而在这样一条长达数千公里的农牧交错带上,系统调查植物δ15N变化与气候环境关系的研究还未见报道。本文通过对中国北方农牧交错带草本植物/土壤δ15N的系统调查,结合相应的气候参数研究植物δ15N变化与气候环境因子之间的关系,探讨植物δ15N对气候环境变化的指标作用,为利用植物δ15N作为气候代用指标在古气候环境定量研究中的应用提供依据,同时也为全球生态系统δ15N变化研究提供区域基础数据。
1 材料与方法 1.1 研究区自然概况中国北方农牧交错带(34°48′N~48°32′ N,103°15′E~124°37′E)位于内蒙古高原东南边缘和黄土高原北部,面积62.1×104km2,人口约7.0×107人。该区域属典型的温带半干旱大陆性季风气候,是半湿润区向半干旱区的过渡地带,干旱少雨,年平均降水量300~450mm,年降水变率15%~30%;年平均温度-6.1~8.9℃,且自东北向西南呈减少趋势[29]。自然植被自东向西由森林草原过渡到典型草原和荒漠草原,属典型的干草原植被类型。土壤以栗钙土和黄绵土为主,大多数地区海拔都在1000m以上,地貌复杂多样,以内蒙古高原为主体,草原、山地、沙地、河流和湖泊并存。近年来,在全球变暖和人为活动等多种因素的综合影响下,北方农牧交错带生态系统的脆弱性愈发明显。
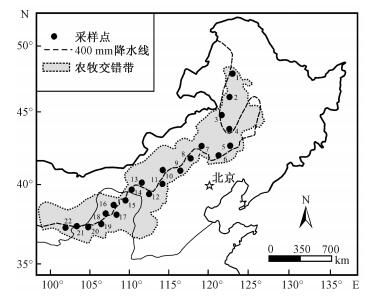
1.2 样品采集与氮同位素测定于2015年7—8月沿北方农牧交错带400mm年等降水量线自东北向西南方向采集植物和土壤样品。大致每隔50~100km选取一个非固定样地,共设置地形平坦开阔、远离居民点、近期没有明显干扰的具有代表性的样地22个(图 1)。在每个样地随机取3个面积均为0.5m×0.5m的样方,对此区域内的优势种和常见草本植物进行采样。取样时,每种植物种视其叶片数量的多少分别采集5~7株,混合作为该种植物的一个样品(约20个叶片),采集的植物样品均单独装入信封内,并在当天洗净、自然晾干。在采集植物样品的同时,也用土钻采集相应样方的表层(0~10cm)土壤,去除杂草、细根、砾石等杂物后,3钻混合形成该样方的一个样品,每个样地共取3个土样,并装入自封袋中。本次共采集草本植物样品241个,其中C3植物样品161个(包括属于一年生草本植物的样品10个和属于多年生草本植物的样品151个),C4植物样品80个(均为一年生草本植物);土壤样品66个。各样点的经纬度、海拔高度采用Magellan Triton-400全球定位系统进行测定,所有样点的气候参数、土壤和植被类型以及每个采样点采集的植物种等信息均列于表 1。
|
Download:
|
| 图 1 研究区采样点分布 Fig. 1 Locations of the sampling sites in the study area | |
|
|
表 1 研究区各样点的基本信息,草本植物平均氮同位值以及采集的植物种 Table 1 Basic information of the sampling sites, average δ15N value of herbs, and plant species collected at each site in the study area |
植物样品带回实验室后,置于烘箱内65℃下烘干48h,然后研磨粉碎过80目筛,供测试用。土壤样品自然风干后过2mm目筛,用0.5mol/L的盐酸溶液浸泡24h,以去除土壤中的碳酸盐,最后用去离子水洗涤至上清液呈中性,并于60℃烘干后磨细备用。
制备好的植物和土壤样品采用带有Flash EA1 112 N元素分析仪的Finnigan MAT DelteplusXP质谱仪进行在线分析,测定每个样品的氮同位素组成和C、N含量,氮同位素的测量精度为±0.3‰。样品δ15N的计算公式为
| $ {\delta ^{15}}{\rm{N}} = \left[ {\left( {\frac{{{R_{{\rm{sample}}}}}}{{{R_{{\rm{standard}}}}}}} \right) - 1} \right]{\rm{ }} \times 1000. $ |
式中,Rsample和Rstandard分别表示样品和标准物(大气N2)的15N/14N比值。
1.3 气象数据来源本文所涉及的温度和降水数据(1971—2015年)均来自当地气象部门或中国气象科学数据共享服务网以及中国生态系统研究网络(Chinese Ecosystem Research Network,CERN)综合中心。在22个采样点中,有14个样点是来自邻近气象站点提供的1971—2015年的年平均温度(annual mean temperature,AMT)、年平均降水量(annual mean precipitation,AMP)以及采样当年的平均温度(mean temperature,MT)和年降水量(annual precipitation,AP);其余8个采样点的AMT(或MT)采用研究区域内以经度(L)、纬度(N)和海拔(E)为自变量的回归方程MT=63.2-0.089L-1.03N-0.005E(R2=0.908)和AMT=82.0-0.167L-1.23N-0.00585E(R2=0.903)进行插值计算得到[30]。由于本研究中各采样点大致是沿中国北方400mm年等降水量线进行布设的,其降水量与经纬度及海拔不存在相关关系。为此,本文从CERN综合中心构建的全国陆地生态信息气象栅格数据库(空间分辨率为1km×1km)用ArcGIS 10.2软件提取年平均降水量作为其余8个采样点的降水数据。
1.4 统计分析采用SAS 9.0软件进行统计分析,所有数据均以样点均值表示。利用线性回归分析检验植物/土壤δ15N与各气候环境因子之间的关系(为消除叶龄差异对植物δ15N的影响,5种一年生C3植物的10个样品未列入分析;C4植物样品与采样当年平均温度和年降水量进行分析,下同)。考虑到研究区降水量与温度之间可能存在相关性,这里采用偏相关和基于赤池信息量准则(AIC)的多元回归分析探讨温度和降水因子与植物δ15N的关系,以便区分温度、降水对植物δ15N的影响程度和消除样点数对统计检验的影响。此外,用One-Way方差分析检验C3、C4草本植物的平均δ15N是否存在显著差异。
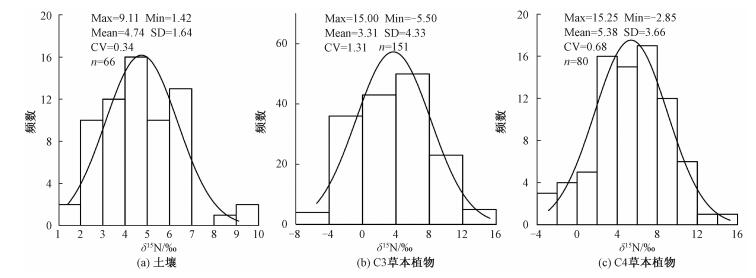
2 结果与讨论 2.1 北方农牧交错带土壤、植物δ15N的组成特征中国北方农牧交错带土壤、植物的δ15N分布如图 2。从图 2(a)可知,研究区土壤δ15N的分布区间为1.42‰~9.11‰(平均值:4.74‰),92.4%的数据位于前人报道[7]的中国黄土高原土壤δ15N的分布范围(-1.2‰~5.8‰)之内,但平均值明显较黄土高原土壤δ15N的(1.9‰)偏正,原因是本研究区属于中国半干旱、半湿润的过渡区域,并且所有土壤样品几乎都是沿400mm等降水量线采集的,而前人研究的黄土高原年平均降水量变化在350~700mm,多数土壤样品来自于黄土高原的半湿润地区。图 2(b)、2(c)显示,研究区草本植物δ15N值的频数分布均呈单峰型,总体植物的δ15N变化区间为-5.5‰~15.3‰,平均值为4.06‰,变异系数为1.05,说明草本植物δ15N在研究区内具有较大的空间变异性和种间差异。其中,C3草本植物的δ15N值范围(-5.5‰~15.0‰)比C4草本植物的(-2.85‰~15.3‰)要宽,变异系数是C4植物的1.9倍,这可能与研究区采集的两种不同光合型植物的种数存在较大的差异有关(表 1)。尽管如此,两者多于95.0%的数据集中在-4‰~12‰的范围内,基本与前人报道的中国北方地区植物δ15N的分布区间(C3植物:-5.1‰~13.0‰;C4植物:-3.2‰~12.4‰)一致[31],但与全球植物δ15N的分布范围(-10.0‰~20.0‰)相比[32],本区调查的植物δ15N的分布区间则较为集中。出现这种现象的原因是:1)本研究中的样品均来自由半干旱地区向半湿润地区的过渡区域,气候条件较全球相对简单;2)本次采集的植物样品均为单一的草本植物,而全球植物的δ15N值则包含木质植物的贡献。一般情况下,不同生态功能型植物对土壤中不同氮源的吸收具有选择性(草本植物从土壤中吸收的氮源的δ15N值比木本植物从土壤中吸收的氮源的δ15N值明显要低),从而导致不同功能型植物的δ15N具有显著差异,表现为乔木>灌木>草本[33-34]。
|
Download:
|
| 图 2 研究区土壤(a)和植物(b、c)δ15N的频数分布 Fig. 2 Frequency distributions of δ15N for soil and herbs in the study area | |
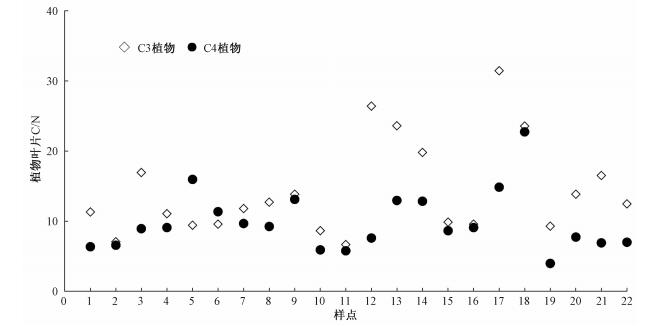
从植物δ15N的平均值来看,本次测试的所有草本植物的δ15N平均值为4.02‰(n=231),其中C3草本植物的δ15N平均值为3.31‰(n=151),显著低于C4植物的δ15N平均值5.38‰(n=80);在同一个样点内,除样点5(乌兰浩特)和样点7(扎鲁特旗)外,其他调查的20个样点的C4植物的δ15N值均显著高于相应样点C3植物的δ15N值(表 1)。出现这种现象的原因可能有两个方面:1)植物δ15N受不同光合型植物碳氮代谢能力差异的影响。图 3显示,C4草本植物的C/N比在多数样点均明显小于C3植物,说明C4植物具有较高的氮吸收性能,有可能使叶片N素富集,叶片N含量增加,而植物δ15N通常与叶片N含量呈正相关关系,从而导致植物δ15N较高;2)植物δ15N与土壤中各种氮源(如铵态氮和硝态氮)的同位素组成及其有效性有关,且不同光合型植物通常对土壤中可利用氮源的吸收具有偏好性[35],特别是当土壤中微生物固持的无机氮特别是铵态氮较多时,植物优先吸收的氮源(铵态氮)的有效性就会降低,C3植物从以铵态氮为主要氮源转变为以硝态氮为主要氮源,而目前普遍认为土壤中硝态氮的δ15N值比铵态氮的明显要低,从而有可能使C3植物的δ15N比C4植物的偏负。由于本研究未对土壤中硝态氮和铵态氮的δ15N值进行测定,从而限制了进一步探讨植物δ15N组成变化的原因。因此,深入分析土壤中不同氮源对植物δ15N的影响是今后需要考虑的问题。
|
Download:
|
| 图 3 研究区各样点C3、C4草本植物叶片碳氮比 Fig. 3 C/N ratios of C3 and C4 herbs at different sites in the study area | |
然而,本研究结果与Aranibar等[33]在南非得到的结果相反,即在同一地点C3植物的δ15N值明显高于C4植物。但我们认为二者的研究结果很难进行比较,主要原因有两点:1)本研究区所有采样是在降水相似(400mm年等降水量线)的条件下沿一定的温度梯度进行的,而Aranibar等[33]在南非选取的4个采样点是沿一定的降水梯度设置的,年均降水量变化在360~900mm,二者气候条件相差较大;2)Aranibar等[33]在研究中除使用的C4植物为草本植物外,C3植物多为乔木和灌木,这与本研究中调查的C3植物均为草本植物明显不同,而不同生活型植物为适应环境条件的变化会从形态、生理特性上表现出较大的差异,进而影响植物的氮同位素组成。
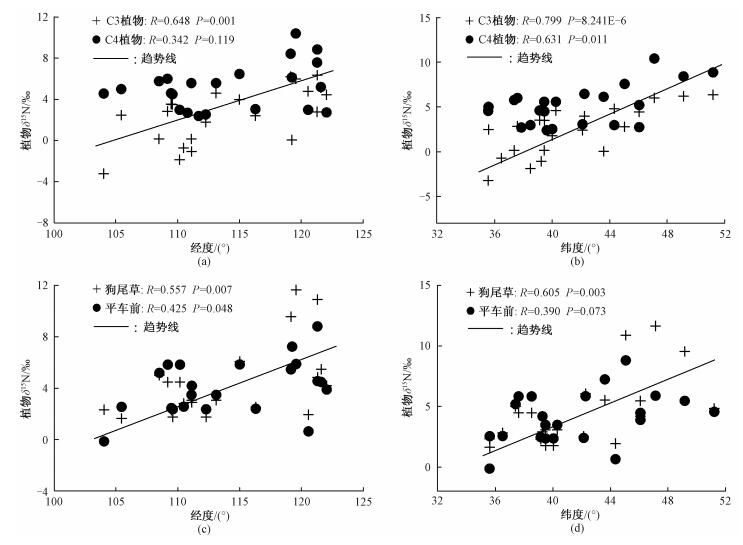
2.2 北方农牧交错带草本植物δ15N的梯度变化及指示的气候环境意义图 4显示,研究区草本植物δ15N随经纬度增加均表现出逐渐偏正的梯度变化趋势,整体草本植物的δ15N值均与经纬度呈显著正相关关系(整体C4草本植物δ15N与经度的相关性不显著除外)。这表明在研究区内不管是C3草本植物还是C4草本植物,整体δ15N值均表现出自东北向西南呈偏负的趋势(图 4(a)、4(b))。对于单个广适性植物种而言,平车前和狗尾草的δ15N值对经、纬度变化的响应基本与整体草本植物相似,不同的是狗尾草的δ15N值与经纬度的相关性较平车前更明显(图 4(c)、4(d))。
|
Download:
|
| 图 4 研究区草本植物δ15N与经度(a、c)和纬度(b、d)的关系 Fig. 4 Relationships between herbs δ15N and longitude and latitude in the study area | |
由于影响植物δ15N的气候环境因素会随经纬度或海拔等的差异而产生不同程度的变化,并且它们与经纬度和海拔之间具有一定的相关关系(表 2)。因此,植物δ15N在研究区内随经纬度呈现的梯度变化在一定程度上可以指示气候环境的变化,但在不同的研究区域,这些影响因子(如温度、降水等)相对于植物δ15N组成的意义则不同。
|
|
表 2 研究区气候因子与地理变量之间的回归分析 Table 2 Regression analysis of climate parameters and geographic variables in the study area |
降水被认为是影响植物、土壤δ15N最重要的环境因子之一。图 5(a)显示,随着年平均降水量的增加,研究区内整体C3植物和整体C4植物的δ15N值均呈现微弱的偏负趋势,这与来自中国北方地区以及南非、赞比亚和纳米比亚等地区的研究结果略微相似[7, 21, 23, 28, 31],即随着干旱的增加,植物δ15N不断偏正。但在本研究区内,植物δ15N对年平均降水量(C4植物对应采样当年的降水量)变化的响应程度(C3草本植物:-0.002‰/mm;C4草本植物:-0.008‰/mm)明显要小于在中国黄土高原(植物根系:-0.011‰/mm;植物残体:-0.014‰/mm)以及东北样带(C3草本植物:-0.013‰/mm;C4草本植物:-0.011‰/mm)等地区得到的结果,表明在本研究中植物δ15N对降水变化的指示作用有限(原因是研究样带上各样点间降水量的差异较小);同时也说明植物δ15N与气候因子之间的关系可能会随区域气候控制因素的变化而有所差异。
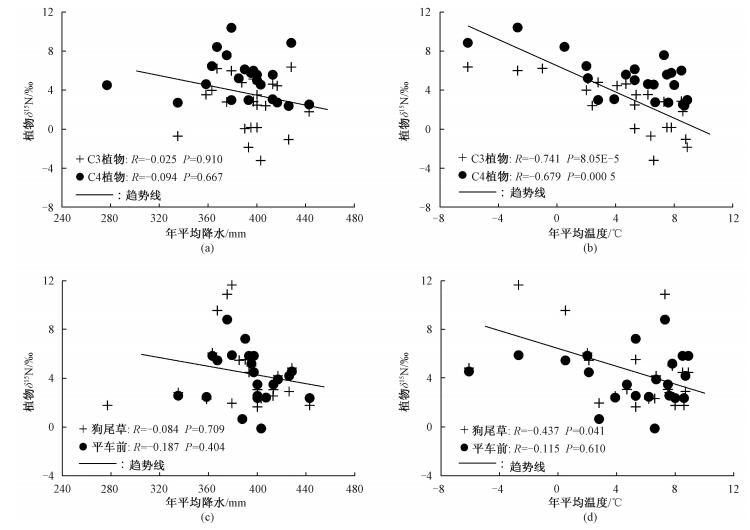
|
Download:
|
| 图 5 研究区草本植物δ15N随降水(a、c)和温度(b、d)的变化 Fig. 5 Changes in the δ15N values for herbs with precipitation and temperature in the study area | |
从植物δ15N与气候因子的多元回归及偏相关分析的结果看,本研究区所有草本植物的δ15N值与年平均降水量(C4植物采用当年降水量)之间的线性关系并不显著(表 3),同样的情况也出现在单个广适性植物种的δ15N与降水量的偏相关分析中(图 5(c)),再次表明在研究样带上降水量对植物δ15N的影响有限。我们认为出现这种现象可能与研究样带上样点的年平均降水量不存在梯度变化有关。这是因为分析的植物样品大多是沿400mm年等降水量线采集的,样点间的年平均降水量变化在357.2~442.8mm,变差系数仅为5.5%,全部样点的年平均降水量在区域范围内随经纬度和海拔变化表现出极微弱的相关性(表 2)。因此,降水对本区各样点间植物δ15N产生的差异应该是有限的。
|
|
表 3 研究区草本植物δ15N与气候参数的偏相关分析 Table 3 Partial correlation analysis of the herb δ15N values and climate parameters in the study area |
目前,关于植物δ15N随降水增加而偏负的解释较多。Sutton等[36]将降水增加引起的植物δ15N偏负解释为植物通过叶片气孔或表皮直接吸收了大气降水中的NH4+,而降水中的铵态氮的δ15N往往较硝态氮的偏负。但另一些研究[33, 35]认为,植物δ15N随降水的变化主要与降水影响土壤有机氮向无机氮的转化以及无机氮损失(硝酸盐淋溶、氨挥发和反硝化作用)导致土壤氮库中15N富集的改变有关。这是因为植物氮素的获取主要是来源于对土壤无机氮(铵态氮、硝态氮)的吸收,而降水增加对土壤中可利用氮的影响主要是通过降低微生物活性以及土壤中铵态氮和硝态氮相对含量的变化来实现,在此过程中会发生氮同位素分馏。一般情况下,随着干燥指数降低,土壤中NO3-的利用效率提高,更多的NO3-会被植物吸收并保存到土壤氮库中,导致土壤氮库中NO3-离子增多,土壤中贫15N;同时,随着土壤湿度增大,土壤微生物活性降低,土壤净硝化作用受到抑制,引起土壤无机氮的有效性降低,进而抑制土壤氮库中15N的富集,从而使植物δ15N偏负。而在相对干旱的环境中,由于降水量减少,土壤微生物活性增加,导致土壤中氨化作用增强,氮循环开放度增加,于是土壤中易发生15N的富集,最终使植物δ15N偏正。在本样带上,尽管各样点间年平均降水量的差异不大,但土壤δ15N随年平均降水量的增加表现出明显的递减趋势(表 2)。出现这种结果的原因,一个很可能的解释是温度上升导致的土壤δ15N的显著偏负效应(表 2)加剧了降水量增加对土壤δ15N的偏负效应,因为在本研究中,年平均降水量与年平均温度随经纬的变化具有一定的同步性,二者随经纬度的增加均呈减少趋势,且年平均温度与经纬度的关系达到极显著水平(表 2);加上本样带上植物δ15N与土壤δ15N具有较好的正相关性(图 6),从而导致整体植物的δ15N随降水增加也表现出微弱的负相关关系。
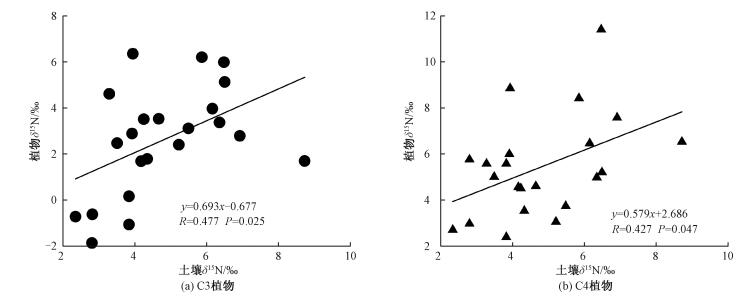
|
Download:
|
| 图 6 研究区C3(a)、C4(b)草本植物δ15N与表层土壤δ15N的关系 Fig. 6 Correlations of δ15N of C3 and C4 herbs with surface soil δ15N in the study area | |
温度是影响植物氮同位素组成的另一重要环境因子。Martinelli等[26]的研究表明,来自热带地区的植物平均δ15N要比来自温带地区的偏正6.5‰;Liu等[9]对东非裂谷带埃塞俄比亚段内的C3植物研究发现,温度每升高1℃植物δ15N值增加0.5‰。而在本研究中,整体草本植物和单个植物种(平车前除外)以及土壤的δ15N均随年平均温度增加呈显著的偏负趋势(图 5(b)、图 5(d)、表 2)。年均温度每增加1℃,整体C3、C4草本植物的δ15N值分别偏负0.41‰和0.39‰,这与上述得到的陆生植物δ15N与其生长温度呈正相关的结论相悖,但与黄土高原和东北样带草原区植物δ15N与年平均温度呈负相关的结果相似。关于植物δ15N与温度呈正相关的原因,Aranibar等[33]将其解释为较高的温度提高了土壤的净硝化潜力或者增加了土壤氮循环的开放性,而Liu和Wang[7]以及刘艳杰等[27]把黄土高原和东北样带植物δ15N与温度呈负相关的结果归结为“雨热同期”中降水增加导致植物δ15N的偏负效应超过温度增加导致的植物δ15N的偏正效应,表明在上述两个区域,植物δ15N的变化究竟是受水分因子主导还是由温度主导并不是完全清楚。而在本样带上,我们认为温度是影响植物δ15N变化的一个重要因素,并且植物/土壤δ15N随温度增加偏负是可能的。原因是:1)本样带跨度范围较广(南北距离约1900km,东西距离约1500km),样点间年平均温度最大值与最小值相差15.0℃左右,且自东北向西南方向存在明显的温度梯度,而研究区各样点的年均降水量差异较小,基本上可视为等同;2)对比样带中温度、降水与经纬度之间的关系,可以发现年平均温度随地理位置由西南往东北呈显著递减的趋势,并且与经、纬度呈极显著的负相关关系,经纬度每增加1°,年均温度分别下降0.43和0.74℃,而年平均降水量与经纬度的关系不显著(表 2),这意味着温度随经纬度变化对植物δ15N产生的影响应该大于降水因子的作用。多元线性回归与偏相关分析的结果显示(表 3),在本样带上,控制降水变化后的草本植物叶片δ15N值与年平均温度之间的相关关系更加显著,表明在本样带上,温度是导致植物δ15N变化的关键因子,也意味着通过对植物氮同位素组成的分析,可以在一定程度上指示该区温度变化的信息;3)前人也得出过植物δ15N随温度增加而偏负或变化不明显的情形[37]。如Yi和Yang[38]发现高寒草甸植物δ15N随海拔升高(温度降低)有逐渐变重的趋势,但不显著;Liu X Z等[39]在对北京东灵山地区植物δ15N的研究中发现,当温度 < 3.5℃时,草本植物δ15N随温度增加而偏负,而当温度高于此值时δ15N随温度增加而偏正。至于植物δ15N随温度降低而偏正,可能是较低的温度增加了土壤溶液或植物体内水分的黏滞性,导致土壤或植物处于水分胁迫状态(生理干旱),从而使植物δ15N值增加。
2.2.3 植物δ15N对海拔变化的指示引起植物δ15N变化的环境因素除温度和降水等外,海拔也被认为是影响植物δ15N组成的重要环境因子之一。图 7显示,在本研究样带,除平车前和狗尾草两种广适性植物的δ15N随海拔增加呈显著减少趋势外,C3、C4整体植物的δ15N值随海拔增加并未表现出明显的偏负趋势,说明海拔不是影响该区植物δ15N的主要环境因子。实质上,海拔本身并不影响植物δ15N的变化,植物δ15N值随海拔增加而偏负主要是与海拔上升引起的温度、降水等的改变导致的土壤净硝化能力下降有关。在高海拔地区,冷湿的环境会使微生物活性降低,土壤净硝化能力明显要弱于低海拔地区,而植物δ15N通常与土壤净硝化能力呈正相关。在本样带上,样点间的海拔变化在265~1931m(表 1),较大的海拔高差可能会引起温度、降水等环境因子的显著变化,从而影响植物的δ15N。然而,表 2的结果显示,随着海拔高度的增加,样点的年平均温度和年平均降水量均表现出微弱的上升趋势(降水的微弱变化与样点大致沿400mm等降水量线布设有关)。这种温度随海拔升高而增加的现象可能与样带纬度由北向南递减产生的增温效应大于海拔升高对温度产生的下降作用有关,原因是该样带南北跨度直线距离约1900km,由北往南样点的海拔高度呈增加趋势(表 1),与纬度的下降趋势相反;而纬度是决定温度变化的关键因素,且二者呈负相关关系。上述年平均温度和年平均降水随海拔升高的微弱变化进一步表明,海拔对本区整体植物的δ15N值影响非常有限(图 7(a)),而对单个广适性植物种的δ15N值影响显著(图 7(b)),至于海拔变化引起的环境因子对植物δ15N产生的叠加效应不是十分清楚,仍需要开展进一步的研究。
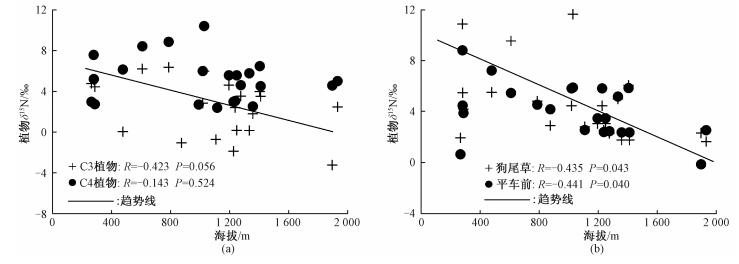
|
Download:
|
| 图 7 研究区整体草本植物(a)和单个植物种(b)δ15N与海拔的关系 Fig. 7 Relationships of the δ15N valuas of the whole herbs and single species with altitude in the study area | |
通过对中国北方农牧交错带草本植物/土壤δ15N的调查以及与气候环境因子的分析表明:1)整体草本植物的δ15N值变化在-5.5‰~15.3‰,平均值为4.02‰,变异系数为105%。其中,C3草本植物的δ15N值范围(-5.5‰~15.0‰)要比C4草本植物(-2.85‰~15.3‰)的宽,但其平均值(3.31‰)比C4草本植物(5.38‰)的显著要低;土壤的δ15N值变化在1.42‰~9.11‰,平均值为4.74‰,分布区间与前人报道的中国北方土壤的δ15N区间一致;2)整体C3、C4草本植物以及2种广适性植物的δ15N值与地理经纬度均呈显著正相关关系(C4草本植物δ15N与经度关系不显著除外),植物δ15N随地理位置由东北往西南呈偏负的梯度变化,但整体植物δ15N与海拔无显著相关性;3)沿样带自东北向西南,整体植物/土壤的δ15N随年平均温度升高呈显著偏负趋势,温度每增加1℃,C3、C4草本植物δ15N分别偏负0.41‰和0.39‰;但植物δ15N随降水增加呈微弱偏负趋势;4)偏相关与多元线性回归分析的结果显示,在降水变化控制后,草本植物δ15N与年平均温度之间的相关性更加显著,而在控制温度变化后,植物δ15N与年平均降水之间的关系变得更加微弱,由此可以推断温度是控制本样带植物δ15N变化的关键因子,降水对植物δ15N的影响有限。上述结果表明,对植物氮同位素组成的分析可以在一定程度上为中国北方农牧交错带温度变化提供较好的指示作用。
| [1] |
Aranibar J N, Otter L, Macko S A, et al. Nitrogen cycling in the soil-plant system along a precipitation gradient in the Kalahari sands[J]. Global Change Biology, 2004, 10(3): 359-373. DOI:10.1111/gcb.2004.10.issue-3 |
| [2] |
Handley L L, Raven J A. The use of natural abundance of nitrogen isotopes in plant physiology and ecology[J]. Plant Cell & Environment, 2006, 15(9): 965-985. |
| [3] |
Sah S P, Brumme R B. Altitudinal gradients of natural abundance of stable isotopes of nitrogen and carbon in the needles and soil of a pine forest in Nepal[J]. Journal of Forest Science, 2003, 49: 19-26. |
| [4] |
Templer P H, Arthur M A, Lovett G M, et al. Plant and soil natural abundance δ15N:indicators of relative rates of nitrogen cycling in temperate forest ecosystems[J]. Oecologia, 2007, 153(2): 399-406. DOI:10.1007/s00442-007-0746-7 |
| [5] |
Kahmen A, Wanek W, Buchmann N. Foliar δ15N values characterize soil N cycling and reflect nitrate or ammonium preference of plants along a temperate grassland gradient[J]. Oecologia, 2008, 156(4): 861-870. DOI:10.1007/s00442-008-1028-8 |
| [6] |
Cheng S L, Fang H J, Yu G R, et al. Foliarand soil δ15N natural abundances provide field evidence onnitrogen dynamics in temperate and boreal forest ecosystems[J]. Plant and Soil, 2010, 337: 285-297. DOI:10.1007/s11104-010-0524-x |
| [7] |
Liu W G, Wang Z. Nitrogen isotopic composition of plantsoil in the Loess Plateau and its responding to environmental change[J]. Chinese Science Bulletion, 2009, 54(2): 272-279. |
| [8] |
Kang H Z, Liu C J, Yu W J, et al. Variation in foliar δ15N among oriental oak stands over eastern China:patterns and interactions[J]. Journal of Geochemical Exploration, 2011, 110: 8-14. DOI:10.1016/j.gexplo.2011.02.002 |
| [9] |
Liu X H, Zhao L J, Menassie G, et al. Foliar δ13C and δ15N values of C3 plants in the Ethiopia Rift Valley and their environmental controls[J]. Chinese Science Bulletin, 2007, 52(9): 1265-1273. DOI:10.1007/s11434-007-0165-5 |
| [10] |
Chang C C, McCormick P V, Newman S, et al. Isotopic indicators of environmental change in a subtropical wetland[J]. Ecological Indicators, 2009, 9(5): 825-836. DOI:10.1016/j.ecolind.2008.09.015 |
| [11] |
Makarov M I. The nitrogen isotopic composition in soils and plants:its use in environmental studies[J]. Eurasian Soil Science, 2009, 42(12): 1335-1347. DOI:10.1134/S1064229309120035 |
| [12] |
Wang L X, D'Odorico P, Ries L, et al. Patterns and implications of plant-soil δ13C and δ15N values in African savanna ecosystems[J]. Quaternary Research, 2010, 73(1): 77-83. DOI:10.1016/j.yqres.2008.11.004 |
| [13] |
Fang Y T, Koba K, Yoh M, et al. Patterns of foliar δ15N and their control in Eastern Asian forests[J]. Ecological Research, 2013, 28(5): 735-748. DOI:10.1007/s11284-012-0934-8 |
| [14] |
Yang Y H, Ji C J, Robinson D, et al. Vegetation and soil 15N natural abundance in alpine grasslands onthe Tibetan Plateau:patterns and implications[J]. Ecosystems, 2013, 16(6): 1013-1024. DOI:10.1007/s10021-013-9664-1 |
| [15] |
Ariz I, Cruz C, Neves T, et al. Leaf δ15N as a physiological indicator of the responsiveness of N2-fixing alfalfa plants to elevated CO2, temperature and low water availability[J]. Frontiers in Plant Science, 2015, 6: 1-10. |
| [16] |
Terwilliger V J, Eshetu Z, Colman A, et al. Reconstructing palaeoenvironment from δ13C and δ15N values of soil organic matter:a calibration from arid and wetter elevation transects in Ethiopia[J]. Geoderma, 2008, 147: 197-210. DOI:10.1016/j.geoderma.2008.09.001 |
| [17] |
Schatz A K, Zech M, Buggle B, et al. The late Quaternary loess record of Tokaj, Hungary:reconstructing palaeoenvironment, vegetation and climate using stable C and N isotopes and biomarkers[J]. Quaternary International, 2011, 240(1/2): 52-61. |
| [18] |
Das O, Wang Y, Donoghue J, et al. Reconstruction of paleostorms and paleoenvironment using geochemical proxiesarchived in the sediments of two coastal lakes in northwest Florida[J]. Quaternary Science Reviews, 2013, 68(3): 142-153. |
| [19] |
Liu J C, Liu W G. Soil nitrogen isotopic composition of the Xifeng loess-paleosol sequence and its potential for use as a paleoenvironmental proxy[J]. Quaternary International, 2017, 440: 35-41. DOI:10.1016/j.quaint.2016.04.018 |
| [20] |
尚晓冬, 时国, 韦恒叶. 贵阳花溪地区早三叠世碳、氧同位素特征及其古环境意义[J]. 中国科学院大学学报, 2015, 32(3): 363-372. |
| [21] |
Amundson R, Austin A T, Schuur E A G, et al. Global parrerns of the isotopic composition of soil and plant nitrogen[J]. Global Biogeochem Cycles, 2003, 17(1): 1-11. |
| [22] |
Amundson R. New insights into the global patterns of the isotopic composition of soil and plant nitrogen[J]. Esa Convention, 2014, 17(1): 2076-2079. |
| [23] |
Swap R J, Aranibar J N, Dowty P R, et al. Natural abundance of 13C and 15N in C3 and C4 vegetation of southern Africa:patterns and implications[J]. Global Change Biology, 2004, 10(3): 359-373. DOI:10.1111/gcb.2004.10.issue-3 |
| [24] |
Craine J M, Elmore A J, Aidar M P, et al. Global patterns of foliar nitrogenisotopes and their relationshipswith climate, mycorrhizal fungi, foliar nutrient concentrations, and nitrogen availability[J]. New Phytologist, 2009, 183(4): 980-992. DOI:10.1111/nph.2009.183.issue-4 |
| [25] |
Peri P, Ladd B, Pepper D, et al. Carbon (δ13C)and nitrogen (δ15N) stable isotope compositionin plant and soil in Southern Patagonia's native forests[J]. Global Change Biology, 2012, 18(1): 311-321. DOI:10.1111/j.1365-2486.2011.02494.x |
| [26] |
Martinelli L A, Piccolo M C, Townsend A R, et al. Nitrogen stable isotopic composition of leaves and soil:tropical versus temperate forests[J]. Biogeochemistry, 1999, 46(1-3): 45-65. DOI:10.1007/BF01007573 |
| [27] |
刘艳杰, 许宁, 牛海山. 内蒙古草原常见植物叶片δ13C和δ15N对环境因子的响应[J]. 生态学报, 2016, 36(1): 235-243. |
| [28] |
Xu Y, He J C, Cheng W X, et al. Natural 15N abundance in soils and plants in relation to N cyclingin a rangeland in Inner Mongolia[J]. Journal of Plant Ecology, 2010, 3(3): 201-207. DOI:10.1093/jpe/rtq023 |
| [29] |
刘贤赵, 王国安, 李嘉竹, 等. 中国北方农牧交错带C3草本植物δ13C与温度的关系及其对水分利用效率的指示[J]. 生态学报, 2011, 31(1): 123-136. |
| [30] |
Cheng W X, Chen Q S, Xu Y Q, et al. Climate and ecosystem 15N natural abundance along a transectof Inner Mongolian grasslands:contrasting regional patternsand global patterns[J]. Global Biogeochemical Cycles, 2009, 23: 1-11. |
| [31] |
Ma J Y, Sun W, Liu X N, et al. Variation in the stable carbon and nitrogen isotope composition of plants and soil along a precipitation gradient in Northern China[J]. PLoS ONE, 2012, 7(12): e51894. DOI:10.1371/journal.pone.0051894 |
| [32] |
Peterson B J, Fry B. Stable isotopes in ecosystem studies[J]. Annual Review of Ecology & Systematics, 1987, 18(1): 293-320. |
| [33] |
Aranibar J N, Anderson I C, Epstein H E, et al. Niriogen isotope composition of soils, C3 and C4 plants along land use gradients in southern Africa[J]. Journal of Arid Environments, 2008, 72(4): 326-337. DOI:10.1016/j.jaridenv.2007.06.007 |
| [34] |
Ometto J P H B, Ehleringer J R, Domingues T F, et al. The stable carbon and nitrogen isotopic composition of vegetation in tropical forests of the AmazonBasin, Brazil[J]. Biogeochemistry, 2006, 79(1/2): 251-274. |
| [35] |
Houlton B Z, Sigman D M, Hedin L O. A climate-driven switch in plant nitrogen acquisition within tropical forest communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(21): 8902-8906. DOI:10.1073/pnas.0609935104 |
| [36] |
Sutton M A, Schjorring J K, Wyers G P. Plant-atmosphere exchange of ammonia[J]. Philosophical Transactions:Physical Sciences and Engineering, 1995, 351(1696): 261-278. |
| [37] |
Bai E, Boutton TW, Liu F, et al. Spatial variation of the stable nitrogen isotope ratio of woody plants along a topoedaphic gradient in a subtropical savanna[J]. Oecologia, 2009, 159(3): 493-503. DOI:10.1007/s00442-008-1246-0 |
| [38] |
Yi X F, Yang Y Q. Enrichement of stable carbon and nitrogen isotopes of plant populations and planteau pikas along altitudes[J]. Journal of Animal & Feedences, 2006, 15(4): 661-667. |
| [39] |
Liu X Z, Wang G A, Li J Z, et al. Nitrogen isotope composition characteristics of modern plants andtheir variations along an altitudinal gradient in Dongling Mountain in Beijing[J]. Science China-Earth Sciences, 2010, 53(1): 128-140. DOI:10.1007/s11430-009-0175-z |
 2018, Vol. 35
2018, Vol. 35 


