活性氧(ROS)是细胞代谢的副产物[1]。内外条件的急剧变化都会使生物体内产生大量的活性氧,形成氧化损伤[2]。ROS包括超氧化物阴离子(O2·-),过氧化氢(H2O2)和羟自由基(HO·)等。生理条件下,低水平的ROS在免疫应答、信号转导、基因表达等生物学功能中起到重要作用。但是高水平的ROS能够引起蛋白质、脂质和核酸的损伤[3]。
由于具有真核细胞生命活动的基本特征,又具有微生物实验过程中的优势,如样品易得、生长周期短、易于操作等;因此,酿酒酵母(S. cerevisiae)是一种理想生物研究模型[1, 3]。实验研究表明营养和环境因素的刺激能够诱导发酵中的酵母产生ROS。与此同时,酵母细胞具有一系列应对ROS的酶和非酶系统[4-5]。
食品中大多数氨基酸是以L-氨基酸的形式存在。作为肽链和蛋白质的合成原料,L-氨基酸是生物体内的关键代谢中间体[6]。然而,研究表明食品中存在着大量的D-氨基酸。食品中的D-氨基酸来自食品加工过程及微生物代谢[7-9]。由于其结构的相似性,D-氨基酸能够模拟L-氨基酸的细胞功能,抑制细胞生长[10]。事实上,大量研究对D-氨基酸对细胞生长的抑制作用进行了报道[11-13]。生物体内,D-氨基酸的代谢是由消旋酶/异构酶和D-氨基酸氧化酶/D-天冬氨酸氧化酶来完成的[14]。作为D-氨基酸的主要代谢途径,D-氨基酸氧化酶/D-天冬氨酸氧化酶能够将D-氨基酸的氨基氧化生成相应的α-酮酸、NH3和H2O2[15]。而H2O2是一种常见的ROS。
综上所述,尽管研究者们对D-氨基酸进行了大量研究,但是D-氨基酸细胞毒性的分子机制的研究仍然缺乏。D-氨基酸诱导的酵母细胞中活性氧的累积和清除,及其对细胞组分的损伤并未见报道。因此,本文研究D-氨基酸的生物化学毒性。我们检测活性氧的含量、脂质过氧化程度、抗氧化酶的活性及抗氧化物的含量以评估D-氨基酸氧化酶的细胞毒性。
1 实验部分 1.1 材料与试剂实验所用的试剂是分析纯。所有溶液用超纯水配制。葡萄糖购自北京化工厂,YNB(无氨基酸酵母氮源)购自BD Difco,马铃薯葡萄糖琼脂培养基(PDA),酵母抽提物和胰蛋白胨购自OXID。所有的氨基酸购自J & K Chemical。还原型谷胱甘肽、NADPH和谷胱甘肽还原酶(GR)购自北京索莱宝公司。其他试剂从Macklin公司购买。
1.2 菌株及培养条件ATCC4126酵母菌接种到YPD培养基(10 g/L酵母抽提物; 20 g/L胰蛋白胨; 20 g/L葡萄糖)中培养,30 ℃培养到指数生长期。将指数生长期的菌液接种到含有不同浓度L-氨基酸和D-氨基酸的合成培养基(6.7 g/L YNB和20 g/L glucose)上培养。所有的培养基在121 ℃下灭菌20 min。葡萄糖115 ℃下单独灭菌20 min后加入。L-氨基酸和D-氨基酸用0.25 μm滤膜(Sartorius Stedim Biotech S.A., Aubagne, France)过滤后加入到培养基中。细胞置于摇床(30 ℃,200 rpm,SPH-110A)中培养24 h后收集酵母细胞,测定600 nm处的吸光度。
菌液离心(4 ℃,12 000 g)10 min后收集细胞,用灭菌水冲洗细胞两次,低温储存备用。
1.3 O2·-的含量O2·-含量的检测基于亚硝酸盐的生成量[16]。将细胞悬浮在含1 mmol/L EDTA,相对体积质量为1%的聚乙烯吡咯烷酮(PVP)的磷酸缓冲溶液(50 mmol/L,pH 7.8)中。12 000 g离心10 min后,弃沉淀,依次向上清液中加入0.5 mL磷酸缓冲溶液(50 mmol/L,pH 7.8),0.1 mL盐酸羟胺(10 mmol/L)。反应物在25 ℃水浴10 min后,加入1 mL α-萘胺(7 mmol/L)和1 mL磺胺(58 mmol/L)。25 ℃孵育30 min后,使用紫外分光光度计(Shimazu, UV-2550)测定530 nm处的吸光度。
| $ \begin{align} &\ \ \ \ \ \ \ \ {\rm O}_{2}^{\cdot {\rm -}}{\rm 含量}\left( {\rm nmol}\cdot {\rm m}{{{\rm g}}^{-1}}\cdot {\rm mi}{{{\rm n}}^{-1}} \right)= \\ &\frac{{{\mathit{A}}_{{\rm 样}}}-{{\mathit{A}}_{{\rm 对}}}}{0.001\times {\rm 加样量}\times {\rm 蛋白浓度}\times {\rm 1}\ {\rm min}\;\;\;\;\;\;\;\;\;\;\;}. \\ \end{align} $ |
H2O2的检测方法参照文献[16]。将细胞悬浮在2.5 mL相对体积质量为3%的三氯乙酸溶液中,破碎,离心(4 ℃,12 000 g)10 min后,将1 mL上清液加入到1 mL磷酸缓冲溶液中,加入2 mL 1 mol/L碘化钾。测定390 nm处的吸光度,根据之前测得标准曲线计算H2O2的含量。
| $ \begin{align} &\ \ \ \ \ \ \ \ {{{\rm H}}_{{\rm 2}}}{{{\rm O}}_{{\rm 2}}}{\rm 含量}\left( {\rm nmol}\cdot {\rm m}{{{\rm g}}^{-1}}\cdot {\rm mi}{{{\rm n}}^{-1}} \right)= \\ &\frac{{{{\rm H}}_{{\rm 2}}}{{{\rm O}}_{{\rm 2}}}\left( {\rm nmol} \right)}{{\rm 细胞鲜重}\left( {\rm mg} \right)\times {\rm 1}\ {\rm min}}. \\ \end{align} $ |
脂质过氧化水平是通过检测MDA的生成量完成的[1]。将细胞悬浮在相对体积质量为10%的三氯乙酸中,超声破碎,保护温度为4 ℃。离心(4 ℃,12 000 g)10 min后,向上清中加入同等体积相对体积质量为0.5%的硫代巴比妥酸。样品沸水浴15 min后,迅速置于冰上终止反应。冷却后,分别记录450、532和600 nm处的吸光度。MDA的浓度表示为nmol·g-1 FW。
| $ \begin{align} &\ \ \ \ \ \ \ \ \ \ {\rm MDA(mmol } \cdot {\rm }{{{\rm g}}^{{\rm -1}}}\ {\rm FW)= } [ {\rm 6}{\rm .452 } \times {\rm (}{{\mathit{A}}_{{\rm 532}}}{\rm -} \\ &{{\mathit{A}}_{{\rm 600}}}{\rm )-0}{\rm .559 } \times {\rm }{{\mathit{A}}_{{\rm 450}}}{\rm } ] \times {\rm }\frac{{{\mathit{V}}_{{\rm t}}}{\rm /}{{\mathit{V}}_{{\rm s}}}}{{\rm FW}}, \\ \end{align} $ |
式中:A450为450 nm处的吸光度;A532为532 nm处的吸光度;A600为600 nm处的吸光度;Vt(mL)为总体积;Vs(mL)为样品体积;FW为细胞鲜重。
1.6 抗氧化酶活性测定细胞重悬于含1 mmol/L EDTA和1% PVP的磷酸缓冲溶液(50 mmol/L,pH 7.8)中,超声破碎。离心(4 ℃,12 000 g)10 min后,上清即为粗酶液。蛋白质含量的测定是采用Bradford法,用牛血清白蛋白作为标准。
超氧化物歧化酶(SOD)活性测定采用的是邻苯三酚自氧化法[17]。向5.0 mL Tris-HCl缓冲液(10 mmol/L, pH 8.1)加入100 μL酶提取液后,25 ℃孵育20 min。向反应体系加入100 μL邻苯三酚(8.14 mmol/L,用盐酸溶解),迅速混匀后,记录3 min内间隔30 s的325 nm处的吸光度。一个SOD活力单位(U)定义为SOD自氧化抑制率为50%时,所对应的SOD量,表示为U·mg-1·FW-1。
| $ \begin{align} &\ \ \ \ \ \ \ \ {\rm SOD活性}\left( {\rm U}\cdot {\rm m}{{{\rm g}}^{-1}}\cdot {\rm F}{{{\rm W}}^{-1}} \right)= \\ &\frac{{\rm 自氧化速率}-{\rm 样品速率}}{50\%\times {\rm 加酶量}\times {\rm 蛋白浓度} \ \ \ \ \ \ \ \ \ \ \ \ \ }. \\ \end{align} $ |
过氧化氢酶(CAT)活性检测采用的是钼酸铵比色法[18]。含1 mL 60 mmol/L磷酸盐缓冲溶液(pH 7.0),1 mmol/L H2O2和0.2 mL粗酶液的反应体系25 ℃孵育1 min后,加入1.0 mL 32.4 mmol/L钼酸铵,定容到10 mL后测定405 nm处的吸光度。
| $ \begin{align} &\ \ \ \ \ \ \ \ {\rm CAT活性}\left( {\rm U}\cdot {\rm m}{{{\rm g}}^{-1}}\cdot {\rm mi}{{{\rm n}}^{-1}} \right)= \\ &\frac{{{\mathit{A}}_{{\rm 标}}}-{{\mathit{A}}_{{\rm 测}}}}{{\rm 蛋白质浓度}\times {\rm 1}\ {\rm min}}\times \frac{\mathit{C}\left( {{{\rm H}}_{{\rm 2}}}{{{\rm O}}_{{\rm 2}}} \right)\times \mathit{V}\left( {{{\rm H}}_{{\rm 2}}}{{{\rm O}}_{{\rm 2}}} \right)}{{\rm 加酶量}\times {\rm 1}\ {\rm } {\rm{ \mathsf{ μ} }} {\rm mol}}. \\ \end{align} $ |
过氧化物酶(POD)活性的检测采用的是愈创木酚法[19]。向含有0.02 mL愈创木酚和0.01 mL过氧化氢和磷酸缓冲溶液(pH 7.0)的3 mL反应体系中加入0.02 mL的酶提取液,记录5 min之内470 nm处的吸光度。
| $ \begin{align} &\ \ \ \ \ \ \ \ {\rm POD活性}\left( {\rm U}\cdot {\rm m}{{{\rm g}}^{-1}}\cdot {\rm mi}{{{\rm n}}^{-1}} \right)= \\ &\frac{\Delta {{\mathit{A}}_{{\rm 470}}}}{{\rm 0}{\rm .01}\times {\rm 加酶量}\times {\rm 蛋白浓度}\times {\rm 1}\ {\rm min}\ \ \ \ \ \ \ \ \ \ \ \ \ }. \\ \end{align} $ |
细胞重悬于含5%三氯乙酸溶液,离心(4 ℃,12 000 g)10 min后进行抗坏血酸(ASA)和谷胱甘肽(GSH)含量的测定。
ASA含量的测定采用之前报道的方法[20]。反应体系(3 mL)含200 mmol/L NaAc-HAc缓冲溶液(pH 4.75),200 μL上清液,0.75 mL 100 mg/L FeCl3,1 mL相对体积质量为1%的2, 2-联吡啶和0.5 mL相对体积质量为1%的NaF。37 ℃反应1 h后测定525 nm处的吸光度,根据之前建立好的标准曲线计算样品中ASA的含量。
| $ {\rm ASA含量}\left( {\rm mg}\cdot {{{\rm g}}^{-1}} \right)=\frac{{\rm ASA}\left( {\rm mg} \right)}{{\rm 细胞鲜重}\left( {\rm g} \right)}. $ |
还原型谷胱甘肽含量采用Teare报道的方法[21]。1 mL的反应体系中包含磷酸缓冲溶液(100 mmol/L,pH 7.4)100 μL上清液,50 μL 0.1 mmol/L DTNB,100 μL NADPH(10 mg/mL),50 μL 1 U/μL谷胱甘肽还原酶。30 ℃反应10 min后测定412 nm处的吸光度,根据之前建立好的标准曲线计算样品中GSH的含量。
| $ {\rm GSH含量}\left( {\rm mg}\cdot {{{\rm g}}^{-1}} \right)=\frac{{\rm GSH}\left( {\rm mg} \right)}{{\rm 细胞鲜重}\left( {\rm g} \right)}. $ |
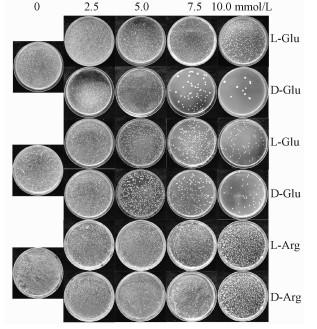
为了评估D-氨基酸对酵母细胞生长的影响,酵母细胞在含有不同浓度纯L-氨基酸和D-氨基酸的培养基上进行培养。如图 1所示,向培养基中加入不同浓度的L-氨基酸和D-氨基酸,酵母细胞的生长出现了很大的差异。对L-精氨酸和D-精氨酸而言,随着浓度的改变,酵母细胞的生长没有出现明显的改变。L-谷氨酸对酵母细胞的生长有轻微的促进作用,而D-谷氨酸浓度的增加会对细胞的生长产生较强的抑制作用。与对照相比,随着L-谷氨酰胺和D-谷氨酰胺浓度的增加,二者都能够明显地抑制酵母细胞生长的生长,并且D-谷氨酰胺的抑制作用要远远强于L-谷氨酰胺。总而言之,实验结果表明与L-氨基酸相比,D-氨基酸能够明显抑制细胞的生长。
|
Download:
|
| 图 1 L-氨基酸和D-氨基酸对酵母细胞生长的影响 Fig. 1 Effects of L-and D-amino acids on cell growth of Saccharomyces cerevisiae | |
图 2显示培养基中含10 mmo/L L-氨基酸和D-氨基酸中酵母细胞的生长情况。与对照相比,丙氨酸、丝氨酸、精氨酸、酪氨酸、蛋氨酸、苯丙氨酸和脯氨酸的L-构型和D-构型对细胞生长的影响差异微小。天冬氨酸、天冬酰胺和亮氨酸的L-异构体和D-异构体略有差别(小于20%):L-异构体略微改善细胞生长而D-异构体明显抑制细胞生长。L-谷氨酸、L-谷氨酰胺、L-色氨酸、L-组氨酸和L-缬氨酸能够显著促进细胞生长(与对照组相比提高10%),而在含有其对映异构体的培养基中,酵母细胞的数量则急剧减少(与对照组相比降低30%)。值得一提的是,L-赖氨酸和D-赖氨酸中,OD600分别下降到0.04和0.03。出乎意料的是,L-半胱氨酸和D-半胱氨酸培养后细胞的OD600分别为0.112和1.868,这表明L-半胱氨酸对酵母细胞的生长具有极强的抑制作用。通过以上结果可以发现,对于大多数氨基酸而言,L-氨基酸对细胞的生长有益,而D-氨基酸对细胞生长有害。

|
Download:
|
| 图 2 L-氨基酸和D-氨基酸(10 mmol/L)对酵母细胞生长的影响 Fig. 2 Effects of L-amino acid and D-amino acid (10 mmol/L) on the growth of Saccharomyces cerevisiae | |
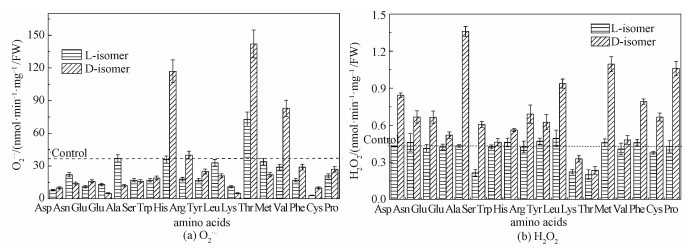
如图 3(a)所示,L-氨基酸和D-氨基酸培养后细胞内O2·-的累积速率趋势不同。大多数氨基酸并没有引起细胞内O2·-含量的增加。然而,D-组氨酸、D-缬氨酸和D-苏氨酸引起细胞内O2·-的含量大量增加。需要指出的是,L-苏氨酸和D-苏氨酸都引起细胞内O2·-含量增加。我们推测,D-组氨酸、D-缬氨酸、L-和D-苏氨酸出现O2·-含量的增加可能是因为除被D-氨基酸氧化酶氧化脱氨基外,这些氨基酸还存在着其他的代谢途径,如组氨酸通透酶/组氨酸脱氢酶[22]、二羟基脱水酶/乙酰乳酸合成酶[23]、苏氨酸脱氢酶[24]等,这些代谢途径能够导致O2·-的累积。如图 3(b)所示,对大多数氨基酸而言,L-异构体培养的细胞内H2O2含量与对照组差别不大。与此相反,D-氨基酸处理后,细胞内H2O2明显高于L-氨基酸处理组。例如,L-丙氨酸处理组H2O2含量(nmol-1·min-1·mg-1·FW)为0.433,而D-丙氨酸处理组则达到1.359。以上数据表明,D-氨基酸培养后细胞内O2·-含量未发生明显改变,而H2O2含量则急剧增加,也表明细胞内ROS产生-消除机制被D-氨基酸破坏。
|
Download:
|
| 图 3 L-氨基酸和D-氨基酸(10 mmol/L)对酵母细胞内O2·-(a)和H2O2(b)含量的影响 Fig. 3 Effects of L-amino acid and D-amino acid (10 mmol/L) on the contents of O2·- (a) and H2O2 (b) in Saccharomyces cerevisiae | |
MDA是脂质过氧化的副产物,能够反映ROS导致脂质氧化损伤的程度[4]。10 mmol/L L-氨基酸和D-氨基酸培养后细胞内的丙二醛含量见图 4。L-氨基酸处理组的丙二醛含量与对照组无显著差异。然而,随着D-氨基酸浓度的增加,酵母细胞内的丙二醛含量逐渐增加。以天冬氨酸为例,L-天冬氨酸组的丙二醛含量(mmol·g-1·FW)为6.30,而D-天冬氨酸组的丙二醛含量则飙升到28.73。这表明D-氨基酸导致细胞内脂质过氧化程度增加。生理条件下,抗氧化系统能够通过清除ROS减少氧化损伤带来的危害,但是过量的未被及时清除的H2O2能够损伤细胞膜上的脂质[25]。由于含有大量不饱和脂肪酸,并且疏水膜对氧原子的高溶解性,因此,膜磷脂最易受到自由基攻击[26]。

|
Download:
|
| 图 4 L-氨基酸和D-氨基酸(10 mmol/L)对酵母细胞内脂质过氧化水平的影响 Fig. 4 Effects of L-amino acid and D-amino acid (10 mmol/L) on the level of lipid peroxidation in Saccharomyces Cerevisiae | |
细胞内存在酶系统来减缓活性氧的损害,维持细胞正常的氧化还原状态。已知在活性氧消除中具有重要作用的酶包括SOD、POD和CAT [27]。为了进一步评估细胞内ROS的积累,我们对酵母细胞内这些酶的活性进行检测。
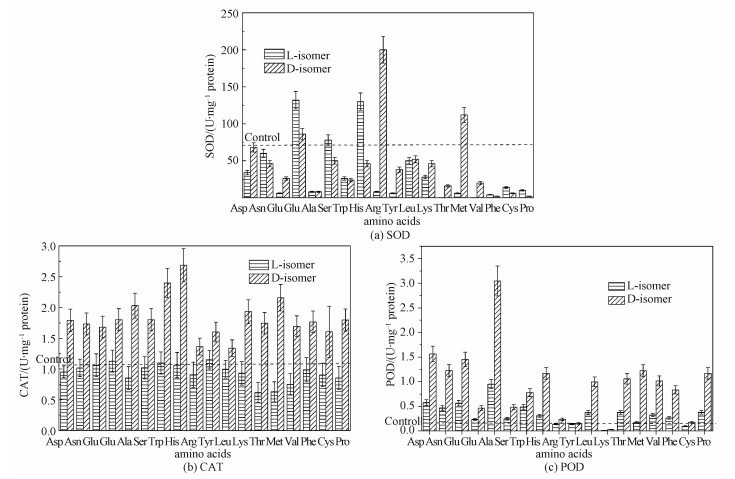
尽管L-构型与D-构型之间存在差异,大多数氨基酸培养后细胞内SOD活性与对照组差别不大。然而,L-谷氨酰胺、D-谷氨酰胺、L-丝氨酸、L-组氨酸、D-精氨酸和D-蛋氨酸的加入改善了SOD的活性(图 5(a))。
|
Download:
|
| 图 5 L-氨基酸和D-氨基酸(10 mmol/L)对酵母细胞内SOD(a), CAT(b)和POD(c)活性的影响 Fig. 5 Effects of L-amino acid and D-amino acid (10 mmol/L) on activities of SOD (a), CAT (b), and POD (c) in Saccharomyces Cerevisiae | |
与此相反,L-氨基酸和D-氨基酸处理后,酵母细胞内CAT的活性差异很大。与SOD不同,D-氨基酸培养后酵母细胞内CAT活性比L-氨基酸培养强得多(图 5(b))。D-氨基酸处理后CAT的活性大大增强。
更为有趣的是,D-氨基酸处理后细胞内POD的活性变化与CAT活性变化趋势相似。L-氨基酸处理组POD的活性没有增强(图 5(c))。D-氨基酸处理组POD的活性显著高于L-氨基酸组,这表明D-氨基酸激活POD的活性。
CAT和POD活性增加,SOD活性未增加,这暗示D-氨基酸诱导酿酒酵母细胞内产生的ROS的主要类型是H2O2。CAT和POD活性的增加可能是由于含量猛增的H2O2将其激活。
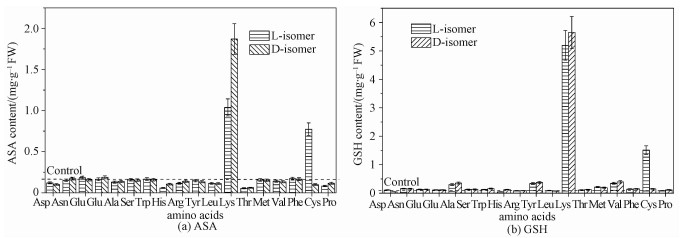
2.5 抗氧化剂含量ASA是一种水溶性的可食用抗氧化剂,在抵御活性氧中起到至关重要的作用[28-29]。GSH也能够抵御ROS引起的氧化损伤[30]。此外,ASA和GSH能够通过ASA-GSH循环的协同作用来消除活性氧[16]。为此,我们比较氨基酸处理后细胞内这两种抗氧化剂的含量(见图 6)。除苏氨酸、赖氨酸和半胱氨酸外,L-氨基酸和D-氨基酸处理后细胞内ASA的含量都与对照组差别不大。经10 mol/L赖氨酸处理后,ASA的含量随着L-赖氨酸浓度的增加而升高。L-半胱氨酸处理后,ASA含量明显增加。同样地,GSH含量变化与ASA趋势相似。即便将氨基酸浓度增加到10 mmol/L,GSH含量也未显著增加。赖氨酸处理后细胞内的ASA和GSH含量增加可能是因为培养基中赖氨酸含量的增加激活了赖氨酸羟化酶,而ASA是它的辅酶[31],因而ASA含量随之增加;ASA是一种强还原剂,可以使氧化型的GSH转变成为还原型GSH,因而导致GSH含量增加。L-半胱氨酸是ASA的稳定剂,二者之间存在协同效应[32],因此培养基中L-半胱氨酸含量的增加导致ASA含量的增加。有文献报道,向培养基中添加L-半胱氨酸能够增加酵母细胞中GSH的含量[33],因此L-半胱氨酸处理后的细胞中GSH含量增加。
|
Download:
|
| 图 6 L-氨基酸和D-氨基酸(10 mmol/L)对酵母细胞内ASA(a)和GSH(b)含量的影响 Fig. 6 Effects of L-amino acid and D-amino acid (10 mmol/L) on the contents of ASA (a) and GSH (b) in Saccharomyces Cerevisiae | |
基于以上实验结果,为进一步阐明各个生物标记物之间的关联,图 7给出实验所选用生物标记物之间的关系。

|
Download:
|
| 图 7 实验所用生物标记物之间的关系 Fig. 7 Relationships among these biomarkers used in this study | |
ROS是细胞代谢的副产物。环境的改变能够引起细胞内ROS含量的改变。本研究中,采用酿酒酵母为模型生物研究D-氨基酸的细胞毒性及其诱导的ROS累积。发现D-氨基酸能够抑制细胞的生长。低浓度时,抑制现象不明显,当浓度增加时,抑制作用增强。此外,高浓度D-氨基酸培养的细胞内H2O2的含量增加,伴随抗氧化酶活性的激活,特别是CAT和POD。生物体内的活性氧可以被抗氧化酶和抗氧化剂清除,使活性氧的水平维持正常。然而,当活性氧水平达到阈值,能够引起氧化损伤。因此我们认为氧化损伤是D-氨基酸毒性的主要机制。
| [1] |
Steels E L, Learmonth R P, Watson K. Stress tolerance and membrane lipid unsaturation in Saccharomyces Cerevisiae grown aerobically or anaerobically[J]. Microbiology-Uk, 1994, 140:569–576.
DOI:10.1099/00221287-140-3-569 |
| [2] |
Landolfo S, Politi H, Angeozzi D, et al. ROS accumulation and oxidative damage to cell structures in Saccharomyces cerevisiae wine strains during fermentation of high-sugar-containing medium[J]. Biochimica et Biophysica Acta-General Subjects, 2008, 1780(6):892–898.
DOI:10.1016/j.bbagen.2008.03.008 |
| [3] |
Ribeiro T P, Fernandes C, Melo K V, et al. Iron, copper, and manganese complexes with in vitro superoxide dismutase and/or catalase activities that keep Saccharomyces cerevisiae cells alive under severe oxidative stress[J]. Free Radical Biology and Medicine, 2015, 80:67–76.
DOI:10.1016/j.freeradbiomed.2014.12.005 |
| [4] |
Qiu Z B, Liu X, Tian X J, et al. Effects of CO2 laser pretreatment on drought stress resistance in wheat[J]. Journal of Photochemistry and Photobiology B-Biology, 2008, 90(1):17–25.
DOI:10.1016/j.jphotobiol.2007.09.014 |
| [5] |
Roehrs R, Freitas D R, Masuda A, et al. Effect of vitamin A treatment on superoxide dismutase-deficient yeast strains[J]. Archives of Microbiology, 2010, 192(3):221–228.
DOI:10.1007/s00203-010-0551-2 |
| [6] |
Radkov A D, Moe L A. Bacterial synthesis of D-amino acids[J]. Applied Microbiology and Biotechnology, 2014, 98(12):5363–5674.
DOI:10.1007/s00253-014-5726-3 |
| [7] |
Daniello A, Donofrio G, Pischetola M, et al. Biological role of D-amino-acid oxidase and D-aspartate oxidase:effects of D-amino acids[J]. Journal of Biological Chemistry, 1993, 268(36):26941–26949.
|
| [8] |
Friedman M. Chemistry, nutrition, and microbiology of D-amino acids[J]. Journal of Agricultural and Food Chemistry, 1999, 47(9):3457–3579.
DOI:10.1021/jf990080u |
| [9] |
Hamase K, Morikawa A, Zaitsu K. D-Amino acids in mammals and their diagnostic value[J]. Journal of Chromatography B, 2002, 781(1/2):73–91.
|
| [10] |
Champney W S, Jensen R A. Molecular events in the growth inhibition of Bacillus subtilis by D-tyrosine[J]. Journal of Bacteriology, 1970, 104(1):107–116.
|
| [11] |
Soutourina J, Blanquet S, Plateau P. D-tyrosyl-tRNA(Tyr) metabolism in Saccharomyces cerevisiae[J]. The Journal of Biological Chemistry, 2000, 275(16):11626–11630.
DOI:10.1074/jbc.275.16.11626 |
| [12] |
Soutourina J, Plateau P, Blanquet S. Metabolism of D-aminoacyl-tRNAs in Escherichia coli and Saccharomyces cerevisiae cells[J]. The Journal of Biological Chemistry, 2000, 275(42):32535–32542.
DOI:10.1074/jbc.M005166200 |
| [13] |
Yow G Y, Uo T, Yoshimura T, et al. Physiological role of D-amino acid N-acetyltransferase of Saccharomyces cerevisiae:detoxification of D-amino acids[J]. Archives of Microbiology, 2006, 185(1):39–46.
DOI:10.1007/s00203-005-0060-x |
| [14] |
Friedman M, Levin C E. Nutritional and medicinal aspects of D-amino acids[J]. Amino Acids, 2012, 42(5):1553–1582.
DOI:10.1007/s00726-011-0915-1 |
| [15] |
Matlashov M E, Belousov V V, Enikolopov G. How much H2O2 is produced by recombinant D-amino acid oxidase in mammalian cells?[J]. Antioxidants & Redox Signaling, 2014, 20(7):1039–1044.
|
| [16] |
Liu T, Zhu L S, Wang J H, et al. Biochemical toxicity and DNA damage of imidazolium-based ionic liquid with different anions in soil on Vicia faba seedlings[J]. Scientific Reports, 2015, 5:18444.
|
| [17] |
Li X C. Improved pyrogallol autoxidation method:a reliable and cheap superoxide-scavenging assay suitable for all antioxidants[J]. Journal of Agricultural and Food Chemistry, 2012, 60(25):6418–6424.
DOI:10.1021/jf204970r |
| [18] |
Goth L. A simple method for determination of serum catalase activity and revision of reference range[J]. Clinica Chimica Acta, 1991, 196(2/3):143–151.
|
| [19] |
Song Y, Zhu L S, Xie H, et al. Effects of atrazine on DNA damage and antioxidative enzymes in Vicia Faba[J]. Environmental Toxicology and Chemistry, 2009, 28(5):1059–1062.
DOI:10.1897/08-285.1 |
| [20] |
Shen C H, Krishnamurthy R, Yeh K W. Decreased l-ascorbate content mediating bolting is mainly regulated by the galacturonate pathway in oncidium[J]. Plant Cell Physiology, 2009, 50(5):935–946.
DOI:10.1093/pcp/pcp045 |
| [21] |
Teare J P, Punchard N A, Powell J J, et al. Automated spectrophotometric method for determining oxidized and reduced glutathione in liver[J]. Clinical Chemistry, 1993, 39(4):686–689.
|
| [22] |
Hecht K, Zhang S, Klopotowski T, et al. D-histidine utilization in Salmonella typhimurium is controlled by the leucine-responsive regulatory protein (Lrp)[J]. Journal of Bacteriology, 1996, 178(2):327–331.
DOI:10.1128/jb.178.2.327-331.1996 |
| [23] |
Barchas J, Katz E, Weissbach H, et al. Metabolism of D-valine by streptomyces antibioticus:isolation of N-succinyl-D-valine[J]. Biochemistry, 1964, 3(11):1684–1687.
DOI:10.1021/bi00899a014 |
| [24] |
Hammer V A, Rogers Q R, Freedland R A. Threonine is catabolized by L-threonine 3-dehydrogenase and threonine dehydratase in hepatocytes from domestic cats (Felis domestica)[J]. Journal of Nutrition, 1996, 126(9):2218–2226.
DOI:10.1093/jn/126.9.2218 |
| [25] |
Costa W M V, Amorim M A, Quintanilha A, et al. Hydrogen peroxide-induced carbonylation of key metabolic enzymes in Saccharomyces cerevisiae:the involvement of the oxidative stress response regulators Yap1 and Skn7[J]. Free Radical Biology and Medicine, 2002, 33(11):1507–1515.
DOI:10.1016/S0891-5849(02)01086-9 |
| [26] |
Burton G, Wayner D D M. Free-radicals in biology and medicine-Halliwell, B, Gutteridge, Jmc[J]. Nature, 1985, 318(6044):322–322.
|
| [27] |
Rowe L A, Degtyareva N, Doetsch P W. DNA damage-induced reactive oxygen species (ROS) stress response in Saccharomyces cerevisiae[J]. Free Radical Biology and Medicine, 2008, 45(8):1167–1177.
DOI:10.1016/j.freeradbiomed.2008.07.018 |
| [28] |
Tominaga H, Kodama S, Matsuda N, et al. Involvement of reactive oxygen species (ROS) in the induction of genetic instability by radiation[J]. Journal of Radiation Research, 2004, 45(2):181–188.
DOI:10.1269/jrr.45.181 |
| [29] |
Wheeler G L, Jones M A, Smirnoff N. The biosynthetic pathway of vitamin C in higher plants[J]. Nature, 1998, 393(6683):365–369.
DOI:10.1038/30728 |
| [30] |
Li Y, Wei G, Chen J. Glutathione:a review on biotechnological production[J]. Applied Microbiology and Biotechnology, 2004, 66(3):233–242.
DOI:10.1007/s00253-004-1751-y |
| [31] |
Kivirikko K I, Pihlajaniemi T. Collagen hydroxylases and the protein disulfide isomerase subunit of prolyl 4-hydroxylases[J]. Advances in Enzymology and Related Areas of Molecular Biology, 1998, 72:325–398.
|
| [32] |
Nakano A, Abe M, Oda A, et al. Delayed treatment with vitamin C and N-acetyl-l-cysteine protects Schwann cells without compromising the anti-myeloma activity of bortezomib[J]. International Journal of Hematology, 2011, 93(6):727–735.
DOI:10.1007/s12185-011-0850-7 |
| [33] |
Wen S H, Zhang T, Tan T W. Utilization of amino acids to enhance glutathione production in Saccharomyces cerevisiae[J]. Enzyme and Microbial Technology, 2004, 35(6/7):501–507.
|
 2018, Vol. 35
2018, Vol. 35 


