锌(Zn)是人体必需微量元素,被近代科学界誉为人体的“生命之花”,而目前粮食作物中由于缺Zn引起的营养失衡问题在世界范围内引起了广泛关注。在中国,Zn缺乏主要集中在儿童、青少年、孕妇及病人中,Zn缺乏会导致生长发育落后、青春期发育迟缓、厌食症、免疫功能降低等症状[1],而农作物的Zn含量难以通过施肥方式得到根本性的改善。由于高Zn种质资源缺乏,通过常规杂交育种改良作物Zn营养品质受到一定的限制。近年来,利用转基因或分子标记辅助育种提高作物Zn含量的途径被认为是一种有效的方法[2]。因此,探究作物Zn营养生理特性和籽粒Zn富集的分子机制,对利用分子育种技术和手段提高作物的Zn元素含量有重要的指导价值。
植物富集Zn的分子机理可能涉及由多基因控制的复杂过程,涉及重金属离子在根部区域的活化、吸收,木质部装载与运输以及茎叶部的再分配、区域化隔离等方面[3]。普遍认为植物的质膜上存在一些离子泵,可以特异性地将离子转运到胞质内,而HMA家族的基因编码一类依赖于ATP酶的质子泵,能够水解释放能量,将离子吸收转运,这类家族的基因功能已通过异源表达、基因敲除以及过表达等方法得到证明[4-6]。目前已发现该家族的特异性Cu2+ ATPase[7]和Zn2+-ATPase[8],另外,一旦金属离子进入植物体内,会经过有机酸(organic acids)、氨基酸(amino acids)、金属硫蛋白(metallothioneins, MT)和植物络合素(phytochelatins, PCs)等络合剂的螯合而增加其溶解性,从而不同程度地提高植物对重金属的抗性及其在植物体内的运输效率和有效分配率[9]。金属硫蛋白是一类低分子量(6 000~7 000Da)、高Cys含量、具有金属结合能力的多肽,其富含Cys的金属结合结构域按CXC或CXXC的独特方式排列[10]。由于它具有结合金属离子(如Cu2+, Cd2+等)的能力, 因此在解除重金属离子的毒害、维持组织中金属离子的稳定以及调节金属离子向特定组织的运输等方面起作用[11]。植物络合素是由PCs合酶合成的一种能与多种金属元素结合的多肽,这类巯基化合物中的巯基能与游离的重金属离子配位结合,使重金属离子由自由态转为络合态,进而降低金属的毒性[12],多种金属可诱导植物体内PCs的产生,其中Cd2+是最强的诱导因子。因此,在本实验中,我们拟通过克隆小麦TaHMA1基因序列,并且设计小麦TaHMA2,MT以及PCs基因的相关引物,分析不同浓度的Zn处理下基因的表达模式,探讨这些基因在高Zn小麦品种中Zn的累积以及螯合解毒中的功能,为今后高Zn小麦的分子育种提供理论依据和技术支撑。
1 材料与方法 1.1 材料高Zn小麦品种“中优”惠赠于中国农业科学院,选取籽粒饱满、大小均匀且完整的种子备用。
1.2 方法 1.2.1 种子的萌发与处理选取饱满完整的小麦籽粒,10%的次氯酸钠溶液消毒5min后置于25℃的温水中浸泡4h,播种于铺有滤纸的培养皿中,芽长约为3.0cm左右时,置于28℃光照培养箱内光照培养。待幼苗长到三叶一心时,移栽在1/2营养液中培养至苗高约10cm,将幼苗随机分组,设置0、400和1 000μmol/L 3个ZnSO4梯度,每个梯度设3个重复,于处理后0、2、8、12、24、48和72h取新鲜根系及叶片液氮速冻,用于RNA的提取。于处理后第1天和第7天称取成熟叶片0.5g, 用于SOD、POD和APX的活性测定。
1.2.2 ICP-MS测定叶片中Zn元素的含量取不同处理天数(0, 1, 2, 3d)的小麦地上部分,经大量的流水冲洗干净后置于20mmol/L的EDTA中浸泡15min,彻底去除黏附的重金属离子,然后超纯水冲洗3遍,吸干水分后快速置于105℃烘箱中杀青10min,之后80℃烘干至恒重。烘干的材料经过研钵研磨之后,每个处理取样0.1g并设立3个重复,HNO3:H2O2=3:1于150℃彻底消化后,去离子水定容至10mL,于中国科学院高能物理研究所进行Zn含量测定,所得数据用Graphpadprism 5.0软件进行显著性及方差分析,用Excel作图。
1.2.3 小麦根系中Zn吸收及细胞凋亡检测Zinpyr-1(Sigma, 40667)探针购于sigma公司,先用1mL DMSO溶解为母液保存于4℃冰箱中。使用前, 用去离子水按1:1 000的比例稀释,将被Zn处理0h, 24h之后的小麦根系浸泡30min, 之后用超纯水轻轻地冲洗,直到冲洗干净根系表面未结合的探针,然后在495nm的荧光显微镜下观察探针显色情况,观察倍数为10倍,每个处理进行10次重复。
碘化丙锭检测细胞凋亡:碘化丙啶(PI)粉末先溶于灭菌水中,配制成浓度为10μg/mL的母液, 然后将母液用0.9%的NaCl按1:100的比例稀释成工作液。选取均匀一致的主根,浸泡在工作液中染色大约3min,然后用0.9%的NaCl溶液冲洗干净并压片,于荧光显微镜下观察并照相,整个过程要求在暗条件下操作以防荧光淬灭, 每个处理进行10次重复。选取代表性图片,用image-pro plus软件将荧光图片转变为灰度图片并转换成反向图,经过校正光密度后计算图形面积的平均光密度值。
1.2.4 酶液的提取及抗氧化酶活性测定分别取0、400和1 000μmol/L的Zn处理第1天和第7天的成熟叶片0.5g,加5mL冰预冷50mmol/L磷酸缓冲液(pH 7.0),于冰浴中研磨,4℃ 12 000g离心20min,收集上清液即酶粗提液。可溶性总蛋白含量的测定采用考马斯亮蓝法,SOD、POD以及APX活性的测定参照Zhang等[13]的方法。每个处理重复3次,所得数据用Graphpadprism 5.0统计软件进行作图及显著性和方差分析,最终数据源于3次重复的平均值±标准误。
1.2.5 TaHMA1基因的克隆及功能分析 1.2.5.1 小麦叶片中RNA的提取及cDNA的合成每0.1g小麦叶片于液氮中研磨充分后,加入1mL invitrogen trizol试剂,按照说明书操作步骤提取总RNA,甲醛变性胶检测RNA的完整性,取1μg总RNA经DNaseI酶处理后用M-MLV逆转录酶(Invitrogen, USA)合成cDNA。
1.2.5.2 TaHMA1序列的克隆登陆GenBank数据库,经过比对搜索EST序列,获得小麦HMA1基因的部分序列,设计3’race的嵌套引物序列GS1 GGCAAGAGACAATGAAA ATGAG, GS2 GTGGTTGCTGTTGAGAGTTTTGA以及5’race的引AAGGGTCAACACCATTACTCGT GGGTTGTTCCTTTCTCCATAGC和TCAAAACTCT CAACAGCAACCAC,以小麦的cDNA为模板进行多轮PCR扩增,产物经电泳检测后切胶回收并连接在 pEASY-T克隆载体上,构建的载体转化大肠杆菌DH5α,在含有抗生素的抗性板子上随机挑选10个菌落并进行PCR鉴定后送上海生工进行测序验证。
1.2.5.3 实时荧光定量PCR分析基因表达变化情况为进一步研究小麦吸收和累积Zn的分子机制,根据GenBank数据库里的相关EST序列,同时筛选HMA2,MT以及PCs基因为目的基因,利用primer express 3.0软件设计实时荧光定量引物,采用美国MX3000pTMqPCR实时荧光定量PCR仪,以26s为内参基因,SYBRGreen Universal Master mix kit (TOYOBO, Japan)为荧光染料,模板采用稀释10倍的cDNA, 设置3组重复,PCR反应体系为20μL, 反应条件为95℃ 10min,(95℃ 30s,60℃ 30s和72℃ 30s)45个循环。PCR结束后进行溶解曲线分析,所需引物序列如表 1所示。
|
|
表 1 实时荧光定量PCR所用引物 Table 1 Primers for qRT-PCR |
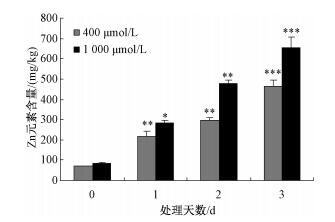
图 1结果显示,与对照相比,400μmol/L和1 000μmol/L的Zn处理1d后,小麦地上部的Zn含量就已达到显著性水平(*表示p < 0.05,**表示p < 0.01),随着处理时间的延长Zn含量不断上升,1 000μmol/L的Zn处理3d后地上部Zn含量能达到654mg/kg(***表示p < 0.001),说明高Zn小麦品种具有短时间内在地上部快速累积Zn的能力,因此暗示,一些与Zn吸收转运及螯合相关的基因在高Zn小麦富集Zn的过程中起到重要作用。
|
Download:
|
| 图 1 不同浓度的Zn处理下小麦中优地上部Zn含量 Fig. 1 Zn contents in the aboveground tissue of wheat treated using different concentrations of Zn | |
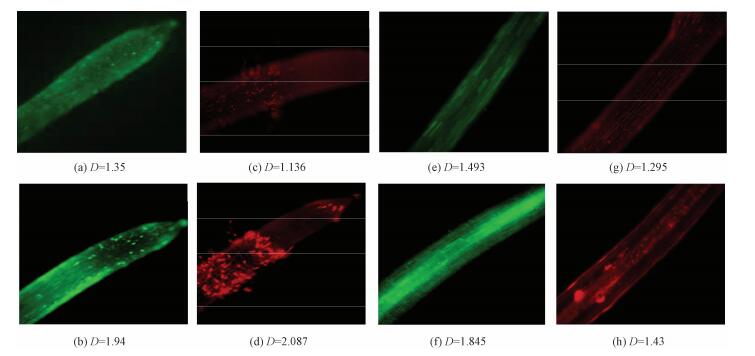
如图 2所示,D表示平均荧光强度。与对照(图 2(a))相比,在400μmol/L的Zn处理24h之后(图 2(b))根尖部位检测到Zn荧光强度增大的趋势;Zn处理的根毛区经PI染色后出现较对照(图 2(b))强的荧光信号,显示该区域出现明显的细胞凋亡现象(图 2(d));与对照相比(图 2(e)和图 2(g)), 在根系木质部经Zn探针和PI染色后都检测到荧光强度增加的趋势(图 2(f)和图 2(h)),显示Zn在木质部的累积、以及导致的根系维管系统细胞凋亡。这一结果说明,小麦通过根系维管系统将Zn向地上部装载运输, Zn对根系的毒害部位主要发生在根尖根毛区以及吸收运输部位。
|
Download:
|
| 图 2 对照及400μmol/L Zn处理24h之后小麦根系中锌累积及细胞凋亡检测 Fig. 2 Detection of Zn accumulation and cell death phenomenon in root tissue by Zinpyr-1 probe and PI staining | |
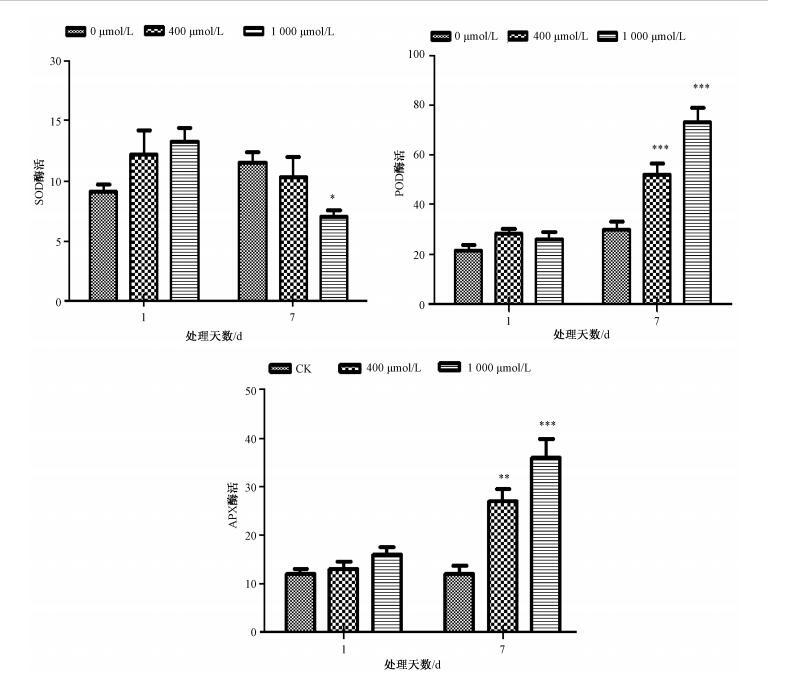
叶片组织中SOD,POD以及APX的酶活性变化如图 3所示,与对照相比,在处理第1天时发现,SOD酶活性有上升趋势,随着处理时间的延长,在第7天却被抑制(*表示p < 0.05)。POD和APX在Zn处理后的第7天都极显著地增加(**表示p < 0.01,***表示p < 0.001),说明高浓度的Zn改变了小麦的抗氧化体系,而POD和APX对Zn胁迫下的小麦起到重要的保护作用。
|
Download:
|
| 图 3 不同浓度的Zn处理下叶片中的SOD,POD和APX的酶活 Fig. 3 SOD, POD, and APX activities in leaf tissue under Zn treatments with two concentrations | |
将3’race的产物经电泳检测及测序分析,发现该片段总共有1 321个碱基,有一段明显的PolyA尾巴序列,在NCBI数据库上比对显示,该序列与Brachypodium distachyon 叶绿体中的cadmium/zinc-transporting ATPase HMA1基因碱基序列相似性达到94%,同样,5’race获得一段大约1 000个碱基长度的基因片段,经测序比对为HMA1基因序列片段。
将两片段经过序列拼接后获得大约2 000个碱基左右的序列,用DNAMAN软件能翻译出一段通读序列含621个氨基酸的蛋白一级结构,利用蛋白序列分析软件(http://www.predictprotein.org)发现已获得的片段有4个跨膜结构域(图 4红框区域),蛋白序列比对该基因属于ATPase-IB2-Cd家族的基因,是一个锌镉特异性跨膜转运蛋白基因,有一个属于E1-E2-ATPase家族的磷酸化位点(图 4绿框区域),推测该基因可能在Zn元素的吸收累积过程中起重要作用。

|
Download:
|
| 图 4 小麦HMA1与二穗短柄草HMA1同源性比对 Fig. 4 Alignments of the deduced amino acid sequences of Triticum aestivu HMA1 and Brachypodium distachyon HMA1 | |
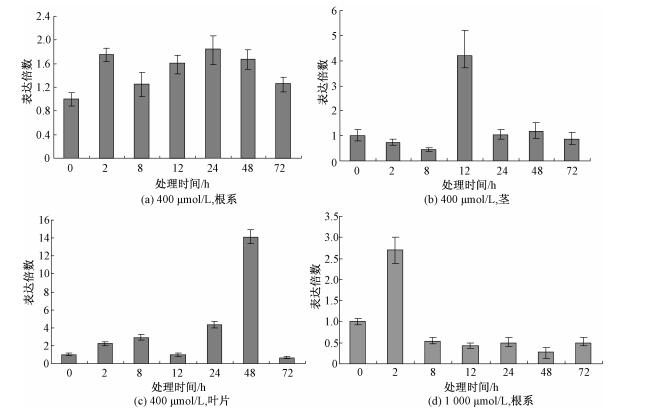
如图 5所示,与对照相比,在400μmol/L的Zn处理下,HMA1基因在根系中被诱导上调表达,但是上调倍数不明显(图 5(a)),但是在茎中,当400μmol/L的Zn处理12h后发现,该基因表达倍数上调4倍多(图 5(b)),而同样的处理浓度下小麦HMA1在叶片中能达到14倍左右(图 5(c))。当用高浓度的Zn处理之后发现,该基因2h之内在根系中表达大约2.5倍,说明该基因的表达倍数和表达模式受外源Zn的调节,并且在茎叶部的表达丰度高于根中,说明该基因可能参与了Zn元素在地上部的累积(图 5(d))。
|
Download:
|
| 图 5 HMA1基因在不同浓度的Zn处理下的表达模式 Fig. 5 Expression patterns of HMA1 under Zn treatments | |
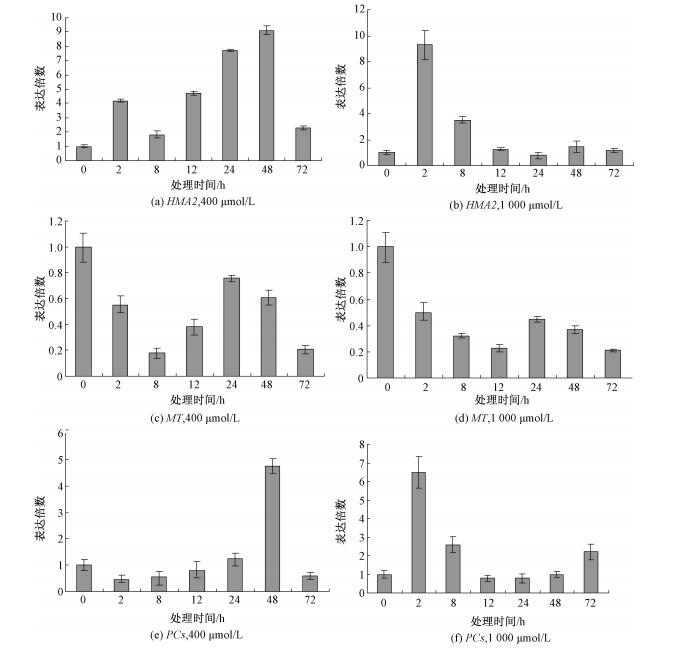
如图 6所示,400μmol/L的Zn处理2h之后,HMA2基因在小麦根系中开始上调表达,在48h上调8倍多(图 6a)。在1 000μmol/L的Zn处理下,2h表达量超过8倍,而后随着时间的延长基因表达丰度下降,说明HMA2基因的表达也受外源Zn的诱导,参与了Zn在根系中的吸收累积(图 6(b))。
MT是参与重金属解毒的重要蛋白之一,但是我们的研究结果显示400μmol/L的Zn处理(图 6(c))和1 000μmol/L Zn处理(图 6(d))都显著性地抑制了该基因的表达,这一结果显示,MT基因可能在对Zn的螯合及转运过程中没有起到积极的作用。
|
Download:
|
| 图 6 HMA2、MT以及PCs基因在Zn处理下根系中的表达模式 Fig. 6 Expression patterns of HMA2, MT and PCs under Zn treatments in root tissue | |
PCs基因在400μmol/L的Zn处理下,于48h上调倍数为5倍左右(图 6(e)),而在1 000μmol/L的Zn处理下,在2h表达倍数上调6倍之多(图 6(f)),说明PCs基因能够对外界Zn浓度做出快速的响应,可能在Zn的螯合和再分配中起到重要作用。
3 讨论目前与Zn转运相关的HMA基因的研究报道主要集中在拟南芥、水稻以及其他一些与重金属吸收转运相关的植物中,已经报道的有HMA2,HMA3以及HMA4等。水稻中的OsHMA2在根系中表达含量高,但不受Zn和Cd处理的诱导表达产物定位在质膜上;OsHMA3在根中表达高而叶片中表达量较低,表达产物也定位在液泡膜上,OsHMA9的表达受到高浓度的Zn/Cd诱导[14];在拟南芥中,AtHMA2和AtHMA4的表达产物定位于质膜上,在根、茎、叶以及发育中的花药中均表达,但是在根中表达水平更高,AtHMA4受外源Zn的诱导表达,Knockout该基因后植株叶片中Zn元素含量降低而在根系中则升高,说明AtHMA4可能参与了Zn元素向地上部的转移[15]。而关于小麦中HMA基因的研究报道较少,Tan等[16]研究发现,将TaHMA2转入到小麦中后,使得Zn的含量在胚乳和糊粉层中增加,显示TaHMA2基因可能参与了Zn元素向籽粒中的累积。我们的研究结果显示,TaHMA1在根系、茎和叶中都有表达,但是在叶片中上调表达倍数更高,暗示TaHMA1基因可能参与了Zn在小麦地上部的富集。TaHMA2在小麦根系中表达倍数较高,该基因可能参与了根系对Zn2+的吸收,而TaHMA1和TaHMA2在高浓度的Zn2+胁迫下表达倍数都较低,其表达模式受到外源离子浓度的影响。徐玉凤等[17]通过对水稻中10个水稻Ⅰ类金属硫蛋白基因进行分析,显示Zn2+可以诱导大部分OsMT-I家族成员的表达, 说明它们可能参与水稻Zn2+的耐受, 储存和地上部分组织之间的转运过程,而在根中OsMT-I-1a和OsMT-I-3a的表达受Zn2+的下调。Hassinen等[10]通过转基因拟南芥过量表达TcMT2、TcMT3基因后发现,这两个基因的过量表达不会对植株Zn元素富集产生直接影响;Zn2+对香蕉MT3基因表达有明显的诱导作用[18],而菊芋htMT2基因表达又受到Zn2+的抑制[19],我们的研究发现TaMT基因的表达也受到Zn元素的抑制,这一结果与Castiglione等[20]的研究结果相似,暗示MT基因的表达特征随着植物的种类、MT 类型的不同而表现出特异性,而PCs 基因却能积极地响应Zn2+的诱导[21]。当Zn元素进入到植物体内时对植物产生一定的毒害作用,表现在根毛区细胞以及木质部细胞的损伤凋亡,以及过氧化胁迫等方面。SOD第一个参与O2-的清除反应,生成H2O2和O2,在抗氧化酶类中处于重要地位。而Zn在叶片中的累积修饰了小麦的抗氧化酶系统,由于SOD酶活性被抑制,这可能导致活性氧代谢系统失调的主要产物为H2O2,而非O2-,从而诱导POD酶和APX酶活性显著性的升高,这显示Zn毒害下的POD和APX的酶活性升高是小麦耐受Zn胁迫的一个重要的生理机制。
| [1] | Hambidge K M, Krebs N F, Jacobs M A, et al. Zinc nutritional status during pregnancy:a longitudinal study[J]. American Journal of Clinical Nutrition, 1983, 37(3):429–442. |
| [2] | Cakmak I. Enrichment of cereal grains with zinc:agronomic or genetic biofortification?[J]. Plant Soil, 2008, 302(1):1–17. |
| [3] | Clemens S, Palmgren M G, Kramer U. A long way ahead:understanding and engineering plant metal accumulation[J]. Trends in Plant Science, 2002, 7(7):309–315. DOI:10.1016/S1360-1385(02)02295-1 |
| [4] | Chong K, Edwin W, Christopher S C. HMA P-type ATPases are the major mechanism for root-to-shoot Cd translocation in Arabidopsis thaliana[J]. New Phytologist, 2009, 181(1):71–78. DOI:10.1111/nph.2009.181.issue-1 |
| [5] | Williams L E, Mills R F. P1B-ATPases:an ancient family of transition metal pumps with diverse functions in plants[J]. Trends in Plant Science, 2005, 10(10):491–502. DOI:10.1016/j.tplants.2005.08.008 |
| [6] | 张玉秀, 张媛雅, 孙涛, 等. 植物重金属转运蛋白P1B-ATPase结构和功能研究进[J]. 生物工程学报, 2010, 26(6):715–725. |
| [7] | Grønberg C, Sitsel O, Lindahl E, et al. Membrane anchoring and Ion-entry dynamics in P-type ATPase copper transport[J]. Biophysical Journal, 2016, 111(11):2417–2429. DOI:10.1016/j.bpj.2016.10.020 |
| [8] | Raimunda D, Subramanian P, Stemmler T, et al. A tetrahedral coordination of Zinc during transmembrane transport by P-type Zn2+-ATPases[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2016, 1818(5):1374–1377. |
| [9] | 汪宏, 金继运. 植物对Zn吸收运输及积累的生理与分子机制[J]. 植物营养与肥料学报, 2009, 15(1):225–235. |
| [10] | Hassinen V H, Tuomainen M, Peraniemi S, et al. Metallothioneins 2 and 3 contribute to the metal-adapted phenotype but are not directly linked to Zn accumulation in the metal hyperaccumulator, Thlaspi caerulescens[J]. Journal of Experimental Botany, 2009, 60(1):187–196. |
| [11] | Joshi R, Pareek A, Singla-Pareek S L, et al. Plant Metal Interaction[M]. Elsevier: 2016: 239-261. |
| [12] | Liu G Y, Zhang Y X, Chai T Y. Phytochelatin synthase of Thlaspi caerulescens enhanced tolerance and accumulation of heavy metals when expressed in yeast and tobacco[J]. Plant Cell Reports, 2011, 30(3):1–10. |
| [13] | Zhang F Q, Wang Y S, Lou Z P, et al. Effect of heavy metal stress on antioxidative enzymes and lipid peroxidation in leaves and roots of two mangrove plant seedlings (Kandelia candel and Bruguiera gymnorrhiza)[J]. Chemosphere, 2007, 67(1):44–50. DOI:10.1016/j.chemosphere.2006.10.007 |
| [14] | Lee S, Kim Y Y, Lee Y, et al. Rice P1B-type heavy-metal ATPase, OsHMA9, is a metal efflux protein[J]. Journal of Plant Physiology, 2007, 145(3):831–842. DOI:10.1104/pp.107.102236 |
| [15] | Verret F, Gravot A, Auroy P, et al. Over expression of AtHMA4 enhances root-to-shoot translocation of zinc and cadmium and plant metal tolerance[J]. FEBS Letters, 2004, 576(3):306–312. DOI:10.1016/j.febslet.2004.09.023 |
| [16] | Tan J J, Wang J W, Chai T Y, et al. Functional analyses of TaHMA2, a P1B-type ATPase in wheat[J]. Plant Biotechnology Journal, 2013, 11(4):420–431. DOI:10.1111/pbi.2013.11.issue-4 |
| [17] | 徐玉凤, 周功克, 李一勤, 等. 锌对水稻金属硫蛋白基因家族的表达以及重组酵母细胞耐受性的影响[J]. 自然科学进展, 2007, 17(7):899–904. |
| [18] | Liu P, Goh C J, Loh C S, et al. Differential expression and characterization of three metallothionein-like genes in Cavendish banana (Musa acuminata)[J]. Physiologia Plantarum, 2002, 114(2):241–250. DOI:10.1034/j.1399-3054.2002.1140210.x |
| [19] | Chang T, Liu X, Xu H, et al. A metallothionein-like gene htMT2 strongly expressed in int-ernodes and nodes of Helianthus tuberosus and effects of metal ion treatment on its expression[J]. Planta, 2004, 218(3):449–455. DOI:10.1007/s00425-003-1114-4 |
| [20] | Castiglione S, Franchin C, Fossati T, et al. High zinc concentrations reduce rooting capacity and alter metallothionein gene expression in white poplar[J]. Chemosphere, 2007, 67(6):1117–1126. DOI:10.1016/j.chemosphere.2006.11.039 |
| [21] | Hirata K, Tsujimoto Y, Namba T, et al. Strong induction of phytochelatin synthesis by zinc in marine green alga, Dunaliella tertiolecta[J]. Journal of Bioscience and Bioengineering, 2001, 92(1):24–29. DOI:10.1016/S1389-1723(01)80193-6 |
 2017, Vol. 34
2017, Vol. 34 


