秸秆是农业生产的废弃物。由于产生比较集中且难以利用,同时焚烧又带来严重的环境污染,因此寻找高附加值的转化利用途径是摆在我们面前的重要问题。近年来,由于石化资源枯竭等原因,更使包括秸秆在内的木质纤维素的利用受到国内外学者的广泛关注。目前,利用它们生产材料[1]、化学品[2]和能源产品[3]的研究正在世界范围内积极开展。在可预见的将来,这类原料在人类社会生活中将会发挥越来越重要的作用。
构成秸秆的主要组分包括纤维素、木质素和半纤维素,其中纤维素是β-1, 4糖苷键连接的葡萄糖链,木质素是苯丙烷单元构成的无定形天然高分子,而半纤维是由戊糖和己糖构成的杂多糖(并含有乙酰基、羧基、甲氧基等基团)[4]。秸秆等原料长期难以被较好利用的一个重要原因是所包含的上述组分——纤维素、半纤维素和木质素,都难溶于水和常规有机溶剂[5]。近十几年来,研究人员陆续发现了一些离子液体,它们具有溶解木质纤维素组分的能力[6]。离子液体通常指熔点低于100℃的有机盐,它们极性强、不挥发,并且能够按照需要设计和合成,因此在催化、萃取分离、电化学、材料制备等领域有着广泛的应用前景[7-8]。由于溶解状态的组分容易进行化学转化和改性,一些能溶解木质纤维素的离子液体在木质纤维素的利用上也已经显示出巨大潜力[9]。
基于离子液体对木质纤维素良好的溶解作用,我们借鉴纤维素球的制备方法[10],首次制备了以秸秆为原料的再生木质纤维素多孔球[11-12]——将秸秆的离子液体溶液乳化分散在与溶剂不互溶的液体中,然后加入抗溶剂(水、乙醇等)固化,最后经冻干得到再生木质纤维素多孔球。这些木质球组分中包含大量富含羟基的纤维素、半纤维素组分,像目前广泛使用的纤维素球一样方便改性,可以在制球的基础上改性制备出具有不同功能的球形材料,用于污染物吸附[13]、色谱分离[14]等领域。从制备过程和原料使用上看,我们制备的木质球比目前广泛研究和使用的纤维素球原料更便宜,也避免了目前广泛使用的纤维素球纤维素分离和制球过程所带来的污染问题。因此,作为一种新型复合材料,木质球具有良好应用前景,完全可能替代一部分纤维素球。
本文中,我们以[Bmim]Cl(1-丁基-3-甲基咪唑氯盐)为溶剂溶解小麦秸秆,进而以不同浓度的秸秆溶液制球,并对秸秆溶液浓度对球的形态、微观结构、粒径、物理性质等方面的影响展开深入研究。
1 实验部分 1.1 材料与试剂小麦秸秆,采收自山西省晋中市农村。小麦收获后剩余的小麦秸秆风干并粉碎到60目以下,然后在索氏抽提器中用苯醇(苯醇体积比3:1)抽提2d,之后风干备用。使用前,将粉碎并抽提过的秸秆用球磨机磨至粉末状。
1-丁基-3-甲基咪唑氯盐(≥99%),(林州市科能材料科技有限公司);液体石蜡,相对密度0.835~0.855g/mL,馏出温度300℃以上(天津市永大化学试剂有限公司);司班80,相对分子量428.61,皂化值145~165(西陇化工股份有限公司);苯(≥99.5%),相对分子量78.11(北京化工厂);无水乙醇(≥99.7%),密度0.789~0.791g/mL,相对分子量46.07(西陇化工股份有限公司);乙醚(≥99.5%),相对分子量74.12(西陇化工股份有限公司)。
1.2 实验方法1) 再生秸秆木质纤维素多孔球的制备
秸秆木质纤维素多孔球通过乳化-固化-冻干的程序制备[10],主要过程包括以下步骤:①将秸秆粉与[Bmim]Cl混合加热至130℃,搅拌1h制成质量浓度为3%~8%的秸秆溶液;②直接向秸秆溶液中加入液体石蜡作为分散剂(10mL液体石蜡/g离子液体),再加入Span 80作为乳化剂(0.03g Span 80/mL液体石蜡),110℃下搅拌15~20min制备乳液;③向乳液中加入与液体石蜡等体积的去离子水,并强烈搅拌使木质球固化成型。固化后离心分离弃去油相(液体石蜡),并以0.45μm的纤维素膜为介质抽滤得到再生木质纤维素球。之后,先后用乙醚、去离子水各洗涤3次,得到湿木质球。湿球通过冷冻干燥得到干球。
2) 扫描电镜(SEM)分析
使用SM-6700F(JEOL, Tokyo, Japan)型场发射扫描电镜观察其微观形貌和表面结构。
3) 粒径分析
取少量湿态微球,采用Winner 2000E激光粒度分析仪测量湿态微球的粒径分布情况。
4) 物性分析
比表面积分析:取冷冻干燥后的再生秸秆木质纤维素多孔球和秸秆粉,60℃下烘干4h,采用Gemini V2380型物理吸附仪测其比表面积S和对氮气的吸附脱附曲线。利用附温比重瓶,通过测定排开去离子水的体积计算湿密度ρ,利用式(1)和式(2)计算其孔隙率P和孔体积V[15]
| $ P = \frac{\rho }{{{\rho ^*}}} \times 100\% , $ | (1) |
| $ V = \frac{X}{{\left( {1 - X} \right){\rho ^*}}}, $ | (2) |
其中, ρ*表示测定时环境温度下纯水的密度。
5) X射线衍射(XRD)分析
采用XD-3型X-射线衍射仪(北京普析通用仪器有限责任公司)对不同浓度秸秆溶液制备的再生木质纤维素多孔球在2θ=10°~90°范围内,以2°/min的步幅扫描,分析样品的晶型或结晶强度变化。
2 结果与讨论 2.1 秸秆球形态首先对各种浓度的秸秆溶液制备的球进行电镜观察。SEM照片反映球的形状和孔隙情况。当不同浓度的秸秆溶液乳化分散制备微球时,这些参数可以通过电镜照片进行直观的比较。
从放大倍数较大的SEM照片图 1(a)、1(c)、1(e)、1(g)可以看到,当秸秆溶液的浓度为5%时,得到的球具有较好的形态,几乎是完美的球形;当浓度为3%和6%时,所制备的球不太规则;当浓度增大到8%时,已经完全不是球形,只能得到颗粒。

|
Download:
|
| 秸秆木质纤维素多孔球冻干后进行电子显微镜观察,所使用的秸秆溶液浓度:(a)和(b)为3%,(c)和(d)为5%,(e)和(f)为6%,(g)和(h)为8%. 图 1 再生秸秆木质纤维素多孔球电镜照片(高放大倍数) Fig. 1 SEM images of porous regenerated wheat straw-lignocellulose-beads (high magnification) | |
影响球形的因素主要来自两个方面,一是秸秆溶液在液体石蜡中的乳化分散状态[16]。如果乳化较好则可能得到形状较好的球。秸秆所包含的主要组分,包括纤维素、半纤维素和木质素都属于天然高分子物质,它们溶解在溶液中时,溶液黏度跟浓度呈正相关。浓度为6%和8%的秸秆溶液制备出的颗粒,其形状不规则可能与溶液黏度比较大、乳化分散较难有关。影响球形的另一个因素是乳化时的颗粒固化以及固化后干燥时颗粒能否保持较好的形状。本实验中,根据理论分析,3%的秸秆溶液浓度比5%时更容易乳化分散,但前者制备的球形不如后者规整,可能是因为制球基质密度太低,在固化和干燥时发生了塌陷。
除形状外,图 1也反映不同浓度秸秆溶液乳化分散后制备的球的微观结构。从放大相同倍数的照片可以直观看出,使用浓度为3%(b)和5%(c)的秸秆溶液制备的球具有清晰的网状结构,其中浓度为3%的秸秆溶液制备的颗粒网状结构并不均匀,5%的秸秆溶液制备的球具有较为均匀的内部网络。
另外,为考察各浓度下的秸秆溶液制备的球形态的整体情况,我们还在较小的放大倍数下进行了秸秆球的SEM研究(图 2)。从图中可以看到,浓度为5%的秸秆溶液制备的球整体形态较好,能观察到比较多规则圆球,同时形态不规则的颗粒也比较少;3%浓度的秸秆溶液制备的球相比之下整体形态较差,不规则的颗粒也相对较多;6%浓度的秸秆溶液制备的球几乎观察不到圆形的球,球的形态大都类似图 1(e)中那样呈现不规则的形态。

|
Download:
|
| 秸秆木质纤维素多孔球冻干后进行电子显微镜观察,所使用的秸秆溶液浓度:(a)为3%,(b)为5%,(c)为6%. 图 2 再生秸秆木质纤维素多孔球电镜照片(低放大倍数) Fig. 2 SEM images of porous regenerated wheat straw-lignocellulose-beads (low magnification) | |
通过对电镜照片的分析发现,秸秆溶液的浓度对球的外部形态和内部微观形态都有重要影响,在本实验所考察的实验条件下,浓度为5%的秸秆溶液制备的球具有最好的球形和较为均匀的内部微观结构。
2.2 物理性质在形态观察的基础上,本文对不同浓度秸秆溶液制备的木质纤维素多孔球的物性参数,包括比表面积、湿密度、孔隙率、孔体积进行表征和比较,并且测定其对氮气的吸附脱附曲线。
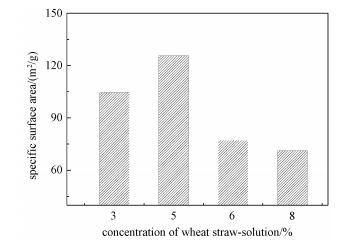
图 3显示用BET法测定的不同浓度秸秆溶液制备的木质球的比表面积。作为空白的秸秆粉的比表面积测定值为2.6m2/g(未显示在图中),而实验制备的所有木质球的比表面积均达到70.0m2/g以上,远高于秸秆原料。其中最高值达到126.0m2/g,这与Olli等[17]用纳米纤维制备的纤维素气凝胶材料的比表面积在同一数量级上,他们制备的气凝胶材料比表面积在108~539m2/g。这说明溶解和再生的制球过程形成了疏松多孔的内部形态,改进了秸秆物理性质,与我们之前的研究结果[11]一致。
|
Download:
|
| 图 3 不同浓度秸秆溶液制备的再生木质纤维素多孔球的比表面积 Fig. 3 Specific surface area of porous regenerated lignocellulose-beads prepared with four different concentrations of wheat straw-solutions | |
值得注意的是,用不同秸秆溶液制备的球比表面积(S)并不相同,且S的大小依浓度变化呈现明显的规律性。浓度为5%的秸秆溶液对应的比表面积最大126.0m2/g。当基质浓度过低(比如3%)时,比表面积较低,只有105.0m2/g,而当基质浓度过高(6%、8%)时,球的比表面积分别只有77.1m2/g和71.2m2/g。结合电镜观察结果,我们推断,秸秆溶液浓度低于5%时,球内部所形成的空隙较大,基质强度低,导致固化和冻干过程中球有塌陷(图 1(b));而当秸秆溶液浓度过高时,固化过程难以形成较好的内部孔隙结构(图 1(f)、图 1(h))。
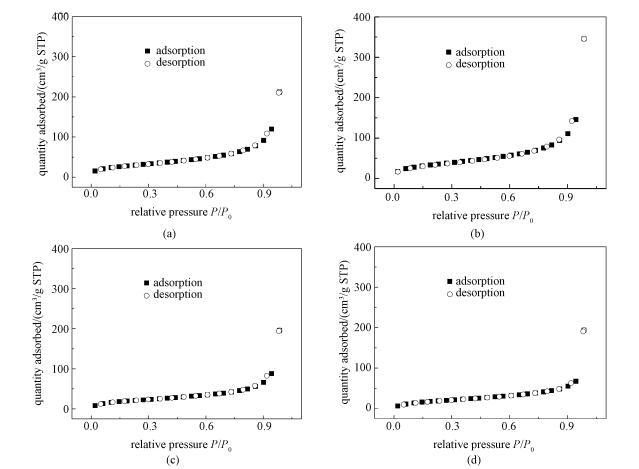
除测定比表面积,我们也测定了各种浓度秸秆溶液制备的球的吸附-脱附曲线(图 4)。这些球对氮气的吸附也呈现与比表面积测定结果相类似的规律,比如在P/P0=1.0时,氮气的吸附量呈现很大的不同。3%、6%和8%都在约200cm3/g附近(分别为213.0、195.8和193.7cm3/g),而当秸秆浓度为5%时,该值为345.5cm3/g。同时,BET吸附脱附曲线也说明了这些球的孔隙类型。按照Kruk等[18]的分类,这些曲线同属于吸附-脱附曲线几乎完全重合的类型,这说明木质球的孔隙主要是大孔(>50nm)。
|
Download:
|
| 使用物理吸附仪测定不同浓度的秸秆溶液制备的再生木质纤维素多孔球对氮气的吸附-脱附情况,所用的秸秆溶液浓度:(a)为3%,(b)为5%,(c)为6%,(d)为8%. 图 4 再生木质纤维素多孔球对氮气的吸附-脱附曲线 Fig. 4 N2 adsorption-desorption isotherms for porous regenerated lignocellulose-beads prepared with wheat straw-solutions | |
另外,在比表面分析仪对比表面积和吸附脱附曲线的表征后,我们用比重瓶对湿密度ρ、孔隙率P、孔体积V等参数做了测定和比较,数据见表 1。从表中可以看到,不同秸秆浓度下制备木质球的湿密度差别不大,都在1.10g/cm3左右。而孔隙率和孔体积随所使用的秸秆溶液浓度的增加而有明显减小的趋势。这些数据进一步定量描述了球内部的空隙状态,即秸秆溶液浓度较低时,再生得到的球内部具有较大的空隙,同时也印证了比表面积分析的结果和变化趋势。
|
|
表 1 不同浓度秸秆溶液制备的再生木质纤维素多孔球的理化性质 Table 1 Physical properties of porous regenerated lignocellulose-beads prepared with four different concentrations of wheat straw-solutions |
物性参数的分析和比较并结合电镜观察结果说明,可以通过溶解和再生制备具有疏松多孔和较大比表面积的微球或颗粒;在制备过程中,所使用的秸秆溶液的浓度对其物理性质有着明显影响,在实验所涉及的浓度范围内,5%的秸秆溶液制备的秸秆球具有最好孔隙结构和最大的比表面积。
另外,我们也注意到,使用浓度为5%的秸秆溶液制备的球的比表面积(126.0m2/g)是本研究中的最大值。但是比Zhang等[11]之前报道的浓度为4%的溶解制备的球比表面积(142.4m2/g)略低,因此结合二者,4%~5%是比较合适的制球秸秆溶液浓度。
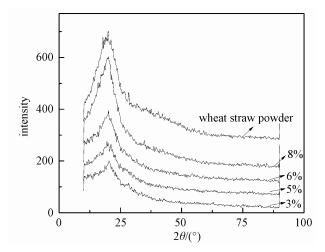
2.3 XRD分析图 5显示原料秸秆粉末和不同秸秆含量的再生木质纤维素多孔球的XRD谱图。从图中可以看到,所制备的球在2θ =20°附近出现明显的衍射峰,对应纤维素Ⅱ的(110)晶面[19-20]。而纤维素Ⅱ是再生纤维素的晶型,说明所制备的球是富含再生纤维素的木质球。此外,作为空白的秸秆原料的XRD图谱呈现的并非典型的天然纤维素的峰型,特别是没有观察到类似文献中[4]那样在2θ =22.6°附近的衍射峰,只是在2θ =20°附近出现一个宽峰。这可能与为了促进溶解而对秸秆进行的球磨预处理有关。Ribeiro等[21]在研究纤维素制备山梨醇的研究中观察到类似的情况,认为球磨会使天然纤维素的衍射峰强度下降,并且出现一个最高点在2θ =20°的宽峰。这种现象说明球磨对纤维素的结构有特定的影响,其作用机制尚待进一步探讨。
|
Download:
|
| 图 5 不同浓度的秸秆溶液制备的再生木质纤维素多孔球的XRD分析 Fig. 5 XRD patterns of porous regenerated lignocelluloses-beads prepared with four different concentrations of wheat straw-solutions and wheat straw-powder | |
另一个值得注意的现象是峰强度的变化趋势。图 5显示,再生木质纤维素球的峰强度低于秸秆粉末的峰强度,这说明再生产物的结晶度下降。这与文献[22]报道结果一致,可能是因为木质纤维素组分在溶解、再生过程中形成了很多无定型区域导致再生木质球结晶度降低。不过,几种浓度的秸秆溶液制备的木质球XRD的衍射峰强度并不一致,而是呈现正相关的趋势,即浓度越高,峰强度越高。说明从离子液体溶液中再生出来时,秸秆溶液的浓度对纤维素组分的结晶情况有影响,浓度越高,结晶度也越高。由于纤维素再生是一个羟基与离子液体之间氢键被破坏,然后在分子内、分子间形成新的氢键的过程[23],所以上述正相关的趋势可能是因为浓度较大的缘故,分子间羟基有更多相互作用的机会。
综上所述,XRD图谱提供了再生木质球中纤维素晶型的信息以及结晶度与制球时秸秆溶液浓度的关系。这些结果表明,本方法制备的球形材料是富含纤维素Ⅱ的再生多组分复合球,其中使用较高浓度秸秆溶液制备的木质球中的纤维素具有更高的结晶度。
2.4 木质球粒径分析为比较不同秸秆溶液浓度乳化分散后得到球的粒径分布情况,我们将3%~8%5个不同质量浓度的秸秆溶液乳化制备再生木质纤维素球,并且使用粒度分析仪对其粒径进行表征。
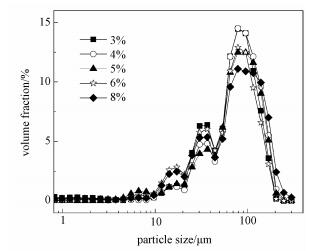
从图 6可以看到,不同浓度的秸秆溶液在相同条件下制备的球,都在79.0~95.6μm范围附近呈现最大的粒径分布,且具体分布的集中程度呈现一定的规律性。相比之下,3%和4%浓度的溶液乳化后制备的球在该尺度范围内分布更集中,分别是28.5%和28.6%;8%浓度的溶液正相反,在相应尺度范围的分布比例相对最低约为22.0%,浓度为5%和6%的秸秆溶液制备的球在100μm附近的分布介于上述二者之间(分别为25.0%和24.4%)。
|
Download:
|
| 图 6 不同浓度的秸秆溶液制备的再生木质纤维素多孔球的粒径分布 Fig. 6 Particle size distribution of porous regenerated lignocellulose-beads prepared with different concentrations of wheat straw-solutions | |
上述分布规律可能与秸秆溶液的黏度有关。秸秆的主要组分都是天然高分子物质,这些物质溶解在溶剂中时其溶液黏度一般跟浓度呈正相关。在本研究涉及的几种浓度的秸秆溶液中,浓度低的秸秆溶液易于较好的乳化分散,因此颗粒的粒径分布窄一些。
3 结论本研究利用离子液体对秸秆的溶解性,通过乳化-固化-冻干的过程制备了再生秸秆木质纤维素多孔球,并对不同浓度秸秆溶液制备的球做了电镜观察、物性分析、粒度分析、XRD分析。通过比较这些结果发现,当秸秆溶液为5%时,所得球的形态和微观结构最优;同时,5%的溶液制备的球也具有最大的比表面积和氮吸附能力;较低的秸秆溶液浓度下制备的球粒径分布更窄;再生球的结晶度与所使用的秸秆溶液的浓度有关,浓度越高结晶度也越高。上述这些结果说明,秸秆离子液体溶液的浓度是制备木质球过程中一个至关重要的影响因素,同时,结合我们[11]之前报道的工作判断,浓度为4%~5%左右是较好的制球条件。这些结果对研究再生秸秆木质纤维素多孔球的理化性质和优化制球工艺有指导意义。
| [1] | Tozluoǧlu A, Özyurek Ö, Çöpür Y, et al. Integrated production of biofilm, bioethanol, and papermaking pulp from wheat straw[J]. BioResources, 2015, 10(4):7834–7853. |
| [2] | Delgado I, Fernandez J, Valles C, et al. Multiple objective optimization of a biomass to bio-refinery logistics system//ⅡE Annual Conference. Proceedings. Institute of Industrial Engineers-Publisher, 2015:76. |
| [3] | Joelsson E. Techno-economic evaluation of integrated cellulose and starch-based ethanol production from wheat straw and wheat meal//37th Symposium on Biotechnology for Fuels and Chemicals. Simb, 2015. |
| [4] | 裴继诚, 平清伟. 植物纤维化学[M]. 中国轻工业出版社, 2012. |
| [5] | 林珊, 曹石林, 黄六莲, 等. 纤维素的溶解及其成膜研究进展[J]. 科学技术与工程, 2014(4):124–130. |
| [6] | Wang J. The impacts of biopolymer-ionic liquid interactions on the utilization of lignocellulosic biomass[M]. Knoxville: University of Tennessee, 2016. |
| [7] | Rogers R D. Materials science:reflections on ionic liquids[J]. Nature, 2007, 447(7147):917–918. DOI:10.1038/447917a |
| [8] | Swatloski R P, Spear S K, Holbrey J D, et al. Dissolution of cellose with ionic liquids[J]. Journal of the American Chemical Society, 2002, 124(18):4974–4975. DOI:10.1021/ja025790m |
| [9] | Abdulkhani A, Marvast E H, Ashori A, et al. Effects of dissolution of some lignocellulosic materials with ionic liquids as green solvents on mechanical and physical properties of composite films[J]. Carbohydrate Polymers, 2013, 95(1):57–63. DOI:10.1016/j.carbpol.2013.02.040 |
| [10] | 曾丹林, 陈诗渊, 张崎, 等. 纤维素制备微球材料的研究进展[J]. 材料导报, 2015, 29(17):68–72. |
| [11] | Zhang H Z, Zhang Z G, Liu K X. Regenerated lignocellulose beads prepared with wheat straw[J]. BioResources, 2016, 11(2):4281–4294. |
| [12] | 中国科学院大学. 一种再生木质微球及其制备方法: 中国, 201310471740. 9. 2014-01-08. http://www.pss-system.gov.cn/sipopublicsearch/patentsearch/searchHomeIndex-searchHomeIndex.shtml. |
| [13] | 吴鹏, 刘志明, 彭涛, 等. Ag2O/再生纤维素球形气凝胶的性能表征[J]. 林产化学与工业, 2016, 36(3):29–35. |
| [14] | Trivedi P, Trygg J, Saloranta T, et al. Synthesis of novel zwitterionic cellulose beads by oxidation and coupling chemistry in water[J]. Cellulose, 2016, 23(3):1751–1761. DOI:10.1007/s10570-016-0939-5 |
| [15] | Shi F, Lin D Q, Phottraithip W, et al. Preparation of cellulose-tungsten carbide composite beads with ionic liquid for expanded bed application[J]. Journal of Applied Polymer Science, 2011, 119(6):3453–3461. DOI:10.1002/app.v119.6 |
| [16] | 马光辉, 苏志国. 高分子微球材料[M]. 北京: 化学工业出版社, 2005. |
| [17] | Aaltonen O, Jauhiainen O. The preparation of lignocellulosic aerogels from ionic liquid solutions[J]. Carbohydrate Polymers, 2009, 75(1):125–129. DOI:10.1016/j.carbpol.2008.07.008 |
| [18] | Kruk M, Jaroniec M. Gas adsorption characterization of ordered organic-inorganic nanocomposite materials[J]. Chemistry of Materials, 2001, 13(10):3169–3183. DOI:10.1021/cm0101069 |
| [19] | French A D. Idealized powder diffraction patterns for cellulose polymorphs[J]. Cellulose, 2014, 21(2):885–896. DOI:10.1007/s10570-013-0030-4 |
| [20] | Xu D, Cai J, Zhang L. High strength cellulose composite films reinforced with clay for applications as antibacterial materials[J]. Chinese Journal of Polymer Science, 2016, 34(10):1281–1289. DOI:10.1007/s10118-016-1840-2 |
| [21] | Ribeiro L S, Írfão J J M, Pereira M F R. Enhanced direct production of sorbitol by cellulose ball-milling[J]. Green Chemistry, 2015, 17(5):2973–2980. DOI:10.1039/C5GC00039D |
| [22] | Luo X G, Zhang L N. Creation of regenerated cellulose microspheres with diameter ranging from micron to millimeter for chromatography applications[J]. Journal of Chromatography A, 2010, 1217(38):5922–5929. DOI:10.1016/j.chroma.2010.07.026 |
| [23] | Zhang H, Wu J, Zhang J, et al. 1-Allyl-3-methylimidazolium chloride room temperature ionic liquid:a new and powerful nonderivatizing solvent for cellulose[J]. Macromolecules, 2005, 38(20):8272–8277. DOI:10.1021/ma0505676 |
 2017, Vol. 34
2017, Vol. 34 


