2. 贵州大学农学院, 贵阳 550025;
3. 中国林业科学研究院沙漠林业实验中心, 内蒙古 磴口 015200
2. College of Agriculture, Guizhou University, Guiyang 550025, China;
3. Experimental Center of Desert Forestry, Chinese Academy of Forestry, Dengkou 015200, Inner Mongolia, China
植物光合作用作为碳循环最关键的环节之一,即使发生微小的变化也会对陆地生态系统碳收支平衡产生很大影响。荒漠生态系统是陆地生态系统的重要组成部分,被认为在全球碳循环中扮演长期碳中性或碳源的角色[1-4],但近年来有研究指示荒漠生态系统可能是一直未明的大气CO2的“失踪汇”所在[4-5]。荒漠生态系统究竟是碳源还是碳汇,依然是学术界争论的焦点。中国荒漠生态系统面积约为165万km2,是西北地区代表性生态系统类型,具有独特的结构和功能,且有逐年扩大的趋势[6-7]。随着全球平均表面温度的上升,中纬度大部分陆地地区的极端降水很可能强度加大、频率增高,全球范围内受季风系统影响的地区降水可能增加[8]。作为水分限制的生态系统,未来降水格局的改变必然会对荒漠生态系统过程产生重大影响。然而,目前有关陆地生态系统对全球变化的响应与适应的研究多集中于生物量较大的森林生态系统和草原生态系统[1, 9],对荒漠生态系统的研究尤其是在原位开展荒漠生态系统对全球变化的响应与适应的研究非常少。自2008年开始,中国林业科学研究院荒漠化研究所在中国西北干旱区库姆塔格沙漠、巴丹吉林沙漠和乌兰布和沙漠的边缘分别建立人工模拟增雨实验平台,研究荒漠生态系统对人工模拟增雨的响应与适应。研究结果表明,多年的人工模拟增雨已经显著改变了荒漠生态系统的碳循环过程。如人工模拟增雨后荒漠生态系统土壤呼吸速率增加,日动态变幅改变[2],根系自养呼吸和土壤微生物呼吸对增雨的响应存在不同的“迟滞效应”[3];白刺生长加快,生物量分配发生变化[10-12]。在光合生理特性方面,人工模拟增雨后白刺叶片气孔导度增加[13-14],瞬时净光合速率、最大净光合速率、CO2饱和点、原初光化学量子效率、电子传递速率、光化学淬灭系数等光合生理参数均随增雨量的增加而增大,其中75%和100%增雨样地与对照相比显著增大[15-16]。基于之前的研究成果和观测数据,本文研究结果发现,人工模拟增雨不仅可以提高白刺叶片净光合速率,还可以改变白刺光合作用对温度的适应范围。由于植物光合作用对温度的适应是碳循环模型中的重要参数,对模型模拟结果的精度具有较大影响[17]。因此,研究人工模拟增雨条件下植物光合作用对温度的适应规律具有重要意义。
1 材料与方法 1.1 样地描述本研究基于中国林业科学研究院在乌兰布和沙漠东缘建立的荒漠生态系统人工模拟增雨实验平台开展。研究地点位于内蒙古自治区磴口县,中国林业科学研究院沙漠林业实验中心第二实验场(106°43′E, 40°24′N, 1 050 m)。气候类型属于中温带大陆性季风气候,年均温7.6 ℃,年平均降水量145 mm,年均蒸发量2 381 mm。白刺(Nitraria tangutorum)是研究地点的优势植物,能够阻挡风沙并形成白刺灌丛沙包,沙包高约1~3 m,直径约6~10 m,植被盖度约为45%~75%,伴生种有沙鞭(Psammochloa villosa)、油蒿(Artemisia ordosica)等。土壤类型沙包上为风沙土,沙包之间没有流沙覆盖处为灰棕漠土[18]。
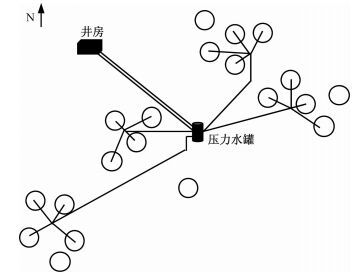
1.2 人工模拟增雨处理荒漠生态系统人工模拟增雨实验平台始建于2008年,共设置5个增雨梯度,即对照,在当年自然降水量的基础上,分别增加实验地年平均降水量的25%、50%、75%和100%。每种处理4个重复,共20个样地,每个样地面积113.04 m2,样地间隔5~15 m,采用随机区组排列,具体分布如图 1所示。增雨时,水由样地附近的水井泵出并暂存在一个压力水罐中,水罐中的水经分水器分流后,通过地下水管输送至每个样地,水流推动全自动喷灌系统(由一个基座和两个长6 m的旋转臂组成)的双臂匀速旋转,水从旋转臂上多点同时喷射,能够保证样地受水均匀。不同处理的增雨量由水表控制。自然降水等气象数据来自样地旁标准气象观测站。
|
Download:
|
|
图 1 实验区20个样地分布示意图 Fig. 1 Distribution map of sample plots |
|
增雨选择在晴朗、无风的天气进行。实验开始第1年即2008年,每月增雨2次,全年共增雨10次,增雨时间分别为5~9月每月的10日和25日。对照、25%、50%、75%和100%增雨处理每次增雨量分别为0、3.63、7.25、10.87和14.5 mm。自第2年即2009年开始,改为每月增雨1次,全年共增雨5次,增雨时间为5—9月每月的13日左右,视天气情况偶有调整。对照、25%、50%、75%和100%增雨处理每次增雨量分别为0、7.25、14.5、21.75和29 mm,增雨时长约5 h。
1.3 净光合速率测定2010年5—9月,分别在增雨前1天,增雨后1、3、5、7、9、11天8:00—10:00,选择白刺沙包中上部生长有2~3片成熟、健康叶片的小枝,采用Li-6400xt便携式光合测定系统分析仪(Li-Cor,Inc., Lincoln, NE, USA)分别测定每个样地白刺叶片的净光合速率(Pn)、蒸腾速率、气孔导度、胞间二氧化碳浓度、叶周围气温(Ta)等生理指标(空气流速设置为500 μmol·s-1),每次测定时间为2 min,具体见文献[16]。10、20、30、40、50 cm深土壤含水量采用Decagon Echo 5 TM探头监测,采用Decagon EM50数据采集器(Decagon Devices, Inc., Pullman, WA)进行数据采集,频率为30 min。本论文仅分析人工模拟增雨后白刺光合作用对温度适应范围的变化规律。
1.4 清晨叶水势测定2010年6—9月,每月增雨前1天,增雨后1、3、5、7、9天清晨5点左右,分别在20个白刺沙包(样地)内随机选取20片健康叶片,采用WP4露点水势仪(model WP4-T, Decagon Devices, Inc., Pullman, Washington)进行清晨水势测定。测定时间为10 min左右。
1.5 统计分析采用重复测量的方差分析法(RMANOVA)分析增雨处理对白刺净光合速率、叶周气温、清晨叶水势以及土壤含水量是否有显著影响,显著性水平设定为α=0.05。光合速率与叶周气温的相关性采用回归法分析。增雨处理后,清晨叶水势采用相对变化值表示,即清晨叶水势相对变化=(增雨样地清晨叶水势-对照样地清晨叶水势)×100%/对照样地清晨叶水势的绝对值。叶周气温变化用增雨处理样地与对照样地之间的差值表示。所有统计分析均在SPSS 17.0(SPSS for Windows, Version 17.0, Chicago, IL, USA)中完成,采用Excel 2007作图。
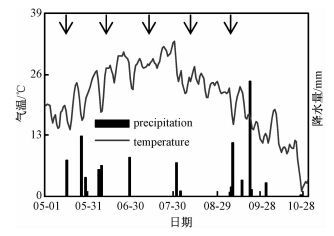
2 结果与分析 2.1 自然降雨和气温动态研究区域2010年生长季5—10月的日降雨量和日均温变化如图 2所示。整个生长季降雨呈U型变化趋势,即生长季早期和末期降雨较多,中期降雨较少。生长季降雨总量为91.6 mm,降水距平(CV)为36.83%,较多年平均降水量偏少。其中,5月、6月和7月分别降雨16.5、20.5和7 mm,8月仅在8月3日当天降雨1 mm,9月降雨最多,为43.4 mm。生长季最大降雨事件发生在9月20日,降雨24.5 mm。研究区域生长季气温为单峰曲线,即在夏季达到峰值。7月平均气温(29.26 ℃)最高,10月(9.78 ℃)最低。
|
Download:
|
|
图中箭头指示增雨时间。 图 2 2010年生长季自然降水和气温日变化 Fig. 2 Daily variations in precipitation and air temperature during the growing season in 2010 |
|
植物生长与植物体内外水分状况密切相关,清晨叶水势(leaf water potential at predawn, ψpd)是一个相对稳定的生理指标,能够直接反应外界环境变化对叶片水分状态的影响。重复测量的方差分析结果表明,增雨处理和增雨时间均对清晨叶水势产生显著影响(P<0.001)。对照样地白刺清晨叶水势生长季平均值为(-5.30±0.14) MPa。由图 3可见,与对照相比,50%((-4.75±0.12) MPa)、75%((-4.62±0.19) MPa)和100%((-4.44±0.16) MPa)人工模拟增雨使白刺清晨叶水势明显上升,上升幅度随增雨量的增加而增大。25%增雨处理样地白刺清晨叶水势生长季平均值为(-5.26±0.06) MPa,低于对照样地平均值。这可能和25%增雨处理单次增雨量向土壤中的入渗深度较浅(<30 cm,图 4),不能很好地被白刺根系,尤其是细根利用,对改善白刺叶片水分状态的贡献有限;与此同时,25%的增雨量却促进白刺叶片气孔开放度和蒸腾速率的增加,加剧了白刺组织内水分的丧失有关[13-16]。

|
Download:
|
|
图中垂直虚线指示增雨时间。 图 3 2010年6—9月增雨处理后白刺清晨叶水势相对变化 Fig. 3 Changes in leaf water potentials at predawn (△ψpd-relative, %) of N. tangutorum in different rain addition treatment plots relative to the ones in the control plot from June to September in 2010 |
|

|
Download:
|
|
图 4 2015年9月增雨处理前后不同土层含水量变化趋势 Fig. 4 Changes in soil water contents at different depths before and after rain addition treatment in September 2015 |
|
由图 5可见,与对照相比,人工模拟增雨(25%~100%)使白刺叶周气温显著升高(P<0.001,RMANOVA),升高幅度随增雨量的增加而增大。对照样地生长季白刺叶周气温平均值为26.6 ℃,25%、50%、75%和100%增雨处理样地生长季白刺叶周气温平均值分别比对照提高0.2、0.2、0.4和0.6 ℃。

|
Download:
|
|
图 5 2010年5—9月增雨样地与对照样地白刺叶周气温差值变化规律 Fig. 5 Changes in leaf surface air temperature of N. tangutorum in different rain addition treatment plots relative to the ones in the control plot from May to September in 2010 |
|
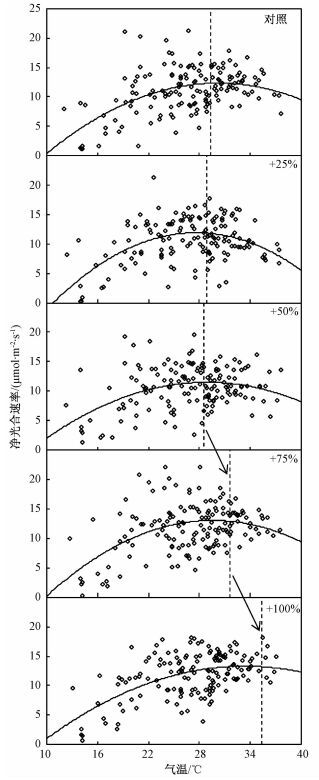
对照样地白刺叶片净光合速率与叶周气温之间呈显著的二次函数关系。增雨处理后,白刺叶片净光合速率与叶周气温之间的拟合曲线没有发生改变,但与对照相比,拟合曲线的顶点发生了平移。其中,25%和50%处理样地向左平移,而75%和100%增雨处理样地向右平移(图 6)。白刺净光合速率达到最大时所对应的叶周气温在对照、25%、50%、75%和100%增雨处理条件下分别为29.31、28.87、28.57、31.57和35.33 ℃。与对照相比,25%和50%增雨处理后拟合曲线顶点,即白刺叶片最大光合速率对应的叶周气温分别下降0.44和0.74 ℃,变化相对较小;随着增雨量继续增加,75%和100%增雨处理条件下,最大光合速率对应的叶周气温较对照分别增加2.26和6.02 ℃(图 6)。该结果意味着75%的增雨量可能是人工模拟增雨对本研究区域白刺光合作用产生正效应的临界点。
|
Download:
|
|
图中虚线指示最大光合速率对应叶周气温所在位置。 图 6 不同增雨处理条件下白刺光合速率和气温的相关关系 Fig. 6 Relationships between the net photosynthetic rate and air temperature in different rain addition treatment plots |
|
本研究中,在叶周气温较低时,各增雨处理间白刺叶片净光合速率与叶周气温拟合曲线的起点非常接近,25%和50%增雨条件下拟合曲线顶点向左偏移;而随着增雨量继续增加,75%和100%增雨处理后拟合曲线的顶点明显向右偏移,曲线在x轴的投影面积增大(图 6)。该结果意味着与对照样地相比,75%和100%增雨处理后,白刺叶片不仅净光合速率增加[15-16]、而且即使在高温条件下也能继续保持较高的光合速率,有利于白刺在高温条件下积累更多的同化产物。即使在降水丰富的地区,植物光合作用也与降水量多少密切相关。如沿着欧洲温度和降水梯度样带(英国、丹麦、荷兰、西班牙;450~1 700 mm;7~15 ℃),杜鹃科灌丛净光合速率与生长季累积降水量呈正相关关系,干旱处理使西班牙杜鹃科灌丛叶片气孔导度和光合速率较对照下降,但由于测定之前降雨的累积效应,其他3个地区植物光合速率变化不明显[19]。在荒漠生态系统,水分是影响植物进行光合作用的主要限制因子[20-21]。因此,我们推测荒漠生态系统在人工增雨处理后由水分限制向非水分限制的转变是白刺光合作用对温度的适应范围发生改变的主要原因之一[22]。在本研究中,人工模拟增雨处理(50%、75%和100%)后白刺叶片清晨水势较对照显著提高,证实增雨处理使白刺叶片水分条件得到明显改善(图 3)。
植物光合最适温度会随环境温度的上升而升高[1, 23-24],但在光量子通量密度受限时,环境温度过高会导致电子传递链上的蛋白复合体解偶联,叶绿素b向叶绿素a传递激发能的通路被阻断,光系统Ⅱ和光系统I之间的激发能分配发生改变,量子产额降低[25]。如在7、12、20 ℃条件下,南极漆姑草光合最适温度分别为8.4、10.3、11.5 ℃[26]。增温条件下,中国温带草原5种植物的光合最适温度和相应光合速率分别增加0.33~0.78 ℃和4%~27%[27]。C3植物适应高温主要通过1, 5-二磷酸核酮糖羧化加氧酶(Rubisco)、二磷酸核酮糖(RuBP)和磷酸(Pi)的再生来调节,且这种适应性具有物种差异性[28-29]。当CO2浓度低于300 ppm时,C3植物叶片光合作用的温度适应性主要由Rubisco活性控制,当CO2浓度继续上升时,控制因素转为Pi的再生能力[28]。对于C4植物,Rubisco活性是耐寒植物在20 ℃以下时光合作用温度适应性的主要限制因素,但高温条件下其限制因素尚不明确[28]。也有研究发现Larrea divaricata叶片光合最适温度的改变主要由捕光色素和光反应中心共同调控[25],与Rubisco关系不大[24]。本研究对增雨后白刺叶周气温变化的研究结果表明,增雨后叶周气温显著升高,且增雨量越大,叶周气温上升幅度越大,尤其在75%和100%增雨处理样地的上升幅度分别可达0.40和0.63 ℃。因此,当人工增雨量达到对白刺光合作用产生正效应的临界值(75%)后,植物叶片较好的水分条件和相对较高的叶周气温共同改变了白刺光合作用对温度的适应范围,使其即使在高温条件下(29~35 ℃)也能继续保持较高的光合能力。
| [1] | Gunderson C A, O'Hara K H, Campion C M, et al. Thermal plasticity of photosynthesis: the role of acclimation in forest responses to a warming climate[J]. Global Change Biology, 2010, 16:2272–2286. |
| [2] | Song W M, Chen S P, Wu B, et al. Vegetation cover and rain timing co-regulate the responses of soil CO2 efflux to rain increase in an arid desert ecosystem[J]. Soil Biology & Biochemistry, 2012, 49:114–123. |
| [3] | Song W M, Chen S P, Zhou Y D, et al. Contrasting diel hysteresis between soil autotrophic and heterotrophic respiration in a desert ecosystem under different rainfall scenarios[J]. Scientific Reports, 2015, 5(12):1436–1438. |
| [4] | Wohlfahrt G, Fenstermaker L F, Arnone J A. Large annual net ecosystem CO2 uptake of a Mojave Desert ecosystem[J]. Global Change Biology, 2008, 14:1475–1487. DOI:10.1111/j.1365-2486.2008.01593.x |
| [5] | Xie J X, Li Y, Zhai C X, et al. CO2 absorption by alkaline soils and its implication to the global carbon cycle[J]. Environmental Geology, 2009, 56:953–961. DOI:10.1007/s00254-008-1197-0 |
| [6] | 程磊磊, 郭浩, 吴波, 等. 荒漠生态系统功能及服务的评估体系与方法[J]. 绿洲农业科学与工程, 2016, 2(1):12–18. |
| [7] | Parick L D, Ogle K, Bell C W, et al. Physiological responses of two contrasting desert plant species to precipitation variability are differentially regulated by soil moisture and nitrogen dynamics[J]. Global Change Biology, 2009, 15:1214–1229. DOI:10.1111/gcb.2009.15.issue-5 |
| [8] | Pachauri R K, Meyer L A. Climate change 2014: synthesis report. Contribution of Working Groups Ⅰ, Ⅱ and Ⅲ to the fifth assessment report of the intergovernmental panel on climate change [R]. Geneva, Switzerland: IPCC, 2014. |
| [9] | Yan L M, Chen S P, Huang J H, et al. Water regulated effects of photosynthetic substrate supply on soil respiration in a semiarid steppe[J]. Global Change Biology, 2011, 17:1990–2001. DOI:10.1111/j.1365-2486.2010.02365.x |
| [10] | 朱雅娟, 贾子毅, 吴波, 等. 模拟增雨对荒漠灌木白刺枝叶生长的促进作用[J]. 林业科学研究, 2012, 25(5):626–631. |
| [11] | 张金鑫, 卢琦, 吴波, 等. 白刺枝叶生长对人工模拟降雨的响应[J]. 林业科学研究, 2012, 25(2):130–137. |
| [12] | 何季, 吴波, 鲍芳, 等. 人工模拟增雨对乌兰布和沙漠白刺生物量分配的影响[J]. 林业科学, 2016, 52(5):81–91. |
| [13] | 任昱, 卢琦, 吴波, 等. 白刺叶片气孔特征对人工模拟降雨的响应[J]. 生态学报, 2014, 34(21):6101–6106. |
| [14] | 任昱, 吴波, 卢琦, 等. 荒漠植物白刺叶片气孔性状对模拟增雨的响应[J]. 林业科学研究, 2015, 28(6):865–870. |
| [15] | 何季, 吴波, 鲍芳, 等. 荒漠植物白刺对模拟增雨的光合响应机制[J]. 林业科学, 2015, 51(6):27–35. |
| [16] | 何季, 吴波, 贾子毅, 等. 白刺光合生理特性对人工模拟增雨的响应[J]. 林业科学研究, 2013, 26(1):58–64. |
| [17] | 张赐成, 韩广, 关华德, 等. 樟树和桂花树光合最适温度对环境温度改变的响应[J]. 生态学杂志, 2014, 33(11):2980–2987. |
| [18] | Zhang J X, Gu L H, Bao F, et al. Nitrogen control of 13C enrichment in heterotrophic organs relative to leaves in a landscape building desert plant species[J]. Biogeosciences, 2015, 12:15–27. DOI:10.5194/bg-12-15-2015 |
| [19] | Llorens L, Peñuelas J, Beier C, et al. Effects of an experimental increase of temperature and drought on the photosynthetic performance of two Ericaceous shrub species along a north-south European gradient[J]. Ecosystems, 2004, 7:613–624. |
| [20] | Li Y G, Jiang G M, Liu M Z, et al. Photosynthetic response to precipitation/rainfall in predominant tree (Ulmus pumila) seedlings in Hunshandak Sand land, China[J]. Photosynthetica, 2007, 45(1):133–138. DOI:10.1007/s11099-007-0021-5 |
| [21] | Haase P, Pugnaire F I, Clark S C, et al. Environmental control of canopy dynamics and photosynthetic rate in the evergreen tussock grass Stipa tenacissima[J]. Plant Ecology, 1999, 145:327–339. DOI:10.1023/A:1009892204336 |
| [22] | Seghieri J, Carreau J, Boulain N, et al. Is water availability really the main environmental factor controlling the phenology of woody vegetation in the central Sahel[J]. Plant Ecology, 2012, 213:861–870. DOI:10.1007/s11258-012-0048-y |
| [23] | Yamori W, Noguchi K, Terashima I. Temperature acclimation of photosynthesis in spinach leaves: analyses of photosynthetic components and temperature dependencies of photosynthetic partial reactions[J]. Plant, Cell and Environment, 2005, 28:536–547. DOI:10.1111/pce.2005.28.issue-4 |
| [24] | Mooney H A, Björkman O, Collatz G J. Photosynthetic acclimation to temperature in desert shrub, Larrea divaricata: I. Carbondioxide exchange characteristics of intact leaves[J]. Plant Physiology, 1978, 61:406–410. DOI:10.1104/pp.61.3.406 |
| [25] | Armond P A, Schreiber U, Björkman O. Photosynthetic acclimation to temperature in desert shrub, Larrea divaricata: Ⅱ. Light harvesting efficiency and electron transport[J]. Plant Physiology, 1978, 61:411–415. DOI:10.1104/pp.61.3.411 |
| [26] | Xiong F S, Mueller E C, Day T A. Photosynthetic and respiratory acclimation and growth responses of Antarctic vascular plants to contrasting temperature regimes[J]. American Journal of Botany, 2000, 87(5):700–710. DOI:10.2307/2656856 |
| [27] | Niu S L, Li Z, Xia J Y, et al. Climatic warming changes plant photosynthesis and its temperature dependence in a temperate steppe of northern China[J]. Environmental and Experimental Botany, 2008, 63:91–101. DOI:10.1016/j.envexpbot.2007.10.016 |
| [28] | Sage R F, Kubien D S. The temperature response of C3 and C4 photosynthesis[J]. Plant, Cell and Environment, 2007, 30:1086–1106. DOI:10.1111/pce.2007.30.issue-9 |
| [29] | Lin Y S, Medlyn B E, Ellsworth D S. Temperature responses of leaf net photosynthesis: the role of component processes[J]. Tree Physiology, 2012, 32:219–231. DOI:10.1093/treephys/tpr141 |
 2017, Vol. 34
2017, Vol. 34 


