2. 四川大学生命科学学院, 成都 610064;
3. 中国科学院大学, 北京 100049;
4. 国际山地综合发展中心, 加德满都 GPO Box 3226, 尼泊尔
2. College of Life Sciences, Sichuan University, Chengdu 610064, China;
3. University of Chinese Academy of Sciences, Beijing 100049;
4. International Centre for Integrated Mountain Development, GPO Box 3226, Kathmandu, Nepal
全球气候变暖已经成为影响人类生存与发展的重要原因之一,甲烷(CH4)和二氧化碳(CO2)是导致全球气候变暖的主要温室气体来源,其中CH4单分子的增温潜势是CO2的25倍,对全球气候变暖的贡献约为15%~20%,是继二氧化碳之后最重要的温室气体之一[1]。在全球人为甲烷排放中,反刍家畜被认为是主要的农业甲烷排放源,每年排放甲烷约85 Tg,其中73%来自于牛的肠道发酵,反刍家畜排放的甲烷占人类活动甲烷排放总量的33%[2-3]。CH4是反刍家畜瘤胃发酵不可避免的代谢产物,通过打嗝释放到体外,以CH4形式损失的能量占总采食饲料能量的2%~15%[4],反刍家畜的甲烷排放不仅造成温室气体的增加,还降低了动物的生产效益。
青藏高原由于其独特的地理环境对气候变化十分敏感。中国是世界牦牛的发源地,全世界94%以上的牦牛生活在中国青藏高原,主要分布在海拔3 000 m以上的西藏、青海、新疆、甘肃、四川、云南等省区[5]。牦牛是藏区牧民最主要的经济来源,近年来随着藏区人民生活水平的不断提高,牦牛的数量持续增加,因此在该地区由畜牧业所产生的温室气体所占的比例也在不断增加。但目前对于自然放牧条件下牦牛的甲烷排放量的研究还较少,并且多集中于间接测定法,如模型公式估算法[6-7]和体外产气法[8-9]。模型公式估算法较为简单,可行性强,但结果的准确性不够理想[10];体外产气法对于估测反刍家畜瘤胃甲烷排放具有操作简单、结果稳定之优点,但原虫和真菌在体外生长不佳,并且没有最终产物的排放和反应底物的持续供给,导致瘤胃微生物的生存环境发生改变,影响结果的稳定性和准确性[11]。因此如何精确测定自然放牧牦牛的甲烷排放量是当前亟待解决的问题,准确测定牦牛甲烷排放既可完善中国反刍动物甲烷排放清单,降低不确定性,也可以为量化全球温室气体排放提供重要数据。对反刍动物瘤胃甲烷直接测定主要有呼吸代谢箱、呼吸面罩、六氟化硫示踪法等[12-16],这些技术在准确度和实用性上各有利弊,要根据试验环境和研究内容选择相应的方法。本研究采用开路回流式面罩-气相色谱结合的方法在青藏高原高寒草甸生长季测定自然放牧不同年龄阶段母牦牛的温室气体排放,主要研究内容有:1) 不同年龄阶段的自然放牧母牦牛CO2和CH4呼吸排放通量;2) 分析影响自然放牧母牦牛CO2和CH4排放的主要因素;3) CO2和CH4呼吸排放通量与血液生化指标的关系及年龄对血液生化指标的影响;4) 对比自然放牧状态下母牦牛与在不同区域放牧的其他牛科动物的CH4呼吸排放通量。以期为准确评估在青藏高原地区反刍家畜温室气体排放清单提供数据支持。
1 材料与方法 1.1 试验地点试验于2015年6月—10月在四川省阿坝州红原县龙日坝种畜场附近(102.56°E,32.51°N,海拔3 790 m)进行,该地区是青藏高原东部向四川盆地过渡的高原区,属于大陆性高原寒温带季风气候,气候寒冷,太阳辐射强烈,日温差较大。年均温为0.6~1.1 ℃,年均降水量为756 mm,全年80%的降水主要集中于5—9月。该高寒草甸草地植被类型以无脉苔草(Carex enervis)、发草(Deschampsia caespitos)、火绒草(Leontopodium leontopodioides)、鹅绒委陵菜(Potentilla anserine)、星状雪兔子(Saussurea stella Maxim)等为优势物种,其中伴生种主要有垂穗披碱草(Elymus nutans)、华丽龙胆(Gentiana sino-ornata Balf. f.)、高山韭(Allium sikkimense)、溚草(Koeleria cristata Pers.)等。
1.2 试验设计试验所用母牦牛共12头,分为1~2岁、3~4岁和5~6岁3个年龄层次试验组,每组4头体重均匀的牦牛,试验开始前对牛面具的调教均不少于5 d。放牧管理方式为每天从6:00开始放牧,17:30放牧结束后牦牛均回牛圈休息,定期定点饮水。试验于2015年在高寒草甸草地生长季期间进行,6月份开始,10月份结束,每月采样一次,采气时间点分别为放牧前和收牧后。之所以选择在放牧前后进行采样:一是放出的牦牛会集中收牧于卧圈中,方便测定;二是采样次数较多会影响牦牛的采食状态;三是考虑到夜间的反刍行为,放牧管理方式为每天从6:00开始放牧(牦牛已经收牧于草场卧圈中一晚无采食),17:30放牧结束(采食一白天),同时参考徐田伟等[17]对舍饲藏绵羊甲烷和二氧化碳排放测定的数据,发现夜间反刍时藏绵羊的CH4呼吸排放量较平稳,没有显著性差异。因此选择2次采样计算排放通量。本试验在取样进行中及取样间隔期会尽量避免影响放牧家畜的正常活动。
1.3 气体样品采集与分析在本试验中采用的呼吸面罩是依据文献[18-20]中的研究设计而改良的。该开路回流式面罩系统主要由面罩、气体流量计和泰德拉集气袋(300 L)组成。面罩是由轻质的PVC管制成的圆柱形筒,高50 cm,上直径26 cm (内装有橡胶气圈确保面部密封),下直径5 cm (用于连接PVC波纹管)。在圆柱形底部装有10个单向排气阀用于进出气体,6个进气阀,4个排气阀,确保牦牛自由吸入空气。呼出的气体顺利经过气体流量计流入泰德拉集气袋中,所有的装置都由PVC波纹管密封连接。通过测定一定时间内进出头罩气体CH4的体积与浓度计算出牦牛CH4呼吸排放通量。
每头试验母牦牛通过气体流量计采集200 L的气体,记录环境温度、湿度、采气时间。采样结束后,需用手摇动采气袋若干下,充分混均气袋内的气体,采集200 mL气体样品于250 mL泰德拉气体小采样袋内,关闭开关,密封保存于采样箱内。将样品立即带回实验室,采用Agilent 7890A型GC System (Agilent, Hewlett Packard, USA)对收集气体浓度进行检测,TCD检测器,Porapak Q 80/100填充柱,载气N2流速为30 mL·min-1,进样口、色谱柱和检测器温度分别为200、80和200 ℃。标准气浓度为:CH4 0.25%和CO2 3.5%。
排放速率计算公式如下
| $F = L \cdot \frac{M}{{{V_0}}} \cdot C \cdot \frac{{{T_0}}}{{{T_0} + t}} \cdot \frac{P}{{{P_0}}},$ |
式中:F为单位时间每头母牦牛某一温室气体的质量变化(g/(头·h));L为研究样地采样时的单位时间内呼出的气体体积(L);M为某一温室气体的摩尔质量(g·mol-1);C为某一温室气体的浓度(ppm);P为采样时的大气压(Pa);t为采样时的温度(℃);V0、T0和P0分别为标准状态下的绝对体积(22.4 L·mol-1)、绝对温度(273.16 K)和标准大气压(101 325 Pa)。
排放通量计算公式如下
排放通量(g/(头·d)=[排放速率(6:00 am)+排放速率(5:30 pm)]·12 h。
1.4 其他样品的采集与分析9月上旬,在放牧地随机选取3个50 cm×50 cm的样方,进行物种调查,并齐地面刈割后105 ℃杀青,风干至恒重,将其用植物样品粉碎机粉碎,过1 mm筛,用于各项营养指标的测定,测定方法详见文献[21],不同牧草及混合样方的营养成分含量见表 1。于8月14日晨时采用颈静脉穿刺法采集试验牛血液各20 mL,利用全自动血清分析仪测定不同年龄试验组母牦牛的血液生化指标。
|
|
表 1 不同种牧草的营养成分含量 Table 1 Nutrient contents in different forage species |
试验数据釆用SPSS 21.0的One-way ANOVA进行方差分析和LSD进行各组间均值的多重比较。绘图采用Origin 8.1完成。
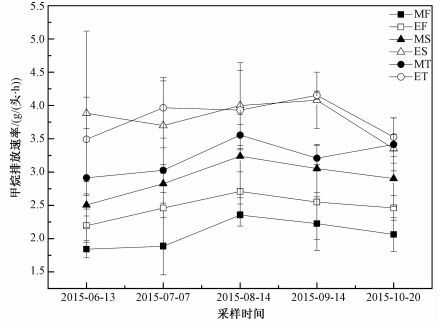
2 结果与分析 2.1 不同年龄自然放牧母牦牛CH4呼吸排放效应3个年龄层次自然放牧母牦牛试验组在高寒草甸生长季(6—10月) CH4呼吸排放速率曲线如图 1所示。研究发现年龄(P<0.01) 和进食(P<0.05) 都对母牦牛CH4呼吸排放速率有显著性影响,但采样时间对其影响不显著(P>0.05)。各时段排放速率在(1.84±0.13) ~(4.15±0.06) g/(头·h)间变化,CH4呼吸排放速率最大值出现在9月份的收牧后5~6岁试验组,最小值出现在6月份放牧前1~2岁试验组。发现1~2岁试验组的CH4呼吸排放速率显著低于其他2个试验组(P<0.01),并且1~2岁(P=0.01)、3~4岁(P<0.01) 和5~6岁(P<0.01) 3个试验组都是收牧后的排放速率要显著高于放牧前的排放速率。
|
Download:
|
|
M:放牧前;E:收牧后;F:1~2岁;S:3~4岁;T:5~6岁。 图 1 高寒草甸生长季不同年龄放牧母牦牛昼夜CH4呼吸排放速率(平均值±标准差) Fig. 1 Respiratory CH4 emission rates of grazing female yaks of different ages in the alpine meadow growing season (Mean±SD) |
|
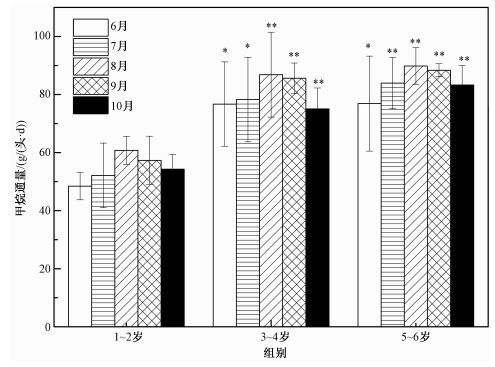
3个试验组的母牦牛在高寒草甸生长季CH4呼吸排放通量特征如图 2所示。从图中我们可以看出,随着年龄的增长,CH4呼吸排放通量分别呈增长趋势,并且1~2岁试验组的CH4呼吸排放通量显著低于3~4岁和5~6岁试验组(P<0.05),而3~4岁与5~6岁试验组的CH4呼吸排放通量无显著差异性(P=0.265)。同时我们还发现3个试验组在高寒草甸生长季的CH4呼吸排放通量分别呈正态分布曲线,CH4呼吸排放通量最大值出现在8月份的5~6岁试验组,最小值出现在6月份的1~2岁试验组。5~6岁试验组平均CH4呼吸排放通量为84.45 g/(头·d),3~4岁试验组为80.48 g/(头·d),1~2岁试验组为54.59 g/(头·d)。其中,1~2岁试验组CH4平均呼吸排放通量显著低于其他2个试验组(P<0.001),而3~4岁试验组和5~6岁试验组之间无显著性差异(P=0.239)。
|
Download:
|
|
相比于1~2岁试验组*:(P<0.05);**:(P<0.01)。 图 2 不同年龄放牧母牦牛在高寒草甸生长季CH4呼吸排放通量(平均值±标准差) Fig. 2 Respiratory CH4 emission fluxes of grazing female yaks of different ages in the alpine meadow growing season (Mean±SD) |
|
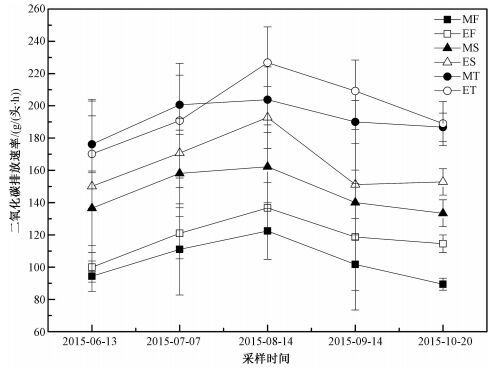
3个试验组母牦牛在高寒草甸生长季CO2呼吸排放速率曲线如图 3所示。研究发现年龄对牦牛CO2呼吸排放速率有显著性影响(P<0.01),但采食前后和采样时间对其没有显著性影响(P>0.05)。各时段排放速率在(89.45±3.72) ~(226.75±22.17) g/(头·h)间变化,CO2呼吸排放速率最大值出现在8月份的收牧后5~6岁试验组,最小值出现在10月份放牧前1~2岁试验组。3个试验组之间的CO2呼吸排放速率具有显著性差异(P<0.001),并且1~2岁试验组收牧后的排放速率要显著高于放牧前的排放速率(P=0.037),而3~4岁(P=0.057) 和5~6岁(P=0.474) 试验组收牧后与放牧前的CO2呼吸排放速率无显著性差异。
|
Download:
|
|
M:放牧前;E:收牧后;F:1~2岁;S:3~4岁;T:5~6岁。 图 3 高寒草甸生长季不同年龄放牧母牦牛昼夜CO2呼吸排放速率(平均值±标准差) Fig. 3 Respiratory CO2 emission rates of grazing female yaks of different ages in the alpine meadow growing season (Mean±SD) |
|
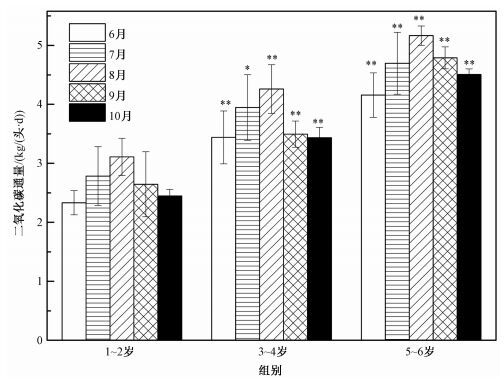
3个试验组母牦牛的CO2呼吸排放通量特征如图 4所示。从图中可以看出,随着年龄的增长,CO2呼吸排放通量也分别呈增长趋势,并且3~4岁和5~6岁试验组显著高于2~3岁试验组(P<0.05),而3~4岁与5~6岁试验组之间的CO2呼吸排放通量也具有显著性差异(P<0.004)。3个试验组在高寒草甸生长季的CO2排放通量分别呈正态分布曲线,CO2呼吸排放通量最大值出现在8月份的5~6岁试验组,最小值出现在6月份的1~2岁试验组。通过计算,1~2岁试验组CO2平均呼吸排放通量为2 663.71 g/(头·d),3~4岁试验组为3 715.17 g/(头·d),5~6岁试验组为4 663.55 g/(头·d)。其中,1~2岁试验组CO2平均呼吸排放通量显著低于其他2个试验组(P<0.001),而3~4岁试验组和5~6岁试验组之间也具有显著性差异(P=0.001)。
|
Download:
|
|
相比于1~2岁试验组*:(P<0.05);**:(P<0.01)。 图 4 不同年龄放牧母牦牛在高寒草甸生长季CO2呼吸排放通量(平均值±标准差) Fig. 4 Respiratory CO2 emission fluxes of grazing female yaks of different ages in the alpine meadow growing season (Mean±SD) |
|
血液是机体重要的内环境,直接参与机体物质代谢、能量代谢和复杂的生化过程,是动物生物学特性的重要指标。通过Spearman相关性分析(表 2)发现,CO2、CH4呼吸排放通量与谷丙转氨酶、总蛋白、球蛋白、尿素氮、钾、氯等含量呈显著正相关,而与钠和高密度脂蛋白胆固醇含量呈显著负相关。CO2和CH4呼吸排放通量之间也存在显著正相关(P<0.001)。
|
|
表 2 不同年龄母牦牛血液生化指标与CO2和CH4呼吸排放通量的Spearman相关性分析 Table 2 Spearman's rank correlation coefficients for correlations between biochemical parameters and flux |
不同年龄阶段的试验组母牦牛的血液生化指标测定结果见表 3。通过单因素方差分析发现谷丙转氨酶、谷草转氨酶、总蛋白、球蛋白、尿素氮、高密度脂蛋白胆固醇含量在1~2岁、3~4岁和5~6岁自然放牧的母牦牛之间具有显著性差异(P<0.05),其中谷丙转氨酶、谷草转氨酶、总蛋白、球蛋白含量在1~2岁试验组显著低于3~4岁和5~6岁试验组,而高密度脂蛋白胆固醇含量显著高于这2个年龄阶段的母牦牛;同时还发现1~2岁、3~4岁母牦牛的尿素氮含量显著低于5~6岁组。但血清中钠、钾、氯的含量在年龄组间差异不显著(P>0.05)。
|
|
表 3 不同年龄阶段的母牦牛血液生化指标(平均值±标准差) Table 3 Biochemical parameters of yaks of different ages (Mean±SD) |
随着畜牧业的发展,畜牧业造成的温室气体排放量占全球总排放量的比例不断增大,畜牧业温室气体主要来自畜禽呼吸代谢、反刍动物瘤胃发酵及畜禽粪便处理过程[22]。反刍动物的瘤胃是一个天然厌氧的生物发酵罐,甲烷是反刍动物瘤胃发酵碳水化合物的必然产物[10, 23]。二氧化碳主要来自动物的呼吸代谢作用,包括自身呼吸、动物胃肠道微生物发酵等[17]。本研究发现1~2岁试验组的CO2和CH4呼吸排放通量都显著低于3~4岁和5~6岁试验组,而3~4岁和5~6岁试验组之间CO2呼吸排放通量具有显著差异性,CH4呼吸排放通量却无显著差异性。许多研究表明反刍动物在从幼年到成年的过程中,CH4呼吸排放通量是逐渐增加的,这与我们的研究结果一致[24-26]。Ulyatt等[27]研究发现1岁的放牧绵羊排放的甲烷(16.8 g·kg-1 DMI)要比成年绵羊减少约20%。Swainson等[28]采用SF6方法分别测定4.5、6.5、9、11.5个月赤鹿的甲烷排放,发现甲烷的排放量也会随着年龄增长而增加。王小林等[29]发现牛犊、青年牛和干奶期奶牛的排放量依次极显著升高,分别为130.64、261.65和340.52 L·d-1,青年牛以CH4形式释放的能量占摄入总能量的比例最多。Grandl等[26]比较成年不同年龄阶段的奶牛的甲烷排放,指出甲烷的净排放量会随着年龄增长而增加。因此我们认为年龄对动物CO2和CH4呼吸排放通量存在着显著的影响,主要原因可能是由于体重因素导致胃容量及采食量的不同、动物摄食行为不同和饲料消化效率的不同。
采食量是影响甲烷排放的最主要因素之一[30]。放牧条件下家畜的牧草采食量并不等同于其自由采食量,放牧条件下家畜的采食量不仅受牧草品质,还受牧草产量和环境应激的影响[31]。在青藏高原草地生物量和盖度从5月份开始逐渐增加,到7、8月达到峰值,同时夏季牧草嫩绿,营养物含量高,牦牛采食量增加。在冬春季节,天然草地上的饲草料缺乏严重限制放牧牦牛的采食量,因此牲畜未走出“夏饱、秋肥、冬瘦、春死亡”恶性循环的困境。在我们的研究中发现CO2和CH4呼吸排放通量在高寒草甸生长季呈正态分布曲线图,峰值出现在8月份;并且3个试验组收牧后(采食一白天)的排放速率均显著高于放牧前(收牧于卧圈一晚无采食)的排放速率。Richmond等[32]发现放牧的肉牛在试验期间(6—8月),采食量随着月份是逐渐增加的,并且甲烷排放量也是增加的。Hegarty等[33]设计试验使奶牛采食量维持低水平,发现甲烷排放量减少,主要原因是在较低采食量条件下,机体为瘤胃内产甲烷菌可提供的底物受限,从而使甲烷产量降低。Blaxter等[34]把采食量水平提高到维持水平的2倍时,总的CH4产量增加,但损失的CH4能占饲料总能的比例却降低12%~30%。赵一广[35]对肉用绵羊甲烷排放的研究也发现甲烷排放量与日粮干物质采食量(DMI)、总能摄入量(GEI)和体重(BW)呈极显著线性正相关关系。以上结果说明,反刍家畜胃肠道甲烷排放量会随着采食量的增加而增加,推测主要原因是采食后,牧草在瘤胃内迅速被消化,瘤胃内的营养物质增多,瘤胃微生物大量繁殖,产甲烷菌可以利用更多的底物大量生成甲烷和二氧化碳。但颜志成等[30]发现虽然泌乳牛在冬季干物质采食量显著高于春季,可春季的甲烷排放量和甲烷转化因子却均显著高于冬季,推测可能是因冬春两季的温度和光照时间等因素引起。孙斌等[36]同样发现奶牛夏季胃肠道甲烷排放量最多,冬季排放量最少,且随着环境温度的降低,瘤胃发酵更趋于丙酸发酵,甲烷产量下降。Kennedy等[37]发现低温可提高日粮在反刍动物瘤胃的流通速率,而使其甲烷产量降低。温度可能影响反刍动物的消化方式和瘤胃发酵类型,从而导致甲烷产量随着环境温度的降低而降低。这一结论进一步证实了我们的研究结果,而CO2是反刍动物瘤胃中合成CH4的主要前体,因此在我们的研究中发现二氧化碳的排放规律与甲烷的排放规律趋于一致。
3.2 不同年龄牦牛血液生化指标与CO2、CH4呼吸排放通量的关系血清中总蛋白、白蛋白、球蛋白和尿素氮的含量是反映饲料蛋白质吸收和代谢的敏感指标,其中白蛋白和球蛋白合称为总蛋白,血清中总蛋白含量升高则显示蛋白质在机体内代谢旺盛,有利于机体吸收和利用蛋白质,尿素氮是蛋白质分子利用的代谢副产物[38]。研究发现血清总蛋白和尿素氮含量随着年龄的增长也逐渐升高,说明随着年龄的增长,动物的机能状态趋于稳定,这与我们的试验结果相一致[39]。同时研究发现血清中总蛋白、球蛋白和尿素氮浓度分别与CO2、CH4排放通量呈显著正相关,也就意味着更多饲料蛋白质被牦牛机体吸收,蛋白质代谢旺盛可能促进甲烷的排放,进一步证明CO2和CH4呼吸排放通量随着年龄的增加而增大。高密度脂蛋白胆固醇(HDL-C)是机体脂肪代谢的重要指标,主要功能是将肝外组织中过多的胆固醇转运到肝脏代谢,以防胆固醇在这些组织中过多地聚集,通过Spearman相关性分析发现CO2、CH4呼吸排放通量与HDL-C浓度呈显著负相关。冯志华等[40]研究发现添加蒺藜皂苷(GSTT)可以显著降低奶牛甲烷排放量,原虫和甲烷菌的数量会随着GSTT添加量的增加均呈线性降低趋势,奶牛血清中HDL-C的浓度随GSTT添加量的增加呈线性提高,这与我们研究结果一致。有关抑制瘤胃甲烷产生的研究表明,通过添加抑制剂,刺激或抑制一些微生物的生长,提高饲料利用率,减少能量损失,进而降低甲烷排放,但血液生化指标也会发生改变[40-41]。通过血液生化指标变化有可能间接地预测反刍动物甲烷排放的大小。
谷丙转氨酶和谷草转氨酶是肝脏机能的重要指征,与畜禽生长发育速度及多方面的生产性能有较强的相关性[42]。研究发现谷丙转氨酶、谷草转氨酶浓度在1~2岁试验组显著低于3~4岁和5~6岁试验组,而HDL-C水平较高,表明1~2岁组的牦牛肝脏功能较好。甘油三酯是动物体内的主要脂类,具有供能、储能、作为结构脂质的基本构件及参与机体物质和能量代谢等重要生理功能[43]。我们发现年龄组间血清中甘油三酯含量差异不显著(P>0.05),说明自然放牧的牦牛对脂肪的利用效率高。钠、钾、氯等是调节酸碱平衡和渗透压的主要离子,具有维持神经肌肉及某些组织器官正常兴奋的作用。钠主要是调节细胞外液的酸碱度,维持血浆和组织间液等细胞外液的渗透液;钾主要参与细胞内糖、蛋白质和能量代谢,具有维持心肌的功能。氯调节细胞外液的渗透压及细胞内酸碱平衡,参与胃液中盐酸的形成。试验结果显示钠、钾、氯浓度在年龄组间差异不显著(P>0.05),与圈华[44]测得的Na (130.2~142.0) mmol·L-1、K (4.16~4.36) mmol·L-1无显著性差异一致,表明牦牛在生长发育阶段血清中的钠、钾、氯在体内代谢水平稳定。年龄是影响生化指标的重要因素。
3.3 不同测定方法下自然放牧状态下牛的CH4排放通量的对比准确测定反刍动物的甲烷排放量,是全球甲烷减排研究与对策制定的前提和基础。对反刍动物甲烷排放量测定的方法有多种,这些方法在准确度和实用性方面各有利弊,如何选择最合适的测定方法,要在实际试验中根据试验环境及研究内容选择相应的手段。与其他区域放牧牛科动物呼吸甲烷排放对比见表 4,本研究选择面罩法测定不同年龄阶段母牦牛的呼吸甲烷排放量,研究发现3~4岁的母牦牛的呼吸甲烷排放量略低于Ding等[45]的研究结果,而一般奶牛的甲烷排放量还要大于公牛的[3],说明在本研究中通过面罩法测定的结果存在着一定的误差,导致了测量值偏小。同时我们还发现母牦牛的甲烷呼吸排放量要远低于其他地区(表 4)。
|
|
表 4 不同方法测定自然放牧牛的呼吸甲烷排放通量 Table 4 Different methods for measuring the respiratory CH4 emission of naturally grazing bovine |
Ding等[45]研究发现与黄牛相比牦牛可以更有效地利用饲料能量,从而减少甲烷的排放。Shao等[46]发现牦牛的舌头比黄牛更适合于采食青藏高原低矮的牧草。Qiu等[5]通过测定牦牛基因组发现其富集了一些营养代谢及适应缺氧的功能基因。牦牛处于高海拔、寒冷、缺氧、高紫外线辐射及饲料极端不平衡的逆境环境中,通过长期的进化适应,可能造成其与其他品种牛的遗传机制不同,瘤胃微生物区系也可能有别于其他品种的牛,导致对饲料利用率的不同。许多研究也表明反刍动物瘤胃甲烷产量会随着环境温度的降低而降低[47-48],青藏高原由于其地理位置的特殊性,全年低温,这也可能是影响牦牛甲烷排放量要小于其他区域放牧牛科动物的原因之一。
4 结论1) 年龄、采食量和环境温度对自然放牧牦牛CO2和CH4呼吸排放通量有影响。
2) 通过血液生化指标变化有可能间接地预测反刍动物甲烷排放的大小,并且年龄是影响生化指标的重要因素之一。
3) 自然放牧牦牛的甲烷排放量要远低于在不同区域放牧的其他牛科动物,可以更有效地利用饲料能量。
| [1] | Rodhe H. A comparison of the contribution of various gases to the greenhouse effect[J]. Science, 1990, 248(4960):1217–1219. DOI:10.1126/science.248.4960.1217 |
| [2] | Beauchemin K A, Kreuzer M, O'Mara F, et al. Nutritional management for enteric methane abatement: a review[J]. Australian Journal of Experimental Agriculture, 2008, 48(2):21–27. DOI:10.1071/EA07199 |
| [3] | 冯仰廉, 李胜利, 赵广永, 等. 牛甲烷排放量的估测[J]. 动物营养学报, 2012, 24(1):1–7. |
| [4] | Johnson K A, Johnson D E. Methane emissions from cattle[J]. Journal of Animal Science, 1995, 73(8):2483–2492. DOI:10.2527/1995.7382483x |
| [5] | Qiu Q, Zhang G, Ma T, et al. The yak genome and adaptation to life at high altitude[J]. Nature Genetics, 2012, 44(8):946–949. DOI:10.1038/ng.2343 |
| [6] | Xue B, Wang L Z, Yan T. Methane emission inventories for enteric fermentation and manure management of yak, buffalo and dairy and beef cattle in China from 1988 to 2009[J]. Agriculture Ecosystems & Environment, 2014, 195:202–210. |
| [7] | 边俊艳. 我国牛的个体特征差异性及其对甲烷排放季节与空间变化影响分析[D]. 武汉: 湖北大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10512-1015500214.htm |
| [8] | 杨博. 青藏高原冬季放牧牦牛甲烷排放的初步研究[D]. 兰州: 甘肃农业大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10733-2009253288.htm |
| [9] | 达珍, 次仁卓玛. 体外法测定青藏高原冬季草场放牧牦牛甲烷排放量[J]. 西藏科技, 2013(11):65–67. DOI:10.3969/j.issn.1004-3403.2013.11.029 |
| [10] | 王成杰, 汪诗平, 周禾. 放牧家畜甲烷气体排放量测定方法研究进展[J]. 草业学报, 2006, 15(1):113–116. |
| [11] | 李恩凯, 杨在宾. 反刍动物甲烷的产生、测定及减排调控的研究[J]. 中国草食动物科学, 2014(5):64–68. |
| [12] | Hu E, Babcock E L, Bialkowski S E, et al. Methods and techniques for measuring gas emissions from agricultural and animal feeding operations[J]. Critical Reviews in Analytical Chemistry, 2014, 44(3):200–219. DOI:10.1080/10408347.2013.843055 |
| [13] | Bhatta R, Enishi O, Kurihara M. Measurement of methane production from ruminants[J]. Asian-Australasian Journal of Animal Sciences, 2007, 20(8):1305–1318. DOI:10.5713/ajas.2007.1305 |
| [14] | Harper L A, Denmead O T, Flesch T K. Micrometeorological techniques for measurement of enteric greenhouse gas emissions[J]. Animal Feed Science and Technology, 2011, 166(7):227–239. |
| [15] | Brouček, J. Methods of methane measurement in ruminants introduction[J]. Slovak Journal of Animal Science, 2014, 47(1):51–60. |
| [16] | Sejian V, Lal R, Lakritz J, et al. Measurement and prediction of enteric methane emission[J]. International Journal of Biometeorology, 2011, 55(1):1–16. DOI:10.1007/s00484-010-0356-7 |
| [17] | 徐田伟, 胡林勇, 葛世栋, 等. 青藏高原高寒牧区冷季补饲藏系绵羊温室气体排放特征[J]. 农业环境科学学报, 2014(10):2071–2076. DOI:10.11654/jaes.2014.10.027 |
| [18] | Wang C, Wang S, Zhou H, et al. Effects of forage composition and growing season on methane emission from sheep in the Inner Mongolia steppe of China[J]. Ecological Research, 2007, 22(1):41–48. DOI:10.1007/s11284-006-0191-9 |
| [19] | Sasaki N, Hobo S, Yoshihara T. Measurement for breath concentration of hydrogen and methane in horses[J]. Journal of Veterinary Medical Science, 1999, 61(9):1059–1062. DOI:10.1292/jvms.61.1059 |
| [20] | Lin S X, Wei C, Zhao G Y, et al. Effects of supplementing rare earth element cerium on rumen fermentation, nutrient digestibility, nitrogen balance and plasma biochemical parameters in beef cattle[J]. Journal of Animal Physiology & Animal Nutrition, 2015, 99(6):1047–1055. |
| [21] | 邹小艳, 罗彩云, 徐世晓, 等. 不同种牧草的产量和品质[J]. 草地学报, 2015, 23(5):1064–1067. DOI:10.11733/j.issn.1007-0435.2015.05.024 |
| [22] | 覃春富, 张佩华, 张继红, 等. 畜牧业温室气体排放机制及其减排研究进展[J]. 中国畜牧兽医, 2011, 38(11):209–214. |
| [23] | Deramus H A, Clement T C, Giampola D D, et al. Methane emissions of beef cattle on forages: efficiency of grazing management systems[J]. Journal of Environmental Quality, 2003, 32(1):269–277. DOI:10.2134/jeq2003.2690 |
| [24] | Molano G, Clark H, Knight T W, et al. Methane emissions from growing beef cattle grazing hill country pasture[J]. Proceedings of the New Zealand Society of Animal Production, 2006, 66:172–175. |
| [25] | Jiao H, Yan T, Wills D A, et al. Development of prediction models for quantification of total methane emission from enteric fermentation of young Holstein cattle at various ages[J]. Agriculture Ecosystems & Environment, 2014, 183(183):160–166. |
| [26] | Grandl F, Amelchanka S L, Furger M, et al. Biological implications of longevity in dairy cows: 2. Changes in methane emissions and efficiency with age[J]. Journal of Dairy Science, 2016, 99(5):3472–3485. DOI:10.3168/jds.2015-10262 |
| [27] | Ulyatt M J, Lassey K R, Shelton I D, et al. Methane emission from sheep grazing four pastures in late summer in New Zealand[J]. New Zealand Journal of Agricultural Research, 2005, 48(4):385–390. DOI:10.1080/00288233.2005.9513671 |
| [28] | Swainson N M, Hoskin S O, Clark H, et al. The effect of age on methane emissions from young, weaned red deer (Cervus elaphus) stags grazing perennial-ryegrass (Lolium perenne)-based pasture[J]. New Zealand Journal of Agricultural Research, 2007, 50(9):407–416. |
| [29] | 王小林. 奶牛不同生理阶段甲烷排放规律研究及热应激对犊牛甲烷排放量的影响[D]. 乌鲁木齐: 新疆农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10758-1013131782.htm |
| [30] | 颜志成, 谢天宇, 王荣, 等. 冬春两季奶牛胃肠道甲烷排放量变化的研究[J]. 湖南农业科学, 2015(2):50–54. |
| [31] | 薛白, 赵新全, 张耀生. 青藏高原天然草场放牧家畜的采食量动态研究[J]. 家畜生态学报, 2004, 25(4):21–25. |
| [32] | Richmond A S, Wylie A R, Laidlaw A S, et al. Methane emissions from beef cattle grazing on semi-natural upland and improved lowland grasslands[J]. Animal, 2014, 9(1):1–8. |
| [33] | Hegarty R S, Goopy J P, Herd R M, et al. Cattle selected for lower residual feed intake have reduced daily methane production[J]. Journal of Animal Science, 2007, 85(6):1479–1486. DOI:10.2527/jas.2006-236 |
| [34] | Blaxter K L, Clapperton J L. Prediction of the amount of methane produced by ruminants[J]. British Journal of Nutrition, 1965, 19(4):511–522. |
| [35] | 赵一广. 肉用绵羊甲烷排放的测定与估测模型的建立[D]. 北京: 中国农业科学院, 2012. |
| [36] | 孙斌, 龚飞飞, 邵伟, 等. 泌乳牛甲烷24小时排放及排放量变化的研究[J]. 中国畜牧兽医文摘, 2013(3):28–31. |
| [37] | Kennedy B P M, Milligan L P. Effects of cold exposure on digestion, microbial synthesis and nitrogen transformation in sheep[J]. Biochemical Journal, 2010, 206(2):287–293. |
| [38] | 于子洋, 王鑫, 林英庭. 大蒜素对动物血清生化指标的影响[J]. 粮食与饲料工业, 2013(9):53–56. |
| [39] | 东北农学院. 兽医临床诊断学[M]. 北京: 农业出版社, 1980. |
| [40] | 冯志华. 蒺藜皂苷对奶牛瘤胃发酵、甲烷产量、抗氧化功能及免疫功能的影响[D]. 保定: 河北农业大学, 2013. |
| [41] | 赵丽萍. 硝酸盐对肉牛瘤胃发酵、微生物多样性、血液生化及抗氧化性能的影响[D]. 北京: 中国农业大学, 2015. |
| [42] | 赵中权, 何晶晶, 李周权, 等. 大足黑山羊生理生化指标测定[J]. 畜牧与兽医, 2011, 43(2):60–62. |
| [43] | 党万花, 李生芳, 赵青山. 含野血牦牛与家牦牛7项生化指标的比较[J]. 黑龙江畜牧兽医, 2014(18):121–122. |
| [44] | 圈华, 李莉. 青藏高原不同生长期牦牛15项指标的测定[J]. 动物医学进展, 2011, 32(8):62–65. |
| [45] | Ding X Z, Long R J, Kreuzer M, et al. Methane emissions from yak (Bos grunniens) steers grazing or kept indoors and fed diets with varying forage:concentrate ratio during the cold season on the Qinghai-Tibetan Plateau[J]. Fuel & Energy Abstracts, 2011, 162(3):91–98. |
| [46] | Shao B, Long R, Ding Y, et al. Morphological adaptations of yak (Bos grunniens) tongue to the foraging environment of the Qinghai-Tibetan Plateau[J]. Journal of Animal Science, 2010, 88(8):2594–2603. DOI:10.2527/jas.2009-2398 |
| [47] | Christopherson R J. Effects of prolonged cold and the outdoor winter environment on apparent digestibility in sheep and cattle[J]. Canadian Veterinary Journal La Revue Veterinaire Canadienne, 1976, 56(2):201–212. |
| [48] | Kennedy P M, Milligan L P. Effects of cold exposure on digestion, microbial synthesis and nitrogen transformations in sheep[J]. British Journal of Nutrition, 1978, 39(1):105–117. DOI:10.1079/BJN19780017 |
| [49] | Pinares-Patiño C S, Franco F E, Molano G, et al. Feed intake and methane emissions from cattle grazing pasture sprayed with canola oil[J]. Livestock Science, 2015, 184:7–12. |
| [50] | Hammond K J, Humphries D J, Crompton L A, et al. Methane emissions from cattle: Estimates from short-term measurements using a GreenFeed system compared with measurements obtained using respiration chambers or sulphur hexafluoride tracer[J]. Animal Feed Science & Technology, 2015, 203:41–52. |
| [51] | Tomkins N W, McGinn S M, Turner D A, et al. Comparison of open-circuit respiration chambers with a micrometeorological method for determining methane emissions from beef cattle grazing a tropical pasture[J]. Animal Feed Science & Technology, 2011, 166(7):240–247. |
| [52] | Mcginn S M, Turner D, Tomkins N, et al. Methane emissions from grazing cattle using point-source dispersion[J]. Journal of Environmental Quality, 2010, 40(1):22–27. |
| [53] | Foley P A, Kenny D A, Callan J J, et al. Effect of DL-malic acid supplementation on feed intake, methane emission, and rumen fermentation in beef cattle[J]. Journal of Animal Science, 2009, 87(3):1048–1057. |
| [54] | Jones F M, Phillips F A, Naylor T, et al. Methane emissions from grazing Angus beef cows selected for divergent residual feed intake[J]. Animal Feed Science & Technology, 2011, 166(7):302–307. |
| [55] | Grainger C, Clarke T, Beauchemin K A, et al. Supplementation with whole cottonseed reduces methane emissions and can profitably increase milk production of dairy cows offered a forage and cereal grain diet[J]. Australian Journal of Experimental Agriculture, 2008, 48(2):73–76. DOI:10.1071/EA07224 |
 2017, Vol. 34
2017, Vol. 34 


