2. 北京市第八中学, 北京 100033
2. Beijing No. 8 Middle School, Beijing 100033, China
氮素是植物生长和进行代谢的必需元素之一,在大多数陆地生态系统中,氮素是亏缺的,是限制植物生长的关键元素[1]。在农田生态系统中,大量的氮肥施用虽然缓解了因氮素亏缺对作物生长的限制,但在实践过程中施肥时间和施肥量经常跟作物的氮需求量脱节,造成氮素无法被作物及时吸收而通过淋溶流失或者经硝化作用和反硝化作用以含氮气体形式释放到大气中,从而降低作物的氮肥利用效率[2]。
生物炭因具有多孔结构而有较大的表面积,呈碱性,并富含养分[3-4],近年来逐渐被证实在改善土壤结构与理化性质、提高作物产量、治理环境污染及增加“农业碳汇”、减少温室气体排放等方面具有重要的作用[3-7]。生物炭施加能增加土壤pH值、改变土壤中的离子交换量及土壤微生物组成与活性,还可以通过释放其携带的养分而影响植物生长[8-9]。许多研究发现生物炭添加能促进、抑制或不改变作物生产力,具体的影响主要取决于生物炭的添加量[3]。进一步研究发现,生物炭添加能够影响植物对氮素的吸收,主要通过以下几个途径:1) 直接吸附土壤中的铵态氮、硝态氮和氨,或者加速氨挥发,改变氮素的可利用性[10-16]; 2) 改变土壤微生物组成和活性[16-18],影响土壤养分的转化过程[19-20]及微生物与植物对氮素的竞争;3) 促进或者抑制植物根系的生长与生理活性及共生菌根[21-25]而影响植物根系的养分吸收。尽管以上研究认为生物炭添加影响了植物的养分吸收与氮素利用效率,但目前鲜有研究评价生物炭添加对作物氮吸收速率的影响。
许多研究认为无机氮——铵态氮(NH4+)和硝态氮(NO3-)是作物的主要氮源,特别是在大量无机氮施加的条件下,但近年来也有研究报道多种作物具有从土壤中直接吸收低分子量有机物质(如自由态的氨基酸)的能力[26]。因此,探究作物对无机氮和有机氮的吸收状况,可为农田生态系统管理提供重要的理论支撑。此外,NO3-和NH4+分属于阴阳离子,前者在土壤溶液中易于移动,而后者则容易被土壤中的阴离子吸附而不易移动;甘氨酸(glycine)为极性氨基酸,较易溶于水[27]。生物炭的多孔结构、高表面积和碱性等特性能改变土壤中的离子交换量,因此生物炭可能会影响以上3种氮素在土壤中的可利用性。为此,本研究提出2个科学假设:1) 因为生物炭能吸附NO3-和NH4+而降低氮素可利用性[14-16],所以随着生物炭添加量的增加,大豆和花生幼苗对NO3-、NH4+和glycine的吸收速率会逐渐降低;2) 因为生物炭的pH呈碱性[3-4],所以生物炭对作物吸收NH4+的影响可能大于对NO3-和glycine的影响。为了验证以上科学假设,本研究选择两种豆科作物——大豆和花生,因为二者是中国重要的油料作物,前者蛋白质含量较高,而后者富含脂肪,这种差异可能导致两种植物对氮素的需求不同,从而在氮素吸收上呈现差异。本研究采用15N同位素示踪技术量化生物炭添加量对大豆和花生幼苗NH4+、NO3-和glycine吸收的影响。
1 材料与方法 1.1 土壤准备为了满足植物的养分需求,本研究选择养分较高的种花土壤和养分较低的农田土壤,按照1:2比例混匀。混合后的土壤有机碳和全氮含量分别为4%和0.3%,pH为7.0。
1.2 土壤分装实验设置4个生物炭添加量处理,分别为0、0.5、2.5和10 mg·g-1土壤。按照各自添加剂量,将生物炭与土壤混匀,然后分别称量300 g土壤分装到花盆内(直径10 cm、高10 cm),共96盆。其中48盆种植大豆,另外48盆种植花生。每组生物炭添加量水平下,再设置3种氮标记处理:15N标记铵态氮、15N标记硝态氮和15N标记甘氨酸,每组处理4个重复。本研究所用生物炭由橡胶枝干在400~500 ℃下焖烧而成[28],施加生物炭前先将其研磨成粉末状。
1.3 播种选取大小一致的大豆或者花生种子,分别播种到相应的花盆中,每盆4粒种子,种子上面覆盖约1 cm厚的土壤。出苗后选择壮苗,每盆保留2株植物。生长期间,通过称重使土壤含水量维持在田间持水量70%,为了保证每株植物的光照和温度基本相同,每隔7 d依次将花盆沿同一个方向随机移动。培养植物30 d后进行15N标记实验。
1.4 15N标记待大豆和花生长至30 d后,分别向不同15N标记处理的盆内一次性均匀浇入50 mL 15N标记的氮素溶液(15NH4+、15NO3-或15N-glycine,15N原子百分含量分别为10.1%、10.1%和10.2%)。为了避免施肥效应,氮素施加量为1 μg·g-1干土。标记4 h后, 采集植物和土壤样品。
1.5 样品采集采用破坏性取样,先将植株从土壤中取出,用蒸馏水冲洗干净,将根系置于0.5 mmol·L-1 CaCl2溶液中浸泡5 min以去除吸附在根系表面的15N,然后再用蒸馏水冲洗干净,置于75 ℃烘至恒重,称量记录生物量。先将烘干的植物剪成小段,然后用球磨仪(Retsch MM 200) 研磨成粉状用于测定植物含氮量和15N/14N比率。同时,收集土壤100 g装入自封袋中,-20 ℃保存,用于测定铵态氮、硝态氮和甘氨酸含量。
1.6 样品测定称取10 g土壤,加入0.05 mol·L-1的K2SO4溶液40 mL,在摇床上震荡浸提1 h,用Whatman 1号滤纸进行过滤,滤液冰冻保存。滤液中的NH4+和NO3-采用连续流动分析仪(SEAL AutoAnalyzer 3, German)进行测定,滤液中的甘氨酸采用高效液相色谱仪(Waters 515, Waters Inc., USA)进行测定[18]。准确称取约2 mg研磨好的植物材料,包入小锡杯中,用稳定性同位素质谱仪(Finnigan MAT 253, Bremen, Germany)测定其含氮量和15N/14N比率[29],该仪器实验室标准样品的重复测定的标准偏差为±0.15%。
1.7 计算与统计分析植物15N吸收速率(μg·g-1·d-1)通过下列公式计算:
| ${\rm{APE }}\left( {\rm{\% }} \right){{\rm{ = }}^{{\rm{15}}}}{\rm{N atom}}{{\rm{\% }}_{{\rm{labeled}}}}{{\rm{ - }}^{{\rm{15}}}}{\rm{N atom}}{{\rm{\% }}_{{\rm{atmosphere}}}}{\rm{,}}$ | (1) |
| $\begin{array}{l} ^{{\rm{15}}}{{\rm{N}}_{{\rm{uptake}}}}{\rm{(\mu g\cdot}}{{\rm{g}}^{{\rm{ - 1}}}}{\rm{\cdot}}{{\rm{d}}^{{\rm{ - 1}}}}{\rm{) = Biomass }}\left( {\rm{g}} \right)\\ \quad {\rm{ \times APE }}\left( {\rm{\% }} \right){\rm{ \times N\% /time }}\left( {\rm{d}} \right){\rm{.}} \end{array}$ | (2) |
式中:APE为15N原子百分含量(%);15N atom%labeled为15N标记植物的15N原子百分含量,15N atom%atmosphere为大气氮的15N原子百分含量;Biomass为植物生物量(g);N%为植物含氮量(%);time是标记时间(d)。
采用Excel 2007和SPSS 23.0(SPSS Inc., Chicago, IL, USA)对获得数据进行计算和统计分析,采用Sigmplot 12.0(Systat Software Inc, San Jose, USA)进行绘图,统计结果在P<0.05水平上存在差异时认为显著。
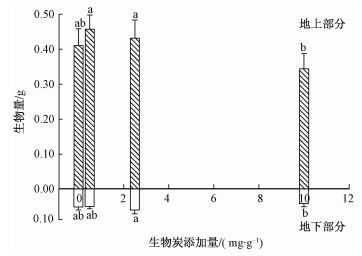
2 结果 2.1 生物炭对大豆和花生幼苗生物量的影响随着生物炭添加量的增加,大豆的地上生物量先增加后下降;当生物炭添加到0.5 mg·g-1时,地上生物量达到最大值,为每盆0.46 g,当生物炭添加到10 mg·g-1时,地上生物量最小,为每盆0.34 g。同对照相比生物炭未显著改变大豆的地上生物量,但在最高剂量和2个较低添加剂量处理之间存在显著性差异。随着生物炭添加量的增加,大豆地下生物量相对稳定,对照和低剂量生物炭添加之间没有显著性差异,但在2个较高添加剂量处理(2.5和10 mg·g-1)之间存在显著性差异。大豆的根冠比很低,在0.13~0.17,生物炭添加未显著影响大豆幼苗根冠比(图 1)。
|
Download:
|
|
图中数值为12个重复的平均值±SE,不同小写字母表征在P<0.05水平上大豆的生物量在不同生物炭添加量之间存在显著性差异。 图 1 生物炭添加对大豆的地上和地下生物量的影响 Fig. 1 Effects of biochar addition on above-and below-ground biomass of Glycine max seedlings |
|
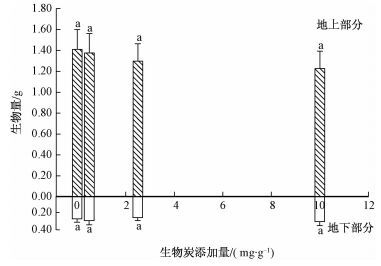
尽管随着生物炭添加量的增加,花生地上生物量呈降低趋势,但并不存在显著性差异,虽然其地下生物量有轻微增加趋势,但也不存在显著性差异。花生的根冠比略高于大豆,在0.19~0.25,最大剂量的生物炭添加显著增加了根冠比(图 2)。
|
Download:
|
|
图中数值为12个重复的平均值±SE,不同小写字母表征在P<0.05水平上花生的生物量在不同生物炭添加量之间存在显著性差异。 图 2 生物炭添加量对花生的地上和地下生物量的影响 Fig. 2 Effects of biochar addition on above-and below-ground biomass of Arachis hypogaea seedlings |
|
对照处理下大豆对15NH4+表现出最高的吸收速率,平均值为4.6 μg·g-1·d-1,随生物炭添加量增加,其吸收速率显著降低至1.5 μg·g-1·d-1,同对照相比吸收速率降低67%;生物炭添加量达到2.5和10 mg·g-1时,对大豆15NH4+吸收速率未产生显著性影响。当生物炭添加量达到2.5 mg·g-1时,生物炭未显著影响大豆对15NO3-的吸收速率,但当生物炭添加达到10 mg·g-1时则显著降低了对15NO3-的吸收速率,同对照相比吸收速率降低了50%。同两种无机氮相比,大豆对15N-glycine的吸收速率最低,对照处理的吸收速率仅为1.6 μg·g-1·d-1,最低剂量添加未影响15N-glycine的吸收速率,当生物炭施加量超过2.5 mg·g-1时显著降低了大豆对15N-glycine的吸收(图 3)。

|
Download:
|
|
图中数值为4个重复的平均值±SE。在不同氮标记处理上的不同小写字母表征在P<0.05水平上大豆的氮吸收速率在生物炭添加量之间存在显著性差异。 图 3 生物炭添加对大豆的15NH4+、15NO3-和15N-glycine吸收速率的影响 Fig. 3 Effects of biochar addition on uptake of 15NH4+, 15NO3-, and 15N-glycine by Glycine max seedlings |
|
同大豆相比,花生对15NH4+的吸收在低添加量条件下未受到显著影响,直到最大添加量时才显著降低了花生对15NH4+的吸收速率,同对照相比降低52%。花生对15NO3-吸收速率先随生物炭添加量增加而增加,在生物炭添加量达到2.5 mg·g-1时达到最大值(2.8 μg·g-1·d-1),而最大量的生物炭添加显著降低花生对15NO3-的吸收速率,同对照相比降低48%。花生对15N-glycine的吸收速率也低于其对无机氮的吸收速率,其趋势类似于花生对15NO3-的吸收速率,也是在生物炭添加量达到2.5 mg·g-1时达到最大值(1.5 μg·g-1·d-1);同对照相比,当生物炭添加量达到最大时,其吸收速率降低38%(图 4)。

|
Download:
|
|
图中数值为4个重复的平均值±SE,在不同氮标记处理上的不同小写字母表征在P<0.05水平上花生的氮吸收速率在生物炭添加量之间存在显著性差异。 图 4 生物炭添加对花生的15NH4+、15NO3-和15N-glycine吸收速率的影响 Fig. 4 Effects of biochar addition on uptake of 15NH4+, 15NO3-, and 15N-glycine by Arachis hypogaea seedlings |
|
大豆对15NH4+、15NO3-和15N-glycine这3种氮形态的总吸收速率随生物炭添加量的增加几乎呈线性递减趋势,而花生在低剂量添加下未显著改变对3种氮形态的总吸收速率,当生物炭添加量为2.5 mg·g-1时达到最大值,但最大剂量添加显著降低了对3种氮形态的总吸收速率。在对照和最低量生物炭添加的处理中,大豆和花生对3种氮形态的总吸收速率存在显著性差异,而在较高添加量下二者对3种氮形态的总吸收速率几乎一致(图 5)。

|
Download:
|
|
图中数值为4个重复的平均值±SE,*表明在P<0.05水平上,在相同生物炭添加量下大豆和花生对总氮吸收速率存在显著性差异。 图 5 生物炭添加对大豆和花生总氮吸收速率的影响 Fig. 5 Effects of biochar addition on total uptake of 15NH4+, 15NO3-, and 15N-glycine by Glycine max and Arachis hypogaea seedlings |
|
很多研究证实生物炭添加能够影响植物生产力,其促进作用通常体现在低剂量的生物炭添加上,而高剂量添加通常有抑制作用[3]。大豆和花生幼苗的生物量对生物炭添加的响应存在明显差异,同对照相比生物炭添加未显著降低大豆生物量,但最大剂量添加和低剂量添加处理之间却存在差异;花生的生物量基本上未受到生物炭添加剂量的影响,这表明植物对生物炭添加的响应存在物种水平上的差异。虽然花生的生物量未受生物炭添加的影响,但最高剂量生物炭添加却显著增加了花生的根冠比,这可能是生物炭添加降低土壤养分浓度,导致花生增加向根系的投入以维持养分的吸收,另一个可能的原因是高剂量生物炭添加对作物生长造成一种胁迫,植物增加向地下部分的分配以维持生长需求。
有研究认为生物炭能够影响植物对养分的吸收[13, 30-31],如有研究借助于15N示踪技术发现生物炭添加促进水稻对肥料氮素的吸收[32]。本研究借助于15N示踪技术,证实生物炭添加的确影响植物对氮素的吸收,但这种影响是复杂的,主要体现在以下2个方面:1) 物种水平上的差异。就本研究而言,大豆的氮素吸收对生物炭添加比较敏感,即使0.5 mg·g-1的添加量就能抑制其对氮素的吸收;而花生对生物炭添加并不敏感,当添加量超过2.5 mg·g-1时才抑制其对氮素的吸收(图 5),部分证实了本研究的第一个科学假设。这也部分解释了生物炭添加对大豆和花生生物量影响的差异。这种差异很可能是因为大豆的植物含氮量(5.6%)较高,因而在生长过程中对氮素有较高的需求,生物炭的添加影响氮素的可利用性而降低其氮素吸收速率;但花生的植物组织的含氮量(3.8%)较低,其在生长过程中对氮素的需求较低,因此生物炭对其氮素吸收速率的影响较弱。另一方面,高剂量生物炭添加可能同时抑制大豆根系的生长与生理活性(如吸收能力),而未影响花生根系的生长却显著抑制花生根系的生理活性,但这还需要进一步研究予以验证。2) 氮形式上的差异。在未添加生物炭的处理中,两种作物均对15NH4+表现出最高的吸收速率,其次是15NO3-和15N-glycine。考虑到在土壤溶液中NO3-和可溶性有机氮比NH4+容易移动[27],作物对不同形态氮素吸收差异可能会导致较多NO3-经淋溶流失,增加环境污染的风险,并降低氮素利用效率[33]。较低剂量的生物炭添加对大豆铵态氮吸收的抑制作用比对硝态氮和甘氨酸的抑制更为强烈(图 3),但并未体现在花生上,这部分证实了本研究的第2个科学假设。这种氮形态上的差异很大程度上归因于它们的离子属性,NH4+作为阳离子更易为生物炭所吸附[27],尽管被生物炭吸附的NH4+依然是生物可利用的[34];另一方面生物炭具有碱性,它的添加可能会引起部分铵态氮以氨气的形式挥发。而甘氨酸作为极性分子,具有疏水性而不易被生物炭所吸附,因此生物炭添加对其影响不大。而大豆和花生所表现出来的差异可能与两个根系分泌物成分不一致有关,从而导致二者对生物炭添加的响应差异。然而,无论大豆还是花生,当生物炭添加量超过2.5 mg·g-1时,两种作物的氮吸收速率均显著降低。以上结果表明,向土壤添加生物炭来调节作物的生长时,必须考虑物种差异和作物对不同氮形态的吸收情况,选择合适的生物炭的施加量,这样才能较好地提高氮素利用效率、维持作物产量和土壤质量。
基于以上分析,本研究证实生物炭添加未显著降低大豆幼苗的生物量,但最大添加剂量和低添加剂量处理之间存在显著性差异;生物炭添加对花生幼苗的生物量未产生明显的影响,却显著增加其根冠比;生物炭对植物氮素吸收的影响在低剂量添加下依赖于物种对生物炭的敏感程度及氮素的形态,但当添加量超过2.5 mg·g-1时,生物炭对植物氮素吸收的影响只取决于生物炭的剂量。基于以上生物炭对氮素吸收速率的影响,我们建议田间种植大豆和花生可以考虑低剂量的生物炭添加以改善土壤和作物产量,其添加量应小于2.0 mg·g-1,但考虑到本研究所种植的大豆和花生尚处幼苗期与花芽分化期的过渡期,未来需加强田间的原位和多个生长发育期的研究。除此之外,未来研究还需要量化生物炭在较长时间尺度上如何通过改变植物根系活性、土壤微生物活性、土壤NO3-、NH4+和glycine的可利用性等来评价生物炭对作物的氮吸收的影响[35]。
| [1] | Vitousek P M, Howarth R W. Nitrogen limitation on land and in the sea: how can it occur?[J]. Biogeochemistry, 1991, 5:7–34. |
| [2] | 张福锁, 巨晓棠. 对我国持续农业发展中氮肥管理与环境问题的几点认识[J]. 土壤学报, 2002, 39(1):41–55. |
| [3] | Sohi S P, Krull E, Lopez-Capel E, et al. A review of biochar and its use and function in soil[J]. Advances in Agronomy, 2010, 105:47–82. DOI:10.1016/S0065-2113(10)05002-9 |
| [4] | Xu G, Lü Y, Sun J, et al. Recent advances in biochar applications in agricultural soils: benefits and environmental implications[J]. Clean-Soil, Air, Water, 2012, 40(10):1093–1098. DOI:10.1002/clen.201100738 |
| [5] | 袁金华, 徐仁扣. 生物质炭的性质及其对土壤环境功能影响的研究进展[J]. 生态环境学报, 2011, 20(4):779–785. |
| [6] | 郭大勇, 范明生, 张福锁. 农田土壤黑炭应用研究进展[J]. 植物营养与肥料学报, 2012, 18(5):1252–1261. |
| [7] | 卜晓莉, 薛建辉. 生物炭对土壤生境及植物生长影响的研究进展[J]. 生态环境学报, 2014, 23(3):535–540. |
| [8] | Chintala R, Schumacher T E, McDonald L M, et al. Phosphorus sorption and availability from biochars and soil/biochar mixtures[J]. Clean-Soil, Air, Water, 2014, 42(5):626–634. DOI:10.1002/clen.v42.5 |
| [9] | 武玉, 徐刚, 吕迎春, 等. 生物炭对土壤理化性质影响的研究进展[J]. 地球科学进展, 2014, 29(1):68–79. DOI:10.11867/j.issn.1001-8166.2014.01-0068 |
| [10] | 李文娟. 生物炭对不同质地土壤NO3--N和NH4+-N运移规律的影响[D]. 陕西杨凌: 西北农林科技大学, 2013. |
| [11] | Zheng H, Wa ng, Z, Deng X, et al. Impacts of adding biochar on nitrogen retention and bioavailability in agricultural soil[J]. Geoderma, 2013, 206:32–39. DOI:10.1016/j.geoderma.2013.04.018 |
| [12] | Spokas K A, Novak J M, Venterea R T. Biochar's role as an alternative N-fertilizer: ammonia capture[J]. Plant and Soil, 2012, 350(1/2):35–42. |
| [13] | Chen C R, Phillips I R, Condron L M, et al. Impacts of greenwaste biochar on ammonia volatilisation from bauxite processing residue sand[J]. Plant and Soil, 2013, 367(1/2):301–312. |
| [14] | Clough T J, Condron L M, Kammann C, et al. A review of biochar and soil nitrogen dynamics[J]. Agronomy, 2013, 3(2):275–293. DOI:10.3390/agronomy3020275 |
| [15] | Yao Y, Gao B, Zhang M, et al. Effect of biochar amendment on sorption and leaching of nitrate, ammonium, and phosphate in a sandy soil[J]. Chemosphere, 2012, 89(11):1467–1471. DOI:10.1016/j.chemosphere.2012.06.002 |
| [16] | Biederman L A, Harpole W S. Biochar and its effects on plant productivity and nutrient cycling: a meta-analysis[J]. GCB Bioenergy, 2013, 5(2):202–214. DOI:10.1111/gcbb.12037 |
| [17] | Anderson C R, Condron L M, Clough T J, et al. Biochar induced soil microbial community change: implications for biogeochemical cycling of carbon, nitrogen and phosphorus[J]. Pedobiologia, 2011, 54(5):309–320. |
| [18] | Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota: a review[J]. Soil Biology and Biochemistry, 2011, 43(9):1812–1836. DOI:10.1016/j.soilbio.2011.04.022 |
| [19] | DeLuca T H, Gundale M J, MacKenzie M D, et al. Biochar effects on soil nutrient transformations [M]//Biochar for environmental management: science. Technology and Implementation. New York: Taylor and Francis Group, 2015: 421-454. |
| [20] | Clough T J, Condron L M. Biochar and the nitrogen cycle: introduction[J]. Journal of Environmental Quality, 2010, 39(4):1218–1223. DOI:10.2134/jeq2010.0204 |
| [21] | Solaiman Z M, Blackwell P, Abbott L K, et al. Direct and residual effect of biochar application on mycorrhizal root colonisation, growth and nutrition of wheat[J]. Soil Research, 2010, 48(7):546–554. DOI:10.1071/SR10002 |
| [22] | Warnock D D, Lehmann J, Kuyper T W, et al. Mycorrhizal responses to biochar in soil: concepts and mechanisms[J]. Plant and Soil, 2007, 300(1/2):9–20. |
| [23] | Bruun E W, Petersen C T, Hansen E, et al. Biochar amendment to coarse sandy subsoil improves root growth and increases water retention[J]. Soil Use and Management, 2014, 30(1):109–118. DOI:10.1111/sum.2014.30.issue-1 |
| [24] | Robertson S J, Rutherford P M, Lopez-Gutierrez J C, et al. Biochar enhances seedling growth and alters root symbioses and properties of subboreal forest soils[J]. Canadian Journal of Soil Science, 2012, 92(2):329–340. DOI:10.4141/cjss2011-066 |
| [25] | 苏倩, 侯振安, 赵靓, 等. 生物碳对土壤磷素和棉花养分吸收的影响[J]. 植物营养与肥料学报, 2014, 20(3):642–650. DOI:10.11674/zwyf.2014.0316 |
| [26] | 徐兴良, 白洁冰, 欧阳华. 植物吸收土壤有机氮的研究进展[J]. 自然资源学报, 2011, 26(4):715–724. DOI:10.11849/zrzyxb.2011.04.017 |
| [27] | Owen A G, Jones D L. Competition for amino acids between wheat roots and rhizosphere microorganisms and the role of amino acids in plant N acquisition[J]. Soil Biology & Biochemistry, 2001, 33(4):651–657. |
| [28] | 徐凡珍. 生物炭对土壤理化性质及橡胶幼苗生长的影响[D]. 云南勐腊: 中国科学院西双版纳热带植物园, 2014. |
| [29] | Xu X L, Ouyang H, Cao G M, et al. Dominant plant species shift their nitrogen uptake patterns in response to nutrient enrichment caused by a fungal fairy in an alpine meadow[J]. Plant and Soil, 2011, 341(1/2):495–504. |
| [30] | Biederman L A, Harpole W S. Biochar and its effects on plant productivity and nutrient cycling: a meta-analysis[J]. GCB Bioenergy, 2013, 5(2):202–214. DOI:10.1111/gcbb.12037 |
| [31] | Kammann C I, Schmidt H P, Messerschmidt N, et al. Plant growth improvement mediated by nitrate capture in co-composted biochar[J]. Scientific Reports, 2015, 5:11080. DOI:10.1038/srep11080 |
| [32] | Huang M, Yang L, Qin H, et al. Fertilizer nitrogen uptake by rice increased by biochar application[J]. Biology and Fertility of Soils, 2014, 50(6):997–1000. DOI:10.1007/s00374-014-0908-9 |
| [33] | Britto D T, Kronzucker H J. Ecological significance and complexity of N-source preference in plants[J]. Annals of Botany, 2013, 112(6):957–963. DOI:10.1093/aob/mct157 |
| [34] | Taghizadeh-Toosi A, Clough T J, Sherlock R R, et al. Biochar adsorbed ammonia is bioavailable[J]. Plant and Soil, 2012, 350(1/2):57–69. |
| [35] | Clough T J, Condron L M, Kammann C, et al. A review of biochar and soil nitrogen dynamics[J]. Agronomy, 2013, 3(2):275–293. DOI:10.3390/agronomy3020275 |
 2017, Vol. 34
2017, Vol. 34 


