2. 中国林业科学研究院湿地研究所湿地生态功能与恢复北京市 重点实验室, 北京 100091;
3. 四川若尔盖高寒湿地生态系统定位观测研究站, 四川 阿坝藏族自治州 624500
2. Beijing Key Laboratory of Wetland Services and Restoration, Institute of Wetland Research, Chinese Academy of Forestry, Beijing 100091, China;
3. Sichuan Zoige Wetland Ecosystem Research Station, Tibetan Autonomous Prefecture of Aba 624500, Sichuan, China
极端气候事件是指在特定时间和区域内,单一或多个异常气候变量引起的生态系统功能高于或低于界定的极端百分比的事件[1]。自工业革命以来,人类活动的加剧显著改变了全球大气循环格局,导致极端气候事件频发[2]。其中,极端干旱事件因其作用强度大、影响范围广、可预测性低,已经成为影响全球生态系统安全的主要生态因子[3-4]。越来越多的证据表明,极端干旱事件可能会打破生态系统原有的碳收支平衡[5-6],引起生态系统结构和功能的改变[7-9],而这种改变又会加剧极端气候事件发生的强度和频率。因此,区域上很小的极端气候事件也可能会引起全球气候格局的变化[1]。
湿地是地球上陆地和水生生态系统相互作用而形成的独特生态环境,而泥炭地是一种类型特殊的湿地生态系统,虽然其总面积很小,但其碳储量却占全球陆地生态系统碳总储量的12%~20%,是所有森林含碳量的2倍,在全球碳循环和碳收支中扮演着重要的角色[2, 10-12]。泥炭地生态系统由于长期或者短期处于淹水状况下,相对低温和厌氧环境抑制了凋落物的分解,使有机物在土壤中不断积累,形成一层部分降解的有机质层(即泥炭层),因而成为抑制大气二氧化碳浓度升高的碳汇[12-13]。然而,泥炭地生态系统尤其是退化泥炭地非常容易受到气候变化的强烈影响。已有的研究结果表明,泥炭地生态系统碳收支很大程度上受气象因子(温度、降水、光照等)、植物生理变化和土壤微生物变化的影响[14-17],而极端干旱事件能够显著地改变温度和水文条件,影响植物生理状态和土壤微生物活动,进而影响生态系统总初级生产力(gross primary productivity, GPP)和生态系统呼吸(ecosystem respiration, Re),改变生态系统的碳收支[18-19]。同时,近年来由于人类活动的影响和极端干旱事件的加剧,加速了高原泥炭地土壤干化,导致泥炭地面积大幅度萎缩,原来封存在土壤中的碳以CO2的形式排放到大气中[20-21],生态系统碳收支的季节和日变化特征也必然会发生改变,但这种变化的定量化研究还没有深入开展。因此,定量研究极端干旱对泥炭地生态系统碳收支的影响,对我们了解区域乃至全球尺度上的碳收支变化规律,保护湿地生态资源,制定减缓温室效应措施都有极大的助益和现实意义[4]。
目前,国内外围绕泥炭地碳源汇的研究虽然已有不少科研成果,但是在国内关于采用野外原位极端控制实验定量研究极端干旱事件对泥炭地生态系统碳交换特征影响的研究还鲜有报道。因此,本研究通过野外控制试验模拟极端干旱事件,研究极端干旱气候条件下若尔盖高原泥炭地生态系统碳通量的变化特征,揭示高原泥炭地生态系统碳收支的主要调控因子及相应机制,有助于定量了解未来极端气候事件频率增加情景下该生态系统的碳收支状况,为区域碳收支测算及全球碳循环模型的进一步完善提供理论和数据支持,为准确评价高寒泥炭地对全球变化的贡献提供重要的科学依据。
1 材料与方法 1.1 观测区域概述研究样地(33.799 06°N, 102.957 90°E)位于若尔盖湿地自然保护区,行政上隶属于四川省阿坝州若尔盖县,海拔为3 430 m。若尔盖湿地位于青藏高原的东部边缘, 地跨四川、甘肃两省, 海拔3 400~3 900 m, 总面积约16 000 km2,是中国第一大高原沼泽湿地,也是世界上面积最大、保存最完好的高原泥炭沼泽,其泥炭积累丰富,泥炭分布面积达5 000多hm2,泥炭最深处厚达38 m, 泥炭总储量达70亿m3。若尔盖湿地年平均气温0.7 ℃,最热月(7月)平均气温10.7 ℃,最冷月(1月)平均气温-10.7 ℃,气温年较差为21.4 ℃,历年极端最高温24.6 ℃,极端最低温-33.7 ℃;年均降水量650~750 mm,主要集中在4~9月,相对湿度78%。若尔盖湿地是中国最大的高原沼泽植被集中分布区,类型多为低位草本沼泽植被,主要优势物种有乌拉苔草(Carex meyeriana),木里苔草(Carex muliensis),细秆羊胡子草(Eriophorum gracile),华扁穗草(Blysmus sinocompressus)、肥状苔草(Carex secbrirostris)、藏嵩草(Kobresia tibetica)等[22]。
1.2 观测方法与技术 1.2.1 样地设计与观测方法根据当地50年的降雨统计数据,在植物生长盛期模拟极端干旱事件,定义日降雨量≥3 mm为生态有效降雨[23],设置无生态有效降雨持续期为32 d (其中无生态有效降雨天数即为干旱天数[6])。试验样地面积20 m×20 m,试验设极端干旱处理(D)和对照处理(CK)2组小区,每个小区面积为2 m×2 m,在极端干旱处理和对照处理每个小区周围深度约1 m的土壤中埋入铁皮板,防止土壤水分的横向流动。采样点(50 cm×50 cm)位于试验小区的中央,极端干旱处理小区采用镁铝合金遮雨棚(长×宽×高:2.5 m×2.5 m×1.8 m)模拟极端干旱,遮雨棚材料透光率>90%,在每个处理小区采样点位置安置不锈钢底座(50 cm×50 cm×20 cm),并将底座插入地下10 cm,底座上有凹槽,将凹槽在每次测量气体前注满水,进行水封,保证测量密闭性;对照处理小区不设置遮雨棚,在野外自然条件下进行气体监测。对照处理和极端干旱处理互为2组对照试验,每组设3个重复数小区,并且重复测量3次求平均值。
通量观测采用静态箱法,利用激光光谱快速温室气体分析仪(DLT-100, Los Gatos Research, USA)监测CO2通量,数据采集频率为1 Hz。测量过程中使用TZS-5X温度计同步监测样点空气温度(Ta)、土壤温度(Ts),使用TDR300土壤水分仪测定土壤含水量(soil water content, SWC)。实验处理时间为2014年7月15日至2014年8月17日,选择晴天9点至13点进行测量。用自制的透明箱体式气室(50 cm×50 cm×50 cm)与激光光谱快速温室气体分析仪相连接。箱子顶部中央有2个直径2 cm的小圆孔,内置橡胶塞,通过20 m长的进气管连通到温室气体分析仪,气体完成分析后经过另一根20 m长的通气管返回到静态箱中。箱内顶部设有直径10 cm的2个小风扇,以保持箱内气体快速混合均匀。每个采样点使用透明箱持续封闭测量2 min,记录透明箱测量数据,对2 min内的测量数据进行计算,求得净生态系统二氧化碳交换(net ecosystem CO2 exchange, NEE);然后开放箱室进行气体交换2 min,再进行暗箱测量2 min,记录暗箱测量数据,对2 min内的测量数据进行计算,求得Re。土壤取样采用土钻多点取样混合的方法,土壤有机质采用重铬酸钾容量法测定,全氮采用凯氏定氮法测定。
1.2.2 数据处理与分析温室气体通量(CFLUX)[24]的计算公式:
| $\begin{array}{l} {F_c} = \frac{{\partial C\prime }}{{\partial t}} \times M/{V_0} \times P/{P_0} \times {T_0}/({T_0} + t) \times \\ \quad \quad \quad \quad H/100 \times 3{\rm{ }}600, \end{array}$ | (1) |
其中:Fc为气体通量(mg/(m2·h));对测得的数据进行线性回归分析,求解∂C′/∂t(气体在观测时间内浓度随时间变化的直线斜率[25]);M为气体摩尔质量(g/mol);V0为气体的标准摩尔体积22.4 L/mol;P/P0是测量大气压比标准大气压;T0为绝对温度273.15 ℃;t为箱内实测温度的平均值(℃);H为静态箱高度(cm)。
通过式(1) 计算得到NEE (正值代表碳源,负值代表碳汇)、Re,再根据式(2) 计算GPP
| ${\rm{GPP}} = {R_{\rm{e}}} - {\rm{NEE}}.$ | (2) |
本研究利用SAS 9.1统计软件的Shapiro-Wilk (W检验)检验正态性,若数据不符合正态分布则进行数据的平方根转换,使用GLM过程对各处理效应进行重复测量方差分析,自变量是不同处理效应,因变量是由不同处理引起的2组测量数据的不同。并利用Origin 8.5软件对各组数据作图。
2 结果 2.1 实验期间气候条件极端干旱控制实验期间(32 d)若尔盖共发生20次降水事件,日降水量范围为0.2~33.2 mm,其中生态有效降水事件(≥ 3 mm)天数为9 d (图 1)。试验期间降水量共计131.5 mm,即对照处理小区降水量为131.5 mm,而极端干旱处理小区降水量为0 mm。实验期间日均最高温度16.1 ℃,日均最低温度6.3 ℃,实验期间总平均温度12.4 ℃。

|
Download:
|
|
图 1 2014年实验期间样地的日降水量和温度动态 Fig. 1 Dynamics of daily precipitation and temperature at sample plots during the experiment period in 2014 |
|
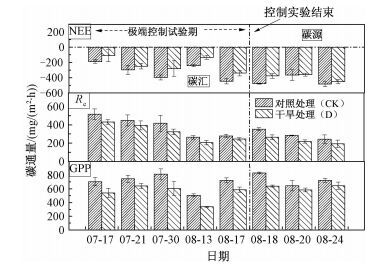
图 2显示研究样点控制实验期间极端干旱处理和对照处理情景下CO2通量的变化。结果表明,极端干旱显著降低了若尔盖泥炭地的GPP (P<0.01) 和Re(P<0.05),分别降低23.57%、18.91%,且极端干旱对GPP的影响明显大于对Re的影响,降低了生态系统的净NEE通量(P<0.05),从而使若尔盖泥炭地的固碳能力下降20.37%。
|
Download:
|
|
图 2 2014极端干旱对CO2通量(NEE、Re和GPP)的影响 Fig. 2 Effects of extreme drought on CO2 fluxes (NEE, Re, and GPP) in 2014 |
|
分析观测期间CO2通量的季节动态,湿地生态系统的GPP和NEE在8月18日左右达到最大值,生态系统固碳能力最强;生态系统的NEE在7月17日最小,8月18日达到最大值;相反地,生态系统呼吸在7月17日最大,8月18日达到最小值。在极端干旱处理和对照处理情景下,生态系统都表现出碳汇的功能。
如图 2所示,极端控制实验结束后,两种处理情景下生态系统的NEE逐渐趋向一致,而GPP和Re受极端干旱的持续影响仍表现出显著降低的现象,但降低的百分比趋向一致。根据若尔盖地区气象数据,8月18日、21日和22日共出现3次生态有效降水,一定程度上缓解了极端干旱处理小区的干旱胁迫,部分恢复了植物及土壤微生物的生态功能。
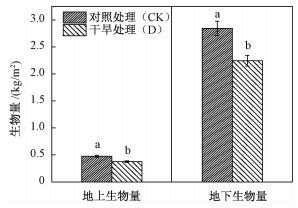
2.3 极端干旱对生物量、土壤水分和土壤碳氮的影响极端干旱显著降低了若尔盖泥炭地的地上和地下生物量(P<0.05)。其中,对照处理和极端干旱处理的地上生物量分别为473.65和374.08 g/m2;对照处理和极端干旱处理的地下生物量分别为2 845.92和2 243.46 g/m2(图 3)。
|
Download:
|
|
图 3 极端干旱对地上和地下生物量的影响 Fig. 3 Impacts of extreme drought on aboveground and belowground biomass |
|
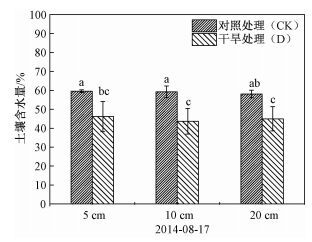
如图 4、表 1所示,在极端干旱控制实验结束期,分析对照处理和极端干旱处理的土壤含水量,结果表明:极端干旱显著降低了若尔盖泥炭地5、10和20 cm深度的土壤含水量(P<0.05)。其中,对照处理下5、10和20 cm深度的土壤含水量基本相同,分别为59.53%、59.24%和58.07%;极端干旱处理下5、10和20 cm深度的土壤含水量也基本相同,分别为46.13%、43.61%和44.94%。
|
Download:
|
|
图 4 对照处理和干旱处理下5、10和20 cm深度的土壤含水量 Fig. 4 Soil water contents at depths of 5, 10, and 20 cm in extreme drought treatment and control treatment |
|
|
|
表 1 土壤含水量、土壤全氮、土壤全碳和土壤有机碳含量的二因素方差分析 Table 1 Two-factor analysis of variance (ANOVA) of soil water content and soil total nitrogen, total carbon, and organic carbon contents |
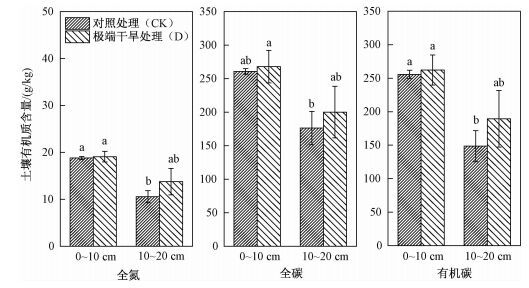
在0~10 cm和10~20 cm土壤深度中,极端干旱处理和对照处理的土壤全氮、全碳和有机碳含量无显著差异(P>0.05),在10~20 cm土壤深度中,极端干旱处理中的土壤全氮、全碳和有机碳含量略高于对照处理(如图 5、表 1),但差异不显著。对土壤全氮、土壤全碳和土壤有机碳进行二因素方差分析,土壤全氮、土壤全碳和土壤有机碳在两处理条件下并无显著差异,但在不同土壤深度条件下显著不同,干旱处理与土壤深度对试验结果无交互影响。
|
Download:
|
|
图 5 极端干旱对不同土壤层全氮、全碳和有机碳含量的影响 Fig. 5 Impacts of extreme drought on soil total nitrogen, total carbon, and organic carbon contents |
|
如图 6所示,对照处理和极端干旱处理下NEE与空气温度(Ta)的相关系数(r)分别为0.54(P<0.05) 和0.51(P<0.05),CK和D处理中NEE与Ta显著正相关。CK和D处理下拟合直线分别为:y=16.56x-782.55(R2=0.29,P<0.05),y=12.01x-606.27(R2=0.26,P<0.05),对两条拟合回归直线进行显著性检验,两条直线显著不同(P<0.05)。可知随着空气温度的上升,两处理下NEE也随之增加,比较两条拟合直线的斜率(K)大小,KCK>KD,极端干旱使Ta的变化对NEE的影响减弱,使NEE对Ta的敏感性降低。

|
Download:
|
|
图 6 不同处理下NEE、Re与空气温度的相关性 Fig. 6 Relationships of NEE and Re with air temperature in different treatments |
|
CK和D处理下Re与Ta的相关系数分别为0.75(P<0.01) 和0.89(P<0.01),Re与Ta显著正相关,CK和D处理下拟合直线分别为:y=17.57x-60.76(R2=0.47,P<0.05),y=15.45x-51.42(R2=0.68,P<0.01),两条直线显著不同(P<0.05)。随Ta的上升,两处理下Re也随之增加,KCK>KD,极端干旱使Ta的变化对Re的影响减弱,使Re对Ta的敏感性降低。总初级生产力计算公式为:GPP=Re-NEE,两处理下GPP与Ta显著相关,GPP随Ta的上升而增加,极端干旱使GPP对Ta的敏感性降低。
2.4.2 NEE、Re、GPP与土壤温度的关系对照处理和极端干旱处理下NEE与5 cm土壤温度(Ts)的相关系数分别为0.71(P<0.01) 和0.57(P<0.05),即CK和D处理下NEE与5 cm土壤温度显著正相关(图 7)。对照处理下拟合直线模型:y=20.87x-719.21(R2=0.50, P<0.01),极端干旱处理下拟合直线模型:y=18.56x-597.83(R2=0.31, P<0.05)。在两种气候情景下,NEE随5 cm土壤温度的上升而增加,对比两条拟合直线的斜率(K),KCK>KD,极端干旱使得5 cm土壤温度升高对NEE的影响减弱,即NEE对5 cm土壤温度的敏感性降低。如图 7所示,CK和D处理下Re与5 cm土壤温度显著正相关(P<0.01,P<0.05), CK拟合直线模型与D拟合直线模型显著不同(P<0.05),两种气候情景下Re随着5 cm土壤温度的上升而增加,KCK<KD,极端干旱使得5 cm土壤温度升高对Re的影响增强,即Re对5 cm深度的土壤温度敏感性增强。CK和D气候情景下总初级生产力(GPP)与5 cm土壤温度有显著正相关关系,随着5 cm土壤温度的上升,GPP也随之增加。
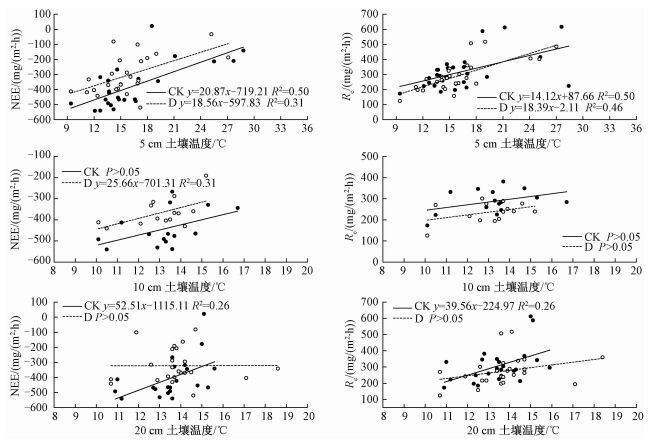
|
Download:
|
|
图 7 不同处理中NEE、Re与不同深度土壤温度的相关性 Fig. 7 Relationships of NEE and Re with soil temperatures at different depths in different treatments |
|
如图 7所示,对照处理下NEE、Re和GPP与10 cm深度的土壤温度没有显著相关性(P>0.05),极端干旱处理下NEE与10 cm土壤温度显著正相关(P<0.05),其拟合直线:y=25.66x-701.31(R2=0.31, P<0.05)。CK处理下NEE、Re与20 cm土壤温度显著正相关(P<0.05),NEE与20 cm土壤温度拟合直线:y=52.51x-1 115.11(R2=0.26, P<0.05)。Re与20 cm土壤温度的拟合直线:y=39.56x-224.97(R2=0.26, P<0.05)。由GPP=Re-NEE可知,CK处理中GPP与20 cm深度的土壤温度显著正相关。
2.4.3 NEE、Re、GPP与土壤含水量的关系如表 2所示,5 cm深度土壤含水量(SWC)与生态系统NEE、Re、GPP有显著相关性(P<0.05);10 cm深度土壤含水量与生态系统NEE、Re、GPP有显著相关性(P<0.05);20 cm深度土壤含水量与生态系统NEE、Re、GPP有显著相关性(P<0.05)。
|
|
表 2 NEE、Re、GPP与不同深度土壤含水量的相关性 Table 2 Relationships of NEE, Re, and GPP with soil water contents at different depths |
极端干旱气候事件会引起生态系统结构和功能发生改变,主要表现为系统状态的持续改变和系统恢复过程延长[26]。前人关于极端干旱的研究主要集中在干旱半干旱草原,研究发现极端干旱气候事件会显著降低草原生态系统生产力,降低生态系统的碳固持和碳排放[27-28],而对极端干旱影响泥炭地生态系统的研究还很少。本研究通过控制降水模拟极端干旱,发现极端干旱事件显著降低了若尔盖高原泥炭地生态系统的GPP和Re,且极端干旱对GPP的影响明显大于对Re的影响,从而显著降低了生态系统的碳汇功能,这与Shi等[29]和Kang等[30]的研究结果相同,相比于Re,GPP对极端干旱事件更为敏感。Shi等[29]研究认为,降水量是影响GPP对极端干旱敏感性的关键因子,并且土壤呼吸受温度的影响显著,土壤呼吸的敏感性受土壤干燥度和土壤碳含量影响,随着极端干旱的持续,逐渐下降的土壤碳库导致了土壤呼吸的进一步减少。Kang等[30]利用内蒙古典型草原2年的通量塔观测数据发现,与2004年(湿润年)相比,2005年的极端干旱显著降低了典型草原的GPP和Re,且GPP下降的幅度要明显大于Re下降的幅度,这说明典型草原总初级生产力在干旱年份要比生态系统呼吸对水分胁迫更加敏感,干旱能够显著改变植物叶面积的季节模式并且能够改变植物的生理机能,从而影响生态系统的碳吸收能力,甚至引起生态系统由碳汇向碳源变化[31-32]。Zhang等[33]在加拿大半干旱草原以及Hunt等[34]在新西兰丛生草原得到的结果也都发现干旱会显著影响草原的碳收支动态,改变草原生态系统的碳源/汇功能。水分不足极大地限制了草原生态系统的固碳能力,而降水(包括降雪和降雨)则是影响半干旱草原水分条件最重要的控制因子[35-37]。
大量研究表明,空气温度不仅能够直接影响湿地生态系统CO2的排放,而且能够通过对土壤温度、土壤水分的调控,间接地影响CO2的排放[38-39]。生态系统碳交换与温度的相关性会因土壤含水量(SWC)的不同而有所差异[40],且温度和降水量的协同作用是湿地生态系统CO2通量变化的主控因子[19]。在本研究中,若尔盖泥炭地生态系统的NEE、Re和GPP与空气温度和土壤温度有显著的正相关关系,这与徐世晓等[41]的研究结果一致。在两种气候情景下,若尔盖泥炭地5 cm深度的土壤温度与NEE、Re和GPP的相关性较好,10 cm、20 cm深度的土壤温度与NEE、Re和GPP无显著相关关系。这可能是因为土壤温度主要受空气温度和光照强度的影响,表层土壤最先响应空气温度和光照强度的变化,进而影响植物和土壤微生物的活动[42],因此表层5 cm深度的土壤温度与NEE、Re和GPP的相关性最高。
碳循环是泥炭地生态系统中重要的生态学过程,与水分有效性密切相关[43]。土壤含水量是表征土壤对植物根系以及土壤微生物供水能力的指标,土壤含水量过低,植物生理活动受阻,导致植被光合能力以及呼吸强度下降[44]。本研究发现,5、10、20 cm深度土壤含水量与生态系统NEE、Re、GPP有显著相关性。而近年的研究表明,增加降水量会使泥炭地的碳储量增加,而土壤含水量降低会使碳储量减少[18]。极端干旱显著改变生态系统的土壤状态,使土壤含水量显著降低,地上植物光合、呼吸过程中的相关酶活性以及地下微生物各类酶反应过程受水分胁迫的影响都会受到抑制[45]。因此,干旱时期土壤含水量是控制生态系统碳交换的主要驱动因子,而植物光合效率降低的程度取决于土壤中植物可利用的水分含量,以及造成的植被生理反应及结构变化[44]。植被对干旱的生理反应包括酶活性的降低以及植物气孔关闭,这种干旱条件下的水分胁迫会引起植株叶气孔导度的降低[46-48],进而使植物的光合速率和蒸腾速率降低。此外,在极端干旱条件下,生态系统中的微生物数量和活性会急剧减少[6],最终导致生态系统的NEE、Re和GPP降低。
本实验比较了两种不同气候情景下0~10 cm和10~20 cm深度的土壤中全氮、全碳和有机碳的含量,极端干旱处理和对照处理下土壤全氮、全碳和有机碳含量无显著差异,而在10~20 cm土壤深度中,极端干旱处理中的土壤全氮、全碳和有机碳含量略高于对照处理,产生这种不显著差异的原因可能是干旱减弱了生态系统中植物根系的生理活动和代谢过程,抑制植物对土壤中元素的吸收[49]和植物根系的生长,并且与土壤碳、氮有效性密切相关的微生物活动对土壤水分的变化也非常敏感[50],在极端干旱条件下,土壤中微生物数量减少,活性变弱,土壤碳、氮的矿化率明显降低[51],并且这种不显著差异也可能与研究地区植被根系在土壤中的分布有关[52],还需要做更深入的研究。
4 结论1) 极端干旱显著降低若尔盖高原泥炭地生态系统的NEE、Re和GPP,导致生态系统固碳能力减弱,温度和土壤含水量是若尔盖高原泥炭地碳收支变化的主要驱动因子。
2) 极端干旱对GPP的影响明显大于对Re的影响,相比于Re,GPP对极端干旱事件更为敏感。
3) 对照处理和极端干旱处理下,生态系统NEE、Re、GPP与空气温度有显著正相关关系,而极端干旱减弱了若尔盖湿地生态系统NEE、Re和GPP对空气温度变化的敏感性。
4) 表层土壤温度与NEE、Re、GPP的相关性高于深层土壤温度与NEE、Re、GPP的相关性,极端干旱减弱NEE对5 cm土壤温度变化的敏感性,增强Re对5 cm土壤温度的敏感性。
| [1] | Reichstein M, Bahn M, Ciais P, et al. Climate extremes and the carbon cycle[J]. Nature, 2013, 500(7462):287–295. DOI:10.1038/nature12350 |
| [2] | IP CC. Climate change 2007: the physical science basis[M]. New York: Cambridge University Press, 2007. |
| [3] | Jiang Z, Song J, Li L, et al. Extreme climate events in China: IPCC-AR4 model evaluation and projection[J]. Climatic Change, 2012, 110(1/2):385–401. |
| [4] | Smith M D. The ecological role of climate extremes: current understanding and future prospects[J]. Journal of Ecology, 2011, 99(3):651–655. DOI:10.1111/jec.2011.99.issue-3 |
| [5] | Mitsch W J, Bernal B, Nahlik A M, et al. Wetlands, carbon, and climate change[J]. Landscape Ecology, 2012, 28(4):583–597. |
| [6] | Jentsch A, Kreyling J, Elmer M, et al. Climate extremes initiate ecosystem-regulating functions while maintaining productivity[J]. Journal of Ecology, 2011, 99(3):689–702. DOI:10.1111/jec.2011.99.issue-3 |
| [7] | Smith M D, Knapp A K, Collins S L. A framework for assessing ecosystem dynamics in response to chronic resource alterations induced by global change[J]. Ecology, 2009, 90(12):3279–3289. DOI:10.1890/08-1815.1 |
| [8] | Tian H, Hall C, Qi Y. Modeling primary productivity of the terrestrial biosphere in changing environments: toward a dynamic biosphere model[J]. Critical Reviews in Plant Sciences, 1998, 17(5):541–557. DOI:10.1016/S0735-2689(98)00364-5 |
| [9] | Rajan N, Maas S J, Cui S. Extreme drought effects on carbon dynamics of a semiarid pasture[J]. Agronomy Journal, 2013, 105(6):1749. DOI:10.2134/agronj2013.0112 |
| [10] | Huntingford C, Lowe J A, Booth B B B, et al. Contributions of carbon cycle uncertainty to future climate projection spread[J]. Tellus Series B-Chemical and Physical Meteorology, 2009, 61(2):355–360. DOI:10.1111/teb.2009.61.issue-2 |
| [11] | Frolking S, Roulet N T, Moore T R, et al. Modeling northern peatland decomposition and peat accumulation[J]. Ecosystems, 2001, 4(5):479–498. DOI:10.1007/s10021-001-0105-1 |
| [12] | Inubushi K, Furukawa Y, Hadi A, et al. Seasonal changes of CO2, CH4 and N2O fluxes in relation to land-use change in tropical peatlands located in coastal area of South Kalimantan[J]. Chemosphere, 2003, 52(3):603–608. DOI:10.1016/S0045-6535(03)00242-X |
| [13] | Bridgham S D, Moore T R, Richardson C J, et al. (2013)[J]. Landscape Ecology, 2014, 29(9):1481–1485. DOI:10.1007/s10980-014-0067-2 |
| [14] | Hao Y B, Cui X Y, Wang Y F, et al. Predominance of precipitation and temperature controls on ecosystem CO2 exchange in Zoige alpine wetlands of Southwest China[J]. Wetlands, 2011, 31(2):413–422. DOI:10.1007/s13157-011-0151-1 |
| [15] | Zhou L, Zhou G S, Jia Q Y. Annual cycle of CO2 exchange over a reed (Phragmites australis) wetland in Northeast China[J]. Aquatic Botany, 2009, 91(2):91–98. DOI:10.1016/j.aquabot.2009.03.002 |
| [16] | Polsenaere P, Lamaud E, Lafon V, et al. Spatial and temporal CO2 exchanges measured by eddy covariance over a temperate intertidal flat and their relationships to net ecosystem production[J]. Biogeosciences, 2012, 9(1):249–268. DOI:10.5194/bg-9-249-2012 |
| [17] | Wassmann R, Aulakh M S. The role of rice plants in regulating mechanisms of methane missions[J]. Biology and Fertility of Soils, 2000, 31(1):20–29. DOI:10.1007/s003740050619 |
| [18] | Pitchford J L, Wu C, Lin L, et al. Climate change effects on hydrology and ecology of wetlands in the mid-Atlantic highlands[J]. Wetlands, 2011, 32(1):21–33. |
| [19] | 王德宣. 若尔盖高原泥炭沼泽二氧化碳、甲烷和氧化亚氮排放通量研究[J]. 湿地科学, 2010, 8(3):220–224. |
| [20] | 张晓云, 吕宪国, 顾海军. 若尔盖湿地面临的威胁、保护现状及对策分析[J]. 湿地科学, 2005, 3(4):292–297. |
| [21] | 刘红玉. 中国湿地资源特征、现状与生态安全[J]. 资源科学, 2005, 27(3):54–60. |
| [22] | 李珂, 杨永兴, 杨杨, 等. 放牧胁迫下若尔盖高原沼泽退化特征及其影响因子[J]. 生态学报, 2011, 31(20):5956–5969. |
| [23] | Hao Y B, Kang X M, Cui X Y, et al. Verification of a threshold concept of ecologically effective precipitation pulse: from plant individuals to ecosystem[J]. Ecological Informatics, 2012, 12(11):23–30. |
| [24] | 孙晓新, 牟长城, 石兰英, 等. 小兴安岭森林沼泽甲烷排放及其影响因子[J]. 植物生态学报, 2009, 33(3):535–545. |
| [25] | Mastepanov M, Sigsgaard C, Dlugokencky E J, et al. Large tundra methane burst during onset of freezing[J]. Nature, 2008, 456(7222):628–658. DOI:10.1038/nature07464 |
| [26] | Mueller R C, Scudder C M, Porter M E, et al. Differential tree mortality in response to severe drought: evidence for long-term vegetation shifts[J]. Journal of Ecology, 2005, 93(6):1085–1093. DOI:10.1111/j.1365-2745.2005.01042.x |
| [27] | Ciais P, Reichstein M, Viovy N, et al. Europe-wide reduction in primary productivity caused by the heat and drought in 2003[J]. Nature, 2005, 437(7058):529–533. DOI:10.1038/nature03972 |
| [28] | Schwalm C R, Williams C A, Schaefer K, et al. Assimilation exceeds respiration sensitivity to drought: a FluxNet synthesis[J]. Global Change Biology, 2010, 16(2):657–670. DOI:10.1111/gcb.2010.16.issue-2 |
| [29] | Shi Z, Thomey M L, Mowll W, et al. Differential effects of extreme drought on production and respiration: synthesis and modeling analysis[J]. Biogeosciences, 2014, 11(3):621–633. DOI:10.5194/bg-11-621-2014 |
| [30] | Kang X, Hao Y, Li C, et al. Modeling impacts of climate change on carbon dynamics in a steppe ecosystem in Inner Mongolia, China[J]. Journal of Soils and Sediments, 2011, 11(4):562–576. DOI:10.1007/s11368-011-0339-2 |
| [31] | Miranda A C, Miranda H S, Lloyd J, et al. Fluxes of carbon, water and energy over Brazilian cerrado: an analysis using eddy covariance and stable isotopes[J]. Plant Cell and Environment, 1997, 20(3):315–328. DOI:10.1046/j.1365-3040.1997.d01-80.x |
| [32] | Welker J M, Brown K B, Fahnestock J T. CO2 flux in Arctic and alpine dry tundra: comparative field responses under ambient and experimentally warmed conditions[J]. Arctic Antarctic and Alpine Research, 1999, 31(3):272–277. DOI:10.2307/1552257 |
| [33] | Zhang Y, Grant R F, Flanagan L B, et al. Modelling CO2 and energy exchanges in a northern semiarid grassland using the carbon-and nitrogen-coupled Canadian Land Surface Scheme (C-CLASS)[J]. Ecological Modelling, 2005, 181(4):591–614. DOI:10.1016/j.ecolmodel.2004.07.007 |
| [34] | Hunt J E, Kelliher F M, McSeveny T M, et al. Evaporation and carbon dioxide exchange between the atmosphere and a tussock grassland during a summer drought[J]. Agricultural and Forest Meteorology, 2002, 111(1):65–82. DOI:10.1016/S0168-1923(02)00006-0 |
| [35] | Parton W J, Scurlock J M O, Ojima D S, et al. Impact of climate-change on grassland production and soil carbon worldwide[J]. Global Change Biology, 1995, 1(1):13–22. DOI:10.1111/gcb.1995.1.issue-1 |
| [36] | Schimel D S, Kittel T G F, Parton W J. Terrestrial biogeochemical cycles: global interactions with the atmosphere and hydrology[J]. Tellus Series A-Dynamic Meteorology and Oceanography, 1991, 43(4):188–203. DOI:10.3402/tellusa.v43i4.11948 |
| [37] | Schimel D S, Parton W J, Kittel T G F, et al. Grassland biogeochemistry: links to atmospheric processes[J]. Climatic Change, 1990, 17(1):13–25. DOI:10.1007/BF00148998 |
| [38] | 王东启, 陈振楼, 王军, 等. 夏季长江口潮间带CH4、CO2和N2O通量特征[J]. 地球化学, 2007, 36(1):78–88. |
| [39] | Ding W, Cai Z, Tsuruta H, et al. Key factors affecting spatial variation of methane emissions from freshwater marshes[J]. Chemosphere, 2003, 51(3):167–173. DOI:10.1016/S0045-6535(02)00804-4 |
| [40] | 刘乙, 胡海波, 刘准桥. 北亚热带次生栎林生态系统非生长季CO2通量特征[J]. 东北林业大学学报, 2013, 41(7):22–27. |
| [41] | 徐世晓, 赵亮, 李英年, 等. 温度对青藏高原高寒灌丛CO2通量日变化的影响[J]. 冰川冻土, 2007, 29(5):717–721. |
| [42] | 宋长春, 王毅勇. 湿地生态系统土壤温度对气温的响应特征及对CO2排放的影响[J]. 应用生态学报, 2006, 17(4):4625–4629. |
| [43] | van Straaten O, Veldkamp E, Köhler M, et al. Spatial and temporal effects of drought on soil CO2 efflux in a cacao agroforestry system in Sulawesi, Indonesia[J]. Biogeosciences, 2010, 7(4):1223–1235. DOI:10.5194/bg-7-1223-2010 |
| [44] | van der Molen M K, Dolman A J, Ciais P, et al. Drought and ecosystem carbon cycling[J]. Agricultural and Forest Meteorology, 2011, 151(7):765–773. DOI:10.1016/j.agrformet.2011.01.018 |
| [45] | Lefi E, Medrano H, Cifre J. Water uptake dynamics, photosynthesis and water use efficiency in field-grown Medicago arborea and Medicago citrina under prolonged Mediterranean drought conditions[J]. Annals of Applied Biology, 2004, 144(3):299–307. DOI:10.1111/aab.2004.144.issue-3 |
| [46] | Lafleur P M, Moore T R, Roulet N T, et al. Ecosystem respiration in a cool temperate bog depends on peat temperature but not water table[J]. Ecosystems, 2005, 8(6):619–629. DOI:10.1007/s10021-003-0131-2 |
| [47] | Updegraff K, Bridgham S D, Pastor J, et al. Response of CO2 and CH4 emissions from peatlands to warming and water table manipulation[J]. Ecological Applications, 2001, 11(2):311–326. |
| [48] | Waddington J M, Rotenberg P A, Warren F J. Peat CO2 production in a natural and cutover peatland: Implications for restoration[J]. Biogeochemistry, 2001, 54(2):115–130. DOI:10.1023/A:1010617207537 |
| [49] | 杨敏生, 裴保华, 朱之悌. 白杨双交杂种无性系抗旱性鉴定指标分析[J]. 林业科学, 2002, 38(6):36–42. DOI:10.11707/j.1001-7488.20020607 |
| [50] | Schimel J, Balser T C, Wallenstein M. Microbial stress-response physiology and its implications for ecosystem function[J]. Ecology, 2007, 88(6):1386–1394. DOI:10.1890/06-0219 |
| [51] | Bloor J M G, Bardgett R D. Stability of above-ground and below-ground processes to extreme drought in model grassland ecosystems: interactions with plant species diversity and soil nitrogen availability[J]. Perspectives in Plant Ecology, Evolution and Systematics, 2012, 14(3):193–204. DOI:10.1016/j.ppees.2011.12.001 |
| [52] | Vance C P, Uhde-Stone C, Allan D L. Phosphorus acquisition and use: critical adaptations by plants for securing a nonrenewable resource[J]. New Phytologist, 2003, 157(3):423–447. DOI:10.1046/j.1469-8137.2003.00695.x |
 2017, Vol. 34
2017, Vol. 34 


