2. 西北农林科技大学资源环境学院, 陕西 杨凌 712100
2. College of Natural Resources and Environment, Northwest A & F University, Yangling 712100, Shaanxi, China
目前,以大气中二氧化碳的浓度增加为主要特征的全球气候变化正显著影响着陆地生态系统碳循环过程。总初级生产力、净初级生产力和呼吸过程是碳循环的3个基本组成部分。总初级生产力(gross primary production, GPP, kg/(m2·a))即在单位时间内,绿色植物利用光合作用将大气中的CO2固定成有机碳的量,净初级生产力(net primary productivity, NPP, kg/(m2·a))即在单位时间内,绿色植物固定的有机碳减去自养呼吸之后剩余的部分[1]。生态系统尺度的碳利用效率(carbon use efficiency, CUE)即净初级生产力和总初级生产力的比率。CUE是生态系统的一个重要功能参数,它能显示出被固定在新组织中的总同化碳的部分,代表陆地生物将碳从大气转移到生物量中的能力,对比较不同生态系统的碳循环之间差异性有重要作用[2],它也是生态系统碳储量的一个关键控制原因[3]。因此,CUE作为一个基本的生态系统模型参数,常常被用于植被模型中的过程模拟[4],对理解和预测全球气候变化以及生态系统的响应发挥着重要的作用。
近些年来,全球已经开展了大量关于陆地生态系统CUE的研究[5-11]。因为所采用的模型、数据以及时空尺度等的不同,研究结果之间存在着一定的差异:一些研究认为陆地生态系统CUE是恒定的,也有研究表明CUE随环境条件的变化而变化。例如,Waring等[12]和Gifford[13]认为在不同温度和CO2浓度条件下,CUE保持恒定。在一些碳循环的模型研究中,在不同的时空条件下CUE也被设置成恒定不变的[14-15]。但是Zhang等[16]基于MRIS数据以及生态系统生产力模型,发现全球CUE在2009—2100年呈现减小的趋势,这是由于在这一时期,NPP降低但GPP保持稳定造成的;随着温度的升高,CUE呈现减小的趋势,而随着降水量的增加,CUE呈现增加的趋势[17]。
中国是全球陆地碳研究的重点区域,探明中国陆地生态系统CUE具有极其重要的意义。中国也有少量这方面的研究,例如Tan等[10]发现西双版纳热带雨林的CUE值为0.34,陈光水等[11]观察到杉木林根系的CUE随着林木年龄的增加而降低。但是总体上对中国各类生态系统CUE的研究还十分不足,仅涉及有限的生态系统类型,尤其是在未来气候变化背景下中国陆地生态系统CUE的变化趋势及其对气候变化的响应还需要进一步探讨。
1 数据来源与研究方法 1.1 数据简介 1.1.1 数据来源世界气候研究计划(World Climate Research Programme, WCRP)组织的第5次耦合模式比较计划(Phase 5 of Coupled Model Intercomparison Project, CMIP5) 为IPCC的第5次评估报告提供数据支持。美国气候模式诊断和对比计划委员会(Program for Climate Model Diagnosis and Intercomparison, PCMDI)收集CMIP5的模拟结果[18]。本研究所使用的数据都来源于PCMDI数据库(https://pcmdi9.llnl.gov/search/cmip5/),从这个数据库中选择12个模型生成的基于不同未来排放情景的逐月总初级生产力,净初级生产力以及相应的温度和降水数据作分析(表 1)。
|
|
表 1 模型简介 Table 1 Descriptions of models |
在IPCC第4次报告之后,很多研究者都在研究新的未来情景模式。RCPs (representative concentration pathways)是在2014年IPCC第5次评估报告中发布的未来情景模式[19],包括RCP2.6、RCP4.5、RCP6.0和RCP8.5共4种排放情景。RCP情景模式更加具有一致性和综合性,它能估计在未来的100年甚至更长的时间里温室气体的浓度,并且能将温室气体浓度换算成增加的辐射强迫(W/m2)。其中RCP4.5和RCP6.0均为中等排放情景,同时由于很多模型并未开展在RCP6.0情景下的模拟研究,为了研究结果的可比较性,本研究选取RCP2.6、RCP4.5和RCP8.5这3种排放情景,分别代表低、中、高3种不同的温室气体排放强度[20](表 2)。
|
|
表 2 RCPs情景模式简介 Table 2 Brief descriptions of RCPs |
基于获取的CMIP5数据库12个模型全球范围2006—2100年的GPP、NPP、降水和温度数据,并提取出中国范围内的相应数据,计算出该时段逐年的GPP、NPP、CUE (NPP/GPP)以及年降雨量(mean annual precipitation, MAP)和年均气温(mean annual temperate, MAT)。同时基于历史时段(1951—2005年)相应模型全球范围的GPP、NPP、降水和温度的月数据,求出中国范围该时段内GPP、NPP、CUE、MAP、MAT的多年平均值,用作距平分析的基准值。
1.2.2 变量时间序列分析为了比较分析不同模型GPP、NPP、CUE、MAT和MAP时间序列上数值变化格局,以1951—2005年的历史多年均值为基准值,计算出每个模型的NPP、GPP和CUE数据与基准值在时间序列上的差值,即距平值,分析比较不同模型数据的距平值,以及不同模型距平值的均值,用以估算距平值在未来时间序列上的变化趋势。
1.2.3 气候变化趋势分析气候随时间变化而变化,气候倾向率是反映气候变化趋势的指标[21],可用一次方程yi=a0+aixi表示,其中a0是截距,ai是气候倾向率,即气候变化因子(如MAT和MAP)随年份变化而变化的趋势。该方法也可以应用于CUE、GPP、NPP等生物指标随时间变化的倾向率分析,研究其对应的变化趋势及其与温度、降水等变量之间的相关关系。
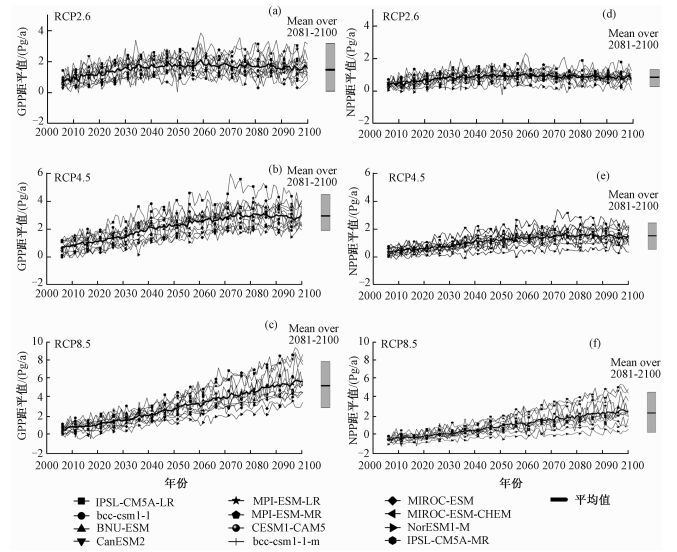
2 结果与分析 2.1 中国陆地生态系统GPP和NPP的时间动态变化由图 1(a)~1(c)可知,12种模型中除MIROC-ESM的模拟结果在RCP2.6情景下表现为不显著的降低趋势外,其余均表现为随时间增加的趋势;在相同情景下,不同模型GPP距平值的平均值在时间序列上呈增加趋势。在2006—2100年间,在RCP2.6、RCP4.5和RCP8.5情景下,GPP距平值的平均值分别处于0.65~2.07、0.71~3.17和0.48~5.81 Pg/a之间。在2081—2100年间,在RCP2.6、RCP4.5和RCP8.5情景下,模型模拟的GPP平均值分别处于0.71~2.75、1.89~4.45和2.91~7.85 Pg/a之间,其总平均值分别为1.63、2.93和5.27 Pg/a。在3种未来情景下,GPP倾向率分别为0.07(Pg/10a, P<0.01)、0.26(Pg/10a, P<0.01) 和0.57(Pg/10a, P<0.01),均达到显著水平(表 3)。可见,GPP不仅随着时间序列的变化逐渐增长,而且随着辐射强迫的增加,GPP变化量增加更加明显。
|
|
表 3 未来情景下CUE、GPP、NPP、MAT与MAP倾向率比较(多模型的平均值) Table 3 Tendency rate of CUE, GPP, NPP, MAT and MAP under future scenarios (average of all models) |
|
Download:
|
|
右侧箱式图代表不同模型从2081—2100年间GPP距平值和NPP距平值多年平均值的范围,其水平线为相应的中值;距平值为模型模拟值与1951—2005年间的历史年均值的差值。 图 1 3种不同情景下GPP和NPP距平值趋势分析 Fig. 1 Trend analysis of GPP anomaly and NPP anomaly under three different scenarios |
|
图 1(d)~1(f)显示,在相同情景下,12种模型NPP距平值均表现为在时间序列上增加的趋势,模型NPP距平值的平均值的变化趋势也表现出一致性规律(表 2)。2006—2100年间,RCP2.6、RCP4.5和RCP8.5情景下,NPP距平值的平均值分别处于0.31~1.06、0.37~1.70和0.27~3.06 Pg/a之间;2081—2100年间,3种RCP情景下模型模拟的平均值分别处于0.26~1.31、0.53~2.44和0.99~4.67 Pg/a之间,其总平均值分别为0.84、1.51和2.76 Pg/a。在未来3种情景中,NPP的倾向率分别为0.03(Pg/10a, P<0.01)、0.12(Pg/10a, P<0.01) 和0.29(Pg/10a, P<0.01),均达到显著水平(表 3)。由此可知,在时间序列上,NPP变化量逐渐增加,而随着辐射强迫的增加,NPP变化量的增加趋势更加明显。
通过对比发现,在相同情景下NPP值总是在GPP值一半上下波动,即CUE (NPP/GPP)的值在0.5上下波动。同时通过研究数据对比发现,在3种情景下,GPP倾向率比NPP的倾向率大,说明随着辐射强迫的增加,NPP增长速率相对于GPP的增长速率低,从而使得CUE在未来气候变化情况下,从整体上会产生略有降低的趋势。
2.2 中国陆地生态系统未来气候变化条件下CUE变化格局从图 2(a)~2(c)可以看出,在相同情景下,不同模型模拟的CUE存在差异,其中BNU-ESM、NorESM1-M和CESM1-CAM5模拟的CUE的值较低,IPSL-CM5A-LR、bcc-csm1-1、CanESM2、MIROC-ESM、MIROC-ESM-CHEM、IPSL-CM5A-MR、MPI-ESM-LR、MPI-ESM-MR和bcc-csm1-1-m的模拟值较高,但不同模型各自CUE值均保持在相对稳定的范围中。

|
Download:
|
|
右侧箱式图代表不同模型从2081—2100年间CUE和CUE距平值多年平均值的范围,其水平线为相应的中值;距平值为模型模拟值与1951—2005年的历史年均值的差值。 图 2 3种不同情景下各模型CUE和CUE距平值的变化趋势分析 Fig. 2 Trend analysis of CUE and CUE anomaly using different models under three different scenarios |
|
从2006年到2100年,在RCP2.6、RCP4.5和RCP8.5情景下,所有模型模拟的CUE分别处于0.332~0.614、0.407~0.611和0.347~0.617之间,其平均值分别处于0.512~0.527、0.514~0.529和0.512~0.530之间。2081—2100年间,在3种RCP情景下,所有模型模拟CUE的平均值分别为0.519、0.518和0.517。不同模型在不同情景条件下模拟的CUE变化范围为0.332~0.617,不同情景下多模型的平均值保持在0.5左右,变化范围比较小。
图 2(d)~2(f)表示不同模型在相同的情景下CUE相对于1951—2005年间多年平均值的距平值随时间的变化,以消除不同模型模拟值差异的影响。2006—2100年间,RCP2.6、RCP4.5和RCP8.5情景下CUE距平值的平均值分别保持在-0.006~0.007、-0.005~0.009和-0.007~0.010之间。2081—2100年之间,3种未来情景下,所有模型距平值的平均值分别为0.000 016、-0.000 69和-0.001 88。可见随辐射强迫的增加,中国陆地生态系统CUE距平值略有降低的趋势,与历史水平相比,未来CUE只有小幅的变化。
12种模型CUE平均值虽然整体上保持在0.5左右,但趋势分析表明CUE在3种情景下表现为在时间序列上的下降趋势。在3种情景下模型平均CUE倾向率分别为-5.00×10-4(1/10a, P<0.01)、-7.00×10-4(1/10a, P<0.01) 和-9.00×10-4(1/10a, P<0.01),均达到显著水平(表 3)。多数模型模拟的CUE在3种情景下表现为随时间下降的趋势,仅有IPSL-CM5A-LR在3种情景下表现为上升趋势;CanESM2在RCP2.6和RCP4.5两种情景下,MPI-ESM-LR和MRI-ESM-MR在RCP4.5和RCP8.5两种情景下,IPSL-CM5A-MR在RCP2.6情景下表现为上升趋势,在其他情景下表现为下降趋势。多模型的平均值可在一定程度上降低由于模型参数、驱动因子和结构等不同造成的模型差异。在不同情景下,多模型的CUE平均值在0.5附近有小幅度的变化,这种小幅度变化主要体现在长时间尺度上表现出的降低趋势,并随着辐射强迫水平的增加,这种降低的趋势有所加强。
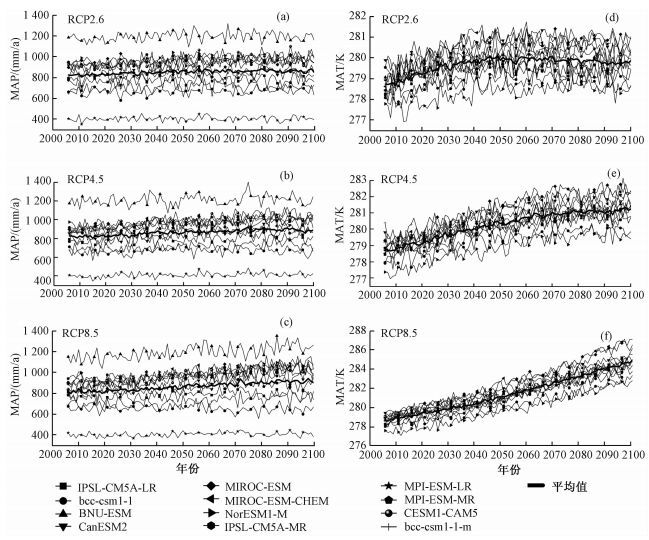
2.3 中国陆地生态系统CUE与其影响因素 2.3.1 关键气候变化因子趋势分析图 3显示MAP和MAT都有增加的趋势,并且随着辐射强迫的增加,MAP和MAT的增加趋势更加明显。在3种不同情景下,MAT的倾向率分别为0.08(P<0.01)、0.26(P<0.01) 和0.65 K/10a (P<0.01),MAP的倾向率分别为4.81(P<0.01)、9.01(P<0.01) 和13.05 mm/10a (P<0.01),均达到显著水平(表 3)。
|
Download:
|
|
图 3 3种不同情景下MAP和MAT趋势分析 Fig. 3 Trend analysis of MAP and MAT under three different scenarios |
|
从图 4可以看出,不同模型模拟的CUE与MAP的相关性大小有较大的不同,但基本呈正相关,即随着MAP的增加,CUE也表现出增加趋势。而CUE与MAT多数呈负相关,少数呈正相关。在呈负相关的模型中,大部分随着辐射强迫的增加,相关性愈加显著,即辐射强迫越大,温度越高,CUE表现出愈加明显的降低趋势。模型IPSL-CM5A-LR与IPSL-CM5A-MR模拟的CUE与MAP的相关性显著,而模拟的CUE与MAT的相关性不明显。bcc-csm1-1、bcc-csm1-1-m、MPI-ESM-LR、MPI-ESM-MR和MIROC-ESM模拟的CUE与MAT的相关性显著,而与MAP的相关性较弱。

|
Download:
|
|
*:在0.05水平上相关性显著; **:在0.01水平上相关性显著。 图 4 3种不同情景下各模型CUE与MAP和MAT的相关性 Fig. 4 Correlations of CUE with MAP and MAT under three different scenarios |
|
CUE是生态系统的一个重要的功能参数,对研究陆地生态系统碳源和碳汇具有非常重要的意义,同时CUE响应气候变化,是环境变化和全球变化研究中必不可少的环节[22]。在未来全球气候变化的背景下,中国陆地生态系统CUE将在0.5水平波动变化,在长时间尺度上表现出略有降低的趋势,并随着辐射强迫水平的增加,降低趋势有所加强。在不同情景下,不同模型所表现出来的CUE变化范围为0.332~0.617,这与Gifford[23]认为的CUE的变化范围为0.40~0.65相近。
CUE是NPP和GPP的比值。在3种气候情景下,NPP和GPP均随时间呈现增长的趋势,而NPP值基本保持在GPP值一半左右,使得CUE相对稳定在一定范围(0.5左右)内。随着辐射强迫的增加,NPP增长相对略低,其与GPP的增长率在RCP4.5和RCP8.5情景下差异显著(P<0.05) (附表),从而使得CUE (NPP/GPP)随辐射强迫的增加呈略微降低的趋势。NPP是GPP减去用于维持生命活动的呼吸作用所剩余部分,所以作为NPP与GPP比值的CUE与影响GPP与呼吸作用的CO2浓度、降水和温度均有相关性。辐射强迫的变化,主要是由于CO2浓度的变化,同时温度、降水格局也会发生变化,进而会影响GPP、呼吸,从而对NPP和CUE产生影响。
CO2浓度的升高可以在短期提高植物的光合速率,从而使得光合产物积累,导致植物的GPP增大,生物量积累。CO2浓度增高也能够引起植物非结构性碳水化合物的积累,从而提高植物的呼吸速率[4]。CO2对植物光合速率的促进作用随着时间的增加会相对降低亦或消失[24],其原因包括Rubisco活性下降,或者随着光合速率的提高和光合产物的积累,反馈抑制光反应的进行,导致光合速率减慢[25]。因此,二氧化碳浓度持续增加的长期效应使得GPP的增长相对呼吸的增长较慢,呼吸与总初级生产力的比值表现出升高的趋势,所以CUE则显示出降低的趋势。由于呼吸所利用的底物是光合产生的,所以呼吸会受到光合的调控,受光合作用制约。呼吸所释放的能量主要用于植物的生长和生物量维持[26],因此在光合作用的底物(CO2)浓度升高时,作为GPP与呼吸差值的NPP与GPP的比值不会发生大的变化,CUE的变化范围相对稳定。
本研究发现在时间序列上CUE与降水量基本呈正相关。在亚马逊雨林进行的大尺度干旱实验的研究中发现,在一定条件下,CUE在降水减少的情况下降低。降水量减少可能影响呼吸速率和光合作用,较之降水量多的区域,呼吸速率升高,而光合速率降低[27]。故而降水量可能与呼吸作用呈负相关,与光合作用呈正相关。降水量增加可能通过增大叶片的气孔导度和胞间二氧化碳浓度等,导致光合作用增强[28],因此,降水增加在一定范围内能够提高光合速率,增加GPP值,同时降低呼吸作用,使得CUE随着降雨的增加而增加。有些在全球尺度上的模型研究发现,在不同的降水强度下,CUE与降水的关系不同,在降雨量足够大的情况下,其他因素则可能成为控制CUE的主要因子[29]。
温度对CUE的影响在不同的模型中有不同的相关性(图 4)。温度与CUE多数呈负相关。呼吸酶的活性随温度升高而提高,故呼吸作用可能随温度升高而增强。前人的研究发现,呼吸速率随着温度呈指数增加,而在一定的温度范围内,光合速率相对稳定[30]。所以,在GPP一定的情况下,随着温度升高呼吸量增高,NPP值会降低,因而NPP/GPP,即CUE降低。也有研究表明,在不同的温度范围内,CUE与温度的相关性不同[29]。
由于温度升高可能会提高生态系统的蒸散量,进而影响植物的水分平衡,产生类似于降水减少的生理效应。因此,温度与降水对植物的光合、呼吸可能存在交互作用,也会共同影响CUE。同时,CUE与植被类型有关[31],与研究区域所处经纬度、海拔高度有关[29]等,由于本研究将中国陆地生态系统作为一个整体进行分析,而同一个栅格中可能存在多个生态系统类型,不同生态系统的CUE会呈现不同甚至相反的变化趋势,因此得到的研究结果的精度较低。下一步应将模型数据做进一步的降尺度处理,提高模型的分辨率,解析中国不同地区、不同生态系统CUE的变化趋势。
4 结论1) 在3种未来情景下,12种模型模拟2006—2100年间中国陆地生态系统的CUE变化范围为0.332~0.617,多模型的平均值保持在0.5左右,其变化幅度较小,并随时间呈现略降低的趋势,随辐射强迫水平的增加(从RCP2.6到RCP4.5再到RCP8.5),降低趋势有所加强。
2) 气温和降水等都会影响CUE。CUE与降水量基本呈正相关,而与温度基本呈负相关。
3) 由于不同模型具有不同的模型参数,驱动因子以及模型结构,所以利用不同模型对陆地生态系统CUE的估算存在一定差异。
附录:|
|
附表 未来情景下不同模型GPP和NPP变化趋势(斜率)差异 Supplementary table Supplementary table Different trends (slope) of GPP and NPP in different models in future scenarios |
[1] Warton D I, Wright I J, Falster D S, et al. Bivariate line-fitting methods for allometry[J].Biological Reviews, 2006, 81(2):259-291.
| [1] | Chapin F S, Matson P A, Mooney H A, et al. Principles of terrestrial ecosystem ecology[M]. New York: Springer-Verlag Inc, 2002. |
| [2] | Ryan M G, Lavigne M B, Gower S T. Annual carbon cost of autotrophic respiration in boreal forest ecosystems in relation to species and climate[J]. Journal of Geophysical Research Atmospheres, 1997, 102(D24):28871–28883. DOI:10.1029/97JD01236 |
| [3] | Allison S D, Wallenstein M D, Bradford M A. Soil-carbon response to warming dependent on microbial physiology[J]. Nature Geoscience, 2010, 3(5):336–340. DOI:10.1038/ngeo846 |
| [4] | Amthor J S. The McCree-de Wit-Penning de Vries-Thornley respiration paradigms: 30 years later[J]. Annals of Botany, 2000, 86(1):1–20. DOI:10.1006/anbo.2000.1175 |
| [5] | Lersel M W V. Carbon use efficiency depends on growth respiration, maintenance respiration, and relative growth rate: a case study with lettuce[J]. Plant Cell and Environment, 2003, 26(9):1441–1449. DOI:10.1046/j.0016-8025.2003.01067.x |
| [6] | Campioli M, Gielen B, Gockede M, et al. Temporal variability of the NPP-GPP ratio at seasonal and interannual time scales in a temperate beech forest[J]. Biogeoscience, 2011, 8(9):2481–2492. DOI:10.5194/bg-8-2481-2011 |
| [7] | Dewar R C, Medlyn B E, Mcmurtrie R E. A mechanistic analysis of lightandcarbon use efficiencies[J]. Plant Cell and Environment, 1998, 21(6):573–588. DOI:10.1046/j.1365-3040.1998.00311.x |
| [8] | Curtis P S, Vogel C S, Gough C M, et al. Respiratory carbon losses and the carbon-use efficiency of a northern hardwood forest, 1999-2003[J]. New Phytologist, 2005, 167(2):437–456. DOI:10.1111/j.1469-8137.2005.01438.x |
| [9] | Kwona Y, Larsen C P S. Effects of forest type and environmental factors on forest carbon use efficiency assessed using MODIS and FIA data across the eastern USA[J]. International Journal of Remote Sensing, 2013, 34(23):8425–8448. DOI:10.1080/01431161.2013.838711 |
| [10] | Tan Z, Zhang Y, Yu G, et al. Carbon balance of a primary tropical seasonal rain forest[J]. Journal of Geophysical Research: Atmosphere, 2010, 115(13):411–454. |
| [11] | 陈光水, 杨玉盛, 高人, 等. 杉木林年龄序列地下碳分配变化[J]. 植物生态学报, 2008, 32(6):1285–1293. |
| [12] | Waring R H, Landsberg J J, Williams M. Net primary production of forests: a constant fraction of gross primary production?[J]. Tree Physiology, 1998, 18(2):129–134. DOI:10.1093/treephys/18.2.129 |
| [13] | Gifford R M. The global carbon cycle: a viewpoint on the missing sink[J]. Australian Journal of Plant Physiology, 1994, 21(1):1–15. DOI:10.1071/PP9940001 |
| [14] | Levy P E, Cannell M G R, Friend A D. Modelling the impact of future changes in climate, CO2 concentration and land use on natural ecosystems and the terrestrial carbon sink[J]. Global Environmental Change, 2004, 14(1):21–30. DOI:10.1016/j.gloenvcha.2003.10.005 |
| [15] | Potter C S, Randerson J T, Field C B, et al. Terrestrial Ecosystem Production: a process model based on global satellite and surface data[J]. Global Biogeo-chemical Cycles, 1993, 7(4):811–841. DOI:10.1029/93GB02725 |
| [16] | Zhang Y J, Yu G R, Yang J, et al. Climate-driven global changes in carbon use efficiency[J]. Global Ecology and Biogeography, 2014, 23(2):144–155. DOI:10.1111/geb.2014.23.issue-2 |
| [17] | 朱万泽. 森林碳利用效率研究进展[J]. 植物生态学报, 2013, 37(11):1043–1058. |
| [18] | 郭彦, 董文杰, 任福民, 等. CMIP5模式对中国年平均气温模拟及其与CMIP3模式的比较[J]. 气候变化研究进展, 2013, 9(3):181–186. |
| [19] | Moss R H, Edmonds J A, Hibbard K A, et al. The next generation of scenarios for climate change research and assessment[J]. Nature, 2010, 463(7282):747–756. DOI:10.1038/nature08823 |
| [20] | 王绍武, 赵宗慈, 罗勇, 等. 新一代温室气体排放情景[J]. 气候变化研究进展, 2012, 8(4):305–307. |
| [21] | 喻彦, 徐建华, 周双喜, 等. 近50年西双版纳最高最低气温对气候变化的响应[J]. 气象科技, 2003, 41(2):334–338. |
| [22] | Delucia E H, Drake J E, Thomas R B, et al. Forest carbon use efficiency: is respiration a constant fraction of gross primaryproduction?[J]. GlobalChange Biology, 2007, 13(6):1157–1167. |
| [23] | Gifford R M. plant respiration in productivity models: conceptualisation, representation and issue for globalterrestrial carbon-cycle research[J]. Functional Plant Biology, 2003, 30(2):171–186. DOI:10.1071/FP02083 |
| [24] | Havelka U D, Ackerson R C, Boyle M G, et al. CO2-enrichment effects on soybean physiology. I. Effects of long-term CO2exposure[J]. Crop Science, 1984, 24(6):1146–1150. DOI:10.2135/cropsci1984.0011183X002400060033x |
| [25] | 张其德, 卢从明, 匡廷云. 大气CO2浓度升高对光合作用的影响[J]. 植物学通报, 1992, 9(4):18–23. |
| [26] | Atkin O K, Tjoelker M G. Thermal acclimation and the dynamic response of plant respiration to temperature[J]. Trends in Plant Science, 2003, 8(7):343–351. DOI:10.1016/S1360-1385(03)00136-5 |
| [27] | Metcalfe D B, Meir P, Aragao L E O C, et al. Shifts in plant respiration and carbon use efficiency at a large-scale drought experiment in the eastern Amazon[J]. New Phytologist, 2010, 187(3):608–621. DOI:10.1111/j.1469-8137.2010.03319.x |
| [28] | 吴建国. 降雨量和温度变化对麻花艽叶片光合作用及相关生理参数的影响[J]. 中国草地学报, 2010, 32(5):73–79. |
| [29] | Zhang Y J, Xu M, Chen H, et al. Global pattern of NPP to GPP ratio derived from MODIS data: effects of ecosystem type, geographical location and climate[J]. Global Ecology and Biogeography, 2009, 18(3):280–290. DOI:10.1111/geb.2009.18.issue-3 |
| [30] | Smith W K, Hinckley T M. Resource physiology of conifers[M]. New York: Academic Press, 1995. |
| [31] | Choudhury B J. Carbon use efficiency, and net primary productivity of terrestrial vegetation[J]. Advances in Space Research, 2000, 26(7):1105–1108. DOI:10.1016/S0273-1177(99)01126-6 |
 2017, Vol. 34
2017, Vol. 34 


