电子转移反应常见于生物大分子如蛋白质、核酸之间,同时对生命活动的正常进行有着关键的影响[1-3]。这些电子转移反应往往发生在两个长程、弱耦合的分子之间,并且容易被分子周围的介质所影响[4-6]。电子转移理论(或称Marcus理论)可以用来解释发生在生物体系内的长程电子转移反应,在理论上计算出电子转移反应速率[7-10]。Winlker等[4-6]成功运用Marcus理论对生物体系的一些长程电子转移反应做了系统的工作。其中,电子转移反应速率与电子给体-受体间的相互作用密切相关,而电子转移耦合矩阵元能够很好地描述这种相互作用的强弱,因此电子转移耦合矩阵元在电子转移理论中有着至关重要的作用[11-13]。
在纳米材料的药用方面,由于目前开发的一些纳米载药系统如石墨烯、氧化石墨烯、碳纳米管等会引起细胞的非正常凋亡,这已经引起了大量的关注。其中一个主要的解释是基于分子动力学的角度来研究生物大分子与纳米载药系统的相互作用[14-15]。我们考虑到蛋白质在很大程度上同样可以与无机纳米材料发生长程电子转移反应,进而影响到蛋白质原有的功能,最后导致细胞的非正常凋亡。
细胞色素c (简称Cyt c)是一种水溶性蛋白,在细胞呼吸链中负责电子的输运。它在细胞能量的产生与消耗、细胞凋亡方面有着非常重要的作用,研究人员已对其从蛋白质折叠、电子转移等角度进行过深入研究[16-18]。氧化石墨烯(简称GO)是一种石墨氧化剥离后的产物,有很好的电子输运性能和水溶性。在生物技术应用中,它已被广泛应用于药物输运、生物传感器等领域[19]。因此,本文主要研究细胞色素c与氧化石墨烯这一电子转移体系的耦合矩阵元问题,在理论上揭示二者之间的相互作用,表明GO对Cyt c的功能产生的可能影响。
1 计算方法在电子转移反应中,电子转移同时伴随着反应物分子的核构型重排。电子转移耦合矩阵元H12在电子转移理论中起着关键性作用[10],如公式(1)所示
| $ {k_{\rm{ET}}} = \frac{1}{h}-H_{12}^2{(\pi /\lambda {k_{\rm{B}}}T)^{1/2}}{\rm{exp}}(-\frac{{{{(\Delta A + \lambda )}^2}}}{{4\lambda {k_{\rm{B}}}T}}), $ | (1) |
其中:kET代表电子转移速率常数;kB代表玻尔兹曼长常数;T代表温度(单位:开尔文K);λ代表重组自由能, 描述核构象重组;ΔA代表驱动力,为热力学性质参数。
H12的强弱来源于反应物分子初态电子波函数与终态电子波函数的耦合强弱程度,反映电子从初态跃迁至终态的概率。同时,它也与反应物分子的构型、残基种类以及介质有关。H12随反应物之间的距离呈指数依赖关系,并且与周围环境密切相关。目前主要的几种用来计算电子转移耦合矩阵元的方法包括广义上的Mulliken-Hush (GMH)方法[20]、两态模型变分法[21]、Koopman理论[22]和路径通道分析法(简称PTM)[11, 23]。PTM通过构造一个电子转移路径通道来计算H12,这一路径通道如同一个“桥”连接了电子给体与电子受体。也就是说在我们的体系中,Cyt c中的Fe原子充当的是电子给体,GO充当的电子受体。这个用来支持电子转移的“桥”可细化为“几段”,每一“段”都会对给体受体间的相互作用产生衰减的影响,并且依赖于共价键(CB)、氢键(HB)或跨空间跳跃(TS),如公式(2)-(4)所示[23]:
| $ {H_{12}} \propto \prod\limits_i {\varepsilon _i^C} \prod\limits_j {\varepsilon _j^H} \prod\limits_k {\varepsilon _k^S}, $ | (2) |
| $ {\varepsilon ^S} = ({\varepsilon ^C}){\rm{exp}}[-{\beta ^S}({R^S}-1.4)], $ | (3) |
| $ {\varepsilon ^H} = {({\varepsilon ^C})^2}{\rm{exp}}[-{\beta ^S}({R^H}-2.8)]. $ | (4) |
其中:共价键对相互作用的衰减影响由衰减因子εC表示,取值为0.6[24];氢键对相互作用的衰减影响由衰减因子εH表示;跨空间跳跃对相互作用的衰减影响由衰减因子εS表示。RS代表跨空间跳跃的距离,单位为Å;RH代表氢键键长,单位为Å;βS代表衰减因子,单位为Å-1。
本文主要运用PTM来计算Cyt c-GO电子转移体系的耦合矩阵元。PTM方法已经成功运用在很多蛋白质体系[6, 25-27],我们假设一个电子从Cyt c的铁原子转移至GO,计算出H12,目前尚未有工作报道出来。为充分比较因Cyt c-GO体系构象的不同而引起H12的不同,我们计算了8个不同的体系,分别是P1, P2, P3, P4, P5, P6, P7和P8。这些不同的构象来自于我们之前的工作[28]。计算工具是VMD的Pathway Analysis Package[23],能够计算出电子给体与受体之间最大的电子转移耦合矩阵元。
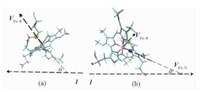
2 结果与讨论首先,为表征这8个不同构型的Cyt c-GO体系,我们定义了两个角度α和φ来说明Cyt c中的残基HEM平面与GO的相对位置,如图 1所示。
|
Download:
|
|
图 1 α (a)和φ (b)的定义 Fig. 1 Definitions of α (a) and φ (b) |
|
其中,Fe原子为棕色球体,S原子为黄色球体,N原子为蓝色球体。其余原子和键为Licorice画图类型。向量VFe-S表示由残基HEM中的Fe原子指向残基MET80中的S原子,它一般与HEM的卟啉环平面垂直;VFe-N表示由残基HEM中的Fe原子指向残基HEM中的N原子,它一般与HEM的卟啉环平面平行;l表示GO所在的平面。因此,α则定义为VFe-S与l形成的夹角,φ为VFe-N与l形成的夹角。α角越接近90°,残基HEM与GO越平行;φ角越接近0°(或180°),残基HEM与GO越平行。α角越接近0°(或180°),残基HEM与GO越垂直;φ角越接近90°,残基HEM与GO越垂直。体系P1-P8的α和φ的计算结果如表 1所示。
|
|
表 1 体系P1-P8的相关计算结果总结 Table 1 Calculation results for systems P1-P8 |
从计算的电子转移耦合矩阵元的大小(表 1)来看,体系P8大于其他7个体系。我们分析了几个可能的原因:
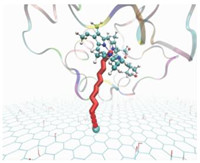
1) 体系P8的构象更有利于电子转移,如图 2所示。
|
Download:
|
|
图 2 P8体系的电子转移路径通道示意图(省去了水分子) Fig. 2 Pathway tunneling model for system P8 (excluding water molecules) |
|
其中红色棱柱通道为PTM构建电子转移路径通道,连续的一段为共价键通道类型(CB),不连续的为跨空间跳跃通道类型(TS)。接受电子的C原子位于GO上,为青色球体。蛋白画图类型为Newribbons, HEM平面画图类型为球棍模型。
2) P8体系的电子转移的路径经过的共价键数量少,通道总长度pathway distance最小,为18.43Å,如表 2所示。
|
|
表 2 P8体系电子转移通道所经过的原子、每两个原子的距离以及路径通道类型 Table 2 Pathway tunneling atoms, atom-to-atom distances, and pathway types for system P8 |
3) 由于衰减因子εS对H12会产生很大的影响,而P8体系的跨空间跳跃距离相对于其他体系较小。此外,我们发现P3体系的电子转移耦合矩阵元并不是最大,因此根据张弛等[28]的工作,可以得出结论,最优吸附构象不一定会导致最大的电子相互作用。同时,通过比较这8个体系的α和φ角与H12的关系,我们发现当同时α角大于100°和φ角小于90°的体系(P1,P3,P8),H12较大,这种情况下的构象更有利于Cyt c-GO体系发生电子转移。这是因为在此构象下,Cyt c中的HEM平面更能有机会与GO平面平行,以取得最佳的电子转移途径。
对于P1,P3,P8这3个体系,为了确定GO是否会对Cyt c参与的与生命活动有关的电子转移反应有影响,我们需要进一步计算出它们的重组自由能以及驱动力以计算出具体的电子转移速率常数,这也是接下来的工作。
3 结论本文采用路径通道分析法(PTM)计算8个不同构象的细胞色素c-氧化石墨烯体系的电子转移耦合矩阵元。计算结果表明,P8体系最有利于细胞色素c与氧化石墨烯产生电子相互作用,进而更可能表现出氧化石墨烯对生物细胞的影响。细胞色素c吸附在氧化石墨烯的最优吸附构象不一定表现出二者之间具有很强的电子相互作用,只有具有特定构象的体系如细胞色素c的HEM平面与GO平面更平行才能表现更强的电子相互作用,进而使得氧化石墨烯对细胞色素c的功能产生影响。
| [1] | Brzezinski P, Larsson G. Redox-driven proton pumping by heme-copper oxidases[J]. Biochimicet Biophysica Acta , 2003, 1605 (1/3) :1–13. |
| [2] | Boon E M, Livingston A L, Chmiel N H, et al. DNA-mediated charge transport for DNA pair[J]. Proc Natl AcadSci USA , 2003, 100 (22) :12543–12547. DOI:10.1073/pnas.2035257100 |
| [3] | Page C. Mechanism for electron transfer within and between proteins[J]. Current Opinion in Chemical Biology , 2003, 7 (5) :551–556. DOI:10.1016/j.cbpa.2003.08.005 |
| [4] | Winkler J R. Long-range electron transfer in Biology[J]. Encyclopedia of Inorganic Chemistry , 2006, 56 (233) :1–11. |
| [5] | Winkler J R, Gray H B. Long-range electron tunneling[J]. Journal of American Chemical Society , 2014, 136 (8) :2930–2939. DOI:10.1021/ja500215j |
| [6] | Gray H B, Winkler J R. Electron transfer in proteins[J]. Annu Rev Biochem , 1996, 65 :537–561. DOI:10.1146/annurev.bi.65.070196.002541 |
| [7] | Marcus R A. On the theory of oxidation-reduction reactions involving electron transfer.1[J]. Journal of Chemical Physics , 1956, 24 (5) :966–978. DOI:10.1063/1.1742723 |
| [8] | Marcus R A. Theory of oxidation-reduction reactions involving electron transfer. 4. A statistical mechanical basis for treating contributions from solvent, ligands, and inert salt[J]. Discussions of the Fraaday Society , 1960, 29 :21–31. DOI:10.1039/DF9602900021 |
| [9] | Marcus R A. On the theory of electron transfer reactions. 6. Unified treatment for homogeneous and electrode reactions[J]. Journal of Chemical Physics , 1965, 43 (2) :679–701. DOI:10.1063/1.1696792 |
| [10] | Marcus R A, Sutin N. Electron transfers in chemistry and biology[J]. Biochimicaer Biophysica Acta , 1985, 811 (3) :265–322. DOI:10.1016/0304-4173(85)90014-X |
| [11] | Beratan D N, Onuchic J N, Betts J N, et al. Electron-tunneling pathways in ruthenated proteins[J]. Journal of American Chemical Society , 1990, 112 :7915–7921. DOI:10.1021/ja00178a011 |
| [12] | Beratan D N, Onuchic J N, Hopfield J J. Electron tunneling through covalent and noncocalent pathways in proteins[J]. Journal of Chemical Phyiscs , 1987, 86 (8) :4488–4498. DOI:10.1063/1.452723 |
| [13] | Walker J R. Electron tunneling pathways in proteins[J]. Curr Opin Chem Biol , 2000, 4 (2) :192–198. DOI:10.1016/S1367-5931(99)00074-5 |
| [14] | Zuo G, Kang S G, Xiu P, et al. Interactions between proteins and carbon-based nanoparticles:exploring the origin of nanotoxicity at the molecularlevel[J]. Small , 2013, 9 (9/10) :1546–1556. |
| [15] | Zuo G, Fang H, Zhou R. Nanotoxicity:Exlporing the interactions between carbon nanotubes and proteins[J]. Carbon Nanotubes-Growth and Applications , 2011, 23 :539–564. |
| [16] | Weinkam P, Zimmermann J, Romsberg F E, et al. The folding energy landscape and free energy excitations of cytochrome[J]. Accounts of Chemical Research , 2010, 43 (5) :652–660. DOI:10.1021/ar9002703 |
| [17] | Diekert K, de Kroon A I, Ahting U, et al. Apocytochrome c requires the TOM complex for translocation across the mitochondrial outer membrane[J]. EMBO Journal , 2001, 20 (20) :5626–5635. DOI:10.1093/emboj/20.20.5626 |
| [18] | Bashir Q, Volkov A N, Ullmann G M, et al. Visualization of the encounter ensemble of the transient electron transfer complex of cytochrome c and cytochrome c peroxidase[J]. Journal of American Chemical Society , 2010, 132 (1) :241–247. DOI:10.1021/ja9064574 |
| [19] | Feng L, Chen Y, Ren J. A graphene functionalized electrochemical aptasensor for selective lable-free detection of cancer cells[J]. Biomaterials , 2011, 32 (11) :2930–2937. DOI:10.1016/j.biomaterials.2011.01.002 |
| [20] | Robert S Mulliken. Molecular compounds and their spectra.Ⅱ[J]. Journal of American Chemical Society , 1952, 74 (3) :811–724. DOI:10.1021/ja01123a067 |
| [21] | Marshall D N. Quantum chemical probes of electron-transfer kinetics:the nature of donor-acceptor interactions[J]. Chem Rev , 1991, 91 (5) :767–792. DOI:10.1021/cr00005a007 |
| [22] | Koopmans T. Vber die zuordnung von wellenfunktionen und eigenwertenzu den einzelnen elektronen eines atoms[J]. Physica , 1934, 1 :104–113. DOI:10.1016/S0031-8914(34)90011-2 |
| [23] | Blabin I A, Hu X, Beratan D N. Exploring biological electron transfer pathway dynamics with the pathways plugin for VMD[J]. Journal of Comput Chem , 2012, 33 (8) :906–910. DOI:10.1002/jcc.22927 |
| [24] | Closs G L, Miller J R. Intramolecular long-distance electron transfer in organic molecules[J]. Science , 1988, 240 (4851) :440–447. DOI:10.1126/science.240.4851.440 |
| [25] | Gray H B, Winkler J R. Electron tunneling through proteins[J]. Quarterly Reviews of Biophysics , 2003, 36 (3) :342–372. |
| [26] | Beratan D N, Miller J R, Onuchic J N. Protein electron transfer rates set by the bridging secondary and tertiarystructure[J]. Science , 1991, 252 (5010) :1285–1288. DOI:10.1126/science.1656523 |
| [27] | Beratan D N, Skourtis S S, Balabin I A, et al. Steering electrons on moving pathways[J]. Acc Chem Res , 2009, 42 (10) :1669–1678. DOI:10.1021/ar900123t |
| [28] | 张弛, 黄须啟, 李晓毅. 细胞色素c与氧化石墨烯的吸附研究[J]. 中国科学院大学学报 , 2016, 33 (1) :70–74. |
 2017, Vol. 34
2017, Vol. 34 


