2. 中国科学院生物物理研究所, 北京 100101
2. Institute of Biophysics, Chinese Academy of Sciences, Beijing 100101, China
随着全球人口老龄化的趋势日益明显和饮食结构的变化,心血管疾病发病率和死亡率呈逐年上升的趋势,已经发展成为威胁生命健康的头号杀手.心肌肥厚,尤其是左心室肥厚是高血压、心瓣膜病、心肌梗死等许多心血管疾病共同的病理过程.持续的心肌肥厚伴随着心肌纤维化增加、心肌细胞凋亡增加、钙离子浓度失衡,最终可导致心力衰竭等多种疾病.因此,预防和治疗心肌肥厚具有十分重要的理论价值和实际意义.
一氧化氮(NO)是体内的一种信号分子,由细胞内L-精氨酸(L-Arg)在一氧化氮合酶(nitric oxide synthase, NOS)作用下产生.NO具有舒张血管、抑制血管平滑肌细胞增殖和血小板聚集等作用,在调节血压和血管稳态方面发挥重要的生理作用[1].L-Arg不足、内源性NOS抑制剂产生增多、NOS酶的辅助因子缺乏和氧化应激都会直接或间接地造成NO的生物利用度的下降,引起血管内皮功能失常,进而引发多种心血管疾病[2].另一方面,在一些病理条件(如心肌缺血再灌注、动脉粥样硬化等)下,NO可以和超氧阴离子(O2·-)反应生成氧化性更强的过氧亚硝基(ONOO-),进而导致蛋白质、核酸及脂质膜发生氧化损伤,引起细胞凋亡[3-4].因此,NO在心血管疾病中发挥着“双刃剑”的作用.
已有研究表明,天然抗氧化剂可以清除缺血再灌注损伤时产生的氧自由基,调节和促进NO自由基产生,保护心肌组织,防止缺血再灌注损伤[4-8].因此我们推测,将天然抗氧化剂和NOS的底物L-Arg进行合理配比,可以达到减少氧化应激,提高NOS酶的活性和NO的生物利用度,保护心血管系统的效果.经过大量试验,我们研制了一种以山楂提取物、知母提取物、虾青素和L-Arg为主要成分的配方ZPF1,发现它能够在多个模型中减少氧化应激,增加NO水平[9],但其是否具有心血管保护作用还不清楚.因此,本文在细胞和动物模型中研究这种NO和天然抗氧化剂组合配方ZPF1对心肌肥厚的保护作用.
1 材料和方法 1.1 实验材料大鼠心肌细胞H9C2购自北京协和细胞资源中心,SPF级8~10周龄雄性C57BL6小鼠购自北京维通利华公司.L-Arg、硝普钠(SNP)、苯肾上腺素(PE)、异丙肾上腺素(ISO)、MTT和DCFH-DA荧光探针购自Sigma公司.SERCA2a和GADPH抗体购自Abcam公司.蛋白酶抑制剂混合物购自Roche公司.山楂提取物、知母提取物和虾青素购自西安清乐生物科技有限公司.将这些天然抗氧化剂和L-Arg按照一定比例混合组成ZPF1,溶于超纯水中,以灌胃的方式喂食动物.其他试剂为国产分析纯,购自北京国药集团.
1.2 实验方法 1.2.1 细胞活力测定取对数生长期的H9C2细胞,以1×104个/孔的密度接种于96孔平底培养板上,在37 ℃,5%CO2中培养24 h,再使用不同浓度的L-Arg、SNP和ZPF1处理24 h,然后每孔加入MTT(终质量浓度为0.5 g/L),继续培养3 h,弃去培养液,每孔加入200 μL DMSO,振荡1.5 min,在酶标板上测定吸光度值(OD值),测定波长492 nm.每组设8个平行孔,空白对照组不接种细胞.细胞活力按下列公式计算:细胞活力(%)=(实验组各孔OD值-空白对照OD值)/(正常对照组OD值-空白对照OD值),对照组细胞活力为100%.
1.2.2 细胞内活性氧水平的检测以5×104个/孔的密度接种于24孔平底培养板上,继续培养24 h,再用50 μmol/L PE或其他药物处理48 h.更换新鲜培养基,并将DCFH-DA探针(终浓度5 μmol/L)加入孔中,继续在培养箱中孵育30 min后,PBS清洗3遍.用0.4 mol/L NaOH溶液裂解细胞,将细胞裂解液取200 μL加入到96孔黑色微孔板中,使用多功能酶标仪测定DCF荧光强度,同时采用BCA法测定蛋白浓度,用二者的比值表示相对密度蛋白的荧光值.每组设4个平行孔.
1.2.3 动物实验将体重和年龄无明显区别的C57BL/6雄性小鼠随机分为3组,每组5~6只小鼠.对照组每天腹腔注射生理盐水,模型组按照每天20 mg/kg的剂量腹腔注射ISO,连续注射14 d,给药组除每天注射同样剂量的ISO外,同时每天给予ZPF1,剂量为100 mg/kg.实验完成后,利用首都医科大学Vevo 2100超高分辨率小动物超声影像系统对小鼠进行超声检测,数值取3个心动周期的平均值.所有动物处死前称量体重,断颈处死后迅速取出心脏和肺脏,称重.心脏组织在液氮里速冻后存放于-80 ℃冰箱,用于后续分析.
1.2.4 Western blot检测对照或药物处理后的细胞样品或心肌组织样品用预冷的RIPA缓冲液(含蛋白酶抑制剂)裂解或高速匀浆处理后,12 000 g离心15 min,收集上清液用于蛋白表达检测.在使用BCA法测定蛋白质浓度后,将相同量的蛋白与电泳缓冲液混合,沸水浴5 min.按常规方法上样、电泳、转膜、5%脱脂奶粉封闭,按照1∶1 000的比例加入一抗,4 ℃过夜.TBS-T缓冲液清洗后,加入HRP标记的二抗,室温孵育1 h,在TBS-T缓冲液清洗后曝光显影.
1.3 数据统计实验数据以平均值±标准误值(mean±SE)表示,2组和多组之间的差异采用SPSS 17.0软件包进行单因素方差分析(one way ANOVA),使用Tukey Post Hoc检验.P<0.05被认为具有统计学意义.
2 结果 2.1 NO及ZPF1对细胞活力的影响为研究NO对心肌细胞活力的影响,我们使用不同浓度的NO供体SNP和L-Arg处理H9C2心肌细胞24 h.SNP在溶液中迅速产生高浓度NO,可能会O2·-结合诱导细胞凋亡.我们发现,SNP对H9C2细胞活性有明显的抑制作用,尤其在较高浓度(图 1(a)).作为NOS的底物,L-Arg能够以温和的速度持续产生低浓度NO,保护细胞.在低浓度时,L-Arg对细胞活力没有明显影响,而在100 μmol/L时可显著提高细胞活力(图 1(a)).我们也研究了ZPF1对细胞活力的影响,发现在150和200 μg/mL的浓度时,ZPF1处理24 h能够提高50%~250%的细胞活力 (图 1(b)).

|
Download:
|
|
H9C2细胞经过不同浓度的药物处理24 h后,MTT法测SNP和L-Arg(a)以及配方药ZPF1(b)对细胞的活力的影响.*P<0.05 vs对照.
图 1 一氧化氮和配方药ZPF1对H9C2心肌细胞活力的影响 Fig. 1 Effect of NO and ZPF1 formula on viability in H9C2 cardiomyocytes |
|
为进一步探讨NO和ZPF1在心肌细胞中的保护作用,我们检测了对照和PE处理细胞中的活性氧水平.和对照细胞相比,5 μmol/L SNP、100 μmol/L L-Arg和200 μg/mL ZPF1单独处理48 h对细胞内活性氧水平没有明显影响.50 μmol/L PE处理48 h后细胞内活性氧增加~40%,ZPF1(200 μg/mL)同时处理48 h可以显著降低细胞活性氧水平,而SNP和L-Arg对PE诱导的细胞活性氧增加没有明显影响(图 2),说明ZPE1减少PE诱导的活性氧主要是通过它的抗氧化剂成分而不是L-Arg.

|
Download:
|
|
H9C2细胞经过ZPF1、SNP、L-Arg单独处理或分别和PE共同处理48 h后,用DCFH-DA荧光探针检测细胞内活性氧水平.*P<0.05 vs.对照组,#P<0.05 vs.PE处理组
图 2 一氧化氮和配方药ZPF1对H9C2细胞内活性氧水平的影响 Fig. 2 Effect of NO and ZPF1 formula on intracellular ROS level in H9C2 cells |
|
我们发现,ISO注射组心脏重量和心脏体重质量比(mg/g)均明显高于对照组(图 3(a)、图 3(b)),同时,ISO注射组中的肺脏体重和肺脏体重质量比(mg/g)也明显高于对照组(图 3(c)、图 3(d)).这些结果证实ISO诱导的心肌肥厚模型建立成功.我们发现,给小鼠喂食ZPF1可以显著降低心脏/肺脏重量以及心脏/肺脏体重质量比(图 3(a)、图 3(b)),表明ZPF1可以显著抑制ISO诱导的心肌肥厚.

|
Download:
|
|
C57BL/6小鼠在腹腔注射异丙肾上腺素ISO造模2周后,分别检测心脏重量(a)、心脏体重质量比(b)、肺脏重量(c)、肺脏体重质量比(d).超声心动法测量心脏功能,以心脏射血分数表示(e).*P<0.05 vs.对照组;#P<0.05 vs.异丙肾上腺素ISO组.
图 3 配方药ZPF1对ISO诱导的心肌肥厚和心脏功能的影响 Fig. 3 Effect of ZPF1 formula on ISO induced myocardial hypertrophy and dysfunction |
|
心肌肥厚往往伴随着心脏功能的下降.造模结束后,ISO注射组小鼠的射血分数由对照组的67.5±0.88下降至48.3±0.36,而ISO+ZPF1组小鼠的射血分数为59.4±0.98,显著高于ISO注射组(图 3(e)).这些数据表明,注射ISO可以引起心脏功能失常,而补充ZPF1可以抑制这一过程,提高心脏功能.
2.4 ZPF1对SERCA2a蛋白表达的影响肌浆网钙泵-2a(Sarcoplasmic reticulum calcium ATPase-2a,SERCA2a)是心肌细胞中参与Ca2+调节的重要蛋白,在心肌细胞钙循环和心肌的收缩/舒张周期中起着关键作用[10].大量研究显示,在人和小鼠的心力衰竭模型中SERCA2a的蛋白表达和活性有明显降低[11].为研究ZPF1的心肌保护作用机制,我们分别在细胞和动物模型中检测了SECA2a的蛋白表达.实验发现,50 μmol/L PE处理48 h引起SERCA2a蛋白表达显著下降(图 4(a)).虽然添加200 μg/mL ZPF1不影响正常细胞的SERCA2a蛋白表达,但可以显著抑制PE对SERCA2a的下调(图 4(a)).同样,ISO注射组小鼠心脏组织中SERCA2a蛋白表达和对照组明显降低,而这种下降可以被ZPF1所抑制.这些结果说明,ZPF1的心脏保护作用与维持SERCA2a的蛋白表达水平有关.
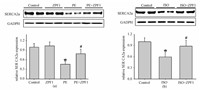
|
Download:
|
|
在H9C2细胞经过ZPF1、PE和PE+ZPF1分别处理48 h或小鼠造模及给药处理完成后,使用 western blot分别检测H9C2细胞(a)和小鼠心脏组织中(b)SERCA2a的蛋白表达水平,GAPDH蛋白作为内参.*P<0.05 vs.对照组,#P<0.05 vs.PE组或ISO组.
图 4 配方药对H9C2心肌细胞和衰竭心脏组织中SERCA2a蛋白表达的影响 Fig. 4 Effect of ZPF1 formula on SERCA2a protein expression in H9C2 and failing hearts |
|
在心血管系统中,内皮型一氧化氮合酶(eNOS)催化L-Arg产生的NO能够调节血压、扩张血管、抑制血小板聚集和白细胞黏附、抑制血管平滑肌细胞增殖.和野生型小鼠相比,心脏特异性过表达eNOS可以显著改善冠脉结扎引起的心肌肥厚和心室功能下降[12].而给大鼠注射eNOS的抑制剂L-NAME则可以导致高血压和心肌肥厚[13].近年来, 大量研究证实,来自血管内皮的NO产生减少则是加剧心肌肥厚和心力衰竭发生发展的重要因素[14-15].因此,恢复和增强eNOS活性,提高eNOS来源的NO含量,在心衰患者的治疗和预防方面具有重要的研究和临床价值.
心肌肥厚和心力衰竭引起心血管NO含量下降的主要原因包括:首先,心肌肥厚过程中产生了大量的氧自由基,特别是O2·-,可以和NO发生快速反应生成ONOO-[3, 16].其次,氧化应激可以氧化eNOS的辅酶BH4,导致eNOS发生解耦联,产生NO的活力下降[17].最后,心衰过程中,不对称二甲基精氨酸产生增高,能够竞争性地抑制NOS酶的活性[18].虽然SNP和硝酸甘油等NO供体能够短时间内释放NO,舒张血管,调节冠状动脉血流,改善心脏功能,但长期使用可能会引起可溶性鸟苷酸环化酶sGC发生巯基亚硝基化修饰而失活[19],使NO丧失心血管保护功能.我们发现,SNP在较低浓度就可以抑制心肌细胞活力,较高浓度的L-Arg对心肌细胞的活力有促进作用.这说明直接使用NO供体可能对正常的心肌功能不利,而通过添加L-Arg增加内源性NO的产生,可以提高心肌细胞活力.L-Arg对心衰病人的保护作用在临床实验中也得到一定的证实[20].但L-Arg对心脏肥厚的抑制作用还有一些争论.例如,最近的一项研究发现,在ISO诱导心肌肥厚的模型中,补充L-Arg可以轻微地提高心脏功能,但不能抑制心肌肥厚和心肌纤维化[21],说明单纯补充L-Arg的心血管保护作用还不明显.
一些天然抗氧化剂也具有重要的心血管保护功能.例如,山楂提取物可以治疗早期充血性心衰,心绞痛,心律不齐和高血压[22-23].山楂提取物还可以通过抑制磷酸二酯酶的活性,增加冠状动脉血液流量和心脏的血液输出,减少心脏的耗氧量[24],保护心肌免受缺血再灌注损伤.虾青素是存在于鱼、虾和藻类中的一种强抗氧化剂,其抗氧化活性为β-胡萝卜素的10倍、维生素E的100倍[25].食用富含虾青素的食物能够抑制O2·-的产生,提高NO含量,降低血压,改善心血管功能[26].知母宁是一类含有4个酚羟基的多酚类物质,能够有效清除大鼠心肌缺血再灌注损伤过程中的氧自由基,减少心肌细胞凋亡,提高心脏功能[6-7].此外,抗氧化剂还可以通过清除氧自由基抑制NOS的解耦连,提高其活力.基于这些研究成果,我们将一氧化氮合酶底物L-Arg和山楂提取物、知母宁山楂提取物和虾青素等天然抗氧化剂进行合理搭配,能够在多种细胞体系和动物模型中清除氧自由基,增加NO产量,从而发挥协同保护作用[9].在免疫系统中,抗氧化剂和NO能够协同调节T淋巴细胞、NK细胞的活性以及细胞因子分泌,提高机体免疫力[27-29].在本研究中,我们发现这种新型配方不仅显著提高心肌细胞活力,降低苯肾上腺素PE诱导的活性氧,还可以在动物模型中显著抑制ISO引起的心肌肥厚和心脏功能失常,说明将天然抗氧化剂和提高内源性NO产量结合起来,可以作为预防和治疗心肌肥厚和心力衰竭的一种新途径.
终上所述,我们发展了一种基于NO和天然抗氧化剂的新配方,可以促进大鼠心肌细胞的增殖,有效降低肥厚心肌细胞的活性氧水平,抑制ISO诱导的心肌肥厚,改善心脏功能,可作为一种潜在的保健食品,用于改善心血管健康.
| [1] | Bauer V, Sotnikova R. Nitric oxide:the endothelium-derived relaxing factor and its role in endothelial functions[J]. General Physiology and Biophysics , 2010, 29 (4) :319–340. DOI:10.4149/gpb_2010_04_319 |
| [2] | Kietadisorn R, Juni R P, Moens A L. Tackling endothelial dysfunction by modulating NOS uncoupling:new insights into its pathogenesis and therapeutic possibilities[J]. American Journal of Physiology,Endocrinology and Metabolism , 2012, 302 (5) :E481–E495. DOI:10.1152/ajpendo.00540.2011 |
| [3] | Pall M L. The NO/ONOO-cycle as the central cause of heart failure[J]. International Journal of Molecular Sciences , 2013, 14 (11) :22274–22330. DOI:10.3390/ijms141122274 |
| [4] | Zhao B, Shen J, Hu J, et al. Synergic effects of NO and oxygen free radicals in the injury of ischemia-reperfused myocardium:ESR studies on NO free radicals generated from ischemia-reperfused myocardium[J]. Science in China,Series C, Life sciences/Chinese Academy of Sciences , 1996, 39 (5) :491–500. |
| [5] | Shen J, Wang J, Zhao B, et al. Effects of EGb 761 on nitric oxide and oxygen free radicals, myocardial damage and arrhythmia in ischemia-reperfusion injury in vivo[J]. Biochimica et Biophysica Acta , 1998, 1406 (3) :228–236. DOI:10.1016/S0925-4439(98)00007-6 |
| [6] | Shen J G, Quo X S, Jiang B, et al. Chinonin, a novel drug against cardiomyocyte apoptosis induced by hypoxia and reoxygenation[J]. Biochimica et Biophysica Acta , 2000, 1500 (2) :217–226. DOI:10.1016/S0925-4439(99)00109-X |
| [7] | Zhao B, Shen J, Li M, et al. Scavenging effect of Chinonin on NO and oxygen free radicals and its protective effect on the myocardium from the injury of ischemia-reperfusion[J]. Biochimica et Biophysica Acta , 1996, 1315 (2) :131–137. DOI:10.1016/0925-4439(95)00112-3 |
| [8] | Shen J, Qiu X, Jiang B, et al. Nitric oxide and oxygen radicals induced apoptosis via bcl-2 and p53 pathway in hypoxia-reoxygenated cardiomyocytes[J]. Science in China,Series C, Life sciences/Chinese Academy of Sciences , 2003, 46 (1) :28–39. DOI:10.1007/BF03182682 |
| [9] | Zhao B. "Double Edge" effects of nitric oxide free radical in cardio-brain-vascular diseases and health studied by ESR[J]. Chinese Journal of Magnetic Resonance , 2015, 32 (2) :195–207. |
| [10] | Hayward C, Patel H, Lyon A. Gene therapy in heart failure:SERCA2a as a therapeutic target[J]. Circulation Journal:Official Journal of the Japanese Circulation Society , 2014, 78 (11) :2577–2587. |
| [11] | Sag C M, Wagner S, Maier L S. Role of oxidants on calcium and sodium movement in healthy and diseased cardiac myocytes[J]. Free Radical Biology & Medicine , 2013, 63 :338–349. |
| [12] | Janssens S, Pokreisz P, Schoonjans L, et al. Cardiomyocyte-specific overexpression of nitric oxide synthase 3 improves left ventricular performance and reduces compensatory hypertrophy after myocardial infarction[J]. Circulation Research , 2004, 94 (9) :1256–1262. DOI:10.1161/01.RES.0000126497.38281.23 |
| [13] | Hlavackova L, Vrankova S, Janega P, et al. The effect of indapamide on development of myocardial hypertrophy and fibrosis in L-NAME-induced hypertension in rat[J]. Physiological Research , 2011, 60 (6) :845–852. |
| [14] | Tang L, Wang H, Ziolo M T. Targeting NOS as a therapeutic approach for heart failure[J]. Pharmacology & Therapeutics , 2014, 142 (3) :306–315. |
| [15] | Marti C N, Gheorghiade M, Kalogeropoulos A P, et al. Endothelial dysfunction, arterial stiffness, and heart failure[J]. Journal of the American College of Cardiology , 2012, 60 (16) :1455–1469. DOI:10.1016/j.jacc.2011.11.082 |
| [16] | Afanas'ev I. ROS and RNS signaling in heart disorders:could antioxidant treatment be successful?[J]. Oxidative Medicine and Cellular Longevity , 2011, 2011 :293769. |
| [17] | Takimoto E, Champion H C, Li M, et al. Oxidant stress from nitric oxide synthase-3 uncoupling stimulates cardiac pathologic remodeling from chronic pressure load[J]. The Journal of Clinical Investigation , 2005, 115 (5) :1221–1231. DOI:10.1172/JCI21968 |
| [18] | Liu X, Fassett J, Wei Y, et al. Regulation of DDAH1 as a potential therapeutic target for treating cardiovascular diseases[J]. Evidence-based Complementary and Alternative Medicine , 2013, 2013 :619207. |
| [19] | Sayed N, Kim D D, Fioramonti X, et al. Nitroglycerin-induced S-nitrosylation and desensitization of soluble guanylyl cyclase contribute to nitrate tolerance[J]. Circulation Research , 2008, 103 (6) :606–614. DOI:10.1161/CIRCRESAHA.108.175133 |
| [20] | Rector T S, Bank A J, Mullen K A, et al. Randomized, double-blind, placebo-controlled study of supplemental oral L-arginine in patients with heart failure[J]. Circulation , 1996, 93 (12) :2135–2141. DOI:10.1161/01.CIR.93.12.2135 |
| [21] | Kralova E, Doka G, Pivackova L, et al. l-Arginine attenuates cardiac dysfunction, but further down-regulates alpha-Myosin heavy chain expression in isoproterenol-induced cardiomyopathy[J]. Basic & Clinical Pharmacology & Toxicology , 2015, 117 (4) :251–260. |
| [22] | Walker A F, Marakis G, Morris A P, et al. Promising hypotensive effect of hawthorn extract:a randomized double-blind pilot study of mild, essential hypertension[J]. Phytotherapy Research:PTR , 2002, 16 (1) :48–54. DOI:10.1002/(ISSN)1099-1573 |
| [23] | Zick S M, Vautaw B M, Gillespie B, et al. Hawthorn extract randomized blinded chronic heart failure (HERB CHF) trial[J]. European Journal of Heart Failure , 2009, 11 (10) :990–999. DOI:10.1093/eurjhf/hfp116 |
| [24] | Li L D, Li Y G, Gao F H, et al. Studies on hawthorn and its active principle. Ⅱ. Effects on cultured rat heart cells deprived of oxygen and glucose[J]. Journal of Traditional Chinese Medicine , 1984, 4 (4) :289–292. |
| [25] | Higuera-Ciapara I, Felix-Valenzuela L, Goycoolea F M. Astaxanthin:a review of its chemistry and applications[J]. Critical Reviews in Food Science and Nutrition , 2006, 46 (2) :185–196. DOI:10.1080/10408690590957188 |
| [26] | Monroy-Ruiz J, Sevilla M A, Carron R, et al. Astaxanthin-enriched-diet reduces blood pressure and improves cardiovascular parameters in spontaneously hypertensive rats[J]. Pharmacological Research , 2011, 63 (1) :44–50. DOI:10.1016/j.phrs.2010.09.003 |
| [27] | van der Veen R C. Nitric oxide and T helper cell immunity[J]. International Immunopharmacology , 2001, 1 (8) :1491–1500. DOI:10.1016/S1567-5769(01)00093-5 |
| [28] | Bidri M, Feger F, Varadaradjalou S, et al. Mast cells as a source and target for nitric oxide[J]. International Immunopharmacology , 2001, 1 (8) :1543–1558. DOI:10.1016/S1567-5769(01)00097-2 |
| [29] | Miranda M S, Sato S, Mancini-Filho J. Antioxidant activity of the microalga Chlorella vulgaris cultered on special conditions[J]. Bollettino Chimico Farmaceutico , 2001, 140 (3) :165–168. |
 2016, Vol. 33
2016, Vol. 33 


