环庚三烯酮1有共轭多烯烃性质,在反应时多表现出环加成反应特征,有时在其他条件下也表现一定的芳基化驱动性质,如在特殊条件控制下也可以反应得到结构类似于芳香体系的取代反应产物,这表明该化合物有烯烃性质和潜在的芳香体系的特征[1-7].二甲氧基苯2是双供电子基团取代的芳烃,在盐酸、硫酸或其他酸的催化作用下可以与脂肪醛或芳香醛反应[8-21]形成不同的化合物.如果控制反应时间及酸的用量时则可以得到简单的大环化合物,体现出超分子体系性能.但如果使用过量浓硫酸脱水缩合,原料比例合适并且取代基利于芳香体系形成时则可以形成多苯环芳烃化合物如取代蒽,此类蒽化合物由于其独特的发光性能可用于光电材料,同时也可用于识别不同的分子或金属离子.此类化合物分子中的甲氧基也可以被脱甲基(去甲基化)制备多酚类化合物.此外也有新型的无机催化剂如无机高价金属酸H3PW12O40 (PWA)(用量5%~9%)应用于此反应的报道[20].此反应可制备的相关化合物无论是大环超分子体系,或小分子,乃至多苯并环化合物都有不同的理论及应用价值,同时也是一系列新反应的前体化合物.
上述关于二甲氧基苯的反应较多的是与饱和醛/酮或芳基醛/酮反应的报道,极个别报道有底物为丁二酮的反应,一般很少有人探讨不饱和醛或酮与二甲氧基苯的实验.因此,本实验设计了一种不饱和醛酮——环庚三烯酮在浓硫酸催化作用下与二甲氧基苯类体系的缩合反应.与羰基共轭的双键是否会影响该反应的机理,相关产物结构或反应过程是否有新颖性,我们希望对这些问题进行探索.实验过程中也会涉及不饱和环庚三烯酮或二甲氧基苯自身在酸(H2SO4)作用下进行不同缩合的反应探讨.
1 实验部分 1.1 试剂与仪器环庚三烯酮(阿法埃莎公司,97%);1,2-二甲氧基苯(百灵威科技有限公司,99%);硫酸,二氯甲烷,甲醇,石油醚(北京化工厂,分析纯);乙酸乙酯(西陇化工股份有限公司,分析纯).
AVANCE Ⅲ 500 MHz核磁共振仪(美国Bruker公司);VERTEX 70红外光谱仪(美国Bruker公司);UV-2550紫外光谱仪(日本SHIMADZU公司);Solarix MALDI-FTMS质谱仪(美国Bruker公司);DFS高分辨磁质谱(美国Thermo Fisher公司).
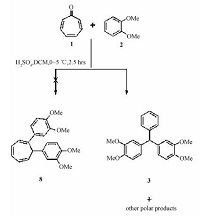
1.2 合成及分离纯化过程取环庚三烯酮(230μL,243mg,2.356mmol),1,2-二甲氧基苯(0.40mL,429mg,3.107mmol),溶于15mL 二氯甲烷,冰浴搅拌下向其缓慢滴加0.5mL浓硫酸.继续0℃反应,TLC监测,2.5h后停止反应.将其滴加入40mL冰水,用二氯甲烷(3×5mL)萃取水相后与有机相合并,用无水硫酸钠除水.滤液旋干除溶剂后用硅胶柱分离,洗脱剂PE/EA 5∶1,回收得到178mg (橙红色液体)原料1,329mg 原料1,2-二甲氧基苯2.得到一白色的固体反应产物26mg,产率3.1%. 该产物氢谱和碳谱与已知化合物3吻合,以此确定结构.
1.3 化合物3Rf=0.62 (petroleum/ethyl acetate 1∶1); 1H NMR (500 MHz,CDCl3) δ 10.55 (s,1H),7.29 (q,J=20 Hz,2H),7.23~7.20 (q,J=15 Hz,1H),7.11 (d,J=7.5 Hz,1H),6.78 (d,J=8.5 Hz,2H),6.67 (d,J=2 Hz,2H),6.60 (dd,J=10.5 Hz,2H),5.44 (s,1H),3.86 (s,6H),3.76 (s,6H); 13C NMR (126 MHz,CDCl3) δ 148.74,147.45,144.34,136.73,129.30,128.27,126.28,121.41,112.74,110.82,55.92,55.86,55.82; ATR-IR (cm-1): 2961w,2936w,2835w,1693w,1587w,1511m,1463w,1446w,1413w,1340w,1318w,1292w,1246w,1224m,1185w,1159w,1137w,1074m,1025m,958w,881w,871w,855w,818w,799w,703w,660w,638w,623w,588w,564w,506w,472w; UV/Vis (methanol/acetonitrile 1∶1)∶λmax(ε)=282nm (2620); EI-MS: m/z: 364 [M]+,333,287.
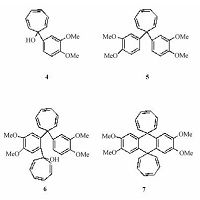
2 结果参照原有的报道,类似羰基酮参与的化学反应产物会从简单1∶1 2个分子的反应逐渐变成1∶2或2∶2发展为3个或4个分子乃至更多分子参与的反应,因此环庚三烯酮与二甲氧基苯在浓硫酸作用下可能的反应产物结构如图 1所示.
|
Download:
|
| 图 1 参照经典反应简单预测的环庚三烯酮与二甲氧基苯在浓硫酸作用下可能的反应产物 Fig. 1 Possible products for the condensation reaction of tropone and Ph(OMe)2,predicted on the basis of the reported references | |
实际化学反应没有按照经典思路如此简单进行,很显然与羰基共轭的双键影响了反应机理,改变了反应路线.实验中考查到二甲氧基苯或三烯环庚酮本身单独与浓硫酸作用时短时间内并不发生快速的化学反应,但当二者放在一起与浓硫酸作用时,则可以生成完全不同的化合物,所形成的化合物既有环庚三烯酮的结构片段,又有二甲氧基苯的结构片段.如果浓硫酸过多或反应时间过长,则易得极性大的复杂化合物.相关结果表明,可以分离得到的一白色固体产物不是以上结构,而是一种由环庚三烯酮在浓硫酸作用下的重排产物.产物的质谱数据为: EI-MS: m/z: 364 [M]+,333,287,结合核磁氢谱、碳谱推测其分子式为C23H24O4,较为合理的结构式至少有8、3两种.
相关产物氢谱(1HNMR)信息中,多数都是芳基氢,化学位移在6.59~7.30ppm 范围内是芳香氢,在5.50~6.4ppm 之间没有特别的信息存在表明体系中不存在独立的HCCH,同时在3.86,3.76两处均有很强的单峰存在,表明分子中有2组不同的OMe基团存在.比较重要一点是在5.44ppm处有一单峰,此是(Ar)3CH的特征峰.氢谱的积分表明该产物不存在多个饱和氢,这说明来源于环庚三烯的3个双键并不会全部变成饱和烷基.
在化合物的红外图谱中,没有特别强的CO基峰存在.同时紫外分析也发现,产物在λmax=282nm处有最大吸收峰(ε=2620),其位置与原料二甲氧基苯2相近,而与原料化合物1的λmax=301nm相差较大,结合到8中有一个H原子应该只有3.4~4.5ppm,从而推断反应白色固体产物的结构是3而不是8,其反应见图 2.之后与文献[20]对照,发现产物与其他原料和方法合成的已知化合物3的氢谱和碳谱吻合,这也证明了此反应确实发生了重排.
|
Download:
|
| 图 2 环庚三烯酮与二甲氧基在浓硫酸作用下的缩合重排产物 Fig. 2 Rearrangement products from the condensation of tropone and Ph(OMe)2 in H2SO4 | |
该化合物形成的机理则涉及到苄基正离子(Ph-CH+)是何时形成的,如果是独立形成的,则环庚三烯酮会得到PhMe或类似产物,但实际发现如果不与1,2二甲氧基苯反应单独使用环庚三烯酮,在类似条件下并没有形成大量的环庚三烯酮的变异或二聚三聚产物.若改用其他原料如令环庚三烯酮与邻苯二甲醛反应,则基本上没有反应,且环庚三烯酮还比较稳定,没有得到环庚三烯酮的异构或反应产物.这表明,先形成苄基正离子的思路是值得怀疑的,发生七元环重排与1,2-二甲氧基苯有关.
当硫酸增加,反应时间加长或温度升高时,二甲氧基苯就会全部消失,在TLC 上显示出极性特别大的化合物形成,此一般是酸作用下,形成了酚类化合物,其极性增大,同时还会继续并环化,形成溶解度更小的化合物.
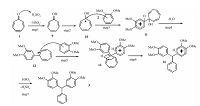
可能的反应机理见图 3.硫酸首先与羰基氧作用,形成9.该中间体形成并不是特别快,且其自身也不会自催化反应.待第二步时发生重排,形成一相对稳定的碳正离子10,紧跟着与邻二甲氧基苯发生类似与傅-克烷基化的反应形成11,后脱水得到12碳正离子,再次重复傅-克烷基化形成中间体13,该中间体13是该反应的关键步骤,因13中间体位阻大有扭曲作用,可以诱导重排发生得到能量更低的14,最终得到产物.
|
Download:
|
| 图 3 环庚三烯酮与二甲氧基苯在浓硫酸作用下的缩合重排机理 Fig. 3 Proposed mechanism of the condensation-rearrangement reaction of tropone with Ph(OMe)2 catalyzed by H2SO4 | |
与环庚三烯酮常见的环加成反应不同,在浓硫酸作用下环庚三烯酮与邻二甲氧基苯可以发生脱水缩合重排反应,该重排导致原料中七元环会收缩为六元环,其中较大位阻导致的扭曲张力及芳基苯环化是主要推动力.相关结果在理论上对大环化合物特别是共轭大环体系(含羰基)的同类型的重排有重要参考价值.
| [1] | Kende A S. The course of tropone photodimerization in acetonitrile[J]. J Am Chem Soc , 1966, 88 (21) :5026–5027. DOI:10.1021/ja00973a049 |
| [2] | Mukai T, Tezuka T, Akasaki Y. Tropone dimer:a new type of photocycloaddition reaction[J]. J Am Chem Soc , 1966, 88 (21) :5025–5026. DOI:10.1021/ja00973a048 |
| [3] | Isakovic L, Ashenhurst J A, Gleason J L. Application of Lewis acid catalyzed tropone cycloadditions to the synthesis of the core of CP-225,917[J]. Org Lett , 2001, 3 (26) :4189–4192. DOI:10.1021/ol016814h |
| [4] | Du Y S, Feng J Q, Lu X Y. A phosphine-Catalyzed annulation reaction of modified allylic compounds and tropone[J]. Org Lett , 2005, 7 (10) :1987–1989. DOI:10.1021/ol050443d |
| [5] | Williams R V, Edwards W D, Zhang P R, et al. Experimental verification of the homoaromaticity of 1,3,5-cycloheptatriene and evaluation of the aromaticity of tropone and the tropylium cation by use of the dimethyldihydropyrene probe[J]. J Am Chem Soc , 2012, 134 (40) :16742–16752. DOI:10.1021/ja306868r |
| [6] | Rivero A R, Fernández I, Sierra M Á. Regio-and diastereo-selective stepwise -cycloaddition reaction between tropone derivatives and donor-acceptor cyclopropanes[J]. Org Lett , 2013, 15 (19) :4928–4931. DOI:10.1021/ol4020656 |
| [7] | Kumar P, Thakur A, Hong X, et al. Ni(NHC)]-catalyzed cycloaddition of ciynes and tropone: apparent enone cycloaddition involving an 8π Insertion[J]. J Am Chem Soc , 2014, 136 (51) :17844–17851. DOI:10.1021/ja5105206 |
| [8] | Davidson I M, Musgrave O C. Condensation of diketones with aromatic compounds. 2. Condensation of hexane-2,5-dione with veratrole and catecho[J]. J Chem Soc , 1963 :3154–3155. |
| [9] | Chung Y, Duerr B F, McKelvey T A, et al. Structural effects controlling the rate of the retro-Diels-Alder reaction in anthracene cycloadducts[J]. J Org Chem , 1989, 54 :1018–1032. DOI:10.1021/jo00266a006 |
| [10] | Chopra N, Hardie M J, Raston C L. Discovery of a novel C-60 receptor based on substituted anthracene[J]. Supramolecular Chemistry , 2000, 11 (4) :275–278. DOI:10.1080/10610270008049138 |
| [11] | Goossens R, Smet M, Dehaen W. Bronsted-and Lewis acid-catalyzed cyclization giving rise to substituted anthracenes and acridines[J]. Tetrahedron Lett , 2002, 43 (37) :6605–6608. DOI:10.1016/S0040-4039(02)01462-4 |
| [12] | Balaban T S, Eichöfer A, Krische M J, et al. Hierarchic supramolecular interactions within assemblies in solution and in the crystal of 2,3,6,7-tetrasubstituted 5,5'-(anthracene-9,10-diyl)bis homotrimer of 2,3,6,7-tetramethoxy-9,10-dimethylanthracene cation radical[J]. Tetrahedron Lett , 2009, 50 :6687–6690. DOI:10.1016/j.tetlet.2009.09.081 |
| [13] | Kodomari M, Nagamatsu M, Akaike M, et al. Convenient synthesis of triarylmethanes and 9,10-diarylanthracenes by alkylation of arenes with aromatic aldehydes using acetyl bromide and ZnBr(2)/SiO(2)[J]. Tetrahedron Lett , 2008, 49 (16) :2537–2540. DOI:10.1016/j.tetlet.2008.02.117 |
| [14] | Chebny V J, Navale T S, Shukla R, et al. X-ray structural characterization of charge delocalization onto the three equivalent benzenoid rings in hexamethoxytriptycene cation radical[J]. Org Lett , 2009, 11 (11) :2253–2256. DOI:10.1021/ol900558s |
| [15] | Modjewski M J, Shukla R, Lindeman S V, et al. Isolation and X-ray structural characterization of a dicationic homotrimer of 2,3,6,7-tetramethoxy-9,10-dimethylanthracene cation radical[J]. Tetrahedron Lett , 2009, 50 :6687–6690. DOI:10.1016/j.tetlet.2009.09.081 |
| [16] | Ogoshi T, Kitajima K, Umeda K, et al. Lewis acid-catalyzed synthesis of dodecamethoxycalix 4 arene from 1,3,5-trimethoxybenzene and its conformational behavior and host- guest property[J]. Tetrahedron , 2009, 65 (51) :10644–10649. DOI:10.1016/j.tet.2009.10.059 |
| [17] | Ghanem B S, Hashem M, Harris K D M, et al. Triptycene-based polymers of intrinsic microporosity: organic materials that can be tailored for gas adsorption[J]. Macromolecules , 2010, 43 :5287–5294. DOI:10.1021/ma100640m |
| [18] | Xia Z Y, Su J H, Wong W Y, et al. High performance organic light-emitting diodes based on tetra(methoxy)-containing anthracene derivatives as a hole transport and electron-blocking layer[J]. J Mater Chem , 2010, 20 (38) :8382–8388. DOI:10.1039/c0jm01297a |
| [19] | Wei J, Han B, Guo Q, et al. 1,5,9-Triazacoronenes: a family of polycyclic heteroarenes synthesized by a threefold pictet-spengler reaction[J]. Angew Chem Int Ed , 2010, 49 (44) :8209–8213. DOI:10.1002/anie.v49:44 |
| [20] | Mohammadpoor-Baltork I, Moghadam M, Tangestaninejad S, et al. H3PW12O40-catalysed alkylation of arenes and diveratrylmethanes:convenient routes to triarylmethanes and to symmetrical and unsymmetrical 9,10-diaryl-2,3,6,7-tetramethoxyanthracenes[J]. Eur J Org Chem , 2011 (7) :1357–1366. |
| [21] | Babu B M, Thakur P B, Rao N N, et al. A rapid, highly efficient, and general protocol for the synthesis of functionalized triarylmethanes: a straightforward access for the synthesis of (-)-tatarinoid C[J]. Tetrahedron Lett , 2014, 55 (11) :1868–1872. DOI:10.1016/j.tetlet.2014.01.107 |
 2016, Vol. 33
2016, Vol. 33 


