氧化锌(ZnO)晶体和纳米粒子(NPs)在过去20多年来应用越来越广泛,如用于LED灯[1]、太阳能电池[2]、催化[3]、气体检测[4]和压电器件[5]等。据估计,氧化锌纳米粒子是仅次于SiO2 NPs和TiO2 NPs的全球第三大产量纳米材料。特别地,由于锌是一种广泛用于钢的金属涂层[6],因此ZnO的稳定性和溶解行为对钢的防腐蚀性能有重大意义。
同时由于ZnO材料的广泛应用,特别是作为防腐蚀层的ZnO,必然会进入自然环境中,且溶出对于水生生物毒性很大的Zn2+[7-8],而自然环境中普遍存在的天然有机质(natural organic matter, NOM)是影响ZnO溶解的一个重要因素[9]。因为NOM中丰富的羟基和羧基等各种可以和金属原子配位的官能团,是金属在水环境中氧化-还原循环的重要驱动力和影响因素。因此研究NOM对ZnO溶解的影响对揭示其环境过程和毒性具有重要意义。
然而,由于天然形成的ZnO防腐蚀层和排放至自然环境中的人工ZnO NPs都是无定型的,无法在条件明确的基础上研究表面反应。相比之下,使用单晶块状ZnO可以对明确的表面进行研究和解释数据[10],因为晶体取向提供了表面结构的详细信息。
以往对ZnO溶解的研究主要集中在纳米材料或特定晶面的平均溶解速率[11-13],而尚未有NOM如何影响ZnO特定晶面溶解情况的研究报道。因此,本文以极性ZnO单晶(0001)面和非极性ZnO单晶(1010)面为研究对象,探究NOM对不同晶面ZnO溶解的影响。
1 实验部分 1.1 材料与试剂ZnO单晶(晶向0001和1010,尺寸2.5 mm×2.5 mm×0.5 mm)从中国科学院上海光学精密机械研究所购买。Suwannee River腐植酸(SRHA Ⅱ)、Upper Mississippi River NOM (UMRN)都从国际腐植酸协会(IHSS)购买。POPSO倍半钠盐从Sigma-Aldrich公司购买。所有试剂和化学试剂均未进一步纯化。实验用水均为超纯水。
1.2 溶液配置POPSO倍半钠盐配置为5 mmol/L备用,以控制溶液pH在7.86~7.88,SRHA Ⅱ、UMRN配置成400 mg C/L的高浓度溶液,放冰箱冷藏里备用。
1.3 溶解实验和表征为了研究其他晶面是否溶解对目标晶面溶解情况的影响(如(1010)面溶解时,晶体侧面(0001)面和(0001)面是否溶解),使用胶带将特定侧面覆盖,分为3组:1)不覆盖4个侧面;2)覆盖2个相邻侧面;3)覆盖4个侧面。所有溶解晶体底部都已覆盖(如图 1(a)所示)。晶体固定在烧杯底部,加入25 mL 10 mg C/L的NOM溶液,静置下溶解,分别在3,10,30,60,84,108 h时取1 mL溶液,使用德国耶拿PQ9000高分辨率ICP发射光谱仪测得溶液Zn2+浓度。数据误差取3次平行实验所得。

|
Download:
|
| 图 1 ZnO单晶侧面(0001)的覆盖示意图和溶解形貌 Fig. 1 The schematic diagram and SEM images of covering the side of ZnO single crystal(0001) | |
为了研究不同晶面在NOM存在下的溶解形貌特征,将覆盖4个侧面的晶体固定在烧杯底部,加入100 mL 10 mg C/L的NOM溶液,静置下溶解24 h后取出晶体,超纯水洗涤并晾干,迅速转移至日本日立冷场发射扫描电镜Regulus 8100取得SEM图像。
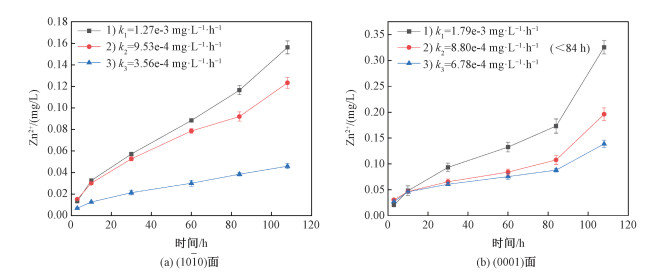
2 结果与讨论 2.1 NOM存在下晶面的溶解速率图 1(b)和图 1(c)为10 mg C/L SRHA Ⅱ溶液中侧面覆盖与否的溶解腐蚀形貌SEM(scanning electron microscope)图,对比可以观察到无覆盖的侧面显示出典型的六边形腐蚀,这是(0001)晶面的溶解导致的,原因在下文讨论。而胶带覆盖的侧面除了白色的胶带残留物和机械破坏痕迹,没有出现腐蚀形貌,说明胶带覆盖可以阻止侧面溶解。而图 2为同一种ZnO晶面的不同情况溶解速率对比,除了立方体晶块4个侧面的覆盖情况不同,其他条件均相同。
|
Download:
|
| k为近似零级反应速率常数。1)、2)、3)分别对应不覆盖4个侧面、覆盖2个相邻侧面、覆盖4个侧面。 图 2 10 mg C/L SRHA Ⅱ溶液中,ZnO单晶溶出的Zn2+随时间变化图 Fig. 2 Zn2+ concentration of ZnO single crystals over time in 10 mg C/L SRHA Ⅱ | |
如果顶面溶解速率与侧面覆盖与否无关,那么应满足近似零级反应速率常数k1-k2=k2-k3。但实验结果显示,k1-k2不等于k2-k3且差别显著,这表明同一块晶体不同晶面之间的溶解相互关联,侧面的同时溶解可以促进顶面的溶解。在Kislov等[14]对ZnO不同晶面光催化降解甲基橙性能的研究中,将非光照面覆盖会使催化效率显著下降,这是由于光生电子可以转移至非光照面,减少电荷再结合现象,同时转移的电子可以在非光照面与氧气产生活性氧物种。同样地,溶解过程产生的电荷积累会阻碍溶解过程的继续,而积累的电荷可以从晶体内转移至未被掩盖的晶面减少电荷积累。
对比不同晶面ZnO单晶的溶解速率,在SRHA Ⅱ溶液中,(0001)面的溶解速率显著快于(101-0)面的溶解速率。这是因为极性ZnO(0001)表面的Zn封端本身带正电,而NOM带负电,使得NOM更容易吸附在(0001)面(Zn面)以促进溶解。
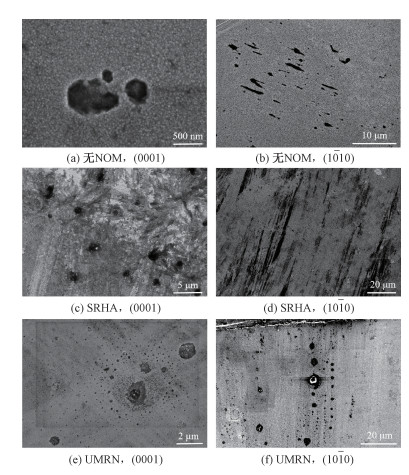
2.2 不同NOM对单晶ZnO溶解形貌的影响图 3列出了在没有NOM和2种NOM影响下(0001)面和(1010)面ZnO单晶溶解之后的SEM图像。
|
Download:
|
| 图 3 ZnO单晶溶解晶面的SEM图(t = 108 h) Fig. 3 SEM images of ZnO single crystals in solutions (t=108 h) | |
ZnO单晶为六角形晶体结构(P63mc),在无NOM的溶液中可以看出(0001)面的ZnO晶体表面凹坑呈现典型的六角形生长。根据Nicholas等[15]的研究结果,这是由于(0001)面开始溶解后,不稳定的(1010)面重构为稳定的(1011)面,形成六角锥形凹坑。随着溶解的持续,这些凹坑横向生长并最终合并。在(1010)面上的溶解是由于(0001)面重构为(1011)面而形成狭长型蚀坑。
加入NOM后,可以看到每种NOM对ZnO单晶溶解的影响不同。在(0001)面上,SRHA破坏了典型的六边形凹坑形状,同时使得整个平面凹凸不均,但仍可以观察到大小相近的多个腐蚀坑分散形成;而UMRN使得(0001)面的溶解凹坑呈现聚集现象,大凹坑周围出现溶解更多的情况。在(1010)面上,SRHA同样有使得整个平面不均匀的趋势,但整体溶解形状仍由狭长型凹坑组成;UMRN同样趋向于优先形成大的蚀坑,同时在大的蚀坑附近沿着相同方向形成小坑,这是由(1010)面的各向异性决定的。
3 总结研究发现ZnO单晶特定晶面溶解的整体速率受其他晶面是否接触溶液影响,侧面接触溶液会加快顶面的溶解速率;其次,不同NOM对ZnO单晶溶解的影响不同,这与NOM的性质有关,但不同晶面仍保留了一部分其原本的溶解特性。
| [1] |
Thompson D B, Richardson J J, DenBaars S P, et al. Light emitting diodes with ZnO current spreading layers deposited from a low temperature aqueous solution[J]. Applied Physics Express, 2009, 2: 042101. Doi:10.1143/apex.2.042101 |
| [2] |
Yan F P, Huang L H, Zheng J S, et al. Effect of surface etching on the efficiency of ZnO-based dye-sensitized solar cells[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2010, 26(10): 7153-7156. Doi:10.1021/la904238n |
| [3] |
Li D, Haneda H. Morphologies of zinc oxide particles and their effects on photocatalysis[J]. Chemosphere, 2003, 51(2): 129-137. Doi:10.1016/S0045-6535(02)00787-7 |
| [4] |
Perez-Lopez O W, Farias A C, Marcilio N R, et al. The catalytic behavior of zinc oxide prepared from various precursors and by different methods[J]. Materials Research Bulletin, 2005, 40(12): 2089-2099. Doi:10.1016/j.materresbull.2005.07.001 |
| [5] |
Wang X D, Song J H, Liu J, et al. Direct-current nanogenerator driven by ultrasonic waves[J]. Science, 2007, 316(5821): 102-105. Doi:10.1126/science.1139366 |
| [6] |
Kondratiuk J, Kuhn P, Labrenz E, et al. Zinc coatings for hot sheet metal forming: comparison of phase evolution and microstructure during heat treatment[J]. Surface and Coatings Technology, 2011, 205(17/18): 4141-4153. Doi:10.1016/j.surfcoat.2011.03.002 |
| [7] |
Li M, Lin D H, Zhu L Z. Effects of water chemistry on the dissolution of ZnO nanoparticles and their toxicity to Escherichia coli[J]. Environmental Pollution, 2013, 173: 97-102. Doi:10.1016/j.envpol.2012.10.026 |
| [8] |
Rousk J, Ackermann K, Curling S F, et al. Comparative toxicity of nanoparticulate CuO and ZnO to soil bacterial communities[J]. PLoS One, 2012, 7(3): e34197. Doi:10.1371/journal.pone.0034197 |
| [9] |
Zhang G S, Tang D J, Wang Y, et al. Overlooked role of carbonyls of natural organic matter on the dissolution of zinc oxide nanoparticles[J]. ACS Earth and Space Chemistry, 2019, 3(12): 2786-2794. Doi:10.1021/acsearthspacechem.9b00253 |
| [10] |
Valtiner M, Borodin S, Grundmeier G. Stabilization and acidic dissolution mechanism of single-crystalline ZnO(0001) surfaces in electrolytes studied by in situ AFM imaging and ex-situ LEED[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2008, 24(10): 5350-5358. Doi:10.1021/la7037697 |
| [11] |
Reed R B, Ladner D A, Higgins C P, et al. Solubility of nano-zinc oxide in environmentally and biologically important matrices[J]. Environmental Toxicology and Chemistry, 2012, 31(1): 93-99. Doi:10.1002/etc.708 |
| [12] |
Valtiner M, Torrelles X, Pareek A, et al. In situ study of the polar ZnO(0001): Zn surface in alkaline electrolytes[J]. The Journal of Physical Chemistry C, 2010, 114(36): 15440-15447. Doi:10.1021/jp1047024 |
| [13] |
Gerischer H, Sorg N. Chemical dissolution of zinc oxide crystals in aqueous electrolytes: an analysis of the kinetics[J]. Electrochimica Acta, 1992, 37(5): 827-835. Doi:10.1016/0013-4686(92)85035-J |
| [14] |
Kislov N, Lahiri J, Verma H, et al. Photocatalytic degradation of methyl orange over single crystalline ZnO: orientation dependence of photoactivity and photostability of ZnO[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2009, 25(5): 3310-3315. Doi:10.1021/la803845f |
| [15] |
Nicholas N J, Ducker W, Franks G V. Differential etching of ZnO native planes under basic conditions[J]. Langmuir, 2012, 28(13): 5633-5641. Doi:10.1021/la2047273 |
 2024, Vol. 41
2024, Vol. 41 


