RD2、RD17、RD19、RD20、RD21、RD22、RD26、RD28和RD29最初是在脱水处理10 h的模式植物拟南芥(Arabidopsis thaliana)中筛选到的15个cDNA片段,依其特性将其分为9个RD[1]。经研究发现这类基因受脱水胁迫诱导,但是每个RD还有各自不同的特点,其中包括脱水胁迫诱导基因表达量响应的时间不同,以及受到诱导后的表达量不同等,初步认为RD基因的表达是由不同的信号转导途径诱导。植物的脱水响应可能导致激素水平的改变,促使脱落酸(abscisic acid,ABA)的合成,ABA在气孔关闭、种子成熟和休眠中起作用[2]。在这些RD基因中,RD22和RD29基因明显被ABA诱导,而RD19、RD21、RD28没有显著的诱导效应[1]。RD的功能虽然都与调节植物脱水有关,是一类均对植物脱水胁迫有响应的基因,但它们来自不同家族。从1992年发现至今,陆续有人对RD基因的功能进行研究和报道,其中,对RD22和RD29这2个基因在植物应对干旱、高盐及低温胁迫时发挥功能的研究相对较多[1-14]。
脱水胁迫信号与基因表达之间存在着依赖于ABA和不依赖于ABA的逆境胁迫信号转导途径:ABA依赖途径和非ABA依赖途径[2]。另外从基因在植物应对逆境胁迫时发挥的功能角度出发,RD基因分为功能基因和转录因子2种类型[3-14]。
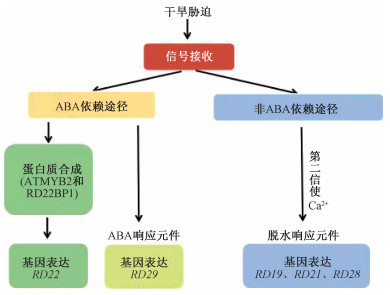
ABA信号转导途径下对9个RD基因分类,发现RD2、RD17、RD20、RD22、RD26和RD29可被ABA诱导,而RD19、RD21及RD28则不能被ABA诱导,推测在干旱胁迫下这些基因的表达,至少存在3种独立的信号转导途径[3-14]。如图 1所示,其中2条ABA依赖途径,1条非ABA依赖途径,并且在ABA依赖的2条途径中有1条途径需要A. thaliana myeloblastosis 2(AtMYB2)和RD22 binding protein1(RD22BP1)2个蛋白质的合成,共同激活RD22基因的表达[2]。
|
Download:
|
| 干旱胁迫下,植物接收信号后分为3种信号转导途径:2条ABA依赖途径;1条非ABA依赖途径 图 1 脱水胁迫与基因表达之间的3种信号转导途径[2] Fig. 1 Three signaling pathways between dehydration stress and gene expression[2] | |
目前对RD基因的研究,发现其中RD17、RD20、RD22、RD28和RD29作为功能基因在植物应对一些干旱、高盐和低温等非生物胁迫时使植物具有一定的耐受性;而RD19、RD21和RD26则作为转录因子,一方面也具有耐受一些干旱和高盐等非生物胁迫的能力,另一方面还对其下游的其他基因起到调控的作用[3-28]。
1 RD蛋白结构特性每个RD都具有调节植物脱水的作用,但其结构组成不同。对9个RD蛋白序列进行比对,发现RD19、RD21与硫醇蛋白酶(cysteine proteinase,CysP)具有显著的序列相似性,且在同一物种中RD19与RD21的相似性要高于不同物种中RD19之间或RD21之间的相似性,这或许与RD19和RD21这2个蛋白来自同一家族有关[3]。RD22与豆科植物种子蛋白(unidentified seed protein,USP)具有一定相似性;RD28编码一种膜蛋白,与大豆结节蛋白26具有局部相似性;RD17编码的蛋白质与ABA诱导相关蛋白(responsive to ABA,RAB)具有同源性[1]。RD20是Caleosin家族编码Ca2+的结合蛋白[12];RD26是No Apical Meristem,ATAF1,2,和Cup-Shaped Cotyledon 2(NAC)蛋白家族的成员[21];而RD29与胚胎发育晚期丰富蛋白(late embryogenesis abundant,LEA)具有一定的相似性[8]。
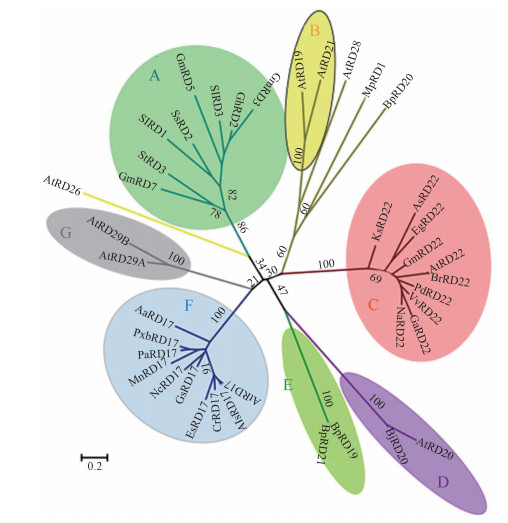
如图 2所示,进化树分析发现每个RD蛋白序列之间的相似性不高。但不同物种中的同一蛋白彼此之间具有较高的相似性,说明每种蛋白特性显著。未发现与RD1、RD2、RD3、RD5和RD7相关的研究报道,而从RD蛋白进化关系也发现它们之间的特性可能没有明显的规律(图 2A);同一物种拟南芥中RD19和RD21的相似性较高(图 2B);不同物种的RD22和RD17表现出较高相似性(图 2C和2F);同样地,不同物种的RD20亲缘关系较近(图 2D);同一物种的2个蛋白RD19和RD21以及RD29A和RD29B之间的相似性较高(图 2C和2F)。
|
Download:
|
| A表示未报道的RD蛋白:Sl, Solanum lycopersicum; Ss, Saccharum spontaneum; Gh, Gossypium hirsutum; St, Solanum tuberosum; Gm, Glycine max;B为同一物种中RD19和RD21蛋白:At, Arabidopsis thaliana;C为不同物种中的RD22蛋白:Ks, Knorringia sibirica; As, Apostasia shenzhenica; Eg, Elaeis guineensis; Br, Brassica rapa; Pd, Prunus dulcis; Vv, Vitis vinifera; Ga, Gossypium arboreum; Na, Nicotiana attenuata;D为2个物种中的RD20蛋白:Bj, Brassica juncea;E表示同一物种中的RD19和RD21:Bp, Bordetella pertussis;F不同物种中的RD17蛋白:Aa, Anthurium amnicola; Pxb, Pyrus x bretschneideri; Pa, Prunus avium; Mn, Morus notabilis; Nc, Nymphaea colorata; Gs, Glycine soja; Es, Eutrema salsugineum; Cr, Capsella rubella; Als, Arabidopsis lyrata subsp. lyrata;G:RD29A和RD29B组成的RD29蛋白;黄线是一个单独的RD26蛋白 图 2 不同物种RD蛋白系统进化关系 Fig. 2 Neighbor-joining phylogenetic relationships among RD1, RD2, RD3, RD5, RD7, RD17, RD19, RD20, RD21, RD22, RD26, RD28, and RD29 from some plant species | |
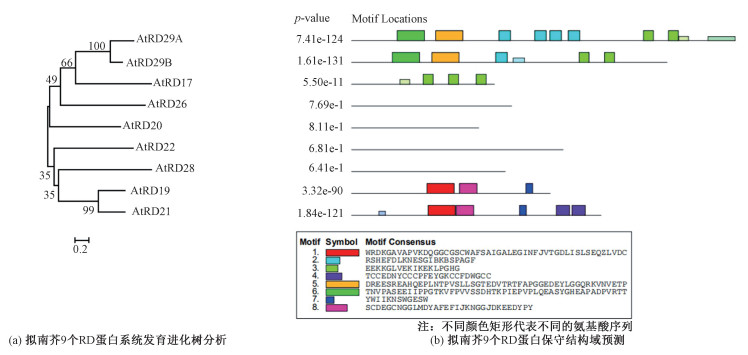
为进一步分析RD的蛋白序列组成,使用Multiple EM for Motif Elicitation(MEME)软件进行在线预测(http://meme-suite.org/)。9个RD的保守基序预测结果主要表现为3种类型(图 3):1)由2个相似蛋白RD19和RD21组成,且含有3个共同的基序motif1、motif7和motif8;2)3个含有保守基序motif3的蛋白RD17、RD29A和RD29B;3)不含有保守基序的4个RD蛋白RD20、RD22、RD26以及RD28。我们以RD蛋白保守基序的这3种类型为主体,对RD蛋白的结构特征进行介绍。
|
Download:
|
| 图 3 RD系统发育树分析及蛋白保守域预测 Fig. 3 RD phylogenetic tree analysis and protein conserved domain prediction | |
Koizumi等[3]预测转录因子RD19和RD21分别含有368和462个氨基酸,二者序列相似性较高,且均与CysP蛋白具有同源性,分别具有表现为Cys161-His297-Asn317和Cys158-His302-Asn329的催化三元组,这2个催化三元组是CysP家族的典型特征,也是RD19和RD21蛋白各自的催化位点。另外,发现RD19基因序列中含111 bp和281 bp的2个内含子;与RD19不同,RD21则含有4个内含子(表 1)。RD19和RD21所包含的内含子数目不同,且对应的位置也有差异,推测它们可能是CysP家族中不同类型的2个成员[3]。观察RD19和RD21 2个蛋白的基序组成也发现,预测的2个蛋白结构域相似性很高。如图 3所示,motif1、motif7和motif8均存在于RD19和RD21蛋白中。
|
|
表 1 RD蛋白家族功能特点及结构示意图 Table 1 Functional characteristics and structural diagram of RD protein family |
进一步研究发现,拟南芥RD21由5个结构域组成:信号肽、自抑制前体蛋白、蛋白酶结构域、富含脯氨酸结构域和颗粒蛋白结构域[4]。而CysP家族的其他成员结构不含有2个结构域组成的C末端延伸序列、富含脯氨酸的结构域和颗粒蛋白结构域[5]。
1.2 亲水性蛋白脱水诱导蛋白RD17也被叫做冷调节蛋白cold-regulated 47(COR47),含有1 073个核苷酸,编码一个47 kDa的亲水性多肽(亲水指数为-1.1),富含谷氨酸(占20%)和赖氨酸(占14%)(表 1)。其多肽不仅与RAB具有较高的同源性,同时还与LEA蛋白序列相近:它具有丝氨酸簇(称为S段)和富含赖氨酸(称为K段)的重复序列,但不含半胱氨酸和色氨酸,RD17是一种酸性蛋白质[6-7]。
Yamaguchi-Shinozaki和Shinozaki[8]通过基因组结构分析发现,在RD29上8 kb区域存在2个串联的蛋白,将其分别命名为RD29A和RD29B(表 1)。RD29A也称为脱水素(low-temperature-induced,LTI78)蛋白或COR78[9],而RD29B被称为LTI65[10],且2个基因均含有3个相近位置的内含子。RD29A由711个氨基酸组成,RD29B含604个氨基酸,在RD29A中有一个112个氨基酸组成的2个重复序列(GFGDESGAELE KDFPTRSHD…GNFPVRSHELDLKNESDIDK),而RD29B中未发现这段序列[8]。RD29A和RD29B蛋白都具有极强的亲水性,并且2个蛋白结构均与LEA蛋白具有一定的相似性,说明RD29的2个蛋白可能参与低温胁迫诱导[8]。
RD29B对低温胁迫的耐受性低于RD29A[10],而RD17对植物类囊体膜具有低温保护作用[23]。如图 3所示,RD17、RD29A和RD29B均含有motif3。此外,2个RD29还含有motif2、motif5和motif6,且2个RD29蛋白的主要区别是motif2基序的数量不同,而RD17蛋白仅含有motif3基序。
1.3 不含有保守基序的蛋白RD蛋白结构域预测结果显示,RD20、RD22、RD26和RD28这4个蛋白中未发现保守结构域。拟南芥RD20是能与Ca2+结合的蛋白,其cDNA包含一个708 bp的开放阅读框,并编码一个由236个氨基酸残基组成的蛋白质,预测分子量为26.6 kDa[11]。尽管暂时未有报道与RD20同源的其他蛋白,但是如表 1所示,Takahashi等发现它的氨基酸序列包含一个与钙结合域(EF-hand motif)高度同源的序列[11],并有研究发现RD20编码的蛋白质属于钙蛋白(Caleosin)家族,是油脂体(oil body,OB)相关蛋白[12]。RD20也被叫做钙依赖(A. thaliana caleosin 3,AtCLO3)蛋白,具有作为过氧化酶所需的所有生化特性[13]。
RD22蛋白在很多物种中均被研究,如:拟南芥[14]、西伯利亚蓼(Polygonum sibiricum Laxm)[15]、柽柳(Tamarix chinensis Lour)16]、秋茄(Kandelia candel (Linn.) Druce)[17]以及玉米(Zea mays L.)等[18]。RD22的氨基酸序列数目大约为375~455[14-18]。其结构主要包括4个区域(表 1):1)N端疏水区;2)简短的保守区域;3)重复序列区域;4)保守的BURP(BNM2、USP、RD22和PG1β)结构域,即C端含有一个由200多个氨基酸组成的保守区域X5-CH-X10-CH-X23-27-CH-X8-W[8, 18]。RD22的N端疏水区序列(前20个左右的氨基酸)因不同物种而存在较大差异,接下来约20个氨基酸序列较保守,其下游一般存在3~5个长度约19个氨基酸的重复序列(T-V-VG-GGV--)[15]。虽然这个重复序列因物种的不同而有所差异,但这7个固定的氨基酸残基可能在维持BURP类蛋白质的结构和功能上起重要作用[19]。
转录因子RD26是植物特异性NAC家族成员,又名ANAC072,编码297个氨基酸,分子质量为32.7 kDa,如表 1所示,其N-末端NAC结构域分别包含一12个氨基酸和一66个氨基酸的预测核定位信号(nuclear localization signals,NLS)序列[20-21]。
拟南芥RD28编码质膜水通道蛋白(aquaporin),最初是在拟南芥中发现的一种脱水胁迫诱导蛋白,其氨基酸序列包含2段高度保守的膜间序列[1]。如表 1所示,该基因编码主要内源性蛋白(major intrinsic protein,MIP)家族成员,其成员在促进小分子在膜上的扩散方面具有一定功能[22]。
RD蛋白保守结构域的预测结果显示,RD20、RD22、RD26和RD28这4个蛋白中不含保守基序,且其他5个RD蛋白的保守基序也存在差异,这可能与RD基因功能的差异性有关。
2 基因功能研究目前对RD基因研究,发现其主要受干旱、高盐以及低温等非生物胁迫的影响;除非生物胁迫,RD基因还受到一些生物胁迫的影响,包括参与植物的免疫、衰老等。
2.1 非生物胁迫 2.1.1 干旱、高盐、低温诱导响应基因9个RD基因中,RD17、RD29A和RD29B受干旱、高盐和低温胁迫诱导,但其表达和信号转导途径不同。有研究发现RD17受ABA和干旱胁迫诱导[7],且对低温胁迫也有一定的响应[6]。随后的研究发现,RD17对类囊体膜具有低温保护作用[23],且能提高植物的抗冻性,推测RD17可能在低温胁迫下作为一种膜稳定剂发挥功能[24]。
Msanne等[25]研究证实低温能够诱导RD29A基因的表达,此外,在干旱和高盐胁迫下,RD29A也受到较强的诱导。其启动子中包含的顺势作用元件,在植物应对干旱、高盐或低温条件时能够调控RD29A的表达,其中一个脱水反应元件dehydration-responsive element(DRE)在RD29A对环境信号的第一次快速响应中起作用[26]。Nakashima等[27]发现,当去除RD29A启动子中的ABA应答元件ABA-responsive element(ABRE)而只保留DRE元件,在干旱、高盐或低温胁迫条件下同样也能诱导RD29A基因的表达,表明这一过程不受ABA的调控。随后进一步发现ABRE结合蛋白acid-responsive element binding 1(AREB1)和AREB2能与RD29A启动子中的ABRE结合,而2个独立的DRE结合蛋白DER-biding 1(DREB1)和DREB2在2种不同的信号转导途径中起着不同作用:DREB1受低温胁迫诱导,而DREB2对干旱和高盐胁迫有响应[28]。此外,DRE在ABA诱导途径中也作为ABRE的偶联因子发挥作用,即DREB蛋白可能与AREB蛋白在RD29A的ABA依赖性基因表达中起协同作用[28]。这表明,RD29A的上游启动子序列中DRE和ABRE元件可以通过分别驱动调控胁迫转录因子DREB1A、DREB2A以及AREB1、AREB2的表达,在植物应对非生物胁迫时发挥重要作用[25]。也有研究将RD29A的启动子与GUS基因融合后转入拟南芥,发现与对照相比,脱水和冷处理后GUS基因在拟南芥的所有器官中表达[9, 26]。
虽然RD29A和RD29B均受到这3种非生物胁迫的诱导,但它们对这些刺激的响应和信号转导途径不同。RD29B启动子的-169到-51区域是诱导该基因脱水表达的调控区,还发现2个ABRE-like序列以及1个MYB(PyAACT/GG)序列[26]。随后的研究发现,在植物脱水条件下这2个ABRE在RD29B的表达中起正调控作用[29]。RD29B基因的表达同样依赖于ABA的诱导,逆境胁迫会促使细胞内ABA含量增加,激活basic leucine zipper(bZIP)转录因子,调控bZIP与ABRE的相互作用,促进RD29B基因的表达[30]。与RD29A基因不同,RD29B主要受干旱和ABA诱导,对低温胁迫响应不明显,且这种低温胁迫不是由ABA本身诱导完成,而是由ABA合成途径中代谢物参与诱导[10, 26]。
RD22是脱水诱导基因RD中的典型成员。最初,RD22是一个在ABA信号通路下受干旱胁迫诱导表达的基因[1]。随着研究的深入,发现RD22是一种多因子诱导型基因,受低温、高盐、干旱等胁迫的诱导表达[15-19]。拟南芥RD22基因侧翼区-207到-141的67 bp区域内包含2个myelocytomatosis(MYC)识别位点和1个myeloblastosis(MYB)识别位点,对位点进行碱基替换,发现第2个MYC位点可能是RD22启动子的负调控因子,而第1个MYC位点和MYB位点在RD22基因的脱水反应表达中都起正调控作用[31]。此外,ABA响应元件(RYACGTGGYR)也与RD22基因参与干旱诱导及ABA应答有关[32]。由此可知,拟南芥RD22的诱导表达是由ABA介导。RD22对ABA依赖性表达需要蛋白质的生物合成[14],其第1个MYC识别位点特异性结合的转录因子RD22BP1能被干旱、高盐和ABA诱导,并能与MYB识别位点结合的AtMYB2基因协同激活RD22基因的转录[33]。目前在除拟南芥的其他植物中有研究报道,将柽柳和秋茄的RD22转入烟草中均提高了烟草的耐盐性[10, 17]。大豆GmRD22的表达在渗透胁迫下能参与植物细胞的防护,并能减少NaCl和PEG处理对转基因拟南芥根系伸长的负面影响,且提高转基因水稻在NaCl和干旱胁迫下的存活率;另外在盐胁迫下,GmRD22转基因植株的木质素含量还会明显高于野生型,推测木质素含量增加,会提高细胞壁对水分的固定,从而提高耐盐胁迫能力[34]。但是研究发现西伯利亚蓼RD22的过表达并没有提高烟草的耐盐碱性[15]。葡萄中3个RD22基因对不同胁迫的耐受性也不尽相同,VvRD22b和VvRD22c基因均受ABA调控,但是在近期的研究中发现VvRD22a不受ABA诱导表达[35]。3个葡萄VvRD22基因在盐处理下均有响应,但表达量不同[36]。这些结果表明RD22基因在不同物种中对非生物胁迫的耐受性存在一定的差异,且在同一物种的多个RD22基因对某些胁迫处理也会表现出不同的耐受性。
2.1.2 同一途径RD20和RD26的胁迫应答同样受ABA信号诱导的2个基因RD20和RD26在应对非生物胁迫时也表现不同。研究发现,在拟南芥RD20的1-kbp 5′侧翼启动子区,存在3个ABRE序列,表明RD20可能受ABA依赖的信号转导途径调控,随后还发现有DRE的存在,所以推测RD20是一种由ABA诱导的干旱胁迫相关基因[11-12, 37]。拟南芥RD20在植株的角果、茎、花和叶中表达,但在根和成熟种子中未检测到[11]。在脱水条件下,RD20基因在花和叶中被强烈诱导[11]。这些结果表明,RD20可能在拟南芥脱水胁迫下的气生组织中发挥作用,特别是在叶片和花中[11]。
Fujita等[20]发现RD26是一个由4个ABREs、1个DRE、2个MYB和1个MYC调节的ABA依赖性表达基因。另外在NaCl处理的ABA突变体中,仍然观察到RD26受诱导显著,意味着存在一种与ABA无关的NaCl信号通路涉及RD26的表达[20]。研究表明干旱、ABA和高盐均可以诱导RD26基因的表达。此外,RD26还对茉莉酸甲酯、H2O2和玫瑰红这类能产生活性氧(reactive oxygen species,ROS)的物质敏感;过表达RD26还诱导许多应激相关基因表达,如对干旱和高盐胁迫有耐受性的RAFL06-15-P15、RAFL05-02-O17、RAFL06-13-E03以及RD20等[20-21]。GUS染色后的组织定位结果发现,RD26启动子在脱水后拟南芥植株的所有营养组织中都有表达[20],ABA处理时,启动子调控GUS不仅在叶片中表达,而且在转基因植株的根中也有较低水平的作用[21]。
2.1.3 非ABA途径响应基因此外,RD相关基因中有3个基因的表达不受ABA信号通路的调控,这3个基因分别是RD19、RD21和RD28。研究发现RD19和RD21受干旱和高盐胁迫诱导后表达量提高,但不受低温、高温和ABA诱导[3]。此外,水通道蛋白能够增加细胞膜的渗透性,拟南芥质膜水通道蛋白RD28的表达可使非洲爪蟾卵母细胞的吸水率提高10~15倍[38]。同样,在盘基网柄菌的营养细胞中过表达RD28,当细胞悬浮在蒸馏水中时,蒸馏水能够快速的被营养细胞吸收[39]。Huang等[40]发现RD28蛋白主要作用在保卫细胞质膜上且与气孔运动有关,在植物受到干旱胁迫时,RD28能够抑制气孔开放,减少水分散失,保护植物正常生长。综上,当植物处于缺水状态时,RD28可以通过增加细胞的吸水能力,或者关闭气孔减少水分输出,进一步缓解植物的缺水状况。
2.2 生物胁迫除非生物胁迫外,有些RD蛋白还受一些生物胁迫诱导。RD20的表达被某些病原体诱导,过表达RD20的植株主要还表现在叶片角质层蜡质组分的改变(含有更多的烷烃和醛)和对病菌(油菜链格孢菌和丁香假单胞菌)的抗性增强[41]。它的主要功能是产生调节氧化状态和细胞死亡的脂蛋白[41]。Bernoux等[42]发现,拟南芥RD19能作为阳性转录因子,同时作为效应器青枯菌Ⅲ型无毒效应子蛋白(Pseudomonas outer protein P2,PopP2)引发青枯菌resistant to ralstonia solanacearum 1-R(RRS1-R)产生抗性的关键宿主因子,从而缓解青枯病对农作物的损害。
CysP家族的成员RD21除参与非生物胁迫外,还参与到植物免疫、衰老等各种生物胁迫中。RD21能够促进细胞死亡,AtSerpin1作为一种拟南芥蛋白酶抑制剂,通过确定控制RD21活性的位点以及限制细胞死亡过程中所引起的损伤,进一步控制RD21的活性,从而阻止RD21的促死亡功能,保护植物正常生长[43-44]。此外,Shindo等发现RD21对坏死营养性病原菌产生免疫[45],另有研究者发现RD21是伏马菌素(fumonisin B1,FB1)诱导细胞死亡的负调控因子[46]。同样地,RD26也被认为在植物的防御和衰老中起关键作用[20]。比如在植物衰老过程中:1)RD26可以直接激活叶绿体囊泡,编码一种对叶绿体蛋白降解至关重要的酪蛋白分解蛋白酶(caseinolytic protease D,ClpD),伴随着RD26在植物衰老时期的过度表达,导致大量酪蛋白损失;相比较而言,RD26敲除突变体中蛋白质的损失较少[47]。2)RD26还直接激活参与赖氨酸分解代谢的赖氨酸酮戊二酸还原酶/酵母氨酸脱氢酶(lys ketoglutaratereductase/saccharopine dehydrogenase,LKR/SDH)以及对植物降解重要的pescadillo 1(PES1)蛋白,通过诱导LKR/SDH表达在植物衰老过程中促进赖氨酸降解和加速植物醇分解代谢,帮助植物在衰老过程中维持线粒体呼吸[47];代谢图谱显示RD26过表达导致γ-氨基丁酸(Gamma aminobutyric acid,GABA)减少,同时相应的分解代谢基因也被诱导,而GABA的降解也有助于维持衰老过程中的线粒体呼吸[47]。3)RD26还能直接参与碳水化合物代谢和增强转运的amylase 1(AMY1)、superfamily protein 1(SFP1)和SWEET15的表达,促进淀粉降解和衰老过程中单糖和双糖的累积[47]。总之,在衰老过程中,RD26通过调控细胞降解层次谱中基因的表达发挥作用[47]。
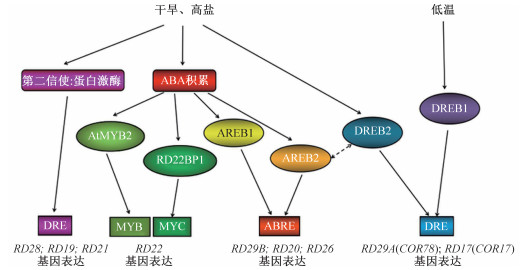
3 展望通过对RD调查研究,发现RD相关基因既具有典型的功能特征,又表现多元化的功能特点,了解RD参与的信号通路,有助于掌握RD基因的功能,我们将其总结如下(图 4)。RD19、RD21和RD28基因受干旱胁迫下非ABA信号通路诱导,它们通过第二信使,如蛋白激酶的作用与脱水响应元件结合,激活基因表达[2],其余6个RD基因均受ABA信号的诱导,其中RD20、RD26和RD29B主要受ABRE元件的调控在ABA通路下发挥作用[20, 29, 37],而RD20和RD26作为转录因子还与DRE元件结合,诱导基因表达[12, 21]。在ABA信号通路下RD22基因比较特殊,在干旱和盐胁迫下MYB与AtMYB2蛋白结合后,同与RD22BP1蛋白质结合的MYC元件共同激活RD22发挥作用[31, 33]。此外,RD17和RD29A基因同属于COR家族,这是由于冷诱导转录因子DREB1与DRE元件结合,使它们对冷胁迫产生一定的耐受性[7, 26];另一个受干旱和盐胁迫诱导的DREB2转录因子与AREB2相互作用,使RD17和RD29A对低温、干旱和盐胁迫均表现出耐受性[25, 27-28]。
|
Download:
|
| 图 4 9个RD基因应对非生物胁迫的表达调控网路 Fig. 4 Gene expression regulation network of 9 RD in response to abiotic stress | |
RD29A启动子作为一种诱导型启动子,在提高作物抗逆性的基因工程研究中起作用。研究基因的功能,是为了更好地利用基因,在分子或生理水平应对人们不同的需求,调控不同植物在抗逆性上更好地发挥其功能。比如:1)目前RD29对非生物胁迫的响应已被用作监测植物胁迫响应途径的分子标记,利用RD29A作为标记基因,用于识别与应激信号转导有关的新分子[48]。Cheong等[49]检测到钙调神经磷酸酶B亚基蛋白(calcineurin B-like 5,CBL5)的过表达能改变胁迫基因的表达(如RD29A,RD29B和Kin1),并证明CBL5可能是植物盐或干旱响应的调节因子。2)RD29A启动子还可以提高植物的抗逆性,并整合了许多应激信号[48]。例如,有研究发现利用RD29A启动子,可以最大限度地减少35 S启动的膨大蛋白基因(Tobacco β-expansion 23,TaEXPB23)这种组成性基因表达的负面影响,还能提高植物的抗旱性[50-51]。利用RD29A启动子具有抗逆性这一特点,可以整合不同基因,丰富基因功能。
过表达RD26能诱导应激相关基因RD20表达[21],但有关2个基因的诱导路径还不清楚,探究2个基因之间的关联对进一步了解RD基因的调控网络有帮助。RD19和RD21均来自CysP家族[3],如图 2所示,同一物种中2个蛋白的相似性高于同一蛋白在不同物种中,进一步研究2个基因在同一物种中的关联,有助于了解CysP家族功能。此外,RD22基因在拟南芥[14]、西伯利亚蓼[15]、柽柳[16]、秋茄[17]以及玉米等[18]多个植物中的功能已经有很多研究,发现在每种植物中该基因对非生物胁迫的耐受性不同,研究更多物种中RD22基因功能有助于分析基因对非生物胁迫耐受性与物种的关系。
RD相关基因研究开展较早,但由于其基因功能较为显著,后期对RD基因的研究较少。但是还有很多RD没有被研究,仍然有很多疑问等待解决。比如RD基因结构和功能之间的关联,亚细胞定位与时空表达的特性等问题,对于是否存在其他诱导路径下的基因表达,以及每个基因之间的关联都需要进一步的研究来证实。
| [1] |
Yamaguchi-shinozaki K, Koizumi M, Urao S, et al. Molecular cloning and characterization of 9 cDNAs for genes that are responsive to desiccation in Arabidopsis thaliana: sequence analysis of one cDNA clone that encodes a putative transmembrane channel protein[J]. Plant and Cell Physiology, 1992, 33(3): 217-224. Doi:10.1093/oxfordjournals.pcp.a078243 |
| [2] |
向旭, 傅家瑞. 脱落酸应答基因的表达调控及其与逆境胁迫的关系[J]. 植物学通报, 1998, 15(3): 11-16. Doi:10.3969/j.issn.1674-3466.1998.03.003 |
| [3] |
Koizumi M, Yamaguchi-Shinozaki K, Tsuji H, et al. Structure and expression of two genes that encode distinct drought-inducible cysteine proteinases in Arabidopsis thaliana[J]. Gene, 1993, 129(2): 175-182. Doi:10.1016/0378-1119(93)90266-6 |
| [4] |
Andeme Ondzighi C, Christopher D A, Cho E J, et al. Arabidopsis protein disulfide isomerase-5 inhibits Cysteine proteases during trafficking to vacuoles before programmed cell death of the endothelium in developing seeds[J]. Plant Cell, 2008, 20(8): 2205-2220. Doi:10.1105/tpc.108.058339 |
| [5] |
Yamada K, Matsushima R, Nishimura M, et al. A slow maturation of a Cysteine protease with a granulin domain in the vacuoles of senescing Arabidopsis leaves[J]. Plant Physiology, 2001, 127(4): 1626-1634. Doi:10.1104/pp.010551 |
| [6] |
Nylander M, Svensson J, Palva E T, et al. Stress-induced accumulation and tissue-specific localization of dehydrins in Arabidopsis thaliana[J]. Plant Molecular Biology, 2001, 45(3): 263-279. Doi:10.1023/a:1006469128280 |
| [7] |
Gilmour S J, Artus N N, Thomashow M F. cDNA sequence analysis and expression of two cold-regulated genes of Arabidopsis thaliana[J]. Plant Molecular Biology, 1992, 18(1): 13-21. Doi:10.1007/BF00018452 |
| [8] |
Yamaguchi-Shinozaki K, Shinozaki K. Characterization of the expression of a desiccation-responsive rd29 gene of Arabidopsis thaliana and analysis of its promoter in transgenic plants[J]. Molecilar and General Genetics, 1993, 236(2/3): 331-340. Doi:10.1007/BF00277130 |
| [9] |
Horvath D P, McLarney B K, Thomashow M F. Thomashow M F. Regulation of Arabidopsis thaliana L. (Heyn) cor78 in response to low temperature[J]. Plant Physiology, 1993, 103(4): 1047-1053. Doi:10.1104/pp.103.4.1047 |
| [10] |
Nordin K, Vahala T, Palva E T. Differential expression of two related, low-temperature-induced genes in Arabidopsis thaliana (L.) Heynh[J]. Plant Molecular Biology, 1993, 21: 641-653. Doi:10.1007/BF00014547 |
| [11] |
Takahashi S, Katagiri T, Yamaguchi-Shinozaki K, et al. An Arabidopsis gene encoding a Ca2+-binding protein is induced by abscisic acid during dehydration[J]. Plant and Cell Physiology, 2000, 41(7): 898-903. Doi:10.1093/pcp/pcd010 |
| [12] |
Aubert Y, Vile D, Pervent M, et al. RD20, a stress-inducible caleosin, participates in stomatal control, transpiration and drought tolerance in Arabidopsis thaliana[J]. Plant and Cell Physiology, 2010, 51(12): 1975-1987. Doi:10.1093/pcp/pcq155 |
| [13] |
Poxleitner M, Rogers S W, Lacey Samuels A L, et al. A role for caleosin in degradation of oil-body storage lipid during seed germination[J]. The Plant Journal, 2006, 47(6): 917-933. Doi:10.1111/j.1365-313X.2006.02845.x |
| [14] |
Yamaguchi-Shinozaki K, Shinozaki K. The plant hormone abscisic acid mediates the drought-induced expression but not the seed-specific expression of rd22, a gene responsive to dehydration stress in Arabidopsis thaliana[J]. Molecular and General Genetics, 1993, 238(1/2): 17-25. Doi:10.1007/BF00279525 |
| [15] |
郑磊. 西伯利亚蓼(Polygonum sibiricum) rd22基因的克隆、表达与功能验证[D]. 哈尔滨: 东北林业大学, 2007.
|
| [16] |
李慧玉, 林士杰, 王珊, 等. 柽柳rd22基因的序列分析及耐盐性研究[J]. 西北农林科技大学学报(自然科学版), 2010, 38(6): 95-101. Doi:10.13207/j.cnki.jnwafu.2010.06.022 |
| [17] |
黄旭新, 侯佩臣, 丁明全, 等. 秋茄KcRD22基因的克隆与功能分析[J]. 基因组学与应用生物学, 2011, 30(4): 273-280. Doi:10.3969/j.issn.1674-568X.2011.04.003 |
| [18] |
Phillips K, Ludidi N. Drought and exogenous abscisic acid alter hydrogen peroxide accumulation and differentially regulate the expression of two maize RD22-like genes[J]. Scientific Reports, 2017, 7(1): 8821. Doi:10.1038/s41598-017-08976-x |
| [19] |
郑磊, 刘关君, 杨传平. 西伯利亚蓼rd22基因的克隆与序列分析[J]. 植物研究, 2007, 27(2): 212-217. Doi:10.3969/j.issn.1673-5102.2007.02.019 |
| [20] |
Fujita M, Fujita Y, Maruyama K, et al. A dehydration-induced NAC protein, RD26, is involved in a novel ABA-dependent stress-signaling pathway[J]. The Plant Journal, 2004, 39(6): 863-876. Doi:10.1111/j.1365-313X.2004.02171.x |
| [21] |
Tran L S P, Nakashima K, Sakuma Y, et al. Isolation and functional analysis of Arabidopsis stress-inducible NAC transcription factors that bind to a drought-responsive cis-element in the early responsive to dehydration stress 1 promoter[J]. The Plant Cell, 2004, 16(9): 2481-2498. Doi:10.1105/tpc.104.022699 |
| [22] |
Reizer J, Reizer A, Saier M H. The MIP family of integral membrane channel proteins: sequence comparisons, evolutionary relationships, reconstructed pathway of evolution, and proposed functional differentiation of the two repeated halves of the proteins[J]. Critical Reviews in Biochemistry and Molecular Biology, 1993, 28(3): 235-257. Doi:10.3109/10409239309086796 |
| [23] |
Bozovic V, Svensson J, Schmitt J, et al. Dehydrins (LTI29, LTI30, and COR47) from Arabidopsis thaliana expressed in escherichia coli protect thylakoid membranes during freezing[J]. Journal of the Serbian Chemical Society, 2013, 78(8): 1149-1160. Doi:10.2298/JSC121127017B |
| [24] |
Puhakainen T, Hess M W, Mäkelä P, et al. Overexpression of multiple dehydrin genes enhances tolerance to freezing stress in Arabidopsis[J]. Plant Molecular Biology, 2004, 54(5): 743-753. Doi:10.1023/B.PLAN.0000040903.66496.a4 |
| [25] |
Msanne J, Lin J S, Stone J M, et al. Characterization of abiotic stress-responsive Arabidopsis thaliana RD29A and RD29B genes and evaluation of transgenes[J]. Planta, 2011, 234(1): 97-107. Doi:10.1007/s00425-011-1387-y |
| [26] |
Yamaguchi-Shinozaki K, Shinozaki K. A novel cis-acting element in an Arabidopsis gene is involved in responsiveness to drought, low-temperature, or high-salt stress[J]. The Plant Cell, 1994, 6(2): 251-264. Doi:10.1105/tpc.6.2.251 |
| [27] |
Nakashima K, Shinwari Z K, Sakuma Y, et al. Organization and expression of two Arabidopsis DREB2 genes encoding DRE-binding proteins involved in dehydration and high-salinity-responsive gene expression[J]. Plant Molecular Biology, 2000, 42(4): 657-665. Doi:10.1023/a:1006321900483 |
| [28] |
Narusaka Y, Nakashima K, Shinwari Z K, et al. Interaction between two cis-acting elements, ABRE and DRE, in ABA-dependent expression of Arabidopsis rd29A gene in response to dehydration and high-salinity stresses[J]. The Plant Journal, 2003, 34(2): 137-148. Doi:10.1046/j.1365-313X.2003.01708.x |
| [29] |
Uno Y, Furihata T, Abe H, et al. Arabidopsis basic leucine zipper transcription factors involved in an abscisic acid-dependent signal transduction pathway under drought and high-salinity conditions[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(21): 11632-11637. Doi:10.1073/pnas.190309197 |
| [30] |
Choi H I, Hong J H, Ha J O, et al. ABFs, a family of ABA-responsive element binding factors[J]. Journal of Biological Chemistry, 2000, 275(3): 1723-1730. Doi:10.1074/jbc.275.3.1723 |
| [31] |
Abe H, Yamaguchi-Shinozaki K, Urao T, et al. Role of Arabidopsis MYC and MYB homologs in drought and abscisic acid-regulated gene expression[J]. The Plant Cell, 1997, 9(10): 1859-1868. Doi:10.1105/tpc.9.10.1859 |
| [32] |
Iwasaki T, Yamaguchi-Shinozaki K, Shinozaki K. Identification of a cis-regulatory region of a gene in Arabidopsis thaliana whose induction by dehydration is mediated by abscisic acid and requires protein synthesis[J]. Molecular and General Genetics, 1995, 247(4): 391-398. Doi:10.1007/BF00293139 |
| [33] |
Urao T, Yamaguchi-Shinozaki K, Urao S, et al. An Arabidopsis myb homolog is induced by dehydration stress and its gene product binds to the conserved MYB recognition sequence[J]. The Plant Cell, 1993, 5(11): 1529-1539. Doi:10.1105/tpc.5.11.1529 |
| [34] |
Wang H M, Zhou L, Fu Y P, et al. Expression of an apoplast-localized BURP-domain protein from soybean (GmRD22) enhances tolerance towards abiotic stress[J]. Plant, Cell & Environment, 2012, 35(11): 1932-1947. Doi:10.1111/j.1365-3040.2012.02526.x |
| [35] |
Hanana M, Deluc L, Fouquet R, et al. Identification et caractérisation d'un gène de réponse à la déshydratation rd22 chez la vigne (Vitis vinifera L.)[J]. Comptes Rendus Biologies, 2008, 331: 569-578. Doi:10.1016/j.crvi.2008.05.002 |
| [36] |
Matus J T, Aquea F, Espinoza C, et al. Inspection of the grapevine BURP superfamily highlights an expansion of RD22 genes with distinctive expression features in berry development and ABA-mediated stress responses[J]. PLoS One, 2014, 9(10): e110372. Doi:10.1371/journal.pone.0110372 |
| [37] |
Aubert Y, Leba L J, Cheval C, et al. Involvement of RD20, a member of caleosin family, in ABA-mediated regulation of germination in Arabidopsis thaliana[J]. Plant Signaling & Behavior, 2011, 6(4): 538-540. Doi:10.4161/psb.6.4.14836 |
| [38] |
Daniels M J, Mirkov T E, Chrispeels M J. The plasma membrane of Arabidopsis thaliana contains a mercury-insensitive aquaporin that is a homolog of the tonoplast water channel protein TIP[J]. Plant Physiology, 1994, 106(4): 1325-1333. Doi:10.1104/pp.106.4.1325 |
| [39] |
Chaumont F, Loomis W F, Chrispeels M J. Expression of an Arabidopsis plasma membrane aquaporin in Dictyostelium results in hypoosmotic sensitivity and developmental abnormalities[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(12): 6202-6209. Doi:10.1073/pnas.94.12.6202 |
| [40] |
Huang R F, Zhu M J, Kang Y, et al. Identification of plasma membrane aquaporin in guard cells of Vicia faba and its role in stomatal movement[J]. Acta Botanica Sinica, 2002, 44(1): 42-48. |
| [41] |
Hanano A, Bessoule J J, Heitz T, et al. Involvement of the caleosin/peroxygenase RD20 in the control of cell death during Arabidopsis responses to pathogens[J]. Plant Signaling & Behavior, 2015, 10(4): e991574. Doi:10.4161/15592324.2014.991574 |
| [42] |
Bernoux M, Timmers T, Jauneau A, et al. RD19, an Arabidopsis cysteine protease required for RRS1-R-mediated resistance, is relocalized to the nucleus by the ralstonia solanacearum PopP2 effector[J]. The Plant Cell, 2008, 20(8): 2252-2264. Doi:10.1105/tpc.108.058685 |
| [43] |
Lampl N, Alkan N, Davydov O, et al. Set-point control of RD21 protease activity by AtSerpin1 controls cell death in Arabidopsis[J]. The Plant Journal, 2013, 74(3): 498-510. Doi:10.1111/tpj.12141 |
| [44] |
Lampl N, Budai-Hadrian O, Davydov O, et al. Arabidopsis AtSerpin1, crystal structure and in Vivo interaction with its target protease RESPONSIVE TO DESICCATION-21 (RD21)[J]. Journal of Biological Chemistry, 2010, 285(18): 13550-13560. Doi:10.1074/jbc.M109.095075 |
| [45] |
Shindo T, Misas-Villamil J C, Hörger A C, et al. A role in immunity for Arabidopsis cysteine protease RD21, the ortholog of the tomato immune protease C14[J]. PLoS One, 2012, 7(1): e29317. Doi:10.1371/journal.pone.0029317 |
| [46] |
Ormancey M, Thuleau P, van der Hoorn R A L, et al. Sphingolipid-induced cell death in Arabidopsis is negatively regulated by the papain-like cysteine protease RD21[J]. Plant Science, 2019, 280: 12-17. Doi:10.1016/j.plantsci.2018.10.028 |
| [47] |
Kamranfar I, Xue G P, Tohge T, et al. Transcription factor RD26 is a key regulator of metabolic reprogramming during dark-induced senescence[J]. New Phytologist, 2018, 218(4): 1543-1557. Doi:10.1111/nph.15127 |
| [48] |
Jia H Y, Zhang S J, Ruan M Y, et al. Analysis and application of RD29 genes in abiotic stress response[J]. Acta Physiologiae Plantarum, 2012, 34(4): 1239-1250. Doi:10.1007/s11738-012-0969-z |
| [49] |
Cheong Y H, Sung S J, Kim B G, et al. Constitutive overexpression of the calcium sensor CBL5 confers osmotic or drought stress tolerance in Arabidopsis[J]. Molecules and Cells, 2010, 29(2): 159-165. Doi:10.1007/s10059-010-0025-z |
| [50] |
Li F, Han Y Y, Feng Y N, et al. Expression of wheat expansin driven by the RD29 promoter in tobacco confers water-stress tolerance without impacting growth and development[J]. Journal of Biotechnology, 2013, 163(3): 281-291. Doi:10.1016/j.jbiotec.2012.11.008 |
| [51] |
柳娜, 杨文雄, 王世红, 等. 拟南芥rd29A启动子在不同胁迫下GUS活性分析[J]. 甘肃农业科技, 2019(5): 44-50. Doi:10.3969/j.issn.1001-1463.2019.05.010 |
 2022, Vol. 39
2022, Vol. 39 










