工业氮肥解决了世界的粮食问题,但是过量施用化肥造成了负面的环境影响[1]。生物固氮作为自然生态系统中氮的主要来源,在氮循环中起着极其重要的作用。研究生物固氮的传统方法主要有差值法、乙炔还原法和氮素平衡法等,由于自然环境中植物种间固氮能力存在差异,根瘤菌固氮能力存在时空变化,以及方法本身存在精度有限,难以在野外原位持续应用、且操作不便等原因,这些方法的应用范围受到很大限制,尤其是在研究多年生植物和木本植物的生物固氮量方面[2]。因此,借助固氮植物和非固氮参考植物氮源不同而形成的植物15N丰度差异来测定生物固氮量,已逐渐成为应用范围较广的定量研究手段。其中,自然丰度法利用的是固氮植物和非固氮植物种间15N丰度的自然差异,同位素稀释法利用的是施加15N标记物之后固氮植物与非固氮植物之间15N丰度的差异。
同位素稀释法灵敏度高、准确度高、可靠性强,能够区分植物氮素来源、选育高固氮能力的品种、确定固氮细菌,缺点是需要施加昂贵的15N标记物,测定手段繁琐,易受大气和土壤中15N的干扰[3]。同位素稀释法在应用中标记后的取样各不相同。Hong等[4]研究紫花针茅(Stipa purpurea)、矮火绒草(Leontopodium nanum)、青藏苔草(Carex moorcroftii)种间氮偏好差异时为标记后48h取样;Xu等[5]为了防止甘氨酸在土壤中快速周转,标记后3h取样;Schleuss等[6]研究高寒嵩草草甸氮素吸收情况时取样间隔为45d。不同标记时长对固氮量计算是否有影响需要进一步研究。自然丰度法与差减法、乙炔还原法相比有许多优点,其中不可替代的一点是可用于多年生固氮植物固氮能力的评估[2]。15N自然丰度法不需要收集根瘤,不干扰土壤生态系统或野外植物,不需要使用昂贵的15N标记物,只需采集植物的少量器官测定15N丰度,即可估计研究对象在整个生长季内的固氮总量,适合于筛选高效固氮植物和野生固氮资源调查[3]。其缺点是同位素分馏效应导致固氮植物不同部位的δ15N值彼此各不相同,取样部位会影响到生物固氮的估算结果。计算必需的B值(氮素完全来源于固氮时植物15N丰度)对于固氮百分率的计算也有很大的影响,且微量15N很难准确测量。
作为生物固氮测量方法,自然丰度法和同位素稀释法各有其优缺点,没有哪一种有明显的优势。Carranca等[7]在葡萄牙南部的草原中通过同位素稀释法、自然丰度法和氮差值法对三叶草固氮情况进行评价,结果显示自然丰度法与同位素稀释法估算的固氮量相似,氮差值法低估了固氮量。对于同位素稀释法和自然丰度法来说,参考植物的选择会强烈影响到计算结果[8]。Yang等[9]发现将禾本科从参考植物中剔除会使高寒草甸固氮量计算结果从9.1kg·ha-1·a-1增加到10kg·ha-1·a-1。生物固氮百分率(%Ndfa)指固氮植物通过生物固氮获取的N素占植株N素总量的比例(%Ndfa)[10],Arnone[11]用菊科植物雷公藤(Leontodon helveticus Mérat)作为高山三叶草(Trifolium alpinum L.)唯一参考植物时计算出的%Ndfa为61%,而用苔草(Carex curvula All.)作为参考植物时,受苔草根际固氮菌的影响,计算得到的高山三叶草的%Ndfa为85%。为了解决参考植物选择的问题,有学者提出基于几种参考植物平均值的计算方法[11]。
青藏高原土壤总氮含量较高,但有效氮匮乏,且氮输入远小于输出,属于氮限制的生态系统,生物固氮很可能是其最主要的氮素来源[12]。Jacot等[13]对阿尔卑斯山不同海拔豆科牧草进行的研究表明随着海拔高度增加,豆科植物对生态系统氮输入的作用越加凸显,但是豆科植物生物量占比降低。代冬雪等[14]却发现西藏纳木错高寒草原(海拔4730m)有豆科植物大面积集中分布的区域,同位素标记后30d取样测得豆科优势植物群落(豆科植物生物量占比30%以上)固氮量约为1.38g·m-2。Yang等[9]在豆科占比更低(豆科覆盖率11%,地上生物量占比15.7%)的青海高寒草甸(海拔3215m)采用同样的方法估算得到了更高的草地生态系统生物固氮量,达8~24g·m-2。因此豆科植物在高海拔地区的分布及其生物固氮的贡献率仍然需要进一步明确。目前在青藏高原相关研究极少。本研究以青藏高原高寒草原团垫黄芪(Astragalus arnoldii)为材料,研究不同参考植物、不同计算方法、不同取样时间和标记后取样间隔时长对生物固氮百分率(%Ndfa)计算结果的影响,对于评估不同测量方法间的差异和了解高寒草地生态系统生物固氮都具有极为重要的意义。
1 材料与方法 1.1 研究区概况研究区位于西藏自治区班戈县,属高原亚寒带季风半干旱气候,土壤类型为高山草原土(寒冷钙土)[15]。研究区是以紫花针茅为建群种的典型高寒草原,伴有矮火绒草,主要物种有中亚早熟禾(Poa litwinowiana)、高山嵩草(Kobresia pygmaea)、青藏苔草等。试验选取研究区内6个地点(编号1~6)采样,所选地点均有共同的优势豆科植物团垫黄芪,以紫花针茅为伴生种的形式均匀分布。采用大小为50cm×50cm的16个样方的调查结果显示团垫黄芪、紫花针茅、中亚早熟禾、高山嵩草、青藏苔草、矮火绒草相对重要值较高(相对高度+相对生物量+相对密度)。基于兼顾较多植物类型的原则,在同属于禾本科的紫花针茅和中亚早熟禾中选择紫花针茅,与高山嵩草、青藏苔草、矮火绒草一起作为参考植物。样地1和样地2海拔4700m,年均降水326.5mm,年均温-0.678℃;样地3和样地4海拔4650m,年均降水370.0mm,年均温0.005℃;样地5和样地6海拔4640m,年均降水396.3mm,年均温-0.045℃。样地土壤基本理化性质如表 1所示:用土钻取0~15cm深度土壤,风干后由球磨仪粉碎再过筛(2mm),用元素分析仪测定土壤全碳和全氮含量,每个地点的采样重复数为4。
|
|
表 1 研究区概况 Table 1 Overview of the study area |
1) 同位素稀释法:于2019年7月24日利用喷洒法模拟自然降雨进行15N标记,各样地内随机设置4组样方(1m×1m),每组1对,分别为标记和未标记,样方与样方之间至少有2m的缓冲带。标记样方中均匀地施加(15NH4)2SO4(15N丰度为99.9%)溶液,标记的施肥量相当于0.3g15N·m-2,远小于土壤中有效氮的含量,不会影响土壤过程或刺激植物生长。为了避免15N同位素被叶片吸收,示踪后立即用一定量超纯水将植物叶片冲洗干净,用水量相当于2mm降水。未标记样方施加等量的超纯水作为空白对照。分别在示踪1d和30d后,在标记范围内采集团垫黄芪和参考植物(紫花针茅、苔草、矮火绒草、高山嵩草)全株,洗净后放入信封,75℃烘干。用混合球磨仪(MM400,Retsh)磨成粉末(粒径约为5μm),采用MAT253稳定同位素质谱仪(Finnigan MAT,Bremen,Germany)测定δ15N和atom%15N。
2) 自然丰度法:分别于2019年7月25日,2019年8月24日挖取同位素稀释法空白对照样方内的团垫黄芪和4种参考植物,同上处理和测定。
1.3 生物固氮百分率的计算方法生物固氮百分率(%Ndfa)可以用自然丰度法(同位素组成法[16]和自然原子百分超法[10])和同位素稀释法(标记原子百分超法[17]和标记原子百分差法[9])计算获得。为了探究参考植物的选择对计算结果的影响,本研究分别以紫花针茅、苔草、矮火绒草、高山嵩草及其平均值(4种参考植物δ15N、atom%15N的平均值)作为参考值带入计算。
同位素组成法(Ⅰ):
| $ \% {\rm{Ndfa}} = \frac{{100({\delta ^{15}}{{\rm{N}}_{{\rm{reference}}}} - {\delta ^{15}}{{\rm{N}}_{{\rm{legume}}}})}}{{({\delta ^{15}}{{\rm{N}}_{{\rm{reference}}}} - B)}}, $ | (1) |
其中:δ15Nreference为参考植物的15N丰度,δ15Nlegume为团垫黄芪的15N丰度。B为生长于无氮培养基质上的固氮植物15N丰度,即只依赖大气时植物的15N自然丰度,一般将其视为0,本研究也视其为0。
自然原子百分超法(Ⅱ):
| $ \% {\rm{Ndfa}} = \left( {1 - \frac{{{\rm{exces}}{{\rm{s}}^{15}}{\rm{N}}{\% _{{\rm{legume}}}}}}{{{\rm{exces}}{{\rm{s}}^{15}}{\rm{N}}{\% _{{\rm{reference}}}}}}} \right) \times 100, $ | (2) |
其中:excess15N%是指植物的15N原子百分比减去0.3663%(大气15N原子百分比,被视为一个常数)。
标记原子百分超法(Ⅲ):
| $ \% {\rm{Ndfa}} = \left( {1 - \frac{{{\rm{exces}}{{\rm{s}}^{15}}{\rm{N}}{\% _{{\rm{legume}}}}}}{{{\rm{exces}}{{\rm{s}}^{15}}{\rm{N}}{\% _{{\rm{reference}}}}}}} \right) \times 100, $ | (3) |
式(3)与式(2)完全一样,只是植物材料来源不同。
标记原子百分差法(Ⅳ):
| $ \% {\rm{Ndfa}} = \left( {1 - \frac{{{\rm{AP}}{{\rm{E}}_{{\rm{legume}}}}}}{{{\rm{AP}}{{\rm{E}}_{{\rm{reference}}}}}}} \right) \times 100, $ | (4) |
其中:APE是指在标记和未标记2种情况下同种植物15N原子百分比差。
1.4 统计分析采用单因素方差分析与Tamhane’s T2多重比较分析不同处理下种间及种内δ15N、atom%15N的差异;双因素方差分析法检验参考植物、计算方法及其相互作用对生物固氮百分率的影响(此时取样时间均为7月25日);多因素方差分析参考植物、计算方法、取样时间及其交互作用对自然丰度法的影响以及参考植物、计算方法、标记时长及其交互作用对同位素稀释法的影响。不同处理下的多重比较%Ndfa均为Duncan’s test。所有图表中的数据均表示为均值±标准误(mean±SE)。所有统计分析均在SPSS 21.0中进行,显著性水平为0.05,绘图软件为SigmaPlot 12.5。
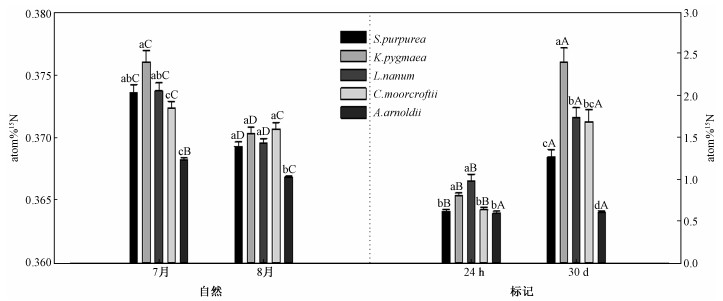
2 结果 2.1 标记与未标记处理下植物的atom%15N自然生长状态下,与7月相比,8月几种参考植物的atom%15N均显著降低(P < 0.05),然而团垫黄芪在施加同位素标记30d后的atom%15N与标记24h后的数值相比无明显差异。自然状态下,不同取样时间下几种参考植物物种间atom%15N间均无明显差异。标记状态下,标记24h后高山嵩草和矮火绒草atom%15N显著高于紫花针茅和青藏苔草(P < 0.05);标记30d后,高山嵩草atom%15N显著高于其他3种参考植物(P < 0.05)(图 1)。
|
Download:
|
| 大写字母表示同种植物在2个处理2个时间的多重比较, 小写字母是同一样地同一时间5种植物的多重比较 图 1 标记与未标记处理下2次取样时间5种植物的atom%15N Fig. 1 Values of atom%15N in two sampling times in labeling and un-labeling treatments | |
参考植物与计算方法都分别显著影响团垫黄芪%Ndfa的估算结果,但参考植物与计算方法之间不存在交互效应(F=0.905,P>0.05)(表 2)。自然丰度法计算的%Ndfa显著高于同位素稀释法(P < 0.01)(图 2)。
|
|
表 2 参考植物、计算方法对%Ndfa影响的方差分析 Table 2 ANOVA test of the influence of reference plants and calculation methods on %Ndfa |

|
Download:
|
| 图 2 不同方法计算的团垫黄芪生物固氮百分率 Fig. 2 %Ndfa of A. arnoldii calculated by different methods | |
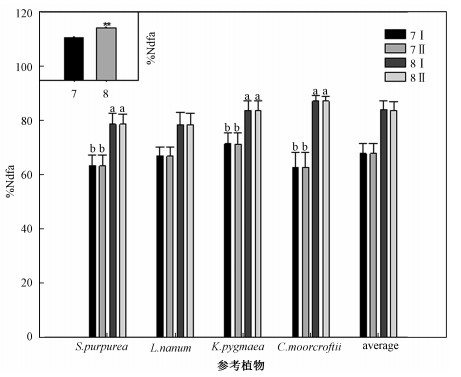
对自然丰度法而言,参考植物无显著影响,2种算法的计算结果间也无显著差异(表 3),但是不同取样时间测定的结果差异极显著(F=89.906,P < 0.01)。8月计算的%Ndfa显著高于7月(P < 0.01)(图 3)。以矮火绒草或4种植物的平均值为参考时,7月份和8月份取样测定的%Ndfa均无显著差异,其他3种参考植物8月计算得到的%Ndfa均显著高于7月(P < 0.05)。
|
|
表 3 参考植物、计算方法、取样时间对自然丰度法计算结果影响的方差分析 Table 3 ANOVA test of the effects of reference plants, calculation method, and sampling times on %Ndfa by natural abundance technique |
|
Download:
|
| 7Ⅰ 和 7Ⅱ :7 月取样,分别用式(1)和式(2)计算;8Ⅰ 和 8Ⅱ :8 月取样,分别用式(1)和式(2)计算 图 3 参考植物、计算方法、取样时间对自然丰度法估测%Ndfa的影响 Fig. 3 Comparison of %Ndfa values measured by natural abundance technique under different reference plants, calculation methods, and sampling times | |
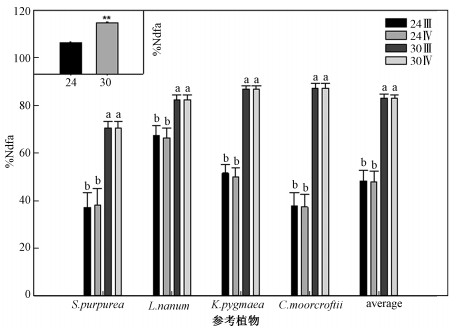
采用同位素稀释法测定时,2种计算方法之间没有显著差异,而参考植物(F=17.982,P < 0.01)、标记后采样时间(F=496.712,P < 0.01)对团垫黄芪%Ndfa估算值都有显著影响,且两者之间存在显著的交互效应(F=13.252,P < 0.01)(表 4)。标记后24h时采样时,以矮火绒草为参考植物计算的团垫黄芪%Ndfa显著高于其他3个物种及4个物种的平均值。几种参考植物的计算结果均表明标记后30d采样的%Ndfa估测值显著高于标记后24h采样的估测值(图 4)。
|
|
表 4 参考植物、计算方法、标记后采样时间对同位素稀释法计算结果影响的方差分析 Table 4 ANOVA test of the effects of reference plants, calculation method, and sampling time after labeling on %Ndfa by isotope dilution technique |
|
Download:
|
| 24Ⅲ 和 24Ⅳ :标记 24 h 后采样,分别用式(3)和式(4)计算;30Ⅲ 和 30Ⅳ :标记 30 d 后采样,分别用式(3)和式(4)计算 图 4 参考植物、计算方法、标记后采样时间对同位素稀释法估测%Ndfa的影响 Fig. 4 Comparison of %Ndfa values measured by isotope dilution technique under different reference plants, calculation methods, and sampling times after labeling | |
青藏高原地区的初级生产力受氮素限制[18]。鉴于该区域氮沉降量较低,作为典型的自然生态系统,青藏高原高寒草地氮素的最主要来源很可能是生物固氮[19]。Bowman等[20]研究表明高海拔研究区(3650m a.s.l)三叶草生物固氮百分率(%Ndfa)为70%~90%;Jacot等[21]研究显示9种不同的豆科植物在瑞士阿尔卑斯山900~2600m海拔内%Ndfa为59%~90%。Yang等[9]研究显示高寒嵩草草甸和温带羊茅草原豆科植物%Ndfa范围为50%~90%。本研究估测团垫黄芪的%Ndfa值在50%~87%,与上述结果类似。
参考植物选择是影响生物固氮能力估算的重要因素,直接影响生物固氮测定的准确性[8],选择不当会造成很大的测定偏差,但完全满足假设条件的参考植物基本上不存在。为了减少由参考植物选择引起的测定偏差,一般选择多个植物物种作为参考植物[22]。本研究在中自然状态下,紫花针茅、高山嵩草、矮火绒草、青藏苔草4种植物种间atom%15N均无明显差异。从7月下旬(生长旺盛期)到8月下旬(生长晚期),4种植物体内的15N自然丰度均降低,这可能与植物自身氮生理代谢过程有关。罗绪强等[23]研究结果表明烟管荚蒾叶片的δ15N变化趋势也为生长晚期(9月)<生长旺盛期(7月)<生长停滞期(12月)。从生长初期(4月)到生长旺盛期(7月),植物体内的细胞生长比较活跃,各种生理活动加强,氨基酸和蛋白质的大量合成导致氮素营养相对缺乏,最终导致氮素吸收过程中对15N的识别和排斥降低[24],从而使δ15N和atom%15N升高。从生长旺盛期(7月)到生长晚期(9月),植物发育趋于成熟,内部生理代谢功能也趋于完备,具备了较完善的生理生化反应调控机制,能有效地识别与排斥15N[23],导致体内atom%15N降低。团垫黄芪的15N丰度降低率高于参考植物,导致8月份自然丰度法测得的生物固氮百分比高于7月份。
施加同位素后参考植物的atom%15N显著增加,且8月下旬比7月下旬高,与自然状态下的变化趋势不一致。这可能是因为植物未能在1天内把施入土壤中的(15NH4)2SO4完全吸收,在7月份取样后继续吸收的缘故。标记状态下团垫黄芪atom%15N在不同取样时间(7月和8月)均低于参考植物,且无明显波动,这也说明团垫黄芪主要靠生物固氮来满足自身的N素需求。因此,同位素稀释法7月测得的%Ndfa均高于8月测得数值。土壤氮库中的15N丰度通常高于大气N2的15N丰度,因此主要依靠从土壤中吸收氮素的参考植物15N丰度比固氮植物大,豆科植物可以从大气获得氮素,降低15N丰度。自然丰度法和同位素稀释法正是利用固氮植物和非固氮植物15N丰度差异估计生物固氮。
自然丰度法下参考植物物种选择对%Ndfa估算的影响不显著,但同位素稀释法下不同参考植物计算的%Ndfa间差异显著,这与Lonati等[8]研究结果一致。Yang等[9]就曾指出参考植物的选择会显著影响同位素稀释法在高海拔自然草原对生物固氮的估算结果。Chalk和Ladha[25]计算低海拔地区一年生豆科作物生物固氮时也表明不同参考植物对计算结果影响显著。而本研究的结果显示,自然丰度法不易受到参考植物的影响,与此相反,同位素稀释法受参考植物影响较大。这与不同参考植物物种生理活动有关,尤其是氮吸收率和氮利用效率。与其他几种参考植物相比,施用标记的氮素后,矮火绒草体内15N丰度增加量最高,导致以其为参考植物时计算的%Ndfa显著高于以其他植物为参考的情形。莎草科植物(Cyperaceae)因为有根际固氮菌的存在,其δ15N和对标记氮的吸收量都较低,甚至接近豆科植物[11]。一般不将苔草属植物作为生物固氮能力估测的参考植物,否则会降低生物固氮百分率的估算值。在本研究中,以青藏苔草为参考植物时,7月下旬自然丰度法和同位素稀释法计算的%Ndfa值均最小;但是在8月下旬计算的%Ndfa值均较高。因此,参考植物会受到取样时间的影响,进而影响自然丰度法和同位素稀释法计算结果。除了参考植物选择带来的影响外,施加的15N标记物还有可能会被土壤微生物群落快速转化[26]。因此,运用同位素稀释法时要考虑多种影响因素。
对自然丰度法而言,B值的影响不容忽视。Carranca等[7]的研究结果显示当B值为0‰时,自然丰度法计算的%Ndfa为80.6%,高于同位素稀释法计算的45.9%;但当将B值修正为-1.13‰时,自然丰度法的计算值降为48.8%,与同位素稀释法无显著差异(P>0.05)。本研究设定B值为0‰,结果显示自然丰度法计算结果显著高于同位素稀释法(P < 0.05)。无氮培养基上培养的固氮植物会因为生物固氮过程中的同位素分馏效应导致体内δ15N与大气不一致(0‰,atom%15N为0.3663)。B值因取样部位而异,以植物地上部分为样品计算时B值一般为负值,而根系为样品时一般为正值[27]。Burchill等[28]修正B值后也表明同位素稀释法与自然丰度法计算结果无明显差异。HØgh-Jensen和Schjoerring[29]在丹麦调查混生白三叶草和红三叶草%Ndfa时,自然丰度法计算结果(57%)却低于同位素稀释法(85%)。这可能也与B值有关,前者B值分别为-1.39‰、-1.44‰、-1.17‰、-1.79‰、0‰;后者B值为1.20‰。
4 结论采用同位素方法估算青藏高原生物固氮情况时要综合考虑参考植物、计算方法、取样时间、标记时长的影响。总体上同位素稀释法和自然丰度法都可以用来评估高寒草原豆科植物生物固氮情况。自然丰度法不需要使用较昂贵的15N标记物,不破坏研究对象生长的生态环境,可重复采取少量植物器官测定15N含量即可估测其固氮状况。本研究发现在自然情况下,植物体内15N丰度在8月比7月低;但是施加同位素之后变成8月比7月高,这种种内差异显然与植物发育规律不一致。结合经济的角度,自然丰度法比同位素稀释法更可取。
综上,自然丰度法更适合于野外固氮资源调查的研究。本研究聚焦计算方法的比较,未考虑土壤理化性质及种间关系对生物固氮的影响,未来需要研究土壤Mo、Fe、V等元素对豆科固氮的影响。
| [1] |
Vicente E J, Dean D R. Keeping the nitrogen-fixation dream alive[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(12): 3009-3011. Doi:10.1073/pnas.1701560114 |
| [2] |
何道文, 孙辉, 黄雪菊. 利用N-15自然丰度法研究固氮植物生物固氮量[J]. 干旱地区农业研究, 2004, 22(1): 132-137. Doi:10.3321/j.issn:1000-7601.2004.01.030 |
| [3] |
陈朝勋, 席琳乔, 姚拓, 等. 生物固氮测定方法研究进展[J]. 草原与草坪, 2005, 25(2): 24-26. Doi:10.3969/j.issn.1009-5500.2005.02.006 |
| [4] |
Hong J T, Ma X X, Zhang X K, et al. Nitrogen uptake pattern of herbaceous plants: coping strategies in altered neighbor species[J]. Biology and Fertility of Soils, 2017, 53(7): 729-735. Doi:10.1007/s00374-017-1230-0 |
| [5] |
Xu X L, Ouyang H, Cao G M, et al. Dominant plant species shift their nitrogen uptake patterns in response to nutrient enrichment caused by a fungal fairy in an alpine meadow[J]. Plant and Soil, 2011, 341(1/2): 495-504. |
| [6] |
Schleuss P M, Heitkamp F, Sun Y, et al. Nitrogen uptake in an alpine Kobresia pasture on the Tibetan Plateau: localization by 15N labeling and implications for a vulnerable ecosystem[J]. Ecosystems, 2015, 18(6): 946-957. Doi:10.1007/s10021-015-9874-9 |
| [7] |
Carranca C, de Varennes A, Rolston D E. Biological nitrogen fixation estimated by 15N dilution, natural 15N abundance, and N difference techniques in a subterranean clover-grass sward under Mediterranean conditions[J]. European Journal of Agronomy, 1999, 10(2): 81-89. Doi:10.1016/S1161-0301(98)00056-2 |
| [8] |
Lonati M, Probo M, Gorlier A, et al. Nitrogen fixation assessment in a legume-dominant alpine community: comparison of different reference species using the 15N isotope dilution technique[J]. Alpine Botany, 2015, 125(1): 51-58. Doi:10.1007/s00035-014-0143-x |
| [9] |
Yang B J, Qiao N, Xu X L, et al. Symbiotic nitrogen fixation by legumes in two Chinese grasslands estimated with the 15N dilution technique[J]. Nutrient Cycling in Agroecosystems, 2011, 91(1): 91-98. Doi:10.1007/s10705-011-9448-y |
| [10] |
McAuliffe C, Chamblee D S, Uribe-Arango H, et al. Influence of inorganic nitrogen on nitrogen fixation by legumes as revealed by N15[J]. Agronomy Journal, 1958, 50(6): 334-337. Doi:10.2134/agronj1958.00021962005000060014x |
| [11] |
Arnone Ⅲ J A. Symbiotic N2 fixation in a high Alpine grassland: effects of four growing seasons of elevated CO2[J]. Functional Ecology, 1999, 13(3): 383-387. Doi:10.1046/j.1365-2435.1999.00325.x |
| [12] |
Che R X, Deng Y C, Wang F, et al. Autotrophic and symbiotic diazotrophs dominate nitrogen-fixing communities in Tibetan grassland soils[J]. Science of the Total Environment, 2018, 639: 997-1006. Doi:10.1016/j.scitotenv.2018.05.238 |
| [13] |
Jacot K A, Lüscher A, Nösberger J, et al. The relative contribution of symbiotic N2 fixation and other nitrogen sources to grassland ecosystems along an altitudinal gradient in the Alps[J]. Plant and Soil, 2000, 225(1/2): 201-211. Doi:10.1023/A:1026524212074 |
| [14] |
代冬雪. 西藏高寒草原豆科与非豆科优势植物群落生物固氮功能比较研究[D]. 北京: 中国科学院大学, 2015.
|
| [15] |
Yang K, He J, Tang W J, et al. On downward shortwave and longwave radiations over high altitude regions: observation and modeling in the Tibetan Plateau[J]. Agricultural and Forest Meteorology, 2010, 150(1): 38-46. Doi:10.1016/j.agrformet.2009.08.004 |
| [16] |
Ledgard S F, Simpson J R, Freney J R, et al. Field evaluation of 15N techniques for estimating nitrogen fixation in legume-grass associations[J]. Australian Journal of Agricultural Research, 1985, 36(2): 247. Doi:10.1071/AR9850247 |
| [17] |
Rennie R J, Dubetz S. Nitrogen-15-determined nitrogen fixation in field-grown chickpea, lentil, fababean, and field pea[J]. Agronomy Journal, 1986, 78(4): 654-660. Doi:10.2134/agronj1986.00021962007800040020x |
| [18] |
Sun Y, Schleuss P M, Pausch J, et al. Nitrogen pools and cycles in Tibetan Kobresia pastures depending on grazing[J]. Biology and Fertility of Soils, 2018, 54(5): 569-581. Doi:10.1007/s00374-018-1280-y |
| [19] |
Ti C P, Pan J J, Xia Y Q, et al. A nitrogen budget of mainland China with spatial and temporal variation[J]. Biogeochemistry, 2012, 108(1/2/3): 381-394. |
| [20] |
Bowman W D, Schardt J C, Schmidt S K. Symbiotic N2-fixation in alpine tundra: ecosystem input and variation in fixation rates among communities[J]. Oecologia, 1996, 108(2): 345-350. Doi:10.1007/BF00334660 |
| [21] |
Jacot K A, Lüscher A, Nösberger J, et al. Symbiotic N2 fixation of various legume species along an altitudinal gradient in the Swiss Alps[J]. Soil Biology and Biochemistry, 2000, 32(8/9): 1043-1052. |
| [22] |
Boddey R M, Urquiaga S, Neves M C P, et al. Quantification of the contribution of N2 fixation to field-grown grain legumes: a strategy for the practical application of the 15N isotope dilution technique[J]. Soil Biology and Biochemistry, 1990, 22(5): 649-655. Doi:10.1016/0038-0717(90)90011-N |
| [23] |
罗绪强, 张桂玲, 杨鸿雁, 等. 喀斯特山地不同退化植被下烟管荚蒾氮同位素组成的季节变化[J]. 科学技术与工程, 2020, 20(11): 4243-4249. Doi:10.3969/j.issn.1671-1815.2020.11.007 |
| [24] |
苏波, 韩兴国, 黄建辉. 15N自然丰度法在生态系统氮素循环研究中的应用[J]. 生态学报, 1999, 19(3): 408-416. Doi:10.3321/j.issn:1000-0933.1999.03.020 |
| [25] |
Chalk P M, Ladha J K. Estimation of legume symbiotic dependence: an evaluation of techniques based on 15N dilution[J]. Soil Biology and Biochemistry, 1999, 31(14): 1901-1917. Doi:10.1016/S0038-0717(99)00095-4 |
| [26] |
Yang L J, Zhang L L, Geisseler D, et al. Available C and N affect the utilization of glycine by soil microorganisms[J]. Geoderma, 2016, 283: 32-38. Doi:10.1016/j.geoderma.2016.07.022 |
| [27] |
Hossain S A, Waring S A, Strong W M, et al. Estimates of nitrogen fixations by legumes in alternate cropping systems at Warra, Queensland, using enriched-15N dilution and natural 15N abundance techniques[J]. Australian Journal of Agricultural Research, 1995, 46(3): 493-505. Doi:10.1071/AR9950493 |
| [28] |
Burchill W, James E K, Li D, et al. Comparisons of biological nitrogen fixation in association with white clover (Trifolium repens L.) under four fertiliser nitrogen inputs as measured using two 15N techniques[J]. Plant and Soil, 2014, 385(1/2): 287-302. Doi:10.1007/s11104-014-2199-1 |
| [29] |
Høgh-Jensen H, Schjoerring J K. Measurement of biological dinitrogen fixation in grassland: comparison of the enriched 15N dilution and the natural 15N abundance methods at different nitrogen application rates and defoliation frequencies[J]. Plant and Soil, 1994, 166(2): 153-163. Doi:10.1007/BF00008328 |
 2022, Vol. 39
2022, Vol. 39 


