2. 渤海大学 海洋研究院, 辽宁 锦州 121013;
3. 渤海大学 辽宁省全谱太阳能电池转光材料专业技术创新中心, 辽宁 锦州 121013
2. Institute of Ocean Research, Bohai University, Jinzhou 121013, Liaoning, China;
3. Professional Technology Innovation Center of Liaoning Province for Conversion Materials of Solar Cell, Bohai University, Jinzhou 121013, Liaoning, China
随着印染行业的蓬勃发展, 产生并排出大量染料废水, 造成严重的环境污染问题。染料废水具有色度高、化学需氧量(COD)高、毒性强、可生化性差、成分复杂等特点, 是一种难以处理的工业有机废水, 也是国内外环保领域急待解决的难题[1]。此外, 废水中的染料可以吸收光线, 使水体透明度降低, 影响水生生物和微生物生长, 对水体自净起到负面作用, 同时容易造成视觉上的污染。严重污染的水体影响人类健康。去除废水中染料的方法有化学法、生物法和物理法。其中物理法中的吸附法具有吸附剂来源广泛、吸附效率高、种类多、方法简单易行、环保, 且能够选择性地富集某些污染物等优势[2]。但活性炭的高成本限制了这种方法的使用, 相比之下, 生物炭生产成本更低, 能耗更低, 并且是一种清洁可再生资源, 所以开发生物质资源成为需要大力研究的课题[3]。
生物炭是一种环保且来源广泛的材料, 能制备生物炭的原料种类繁多, 且在自然环境中随处可见, 如农业废弃物秸秆[4], 水生植物海藻[5], 生物质复合材料[6]等。生物炭近年来在吸附方面的研究十分广泛, Yin等[7]和Fan等[8]分别将豆饼、活性污泥等生物质废弃物制备成生物炭基材料, 用于处理受重金属污染的水体, 均取得较好的效果。Ahmed和Hameed[9]利用大麦杆制备生物炭, 用于处理水杨酸废水。Tian等[10]制备生物炭/纳米零价铁复合材料, 用于处理雨水中的硝酸盐, 也取得不错效果。本文采用农业废弃物葡萄皮作为原材料, 通过限氧热解法将其制备成生物炭, 并通过正交试验设计对其进行活化, 以活化生物炭对目标污染物甲基橙的去除率为指标, 探讨生物炭磷酸质量比、活化温度及活化时间对活化效果的影响, 并考察活化生物炭在不同条件下对甲基橙的吸附规律, 对实验结果进行分析与表征。
1 材料与方法 1.1 实验材料与仪器甲基橙(分析纯)购买于天津市精细化工研究所, 葡萄皮采自锦州市场。仪器包括: 电子分析天平(JJ224BC, 常熟市双杰测试仪器厂)、陶瓷纤维马弗炉(TC162-12, 上海康路仪器设备有限公司)、电热鼓风干燥箱(DHG-9 245 A, 上海一恒科学仪器有限公司)、恒温震荡培养箱(HZQ-X100, 金坛市华龙实验仪器厂)、紫外可见分光光度计(UV-1801, 北京北分瑞利分析仪器(集团)有限责任公司)。
1.2 生物炭制备过程采用限氧热解炭化法制备生物炭样品, 具体步骤如下: 将葡萄皮作为原料, 用去离子水清洗干净, 在80 ℃下烘干12 h, 拿出后粉碎过80目筛备用。将粉碎后的原料置于坩埚中, 盖上盖子, 然后转移至马弗炉中于550 ℃下炭化反应2 h, 冷却后取出, 研磨过80目筛, 储存于干燥器中备用。
1.3 生物活化炭制备过程本文采用正交试验设计制备磷酸活化生物炭, 具体活化过程如下: 准确称取一定量葡萄皮基生物炭样品与磷酸, 将二者混合均匀, 放入陶瓷坩埚中浸泡24 h, 然后放在烘箱烘干24 h, 为保证生物炭与磷酸溶液混合均匀, 每隔8 h搅拌一次。将陶瓷坩埚的盖子盖好, 置于马弗炉中, 以5 ℃/min升温至指定温度活化设定时间。待温度降至200 ℃以下, 打开炉门, 此时可得到活性炭。向坩埚中加入质量分数为5%的盐酸浸泡8 h。将浸泡后的活性炭样放入离心管, 去离子水冲洗多次, 直至中性。放入鼓风干燥箱中以105 ℃的温度干燥8 h得到活化炭样品。
1.4 生物炭表征用傅里叶变换红外光谱仪(FT-IR, Varian Scimitar 2000) 测定生物炭的红外光谱, 使用KBr压片制样, 扫描波数范围为400~4 000 cm-1。通过场发射扫描电镜(FE-SEM, Hitachi S-4800) 表征其表面形貌特征。
1.5 生物炭对甲基橙吸附实验过程 1.5.1 正交试验指标去除率测定实验用电子天平准确称取所制备生物活化炭样品0.020 0 g(误差保持在0.000 5 g以内), 做3组平行实验, 共27组, 将称好的样品依次放入42 mL的棕色螺口瓶中, 并贴好标签, 用量筒量取40 mL甲基橙溶液(40 mg/L)倒入瓶中, 拧紧瓶盖均匀摆放在铁架上, 将铁架放入旋转混合器中, 开启电源旋转24 h, 将螺口瓶取出静置2 h后, 使用分光光度计于464 nm下测定被吸附后甲基橙溶液的浓度。
1.5.2 实验条件对吸附性能影响批实验 1.5.2.1 吸附剂用量对吸附的影响将40 mL(40 mg/L)的甲基橙溶液置于42 mL螺口瓶中, 分别投加0.002 0, 0.004 0, 0.006 0, 0.008 0, 0.010 0 g生物活化炭, 将螺口瓶放进恒温振荡培养箱, 在(30±1) ℃条件下以150 rpm的转速振荡24 h, 用移液器取3 mL上清液置于离心管内, 将样品以8 000 rpm离心分离5 min, 然后用移液器取液2 mL, 测其浓度。
1.5.2.2 甲基橙初始浓度对吸附的影响将生物活化炭添加量设置为0.006 0 g, 分别配置20、30、40、50、60、80、100 mg/L的甲基橙溶液加入42 mL棕色螺口瓶中, 如1.5.2.1节描述, 控制其余实验条件不变, 待吸附达到平衡时取出, 在464 nm处测甲基橙的浓度。
1.5.2.3 反应体系温度对吸附的影响将甲基橙溶液质量浓度设置为40 mg/L, 将加入生物炭的甲基橙液分别置于30、40、50、60、70 ℃的恒温振荡培养箱振荡, 如1.5.2.2节描述, 控制其余实验条件不变, 待其达吸附平衡时于464 nm处测定溶液中甲基橙浓度。
1.6 活化炭吸附动力学批实验将400 mL(40 mg/L)的甲基橙溶液置于500 mL具塞锥形瓶中, 投加0.06 g生物炭, 最后将锥形瓶放进恒温振荡培养箱, 在(30±1) ℃条件下以150 rpm的转速振荡, 分别于5, 10, 20, 40, 60, 90, 120, 180, 240, 360, 600, 960, 1 440 min进行取样, 用移液器取3 mL上清液置于离心管内, 将样品以8 000 rpm离心分离5 min, 然后用移液器取液2 mL, 稀释后于464 nm波长处用紫外可见分光光度计测试甲基橙的浓度。每个处理设3个平行, 取平均值进行分析。
1.7 数据分析 1.7.1 吸附性能生物炭对甲基橙的吸附量计算公式为
| $ {{Q_t} = \frac{{({C_0} - {C_t})V}}{m},} $ | (1) |
生物炭对甲基橙的去除率计算公式为
| $ {{R_t} = \frac{{{C_0} - {C_t}}}{{{C_0}}} \times 100\% .} $ | (2) |
式中: Qt是时间为t时生物炭对甲基橙染料的吸附量, mg/g; C0是甲基橙的初始质量浓度, mg/L; Ct是时间为t时溶液的甲基橙质量浓度, mg/L; V是溶液的体积, L; m是生物炭的质量, g。
1.7.2 吸附动力学方程准一级动力学方程
| $ \log \left(Q_{\mathrm{e}}-Q_{t}\right)=\log \left(Q_{\mathrm{e}}\right)-k_{1} \times t, $ | (3) |
准二级动力学方程
| $ t / Q_{\mathrm{e}}=1 / k_{2} Q_{\mathrm{e}}^{2}+1 / Q_{\mathrm{e}} \times t, $ | (4) |
由准二级动力学数据可推出初始吸附速率
| $ h=k_{2} Q_{\mathrm{e}}^{2}, $ | (5) |
颗粒内扩散模型
| $ Q_{t}=k_{\mathrm{ip}} \times t^{0.5}+C, $ | (6) |
双室动力学模型
| $ {\frac{{{C_{s,t}}}}{{{C_{s,t = \infty }}}} = 1 - \left( {{F_{{\rm{fast }}}}{{\rm{e}}^{ - {k_{{\rm{fast}}}}t}} + {F_{{\rm{slow}}}}{{\rm{e}}^{ - {k_{{\rm{slow}}}}t}}} \right),} $ | (7) |
| $ {\frac{{{C_{s,t}}}}{{{C_{s,t = \infty }}}} = \frac{{{C_{{\rm{w}},0}} - {C_{{\rm{w}},t}}}}{{{C_{{\rm{w}},0}} - {C_{{\rm{w}},t = \infty }}}} = \frac{{{C_{{\rm{w}},0}} - {C_{{\rm{w}},t}}}}{{{C_{{\rm{w}},0}} - {C_{{\rm{w}},{\rm{e}}}}}}.} $ | (8) |
式中: k1表示准一级速率常数, min-1; k2表示准二级速率常数, g/(mg·min); t表示反应时间, min; Qe和Qt分别表示反应达到平衡时和t时刻的吸附量, mg/g; kip是颗粒内扩散速率常数, mg/(g·min0.5); C为常数, 为生物活化炭边界层; Cs, t, Cs, t=∞是在t分钟和无穷大时被吸附甲基橙的质量浓度, mg/L; Ffast 和Fslow分别是生物活化炭对甲基橙的快速吸附和慢速吸附部分; Cw, 0、Cw, t、Cw, t=∞、Cw, e分别是初始、t时刻、无穷大和平衡时水相中甲基橙的质量浓度, mg/L。
1.7.3 吸附等温线方程Freundlich等温线模型
| $ {Q_{\rm{e}}} = {K_{\rm{F}}}C_{\rm{e}}^{1/n}, $ | (9) |
Langmuir吸附等温线模型
| $ Q_{\mathrm{e}}=\frac{Q_{\mathrm{m}} K_{\mathrm{L}} C_{\mathrm{e}}}{1+K_{\mathrm{L}} C_{\mathrm{e}}}, $ | (10) |
Langmuir-Freundlich吸附等温线模型
| $ Q_{\mathrm{e}}=\frac{Q_{\mathrm{m}} K_{\mathrm{L}} C_{\mathrm{e}}^{n}}{1+K_{\mathrm{L}} C_{\mathrm{e}}^{n}}, $ | (11) |
T型等温线模型
| $ Q_{\mathrm{e}}=R T / \mathrm{b} \times \ln \left(K_{\mathrm{T}} C_{\mathrm{e}}\right). $ | (12) |
式中: Qe为吸附达到平衡时生物炭对甲基橙的吸附量, mg/g; KL为Langmuir吸附平衡常数, L/mg; KF为Freundlich吸附平衡常数, mg/(g·mgn·Ln); Ce为达到吸附平衡时溶液的甲基橙质量浓度, mg/L; 1/n为Freundlich指数; Qm为生物炭对甲基橙的饱和吸附量, mg/g。
2 结果与讨论 2.1 正交实验 2.1.1 确定实验因素水平表本文选取生物炭/磷酸质量比、活化温度和活化时间为影响因素, 以活化生物炭对甲基橙的去除率为试验指标, 采用3因素3水平正交试验方法, 并用L9(34)正交表对生物炭活化工艺参数进行优化, 其因素水平的选取见表 1。
|
|
表 1 正交试验的因素和水平表 Table 1 Experimental factors and levels |
由表 2可得出实验结果, 葡萄皮基生物炭在A3B3C2条件下活化效果最好, 去除率为99.35%, 所以得出最佳实验条件为, 1∶5的生物炭磷酸质量比, 850 ℃下活化1 h。通过分析极差R值, RB > RC > RA, 所以影响生物活化炭制备的因素次序为温度>活化时间>生物炭磷酸质量比。
|
|
表 2 正交实验设计表L9(34)和试验结果 Table 2 Deviation analysis of orthogonal results of MO removal |
极差分析简单明了, 但是不能将试验中由于试验条件改变引起的数据波动与试验误差引起的数据波动区分开, 为了估计试验误差的大小和考察实验因素作用是否显著, 采用方差分析和显著性检验(F检验)做进一步分析, 结果如表 3所示。由表 3分析可知, 3个因素的F值比均小于临界值, 所以认为3个因素或交互作用对试验无显著性的影响。这可能是因为误差自由度较小, 所以F检验灵敏度低。通过分析偏差平方和, 可得知因素影响主次顺序为温度>时间>生物炭磷酸质量质量比, 与上述极差分析结果一致。
|
|
表 3 方差显著性分析 Table 3 Prominent analysis of removal rate of MO |
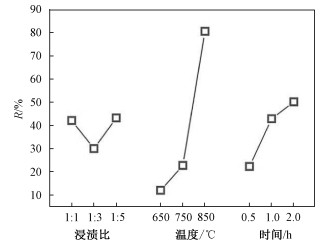
如图 1所示, 当生物炭与磷酸的质量比由1∶1增大到1∶3时, 去除率从42.10%降低到30.03%;而当质量比继续增大到1∶5时, 去除率增大到43.23%。去除率变化幅度不是很大, 说明质量比对反应影响并不是很大, 质量比为1∶5时去除率最高。当活化温度由650 ℃上升到750 ℃时, 甲基橙去除率由12.06%上升至22.74%;当温度继续升高至850 ℃时, 甲基橙去除率大幅度增加至80.56%。说明温度对活化结果的影响极大, 且随着活化温度升高, 活化生物炭的吸附性能增强。当活化时间由0.5 h增至1 h, 活化炭对甲基橙的去除率由22.31%增至42.88%; 当进一步提高活化时间至2 h, 去除率增至50.15%, 较1 h去除率略有升高但变化不大。
|
Download:
|
| 图 1 正交设计效应曲线图 Fig. 1 Orthogonal design effect curve | |
生物炭表面形貌如图 2所示, 图 2(a), 2(b)为初始生物炭, 图 2(c),2(d)为活化后生物炭(活化条件为: 浸渍比1∶5, 活化温度850 ℃, 活化时间为1 h)。由图可知初始生物炭表面较平, 孔的含量十分稀少, 因此可以推断未经活化的生物炭吸附能力较弱。而从图 2可观察到明显的孔状结构, 孔的数量明显增多, 孔径增大, 增强了生物炭的吸附能力, 并且生物炭表面附着圆形分子结构, 可能是经活化后引入含氧基团, 提高了生物炭的化学吸附能力。

|
Download:
|
| (a)和(b)为初始生物炭(550 ℃下炭化反应2 h); (c)和(d)为活化炭(浸渍比为1∶5, 活化温度为850 ℃, 活化时间为1 h)。 图 2 SEM图像 Fig. 2 Images of SEM | |
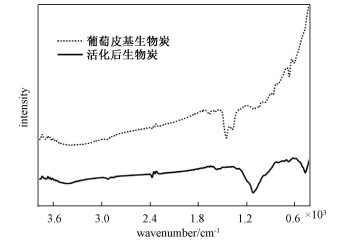
图 3为葡萄皮基生物炭活化前后的红外光谱图, 分析图谱得知, 3 720 cm-1附近的低吸收强度小肩峰为C=C—H的伸缩振动; 位于2 925和2 850 cm-1处的吸收峰分别对应于—CH3的不对称和对称伸缩振动[11-12]; 位于2 398 cm-1峰对应于CC官能团的拉伸震动[7]; 在生物炭样品中1 663 cm-1处吸收峰为C=C或C—O的伸缩运动[4], 经磷酸活化后吸收峰强度减弱并向低频移动约20 cm-1; 1 591 cm-1处为典型芳香官能团吸收特征峰(如C=C)[13]; 1 414和1 377 cm-1处为C—H弯曲振动[14]; 870 cm-1处对应呋喃γ—C—H面外弯曲振动吸收[15]。经磷酸活化后, 位于2 985, 2 850和2 398 cm-1处的吸收峰基本无变化, 1 414和1 317 cm-1处C—H的吸收峰向低频移动, 而且几乎消失, 而位于1 119 cm-1处产生新的强吸收峰, 它是磷酸(对应于P—O伸缩振动)或磷炭化合物(对应P—O—C的O—C伸缩振动)的特征峰, 说明经磷酸活化给生物炭引入了新的含氧基团, 能够提高生物炭的化学吸附能力[16]。870, 671 cm-1处吸收峰明显削弱, 并有轻微位移, 表明生物炭更趋于稳定[17]。
|
Download:
|
| 葡萄皮基生物炭(550 ℃下炭化反应 2 h);活化后生物炭 (浸渍比为1∶5,活化温度为 850 ℃ ,活化时间为 1 h)。 图 3 FT-IR光谱 Fig. 3 FT-IR spectrum | |
葡萄皮基生物炭经磷酸活化前后对甲基橙的吸附情况如图 4(a)所示。由图可知, 经磷酸活化后, 葡萄皮对甲基橙的去除率由3.8%增加到39.6%, 去除率提高35.6%, 吸附量由原来的10.35 mg/g增加到101.67 mg/g, 增加近10倍。原因是经磷酸活化, 非炭元素会逐渐消失, 如挥发性化合物, 使被释放的炭原子成键, 形成多孔结构并且改变了生物炭的性能, 引入新的含氧基团(P—O和O—C), 对甲基橙的吸附更有利[16]。

|
Download:
|
| 图 4 生物炭活化前后吸附性能比较及实验条件对吸附甲基橙的影响 Fig. 4 Comparison of adsorption performance from biochar and activated biochar and effect of experiment factors on adsorption of MO | |
活化生物炭投加量对甲基橙吸附性能的影响如图 4(b)所示, 由图可知, 当生物炭投加量由0.02 g增大到0.1 g的过程, 对甲基橙的平衡吸附量是不断下降的, 生物炭投加量为0.02 g时, 它的平衡吸附量为106.4 mg/g。而当投加量增大到0.1 g时, 平衡吸附量下降到92.25 mg/g。这是由于生物炭投入越多, 甲基橙在液相中平衡浓度越低, 使生物炭吸附容量相应下降所致[18]。与此相反, 随着活化生物炭投加量的不断增大, 对甲基橙的去除率也不断增加。当炭投加量为0.02 g时, 其对甲基橙的去除率为13.48%; 当炭投加量增大至0.1 g时, 对甲基橙的去除率增大至60.02%。吸附量与去除率的趋势恰好相反, 这与文献报道相一致[18-19]。
2.4.2 甲基橙初始浓度对吸附规律的影响图 4(c)为生物炭对不同浓度甲基橙溶液的吸附规律变化曲线。由图得知, 活化生物炭对甲基橙的吸附量随着甲基橙初始浓度的升高而升高, 当初始质量浓度由20 mg/L增加到100 mg/L时, 吸附量从74.12 mg/g上升到130.55 mg/g。这是由甲基橙在活化生物炭表面活性位点的覆盖程度决定的, 当吸附达到平衡时, 甲基橙初始浓度越高, 炭表面的活性位点被覆盖的越多, 使吸附量越高直至达到饱和[19]; 另一方面, 甲基橙浓度越高其在炭表面与液相主体之间的浓度差越大, 从而导致它具有更高的传质速率[20]。而随着甲基橙初始质量浓度由20 mg/L增加到100 mg/L时, 去除率由59.29%下降到21.25%, 这是因为溶液中的甲基橙离子越来越多, 高于生物炭上的活性位点所致[21]。
2.4.3 反应体系温度对吸附规律的影响图 4(d)为不同温度下生物炭对甲基橙的吸附规律变化曲线。由图可知, 随着反应温度的升高, 生物炭对甲基橙的平衡吸附量也随之升高。当反应体系温度为30 ℃时, 平衡吸附量为105.62 mg/g; 当反应体系温度达到70 ℃时, 平衡吸附量升高到129.24 mg/g。这可能是因为随着温度升高, 甲基橙扩散速度加快、离子之间无规则运动加剧, 增加了甲基橙与活化炭表面吸附位点接触和碰撞的机会, 从而使吸附性能增强, 有利于吸附反应进行。通过升高反应温度促进了甲基橙在生物炭上的吸附, 说明此反应是吸热反应。随着反应温度升高, 甲基橙去除率也随着升高, 由39.82%上升到50.67%。温度的升高为活化炭表面官能团化学键断裂提供了更多的能量, 促进了活化炭表面官能团与甲基橙之间新化学键的形成, 从而提高了吸附效率[22]。
2.5 活化炭对甲基橙的吸附动力学研究活化生物炭吸附溶液中甲基橙的准一级动力学方程、准二级动力学方程拟合曲线如图 5(a)、5(b)所示, 拟合参数结果见表 4。通过拟合结果可得出活化生物炭的准一级动力学方程R2为0.925 1, 准二级动力学方程的R2为0.998 5。R2越接近于1表示拟合效果越好, 且准二级动力学方程计算得出的平衡吸附量更接近于实际平衡吸附量。所以生物炭对甲基橙的吸附过程更适用于准二级动力学方程进行拟合, 即吸附速率和被吸附物的浓度或压强的平方成正比。准二级动力学模型是基于假定吸附速率受化学吸附机理控制, 这种化学吸附涉及到吸附剂与吸附质之间的电子共用或电子转移[12]。

|
Download:
|
| 图 5 生物活化炭对甲基橙的吸附动力学拟合曲线 Fig. 5 Different kinetic plots for the adsorption of MO onto activated biochars | |
|
|
表 4 活化生物炭3种吸附动力学拟合参数 Table 4 Three adsorption kinetic fitting parameters of activated biochar |
用颗粒内扩散模型对活化生物炭吸附甲基橙过程进行更进一步研究。如图 5(c)所示, 为生物炭对甲基橙的吸附量Qt与t0.5的线性拟合图。拟合图像不过原点, 表明整个吸附过程中颗粒内扩散不是唯一的限速因素, 液膜扩散同时也在起作用[23]。由拟合图可以看出明显存在两个吸附阶段。第一阶段即液膜扩散阶段, 就是在固液反应中甲基橙分子从液相主体运动到水和生物炭的液膜表面, 再通过分子扩散的形式通过液膜到达固液两相界面, 然后在固液两相界面进行反应。第二阶段为颗粒内扩散, 即甲基橙进入到生物炭孔隙内的扩散。由表 5可得出扩散速率常数kip1(4.74 mg/(g·min0.5))远大于kip2(0.47 mg/(g·min0.5)), 这是因为通过甲基橙不断向活化生物炭孔隙扩散, 导致扩散阻力越来越大, 所以扩散越来越困难从而使扩散速率迅速下降。C表示活化生物炭边界层, 颗粒内扩散过程的C2(78.59)值要大于液膜扩散的C1(15.34)值, 所以颗粒内扩散过程边界层对吸附过程的影响更大[24]。综上所述, 甲基橙在活化炭表面的吸附由液膜扩散和颗粒内扩散共同控制, 且以颗粒内扩散是主要限速步骤。
|
|
表 5 活化生物炭一级二室模型拟合参数 Table 5 First-order, two-compartment model fitting parameters of activated biochar |
由上述颗粒内扩散模型可知, 活化生物炭对甲基橙的吸附可分为快反应和慢反应两阶段, 因此, 可以用双室动力学模型对吸附反应进行拟合见图 5(d), 拟合参数见表 5。由图和表可知, 快吸附分布比例参数Ffast值约为0.65, 大于0.50, 这说明快吸附反应在整个吸附过程中起主导作用[25]。
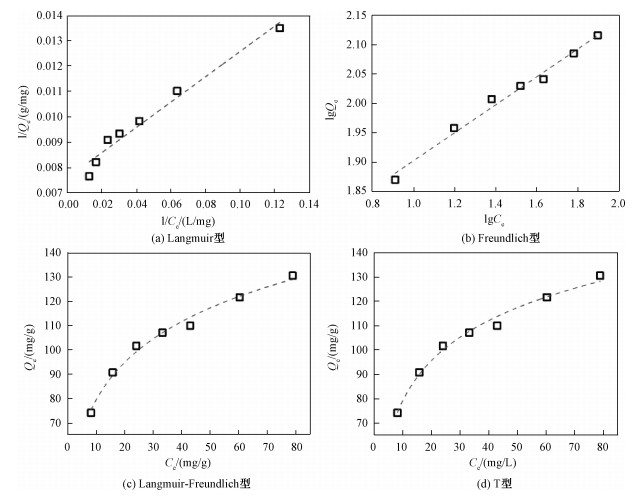
2.6 活化炭对甲基橙的吸附等温线吸附等温曲线是指在一定温度下溶质分子在两相界面上进行的吸附过程达到平衡时它们在两相中浓度之间的关系曲线[26]。利用各种等温线模型对实验数据进行分析, 可以识别吸附性质和最大吸附程度[9]。本文中分别用Langmuir、Freundlich、Sip (Langmuir-Freundlich)、Temkin-Pyzhev方程对数据进行拟合。图 6为拟合曲线, 拟合参数见表 6。通过比较4种吸附等温线模型的R2, Temkin-Pyzhev(R2=0.986 6)大于Freundlich(R2=0.983 4)大于Sips(R2=0.983 3)大于Langmuir(R2=0.964 5)。所以吸附过程更适合用Temkin-Pyzhev方程进行拟合。Temkin-Pyzhev模型是在化学吸附的基础上推导出来的一个理论公式, 它假定吸附质在活化生物炭表面的吸附热随覆盖度的增大而线性降低, 说明活化炭对于甲基橙的吸附更倾向于不规则的表面吸附[27]。通过式(13)和Langmuir方程拟合得到的KL值, 可以计算出无量纲平衡常数的RL(也成为分离因子)约为0.14, 大于0小于1, 说明活化炭对甲基橙的吸附为有利吸附[18]。而通过Freundlich模型计算得出的n值为4.20, 则1/n为0.24。1/n值的大小表示浓度对吸附量影响的强弱, 吸附性能越好则1/n值越小。通常1/n在0.1~0.5范围内时易于吸附, 大于2时难以吸附[15]。所以在本文中活化生物炭对甲基橙的吸附过程是易于进行的。此外, 通过Langmuir和Sips方程拟合得到最大吸附量分别是131.58和288.35 mg/g。Langmuir方程所得的最大吸附量更接近实测最大吸附量(92.24 mg/g)。
| $ {R_{\rm{L}}} = 1/(1 + {K_{\rm{L}}}{C_0}). $ | (13) |
|
Download:
|
| 图 6 甲基橙在生物炭上的吸附等温线 Fig. 6 Adsorption isotherms of MO onto activated biochars | |
|
|
表 6 活化生物炭吸附甲基橙的吸附等温线拟合参数 Table 6 Isotherm constants for MO adsorption onto activated biochars |
在400 mL的甲基橙溶液(40 mg/L)中添加0.06 g活化生物炭, 分别在30、40、50、60、70 ℃下150 rpm振荡24 h后测量浓度, 考察甲基橙在活化生物炭上的等温吸附, 实验结果如表 7所示。
|
|
表 7 活化生物炭对甲基橙的热力学参数 Table 7 Thermodynamic parameters of activated biocar to methyl orange |
根据式(14)~式(16)计算不同实验温度的吉布斯自由能变化(ΔGθ)、熵变(ΔSθ)和焓变(ΔHθ)[19, 28-29]。
| $ \Delta G^{\theta}=-R T \ln K , $ | (14) |
| $ \Delta G^{\theta}=\Delta H^{\theta}-T \Delta S^{\theta}. $ | (15) |
由式(14)、式(15)可以得出
| $ \ln K=-\left(\Delta H^{\theta} / R T\right)+\Delta S^{\theta} / R. $ | (16) |
式中: R是气体常数, 值为8.314 J/(mol·K); T为开尔文温度, K; K=Qe/Ce为平衡常数, L/g。由范特霍夫方程(式(16))可知, 以lnK对1/T作图所得到的线性回归直线。通过拟合所得斜率和截距即可分别计算出ΔHθ和ΔSθ, 继而可求出ΔGθ, 结果见表 7。由所得数据可知ΔHθ=10.07 kJ/mol, 是大于0的, 说明反应是吸热反应[30]。ΔSθ=0.045 5 kJ/mol大于0, 表明吸附过程反应体系混乱度增大[31]。经热力学计算, 在不同温度下得到的ΔGθ(-3.70~-5.52 kJ/ mol)<0, 说明吸附反应过程是自发的过程; 随着温度升高, 标准吉布斯自由能绝对值增大, 说明其吸附驱动力增强[27]。
3 结论1) 通过正交实验确立最佳的优化条件为1∶1的浸渍比, 850 ℃下烧1 h, 并通过极差分析得到因素对去除率的影响次序为活化温度大于活化时间大于浸渍比。
2) 经水热炭化处理葡萄皮基生物炭后, 活化生物炭对甲基橙的吸附性能显著提高, 对甲基橙的去除率提高35.6%。并且通过红外光谱分析, 水热炭化处理后产生了新的含氧基团, 提高了生物炭的吸附能力。
3) 活化生物炭对甲基橙的吸附量随着生物炭添加量的上升而下降; 随着甲基橙初始浓度上升而上升; 随着温度升高而上升。而活化生物炭对甲基橙的去除率随着生物炭添加量上升而上升; 随着甲基橙初始浓度上升而下降; 随着温度升高而上升。
4) 活化生物炭对甲基橙的吸附能被准二级动力学模型很好地描述(R2=0.998 5)。结合双室模型和颗粒内扩散模型的结果, 活化生物炭对甲基橙的吸附过程由液膜扩散和颗粒内扩散两个阶段共同控制, 颗粒内扩散是主要限速因素。并且可分为快反应和慢反应两阶段, 快吸附反应在整个吸附过程中起主导作用。
5) 吸附过程更符合Temkin-Pyzhev吸附等温线方程(R2=0.986 6)。吸附质在生物炭表面的吸附热随覆盖度的增大而线性降低, 说明活化炭对于甲基橙的吸附更倾向于不规则的表面吸附。
6) 通过热力学得出吸附反应为吸热过程, 吸附量随着温度升高而升高, 且吸附反应在任何条件下都可以自发进行。
| [1] |
陈文华, 李刚, 许方程, 等. 染料废水污染现状及处理方法研究进展[J]. 浙江农业科学, 2014(2): 264-269. Doi:10.3969/j.issn.0528-9017.2014.02.041 |
| [2] |
王春梅, 尹宇, 郭正祥, 等. 活性炭在染料废水处理中的应用[J]. 印染, 2019(2): 42-45, 55. |
| [3] |
Dai Y J, Zhang N X, Xing C M, et al. The adsorption, regeneration and engineering applications of biochar for removal organic pollutants: a review[J]. Chemosphere, 2019, 223: 12-27. Doi:10.1016/j.chemosphere.2019.01.161 |
| [4] |
Yang F, Zhang S S, Cho D W, et al. Porous biochar composite assembled with ternary needle-like iron-manganese-sulphur hybrids for high-efficiency lead removal[J]. Bioresource Technology, 2019, 272: 415-420. Doi:10.1016/j.biortech.2018.10.068 |
| [5] |
Ahmed M J, Okoye P U, Hummadi E H, et al. High-performance porous biochar from the pyrolysis of natural and renewable seaweed (Gelidiella acerosa) and its application for the adsorption of methylene blue[J]. Bioresource Technology, 2019, 278: 159-164. Doi:10.1016/j.biortech.2019.01.054 |
| [6] |
Liu X N, Shen F, Qi X H. Adsorption recovery of phosphate from aqueous solution by CaO-biochar composites prepared from eggshell and rice straw[J]. Science of the Total Environment, 2019, 666: 694-702. Doi:10.1016/j.scitotenv.2019.02.227 |
| [7] |
Yin W Q, Dai D, Hou J H, et al. Hierarchical porous biochar-based functional materials derived from biowaste for Pb(Ⅱ) removal[J]. Applied Surface Science, 2019, 465: 297-302. Doi:10.1016/j.apsusc.2018.09.010 |
| [8] |
Fan Z X, Zhang Q, Gao B, et al. Removal of hexavalent chromium by biochar supported nZVI composite: batch and fixed-bed column evaluations, mechanisms, and secondary contamination prevention[J]. Chemosphere, 2019, 217: 85-94. Doi:10.1016/j.chemosphere.2018.11.009 |
| [9] |
Ahmed M J, Hameed B H. Adsorption behavior of salicylic acid on biochar as derived from the thermal pyrolysis of barley straws[J]. Journal of Cleaner Production, 2018, 195: 1162-1169. Doi:10.1016/j.jclepro.2018.05.257 |
| [10] |
Tian J, Jin J, Chiu P C, et al. A pilot-scale, bi-layer bioretention system with biochar and zero-valent iron for enhanced nitrate removal from stormwater[J]. Water Research, 2019, 148: 378-387. Doi:10.1016/j.watres.2018.10.030 |
| [11] |
Wang J G, Chen N, Feng C P, et al. Performance and mechanism of fluoride adsorption from groundwater by lanthanum-modified pomelo peel biochar[J]. Environmental Science and Pollution Research, 2018, 25: 15326-15335. Doi:10.1007/s11356-018-1727-6 |
| [12] |
Tang Y, Alam M S, Konhauser K O, et al. Influence of pyrolysis temperature on production of digested sludge biochar and its application for ammonium removal from municipal wastewater[J]. Journal of Cleaner Production, 2019, 209: 927-936. Doi:10.1016/j.jclepro.2018.10.268 |
| [13] |
Tan G Q, Wu Y, Liu Y, et al. Removal of Pb(Ⅱ) ions from aqueous solution by manganese oxide coated rice straw biochar: a low-cost and highly effective sorbent[J]. Journal of the Taiwan Institute of Chemical Engineers, 2018, 84: 85-92. Doi:10.1016/j.jtice.2017.12.031 |
| [14] |
Xiang J X, Lin Q T, Cheng S L, et al. Enhanced adsorption of Cd(Ⅱ) from aqueous solution by a magnesium oxide-rice husk biochar composite[J]. Environmental Science and Pollution Research, 2018, 25: 14032-14042. Doi:10.1007/s11356-018-1594-1 |
| [15] |
王章鸿, 郭海艳, 沈飞, 等. 热解条件对生物炭性质和氮、磷吸附性能的影响[J]. 环境科学学报, 2015, 35(9): 2805-2812. |
| [16] |
Cao L C, Yu I K M, Tsang D C W, et al. Phosphoric acid-activated wood biochar for catalytic conversion of starch-rich food waste into glucose and 5-hydroxymethylfurfural[J]. Bioresource Technology, 2018, 267: 242-248. Doi:10.1016/j.biortech.2018.07.048 |
| [17] |
Yin Z H, Liu Y G, Liu S B, et al. Magnetic biochar by one-step synthesis: enhanced adsorption and coadsorption for 17β-estradiol and copper[J]. Science of the Total Environment, 2018, 639: 1530-1542. Doi:10.1016/j.scitotenv.2018.05.130 |
| [18] |
常春, 刘天琪, 王瑀婷, 等. 水热法制备玉米叶基生物炭对亚甲基蓝的吸附性能研究[J]. 环境科学学报, 2017, 37(7): 2680-2690. |
| [19] |
Ur Rehman M S, Kim I, Rashid N, et al. Adsorption of brilliant green dye on biochar prepared from lignocellulosic bioethanol plant waste[J]. Clean-Soil Air Water, 2016, 44: 55-62. Doi:10.1002/clen.201300954 |
| [20] |
Ur Rehman M S, Munir M, Ashfaq M, et al. Adsorption of brilliant green dye from aqueous solution onto red clay[J]. Chemical Engineering Journal, 2013, 228: 54-62. Doi:10.1016/j.cej.2013.04.094 |
| [21] |
Mahmoud M E, Khalifa M A, Wakeel Y M, et al. A novel nanocomposite of liquidambar styraciflua fruit biochar-crosslinked-nanosilica for uranyl removal from water[J]. Bioresource Technology, 2019, 278: 124-129. Doi:10.1016/j.biortech.2019.01.052 |
| [22] |
应博, 林国林, 金兰淑, 等. 玉米芯生物炭对2, 4-D在土壤中吸附性能的研究[J]. 环境科学学报, 2015, 35(5): 1491-1497. |
| [23] |
张默, 贾明云, 卞永荣, 等. 不同温度玉米秸秆生物炭对萘的吸附动力学特征与机理[J]. 土壤学报, 2015, 52(5): 1106-1115. |
| [24] |
常春, 王胜利, 郭景阳, 等. 不同热解条件下合成生物炭对铜离子的吸附动力学研究[J]. 环境科学学报, 2016, 36(7): 2491-2502. |
| [25] |
王震宇, 刘国成, Xing M, 等. 不同热解温度生物炭对Cd(Ⅱ)的吸附特性[J]. 环境科学, 2014, 35(12): 4735-4744. |
| [26] |
马迎春. 固定化生物吸附剂对重金属铜的吸附性能研究[D]. 长沙: 湖南大学, 2013.
|
| [27] |
马锋锋, 赵保卫, 钟金魁, 等. 牛粪生物炭对磷的吸附特性及其影响因素研究[J]. 中国环境科学, 2015, 35(4): 1156-1163. |
| [28] |
Sadaf S, Bhatti H N. Batch and fixed bed column studies for the removal of Indosol Yellow BG dye by peanut husk[J]. Journal of the Taiwan Institute of Chemical Engineers, 2014, 45(2): 541-553. Doi:10.1016/j.jtice.2013.05.004 |
| [29] |
Auta M, Hameed B H. Modified mesoporous clay adsorbent for adsorption isotherm and kinetics of methylene blue[J]. Chemical Engineering Journal, 2012, 198/199: 219-227. Doi:10.1016/j.cej.2012.05.075 |
| [30] |
郎印海, 王慧, 刘伟. 柚皮生物炭对土壤中磷吸附能力的影响[J]. 中国海洋大学学报(自然科学版), 2015, 45(4): 78-84. |
| [31] |
郭文娟, 梁学峰, 林大松, 等. 土壤重金属钝化修复剂生物炭对镉的吸附特性研究[J]. 环境科学, 2013, 34(9): 3716-3721. |
 2021, Vol. 38
2021, Vol. 38 


