2. 中国林业科学研究院湿地研究所 湿地生态功能与恢复北京市重点实验室, 北京 100091
2. Beijing Key Laboratory of Wetland Ecological Function and Restoration, Institute of Wetland Research, Chinese Academy of Forestry, Beijing 100091, China
中国化肥利用率较低,这不仅造成资源的浪费和农业经济效益下降,也造成了严重的环境污染。缓释肥研发与使用能有效提高肥料养分利用率,减少氮磷流失[1]。根据缓释包膜肥料包膜材料是否含有养分,可将缓释包膜肥料分为2类:一类包膜材料含有营养元素,例如硫包尿素、生物炭包膜尿素、钙镁磷包膜碳铵、磷酸镁铵包覆尿素、超微细磷矿粉包膜尿素等[1-2];另一类包膜材料不含养分,例如聚乳酸包膜尿素等[1]。含养分包膜材料不仅可以控制氮释放效果,还可以提供额外养分,越来越引起关注。例如,石灰性土壤中磷酸盐离子容易被微生物固定和非生物固定[3], 以及淋溶、径流损失[4],通过在富磷土壤中施用含磷包膜材料缓释包膜尿素可以满足作物生长对氮磷的需求。所以,开发缓释氮磷肥对满足富磷土壤施肥需求具有较好的应用前景。
采用鸟粪石沉淀方法从废水和尿液中回收磷作为农业磷肥替代产品得到广泛关注[5-6]。鸟粪石不仅含有大约10%的磷,也含有大约4%氮、10%镁、0.3%钾等作物必需营养元素[7-8],具有复合肥特征。生物炭也含有多种营养成分,38种生物炭分析发现其含磷介于0.13~42.79 g/kg[9]。生物炭结构稳定、多孔、比表面积大,同时具有大量的表面负电荷以及高电荷密度特性,具有较强吸附土壤阴阳离子的能力[5]。土壤施用生物炭影响土壤磷吸附-解吸、微生物活性[10],进而影响土壤磷生物有效性。生物炭包膜尿素不仅能减少氮淋溶,也能减少氨挥发,进而提高氮肥利用率[2]。因此,以鸟粪石、生物炭作为包膜材料的缓释肥料,不仅具有氮磷营养复合肥特征,而且可能减少氮磷流失。本研究采用静水培养方法,结合土柱间歇淋溶试验考察鸟粪石包膜尿素以及鸟粪石结合生物炭包膜尿素的氮磷释放特性,为高氮低磷缓释肥料的研发和农用提供支撑依据,为生物炭及废水回收的鸟粪石高附加值利用提供新途径。
1 材料与方法 1.1 缓释肥料的制备以尿素作为肥芯,以鸟粪石、生物炭作为包膜材料,制备缓释肥料。鸟粪石pH6.72,含氮37.7 g/kg,总P108 g/kg,Mg97.64 g/kg,Ca3.93 g/kg,K3.27 g/kg。生物炭pH10.08,含氮6.2 g/kg,总P2.97 g/kg,Mg7.85 g/kg,Ca2.71 g/kg,K10.08 g/kg,含Olsen-P275 mg/kg。向不锈钢小型包衣机中加入缓释肥内芯(占缓释肥重量60%~80%),开启转机旋转搅拌,喷涂黏结剂溶液,随后分批加入包膜材料(占缓释肥重量20%~40%),直到包膜材料全部包覆完为止,随后将其加入塑料容器,嵌入螺旋振荡仪中,向容器中分批加入可降解树脂并风干。再采用高压喷枪并升温使得微晶蜡呈熔融状态,在肥料最外层喷涂包裹微晶蜡层。利用此方法分别制备鸟粪石包膜缓释尿素(USR)、鸟粪石与低比例生物炭包膜缓释尿素(USB1R,含生物炭5%)和鸟粪石与高比例生物炭包膜缓释尿素(USB2R,含生物炭7.5%)3种缓释肥。通过筛分获得4~5 mm粒径的缓释肥作为供试肥料。
1.2 静水培养试验分别称取每种缓释肥样品各10.00 g,放入150 μm (100目)的尼龙袋中,封口后放入250 mL玻璃瓶中,加水200 mL后,加盖密封,置于25 ℃的生化恒温培养箱中静置培养。培养24 h后,将尼龙网袋取出,用水冲洗尼龙网袋3次,将冲洗水倒入玻璃瓶中,再将溶液充分摇匀后移250 mL容量瓶中,冷却至室温后定容,供分析全氮用。将尼龙网袋放入另一个250 mL玻璃瓶中,再向瓶中注200 mL水,加盖密封后放入培养箱中继续培养至下一次取样。静水培养试验取样时间为24 h、3、5、7、10、13、16、19、22、25、28、35、42 d,保证累计养分溶出率达80%以上。分别计算肥料初期溶出率,微分溶出率,及28 d累计溶出率[11-12]。
| $ \begin{array}{l} 初期溶出率 = \frac{第1天溶出的养分量}{样品中该养分的总含量} \times 100\% , \\ 微分溶出率 = \frac{{\frac{7 d溶出的养分量}{样品中该养分的总含量} \times 100\% - 初期溶出率}}{放置天数-1}。\end{array} $ |
采用土柱淋溶试验调查缓释肥和尿素在土壤中氮磷释放特征。试验土壤采自北京市怀柔区邓各庄村蔬菜地,土壤类型为潮土,土壤pH 8.24,全氮0.39 g/kg,全磷0.21 g/kg,Olsen-P 85 mg/kg。试验共设5个处理,分别为空白不施肥处理(CK)、普通尿素(U)、鸟粪石包膜缓释尿素(USR)、鸟粪石与低比例生物炭包膜缓释尿素(USB1R)、鸟粪石与高比例生物炭包膜缓释尿素(USB2R)。每个处理设4次重复。
土柱淋溶试验参照吕静等的方法[13]。选用30 cm长、内径2.65 cm的PVC管作为土壤淋洗柱。为防止淋洗过程柱中土壤流出进入滤液中,在PVC管底部包裹一块200目的纱网。预先将33 g土壤与一种肥料混匀形成土壤肥料混合样备用。向土柱中依次加入10 g石英砂,97 g土,33 g土壤肥料混合样,再加10 g石英砂覆盖。将装好的每个土柱PVC管底部分别接一个玻璃漏斗,并与锥形溶液收集器连接,用于收集淋洗液。向每个土柱加39 mL水,使土壤含水量达到田间持水量(土壤饱和含水率为30%),放置24 h使柱中土壤平衡稳定。随后向每个土柱加水40 mL,收集淋溶水(大约需4 h)作为土柱培养第1天淋洗液;土柱继续培养至下次取样时间(第3天),再加水40 mL,收集淋洗液;如此继续直到完成6次淋洗。试验过程中分别在1、3、7、14、21、28 d收集淋溶水,测定养分含量。每个土柱添加肥料量,通过肥料加入土壤氮磷量,以及施肥提高土壤氮磷浓度见表 1。
|
|
表 1 不同处理中添加肥料量、添加氮磷量及土壤氮磷浓度增加量 Table 1 Amounts of added fertilization, added N and P in soil column, and increasing concentrations of N and P in various fertilized soils |
试验前本底土壤分析:土壤磨碎,过1 mm和100目筛。土壤pH用pH计(Hanna,Italy)测定(土水比1:2.5)。土壤全氮用凯氏定氮法(半微量开氏法)测定[14]。全磷采用钼蓝比色法进行测定[15]。土壤有效磷用0.5 mol/L NaHCO3溶液浸提[16],钼蓝比色法测定[15]。
生物炭分析:分析生物炭方法与分析土壤相同。
鸟粪石分析:鸟粪石pH用pH计(Hanna,Italy)测定(固水比1:5)。称取0.1 g鸟粪石溶于50 mL, 1 mol/L HCl中[8];采用过硫酸钾氧化-紫外分光光度法测定溶液全氮,ICP-OES测定溶液TP,Mg,Ca,K。
土壤淋洗液分析:每次收集的淋溶液,当天测定其全氮,NH4+-N和NO3--N。过硫酸钾氧化-紫外分光光度法测定淋洗液中全氮,水杨酸次氯酸钠光度法测定淋洗液中NH4+-N, 双波长紫外分光光度法测定淋溶液NO3--N[17]。钼蓝比色法测定淋洗液中无机磷[15]。
淋洗试验结束后土壤分析:淋洗试验结束后,从土柱中取出土壤,风干,磨碎,过16目和100目筛。2 mol/L KCl溶液浸提土壤NH4+-N和NO3--N。水杨酸次氯酸钠光度法测定NH4+-N,双波长紫外分光光度法测定NO3--N [17]。土壤有效磷用0.5 mol/L NaHCO3溶液浸提[16],钼蓝比色法测定[15]。
1.5 数据处理与分析土壤NH4+-N和NO3--N之和获得土壤无机氮。
土壤中肥料氨挥发氮量=土壤施氮量- (肥料氮淋溶量+肥料在土壤中残留氮量+反硝化损失量)。由于反硝化作用产生的氧化亚氮占土壤施氮量的比例很小,大约1%[18],本研究忽略不计。其中,肥料氮淋溶量为施肥处理和CK处理土柱氮淋溶量的差值;肥料在土壤中残留氮量是施肥处理与CK处理土壤总氮的差值。
肥料在土壤中氨挥发率=氨挥发氮/施氮量×100%。
肥料N表观释放率=(肥料N淋溶量+肥料转化的NO3--N在土壤中残留量+肥料转化的NH4+-N在土壤中残留量+肥料在土壤中的氨挥发量)/施氮量×100%。
用SPSS软件统计分析中的LSD方法检验肥料(施肥)处理间差异显著性。用SAS (SAS Inc., NC, version 9.4)软件中统计分析的MIXED model分析不同采样时间与各处理间的交互作用。用SigmaPlot 12.5软件和Excel2010软件进行制表作图。
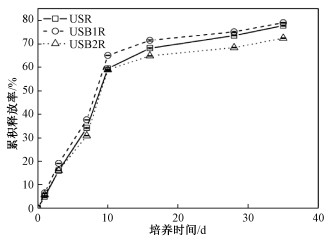
2 结果与分析 2.1 缓释肥中氮在静水培养中释放率特征本研究考察静水培养过程中缓释肥氮释放速率,以此评价本研究制备的3种肥料缓释性能。从图 1可以看出,第1天,3种肥料氮释放率均小于15%,第28天时USR、USB1R释放率达75%以上,USB2R释放率接近75%,第35天3种肥料释放率均达到80%以上。USR、USB1R、USB2R肥料第1天初始溶出率分别为4.8%、6.5%、5.7%,微分溶出率分别为2.2%、2.0%、1.5%。USR、USB1R和USB2R缓释肥28 d氮累积释放率分别为73.5%、68.4%和75.1%,而35 d氮累积释放率分别为77.8%、79.0%和72.4%。
|
Download:
|
| 图 1 不同缓释肥静水培养氮累积释放率 Fig. 1 Cumulative release rate of nitrogen in slow-release fertilizers under hydrostatic culture | |
从图 1可以看出,本研究制备的缓释肥料,在第1~第7天氮累积释放曲线斜率较大,表明静水培养最初7 d肥料氮处于快速释放阶段;在第7~第10天氮累积释放曲线斜率最大,说明该时期缓释肥处于养分最大释放阶段;第10~第35天养分累积释放曲线斜率明显下降,但是斜率处于稳定,表明肥料在10 d以后低速均匀释放氮;35 d后缓释肥75%氮素都得以释放。
静水培养条件下肥料氮的累积释放率处理与培养时间之间交互作用显著(p < 0.05)。整个时期USB1R肥料氮累积释放率都显著高于USR和USB2R(p < 0.05,);除第3和第10天外,USR的氮累积释放率显著高于USB2R(p < 0.05)。3种肥料28 d氮累积释放率依次为:USB1R>USB2R>USR (p < 0.05)。
2.2 缓释肥在土壤中氮磷释放特征 2.2.1 肥料在土壤中磷释放特征由表 2可见,在28 d培养淋溶各时间段,无肥料处理(CK)土壤也有无机磷(PO43-)淋溶,总体来讲随着培养淋溶时间延长,土壤PO43-淋溶量越多,这主要来自土壤本身PO43-,及培养过程中有机磷矿化形成的PO43-。整个培养淋溶期间,施用尿素U处理土壤PO43-淋溶量均大于CK处理。
|
|
表 2 不同施肥处理土壤无机磷淋溶量(μg/柱)的动态变化 Table 2 Dynamics of inorganic phosphorus leaching amount (μg/soil column) in different fertilized soils |
统计分析表明,无机磷(PO43-)淋溶量施肥处理效应(p < 0.01)、培养时间效应均达到显著性水平(p < 0.01),施肥处理与培养时间之间也存在显著的交互作用(p < 0.01)。培养淋洗试验前7 d,所有处理无机磷淋溶量较多,表明该时间段土壤本身无机磷容易被淋洗,肥料中磷释放快,并被淋洗;从试验第7天开始,每隔7 d CK处理土柱无机磷淋溶量逐渐增加,而施肥处理土柱无机磷淋溶量却逐渐减少,3种含磷缓释肥无机磷淋溶量减少尤其明显。
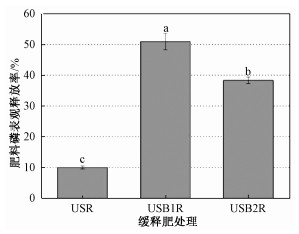
在整个淋洗试验期间,施肥处理(U、USR、USB1R、USB2R)无机磷淋溶量均大于CK处理;除第21天以外,其他时间段USB1R无机磷淋溶量均最高;其他3个施肥处理磷淋溶量(U、USR、USB2R)之间相对大小与培养时间有关。淋洗试验第1天,USB2R、USR处理无机磷淋溶量大于U处理,但是USB2R、USR处理之间差异不显著;淋洗试验进行到第3天,无机磷淋溶量USB2R>U>USR; 淋洗试验进行到第7天,无机磷淋溶量USR>USB2R>U; 淋洗试验进行到第14天,无机磷淋溶量U>USB2R、USR;淋洗试验进行到第21天,无机磷淋溶量USB2R>U>USR;淋洗试验进行到第28天,无机磷淋溶量U>USR、USB2R。3种缓释肥料无机磷淋溶量之间存在显著差异(p < 0.05),28 d土壤培养累计无机磷淋溶量依次:USB1R>USB2R>USR;3种缓释肥料无机磷表观释放率之间也存在显著差异(p < 0.05),无机磷释放率依次:USB1R(50.9%)>USB2R (38.3%)>USR(10.0%)(图 2)。
|
Download:
|
| 图 2 肥料在土壤中无机磷表观释放率 Fig. 2 Apparent release rate of inorganic phosphorus from fertilizers in soils | |
可见,本研究制备3种缓释肥在土壤中无机磷释放速率都是前7 d是快速释放期,随后开始下降,直到28 d进一步下降。
2.2.2 肥料在土壤中氮释放特征由表 3可见,在28 d培养淋溶各时间段,不施肥CK处理土壤也有大量的氮被淋洗出来;其绝大多数来自土壤有机氮、少量来自NO3--N,以及痕量NH4+-N;因为土壤淋洗出NO3--N很少,NH4+-N痕量(表 4,表 5)。在28 d培养淋溶各时间段,施U处理土壤氮淋溶量都大于CK处理,尤其是前3 d(表 3)。这种差异不仅来自NO3--N、NH4+-N差异,可能也来自尿素的溶解,随后被淋洗出土壤。因为土壤淋溶出无机氮(NO3--N,NH4+-N)远低于总氮(表 3~表 5)。
|
|
表 3 不同施肥处理土壤总氮淋溶量(mg/柱)的动态变化 Table 3 Dynamics of total nitrogen leaching amount (mg/column) in different fertilized soils |
|
|
表 4 不同施肥处理土壤NH4+-N淋溶量(μg/柱)的动态变化 Table 4 Dynamics of NH4+-N leaching amount (μg/column) in different fertilized soils |
|
|
表 5 不同施肥处理土壤NO3--N淋溶量(mg/柱)的动态变化 Table 5 Dynamics of NO3--N leaching amount (mg/column) in different fertilized soils |
统计分析表明,土柱总氮淋溶量施肥处理效应、培养时间效应均达到显著性水平(p < 0.01),施肥处理与培养时间之间也存在显著的交互作用(p < 0.01)。在整个培养淋洗试验期间,施肥处理(U、USR、USB1R、USB2R)土柱总氮淋洗量均显著大于CK;培养淋洗第1天,3种缓释肥总氮淋溶量均小于U处理,随后3种缓释肥总氮淋溶量均大于U处理。3种缓释肥总氮淋溶量与肥料种类、培养淋溶时间有关。培养淋溶前3 d,总氮淋溶量:USB2R>USB1R、USR;培养淋溶第7天,3种缓释肥总氮淋溶量差异不显著;培养淋溶第14天,总氮淋溶量:USR>USB1R>USB2R;培养淋溶第21、28天,总氮淋溶量:USR>USB1R、USB2R。3种缓释肥料总氮淋溶量之间稍有差异,28 d土壤培养累计总氮淋溶量USB1R最少,USR最多。
3种缓释肥处理土壤总氮淋溶速率在前7 d最大,在7~21 d时期有所下降,到28 d进一步下降。说明3种缓释肥氮快速释放期在前7 d。可见,本研究制备3种缓释肥在土壤中氮、磷释放速率基本同步,都是前7 d是快速释放期,随后开始下降,直到28 d进一步下降。
表 4统计分析表明,土柱NH4+-N淋溶量施肥处理效应、培养时间效应均达到显著性水平(p < 0.01),施肥处理与培养时间之间也存在显著的交互作用(p < 0.01)。在培养淋洗试验期间,施肥处理(U、USR、USB1R、USB2R)土柱NH4+-N淋洗量均显著大于CK。在培养淋洗试验前7 d,3种缓释肥NH4+-N淋溶量均显著小于U处理,随后培养淋洗NH4+-N淋溶量则相反,3种缓释肥NH4+-N淋溶量均显著大于U处理。3种缓释肥NH4+-N淋溶量与肥料种类、培养淋溶时间有关。培养淋洗前3 d,3种缓释肥NH4+-N差异不明显;培养淋溶第7天,NH4+-N淋溶量:USB2R>USB1R>USR;培养淋溶第14天,NH4+-N淋溶量:USB2R>USR>USB1R;培养淋溶第21,28天,NH4+-N淋溶量:USR>USB1R>USB2R。3种缓释肥料NH4+-N淋溶量之间存在差异,28 d土壤培养累计NH4+-N淋溶量USR显著大于USB1R、USB2R(p < 0.05),USB1R处理NH4+-N淋溶量稍大于USB2R。
培养淋溶试验前7 d,3种缓释肥NH4+-N淋溶量均较小,从培养淋溶第14天开始,3种缓释肥NH4+-N淋溶量急剧增加,在第21天达到最大值,第28天,USR、USB2R肥料NH4+-N淋溶量稍有下降,而USB1R稍有增加。28 d培养淋溶期间,USR处理NH4+-N淋溶量最大,其次是USB1R,而USB2R最低。
表 5统计分析表明,NO3--N淋溶量施肥处理效应、培养时间效应均达到显著性水平(p < 0.01),施肥处理与培养时间之间也存在交互作用(p < 0.01)。在培养淋洗试验期间,USR、USB1R、USB2R处理NO3--N淋洗量均显著大于CK;前7 d U处理NO3--N淋洗量与CK差异不显著,随后培养淋溶期间U处理NO3--N淋洗量大于CK。培养淋溶第1天,USR、USB2R处理NO3--N淋洗量大于U处理,而USB1R与U处理差异不明显;培养淋溶第3天,USR处理NO3--N淋洗量大于U处理,USB1R、USB2R处理NO3--N淋洗量与U处理差异不明显;培养淋溶第7天,USB1R、USB2R处理NO3--N淋洗量大于U处理,USR处理与U处理差异不明显;培养淋溶第14天,USB1R处理NO3--N淋洗量小于U处理,USR、USB2R处理NO3--N淋洗量与U处理差异不明显;培养淋溶第21天,USR、USB1R、USB2R处理NO3--N淋洗量都小于U处理;培养淋溶第28天,USR、USB2R处理NO3--N淋洗量都大于U处理,而USB1R小于U处理。
3种缓释肥处理NO3--N淋洗量差异与培养时间有关。培养淋溶第1天,USR、USB2R处理NO3--N淋洗量大于USB1R,但USR与USB2R差异不显著;培养淋溶第3天,USR、处理NO3--N淋洗量大于USB1R、USB2R,但USB1R与USB2R差异不显著;培养淋溶第7天,USB1R、USB2R处理NO3--N淋洗量大于USR,但USB1R与USB2R差异不显著;培养淋溶第14天,USR、USB2R处理NO3--N淋洗量大于USB1R,但USR与USB2R差异不显著;培养淋溶第21天,USR、USB1R处理NO3--N淋洗量大于USB2R,但USR与USB1R差异不显著;培养淋溶第28天,NO3--N淋洗量USR>USB2R>USB1R。
3种缓释肥料NO3--N淋溶量之间存在差异,28 d土壤培养累计NO3--N淋溶量依次:USR>USB2R>USB1R(p < 0.05)。
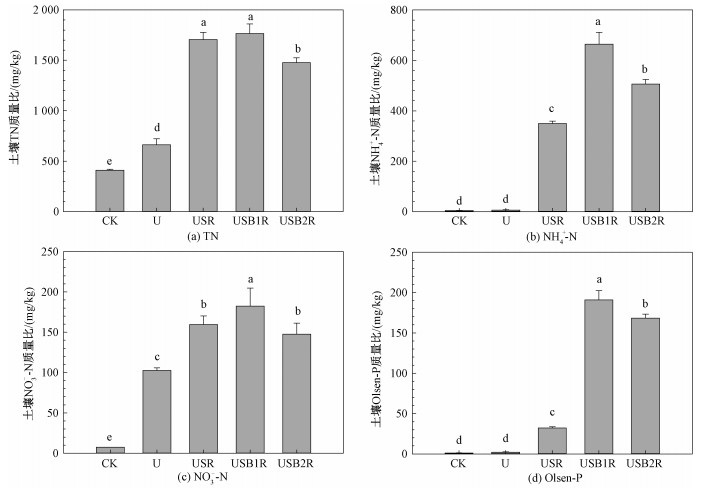
2.2.3 不同肥料施用对土壤氮磷浓度的影响28 d培养淋洗试验结束后,土壤各种形态氮浓度与施肥处理如图 3所示。土壤总氮浓度USR、USB1R>USB2R>U>CK; 土壤NH4+-N浓度USB1R>USB2R>USR>U、CK; 土壤NO3--N浓度USB1R>USR、USB2R>U>CK。淋洗试验结束后,土壤Olsen-P浓度USB1R>USB2R>USR>U、CK。
|
Download:
|
| 图 3 淋洗试验结束后不同施肥处理土壤TN、NH4+-N、NO3--N、Olsen-P浓度比较 Fig. 3 Concentrations of TN, NH4+-N, NO3--N, and Olsen-P in different fertilized soils collected after the leaching experiments | |
由图 4可知,不同肥料种类氨挥发量有极显著差异。尿素处理氨挥发量占施氮量83.1%,显著大于3个缓释肥处理氨挥发量USR(44.6%)、USB1R(44.5%)、USB2R(52.8%)。在3个缓释肥处理中,氨挥发量USB2R大于USR、USB1R处理,而USR、USB1R处理间差异不显著。

|
Download:
|
| 实验前本底土壤氮浓度:420 mg N/kg土,土壤施氮量3 076.92 mg N/kg土(400 mg N/柱);土壤中肥料氨挥发量=土壤施氮量-肥料氮淋溶量-肥料在土壤中残留氮量。 图 4 不同肥料在土壤中氨挥发量估计值 Fig. 4 Estimated values for the ammonia volatilization of different fertilizers in soil | |
由图 5可知,不同肥料种类氮表观释放率差异明显。尿素表观氮释放率94.9%,显著大于3种缓释肥氮表观释放率USR(74.0%)、USB1R(83.1%)、USB2R(86.2%)。在3个缓释肥处理中,氮表观释放率USB2R、USB1R大于USR,但是USB1R与USB2R处理间差异不显著。

|
Download:
|
| 肥料N表观释放率(%)=(肥料N淋溶量+肥料形成的NO3--N在土壤中残留量+肥料形成的NH4+-N在土壤中残留量+肥料在土壤中氨挥发)/施氮量(3 076.92 mg N/kg)。 图 5 不同肥料在土壤中氮释放率 Fig. 5 Nitrogen release rates of different fertilizers in soil | |
土壤无机氮磷增量法是评价缓释肥在土壤中养分释放特征常用方法[19]。由于土壤对肥料释放出的NH4+、NO3-、PO43-离子具有吸附作用,以及肥料中释放的氮,部分以氨挥发形式而损失。因此,淋溶液收集氮、磷仅为缓释肥料在土壤中释放的部分养分。尽管如此,不同肥料在土壤中氮磷淋溶量,仍可以比较不同肥料在土壤中氮磷释放速率相对大小。
3.1 缓释肥中磷释放与淋溶特征本研究制备的3种肥料处理土壤无机磷淋溶速率都是前7 d最大;前7 d USR、USB1R、USB2R处理无机磷淋溶累积量分别为11.97、18.89、15.11 μg/柱,占其28 d培养期无机磷淋溶累积量的76.2%、71.8%、76.6%。表明,前7 d是缓释肥中磷快速释放期,14 d以后属于慢速释放期,即3种肥料具有缓释特性。3种肥料中磷的释放曲线呈“S”型,与已报道的缓释肥养分释放曲线相似[1, 20]。
整个培养淋溶期间,施用尿素U处理土壤PO43-淋溶量均大于CK处理。这种差异主要是由于施尿素为土壤溶磷微生物提供氮源,尿素发生水解产生铵态氮时比用硝态氮作氮源时溶磷能力高很多,促进了土壤中无机磷的溶解,进而导致更多PO43-被淋溶。Roos等[21]研究证实,土壤溶磷微生物的溶磷能力与培养基中所用氮源密切相关,施用氨态氮比硝态氮土壤溶磷微生物溶磷能力大,这是由于铵氮硝化降低了土壤pH的缘故。
3种缓释肥中无机磷淋溶量、释放速率存在明显差异,无机磷淋溶量和释放率依次:USB1R>USB2R>USR。3种缓释肥处理无机磷淋溶、释放速率差异是由缓释肥材料中无机磷含量,以及生物炭对土壤磷、包膜材料中磷转化影响共同作用的结果。缓释肥料包膜中生物炭对其磷释放及淋溶有3个方面的影响。第一,生物炭本身含有磷[10]。本研究缓释肥料中包膜材料生物炭含总磷2.97 g/kg,Olsen-P 275 mg/kg; 包膜材料生物炭比例越高(USB1R含生物炭5%,USB2R含生物炭7.5%),将有更多潜在被淋溶磷。第二,生物炭可以促进微生物活性,诱导有机磷矿化形成更多无机PO43-,进而导致更多PO43-释放及淋溶[10]。第三,生物炭对PO43-有很强吸附能力,其可减少PO43-淋溶。因此,包膜材料生物炭及其用量对本研究制备的缓释肥PO43-淋溶的影响应该是上述3种机理综合效应。USB1R处理土壤PO43-淋溶量(23.53 μg/柱)显著大于USR处理(15.70 μg/柱)(p < 0.05)。这种差异有两个原因:一是USB1R处理输入土壤P(37 mg/柱)大于USR处理(31 mg/柱);二是USB1R处理中包膜材料生物炭可能促进微生物活性,进而促进土壤有机磷分解[10],形成更多无机PO43-而淋溶。因为USB1R处理磷表观释放率50.9%,显著大于USR处理磷表观释放率(10%)。USB1R处理土壤PO43-淋溶量(23.53 μg/柱)也显著大于USB2R处理(19.72 μg/柱)(p < 0.05)。这种差异不是由于这2种缓释肥添加到土壤磷含量的差异所致,因为USB1R处理向土壤输入磷(37 mg/柱)低于USB2R处理(43 mg/柱)。这种差异原因可能是由于USB2R缓释肥中生物炭比例大于USB1R,过多生物炭吸附土壤中PO43-,减少PO43-淋溶。USB2R中磷在土壤中表观释放率38.3%,显著低于USB1R中磷释放率(50.9%)。
综上可知,针对肥料无机磷释放来讲,本研究制备的USB1、USB2R、USR肥料都具有缓释特征;3种肥料在土壤中无机磷释放速率存在差异,依次为:USB1>USB2R>USR。
3.2 缓释肥料氮释放与淋溶特征缓释肥料国标列出了氮释放评价标准及建议方法[11];静水培养试验是推荐的方法之一,常被用来检验缓释肥料缓释性能[11]。本研究制备的肥料静水培养氮释放速率为68.4%~75.1%,低于生物质炭包膜控释尿素[22],与工业木质素包膜缓释尿素相当,其28 d养分释放率达到73.8%[20]。这种差异主要是由于缓释肥料包膜材料以及包膜工艺差别。本研究采用鸟粪石,以及鸟粪石与生物炭作为包膜材料,并采用分层包膜工艺,充分利用生物炭吸附,控制养分快速释放。USR、USB1R、USB2R肥料第一天初始溶出率分别为4.8%、6.5%、5.7%,微分溶出率分别为2.2%、2.0%、1.5%;USR、USB1R在28 d内氮释放率不超过75%,USB2R肥料氮释放率接近75%,在35 d内3种肥料释放率均接近80%(图 1)。3种肥料氮释放均符合缓释肥料国标(GB/T 23348—2009)要求(初期养分释放率≤15%,微分溶出率为(0.25%~2.5%)/d,28 d累积养分释放率≤80%,养分释放期的累计养分释放率≥80%)[11]。因此,本研究制备的3种肥料均可属于缓释肥料。
本研究制备的3种肥料处理土壤氮淋溶速率都是前7 d最大,随后开始下降,到28 d进一步下降,说明,前7 d是缓释肥氮快速释放期,14 d以后属于慢速释放期,即3种肥料具有缓释特性。可见,3种肥料中氮的释放曲线呈“S”型,与已报道的缓释肥养分释放曲线相似[1, 20]。
本研究制备的3种缓释肥氮释放速率存在差异,单独用鸟粪石包膜尿素氮(USR)释放速率显著低于生物炭-鸟粪石包膜尿素(USB1R、USB2R),USB2R肥料氮释放速率稍微大于USB1R肥料,但是差异没有达到显著水平。这种差异主要是由于包膜材料成分差异所致。USB1R、USB2R肥料包膜成分中含有生物炭,生物炭具有丰富空隙结构和巨大表面积,具有良好吸水和保水性能[23]。亲水性包膜材料,有利于尿素吸水溶解而被释放[1]。
缓释氮肥通过尿素溶解、尿素水解并转化为NH4+-N,NH4+-N转化为NO3--N而释放,部分NH4+-N转化为NH3而挥发[24-25]。在28 d培养淋溶各时间段,3种缓释肥处理土壤总氮淋溶量显著大于无机氮(NH4+-N+NO3--N)。表明土壤淋溶氮部分是缓释肥中尿素的溶解,随后被淋洗出土壤。吕静等[13]采用土柱培养间隙淋洗方法研究不同含氮量聚乳酸包膜尿素氮释放特征时发现尿素态氮占氮淋溶量4.8%~26.1%。吕东波等[24]采用土柱培养间隙淋洗方法研究3种缓释尿素氮释放特征时发现尿素态氮占氮淋溶量14.6%~20.8%。本研究发现,土柱培养淋溶期间,土壤淋溶出NH4+-N显著大于NO3--N淋出量。吕静等[13]也观察到NH4+-N淋出量是NO3--N的40.7~254.8倍;吕东波等[24]也发现NH4+-N淋出量是NO3--N的8.0~9.9倍。土柱培养间隙淋洗方法研究缓释肥氮释放特征中NH4+-N淋出量显著大于NO3--N主要原因是土柱培养淋溶期间频繁添加淋溶水,土壤基本处于水分饱和状态,土壤通气和供氧受到阻碍,致使硝化作用不能正常进行,尿素水解形成的NH4+-N不能及时转化为NO3--N,土壤积累大量NH4+-N,而被淋溶[13, 24]。培养实验结束后,施肥处理3种缓释肥处理土壤NH4+-N浓度是NO3--N浓度的2.2~6.4倍,进一步支持了上述结果。
综上可知,针对肥料无机氮释放来讲,本研究制备的USB1R、USB2R、USR肥料都具有缓释特征;3种肥料在土壤中无机氮释放速率存在差异:USB1R、USB2R>USR;USB2R肥料氮释放速率稍微大于USB1R肥料,但是差异不显著。3种肥料氮释放均符合缓释肥料国标(GB/T 23348—2009)要求[11]。因此,均可属缓释肥料。
本研究发现尿素处理土壤氨挥发量估计值占施氮量83.1%,显著大于3个缓释肥处理氨挥发量(占施氮量44.5%~52.8%)。胡小凤等[25]研究缓释复合肥在淹水石灰性紫色土(pH 8.0)中氨挥发氮占施氮量7.6%~28.6%。本研究3种缓释氮肥氨挥发量大于上述报道结果。这种差异的可能原因包括本研究包膜材料性质差异,反硝化氮损失,以及氨挥发估计方法不同所致。本研究采用根据施氮量与肥料氮淋溶量、肥料在土壤中残留氮量差减估计,可能存在一定误差。因此,本研究缓释肥料氨挥发有待采取实测方法进一步观测。3种缓释肥氨挥发量差异明显,土柱培养淋溶期间氨挥发量USB2R大于USR、USB1R处理,而USR、USB1R处理间差异不显著。USB2R肥料氨挥发量稍高可能与该肥料包膜材料含有较高比例偏碱性生物炭(pH 10.08)有关。
可见,3种缓释肥具有氮磷缓释特征,其应用在石灰性土壤可以减少氨挥发,控制氮淋溶,有利于氮磷在土壤中残留,提高土壤氮磷供应能力。
4 结论以鸟粪石(S)、生物炭(B)包膜尿素(U)制备的缓释肥USR(含氮34.4%、含磷2.6%),USB1R(氮30.3%、含磷2.8%),USB2R(氮24.4%、含磷2.6%),具有高氮低磷特征。缓释肥在静水中(25 ℃)24 h和28 d氮释放速率分别≤15%和≤80%,符合缓释肥标准(GB/T 23348—2009)。前7 d 3种缓释肥在土壤中快速释放氮磷,随后氮磷释放速率逐渐下降。缓释肥在土壤中磷释放速率依次为:USB1R>USB2R>USR,氮释放速率USB2R、USB1R>USR。缓释肥氮释放速率比尿素低9~21个百分点。鸟粪石及其与生物炭结合包膜尿素氮磷具有缓释性,其氮磷释放特征参数对指导缓释肥应用具有参考价值。这些研究结果有待通过田间试验进一步验证。
| [1] |
刘宝存, 徐秋明, 邹国元. 缓控释肥料理论与实践[M]. 北京: 中国农业科学技术出版社, 2009.
|
| [2] |
Wang H H, Hu Z Y, Zhu X Q, et al. A comparative study of nitrogen loss after application of biochar coated urea and common urea in vegetable-growing soil at Chaihe catchement of Dianchi lake[J]. Agricultural Science and Technology, 2015, 16(12): 2688-2692, 2804. |
| [3] |
Balemi T, Negisho K. Management of soil phosphorus and plant adaptation mechanisms to phosphorus stress for sustainable crop production:a review[J]. Journal of Soil Science and Plant Nutrition, 2012, 12(3): 547-562. |
| [4] |
Heathwaite A L, Dils R M. Characterising phosphorus loss in surface and subsurface hydrological pathways[J]. Science of the Total Environment, 2000, 251: 523-538. |
| [5] |
Stratful I, Scrimshaw M D, Lester J N. Conditions influencing the precipitation of magnesium ammonium phosphate[J]. Water Research, 2001, 35(17): 4191-4199. Doi:10.1016/S0043-1354(01)00143-9 |
| [6] |
Liu X N, Tao Y, Wen G Q, et al. Influence of soil and irrigation water pH on the availability of phosphorus in struvite derived from urine through a greenhouse pot experiment[J]. Journal of Agricultural Food Chemistry, 2016, 64(17): 3324. Doi:10.1021/acs.jafc.6b00021 |
| [7] |
Liu X N, Wen G Q, Hu Z Y, et al. Coupling effects of pH and Mg/P ratio on P recovery from anaerobic digester supernatant by struvite formation[J]. Journal of Cleaner Production, 2018, 198: 633-641. Doi:10.1016/j.jclepro.2018.07.073 |
| [8] |
Wen G Q, Hu Z Y, Liu X N, et al. Improvement of the quality of struvite crystals recovered from a mixture of human urine and municipal sewage via a novel two-step precipitation method[J]. Environmental Technology & Innovation, 2018, 12: 80-90. |
| [9] |
Gul S, Whalen J K, Thomas B W, et al. Physico-chemical properties and microbial responses in biochar-amended soils:mechanisms and future directions[J]. Agriculture Ecosystems & Environment, 2015, 206: 46-59. |
| [10] |
Zhu J, Li M, Whelan M. Phosphorus activators contribute to legacy phosphorus availability in agricultural soils:a review[J]. Science of the Total Environment, 2018, 612: 522-537. Doi:10.1016/j.scitotenv.2017.08.095 |
| [11] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.缓释肥料GB/T 23348-2009[S].北京: 中国标准出版社, 2009.
|
| [12] |
尹洪斌, 石元亮. 缓释肥料的研制及其缓效性评价[J]. 土壤通报, 2006, 37(2): 411-413. Doi:10.3321/j.issn:0564-3945.2006.02.046 |
| [13] |
吕静, 李丹, 孙建兵, 等. 低分子量聚乳酸包膜尿素的缓释特性及其减少氨挥发的作用[J]. 中国农业科学, 2012, 45(2): 283-291. |
| [14] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
|
| [15] |
Murphy J, Riley J P. A modified single solution method for the determination of phosphate in natural waters[J]. Analytica Chimica Acta, 1962, 27: 31-36. Doi:10.1016/S0003-2670(00)88444-5 |
| [16] |
Olsen S R, Cole C V, Watanabe F S, et al. Estimation of available phosphorus in soils by extraction with sodium bicarbonate[M]. Washington DC: USDA circular 939, 1954.
|
| [17] |
国家环保局本书编委会. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社, 1989.
|
| [18] |
丁洪, 蔡贵信. 玉米-潮土系统中氮肥硝化反硝化损失与N2O排放[J]. 中国农业科学, 2001, 34(4): 416-421. Doi:10.3321/j.issn:0578-1752.2001.04.012 |
| [19] |
谢银旦, 杨相东, 曹一平, 等. 包膜控释肥料在土壤中养分释放特性的测试方法与评价[J]. 植物营养与肥料学报, 2007, 13(3): 491-497. Doi:10.3321/j.issn:1008-505X.2007.03.022 |
| [20] |
崔智多, 张小勇, 莫海涛. 工业木质素包膜缓释尿素释放规律的研究[J]. 中国农学通报, 2013, 29(30): 143-147. |
| [21] |
Roos W, Luckner M. Relationships between proton extrusion and fluxes of ammonium ions and organic acids in penicillium cyclopium[J]. Journal of General Microbiology, 1984, 130(4): 1007-1014. |
| [22] |
朱晓旭.生物质炭包膜控释尿素的制备及性能研究[D].长春: 吉林农业大学, 2016.
|
| [23] |
姚俊卿, 侯建伟, 索全义, 等. 不同炭化条件对黑沙蒿生物炭保水性能的影响[J]. 北方园艺, 2017(6): 171-176. |
| [24] |
吕东波, 吴景贵, 任玲, 等. 几种缓控尿素的养分释放特性研究[J]. 水土保持学报, 2015, 29(2): 283-287. |
| [25] |
胡小凤, 王正银, 游媛, 等. 缓释复合肥在不同土壤水分条件下氨挥发特性研究[J]. 环境科学, 2010, 31(8): 1937-1943. |
 2021, Vol. 38
2021, Vol. 38 


