2. 成都医学院结构特异性小分子药物研究四川省高校重点实验室, 四川 成都 610500
2. Sichuan Provincial Key Laboratory of Structurally Specific Small Molecule Drug Research, Chengdu Medical College, Chengdu 610500, China
群体感应(quorum sensing, QS)是细菌种内与种间传递信息的重要通讯机制。调控QS过程的信号分子称为自诱导物(auto-inducer, AI),在细菌生命活动的各个时期都有一定水平QS信号分子的分泌,只有当菌落中的细菌到达一定密度时,分泌的QS信号分子达到阈浓度才能进入细胞内激活QS系统[1],调控菌群数量与密度,影响群体细胞基因表达,通过细菌的生物发光、毒力因子的表达、生物膜的形成、耐药基因转移等多途径影响细菌生物行为,改变菌群生理、生化特性,表现出单个细胞所不具备的特征[2],赋予细菌群落特定的生物学功能[3-4]。因此,QS系统对调控细菌的生命活动具有重要作用,是细菌感染防治的重要靶点。
最新研究[5]表明,QS系统是由多个通路组成的复杂的信号网络系统。每种细菌的生命活动可通过多个QS通路调控,而每个通路又可以被多种细菌利用。由于细菌种群的差异,使用相同通路的细菌也会分泌特异的QS信号分子,这些具有活性的QS信号分子的母核相同,但侧链修饰却复杂多样。因此,分离检测这些QS信号分子尤为困难。
QS信号分子检测在海水污染、生态修复、食品安全、临床诊断等诸多领域都有广泛的应用价值[6-9],对阐明细菌QS系统,开发QS系统抑制剂,甚至最终解决细菌耐药也具有重要意义。如何准确检测(分离和表征)QS信号分子是当前QS系统研究的热点[10-11]。
因此,本文对QS信号分子结构和相应的检测方法进行综述,以期为QS系统通路与机制研究、食品安全、临床检测、生态环境等多个领域提供参考。
1 QS信号分子的结构特点QS信号分子检测以结构为基础。根据母核可将QS信号分子分为以下几类:(1)酰基高丝氨酸内酯(acyl homoserine lactone, AHLs); (2)自诱导物-2 (auto-inducer-2, AI-2);(3)自诱导肽(auto-inducing peptide, AIP); (4)其他,如喹诺酮假单胞菌信号、二酮哌嗪类化合物等。本文主要针对前三类常见的信号分子的结构特点进行介绍。见图 1。
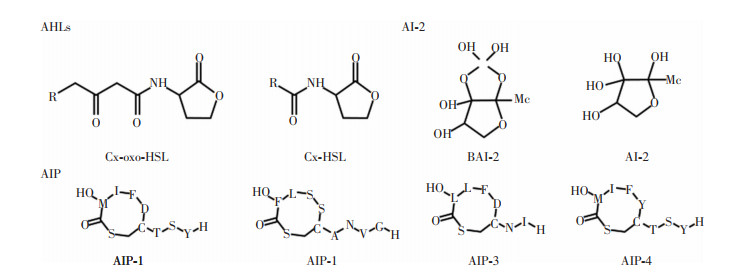 |
| 图 1 部分QS信号分子结构 |
AHLs是广泛存在于革兰阴性菌中的一种信号分子。这种信号分子通常由高丝氨酸内酯(homoserine lactones, HSL)环和可变酰基侧链两部分组成。HSL环具有亲水性,而酰基侧链则呈现出疏水性,因此AHLs分子具有两亲性[12]。这种信号分子由LuxI合成,与LuxR结合后能调节细菌下游的基因表达和生物学过程[13]。AHLs的碳链长度为4~18个不等,其中C4~C8的AHLs称为短链AHLs,C10~C18称为长链AHLs[14]。细菌不同,其产生的AHLs分子可能具有3-羟基、3-氧代、甲基等不同的侧链[13]。
1.2 AI-2类信号分子AI-2是广泛存在于革兰阳性菌、革兰阴性菌和真菌中的信号分子。因其能被两种细菌共同分泌和检测,被称为种间信号分子。已表征的具有活性的AI-2分子主要有两种,一种是能与哈维氏弧菌(V. harveyi)接收蛋白LuxP结合的含硼的(2S, 4S)-2-甲基-2, 3, 3, 4-羟基四氢呋喃酮-硼酸盐[(2S, 4S)-2-methyl-2, 3, 3, 4-tetrahydroxytetrahydrofuranborate], 另一种是能与鼠伤寒沙门菌(Salmonella typhimurium)接收蛋白LrsB结合的不含硼的(2R, 4S)-2-甲基-2, 3, 3, 4-四羟基四氢呋喃[(2R, 4S)-2-methyl-2, 3, 3, 4-tetrahydroxytetrahydrofuran][15]。由于4, 5-二羟基2, 3-戊二酮(4, 5-dihydroxy-2, 3-pentanedione, DPD)会自发进行重排,导致两种AI-2可相互转换[16],见图 2。这种转换机制的存在使细菌可以感知其他种类细菌分泌的AI-2,以实现种间交流。因此,对AI-2进行仪器检测时通常不检测其活性形式,而将其前体DPD作为检测指标。
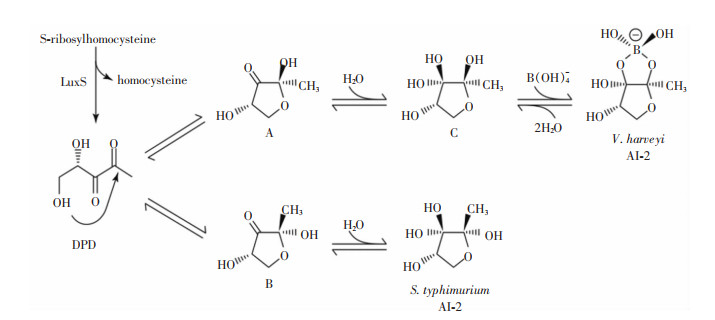 |
| 图 2 AI-2分子的形成途径 |
AIP是革兰阳性菌转录后修饰产生的短肽,其长度为7~9个氨基酸。AIP的氨基酸序列因物种而异,目前已确定至少48种不同革兰阳性菌产生的AIP序列。金黄色葡萄球菌中,不同的agrBDCA操纵子能形成四种辅助基因调节(accessory gene regulator, Agr)系统(agr-Ⅰ、agr-Ⅱ、agr-Ⅲ和agr-Ⅳ)。每个Agr系统识别不同的AIP结构,这些信号分子也被相应的称为AIP-Ⅰ~AIP-Ⅳ。四种金黄色葡萄球菌AIP的整体结构相似,每种AIP都包含一个基于半胱氨酸巯基与C端羧酸的连接而形成的五残基硫内酯环,而N末端的氨基酸是可变的,具有2~4个残基延伸[17],见图 1。AIP在环境中浓度较低,在化学介质中不稳定,且易被蛋白酶降解,对其检测有很多阻碍。
2 QS信号分子的检测方法 2.1 生物传感器法生物传感器是一种利用生物元件,如细胞、酶、抗体等,作为识别元素的传感器。在QS信号分子检测领域中,其优势在于其高度选择性、快速响应、可重复使用、易于制备和操作等,如果配合薄层色谱(TLC)可以做到检测结果可视化[18-19]。
2.1.1 AHLs的检测方式检测AHLs分子的生物传感器大部分为细菌生物传感器。细菌多数为自身不产AHLs的菌株,但却包含LuxR蛋白家族。当存在外源性的AHLs时,特定的基因被激活,从而产生生物发光、β-半乳糖苷酶、绿色荧光蛋白和紫罗兰素色素等来实现对AHLs的检测。
紫色杆菌(C. violaceum)是一种革兰阴性菌。McClean等[20]构建了一种自身不能合成AHLs,但外源性AHLs存在时能产生紫色素的紫色杆菌突变体(C. violaceum CV026),可作为检测AHLs的生物传感器。随后,在此基础上开发出一种可通过检测紫色素产生量来量化特定物种的AHLs的定量检测方法[21]。CV026是检测AHLs时最常用的细菌生物传感器,已有近200篇论文使用CV026检测革兰阴性菌QS活性[22],成为诸多研究中初步检测的手段之一。
根癌农杆菌(A. tumefaciens)是一种革兰阴性菌。类似于CV026,携带质粒pZLR4的根癌农杆菌NT1不能自发产生AHLs,但质粒pZLR4含有traR和lacZ与traG的融合物,其中traR是其转录激活因子,lacZ可以编码β-半乳糖苷酶。当外源性AHLs存在时就能产生β-半乳糖苷酶,并水解指示物5-溴-4-氯-3-吲哚半乳糖苷(X-Gal)产生蓝色不溶性物质,从而指示存在AHLs达到检测目的[23]。Zhu等[24]通过构建超表达traR的KYC55根癌农杆菌来提升检测的灵敏度,Kawaguchi等[25]用发光底物Beta-Glo替代X-Gal,将AHLs检测灵敏度提高了10倍,且大大缩短了检测耗时。根癌农杆菌也是初步检测的手段之一,且常常与紫色杆菌一起使用以达到扩大检测范围的效果。
大肠埃希菌构建的生物传感器被广泛应用于AHLs信号分子的检测中。大部分大肠埃希菌生物传感器含有发光杆菌的luxCDABE操纵子,通过生物发光来检测AHLs的存在[26]。研究[27]显示,增加调节基因数量及表达水平可显著提高生物传感器对AHLs的敏感性,由此所得到的大肠埃希菌MG1655对C6-3-oxo-HSL的敏感程度超过之前的传感菌。Wu等[28]首次构建了基于QscR QS信号系统的生物传感器,将QscR传感模块与表达增强型绿色荧光蛋白(EGFP)的报告模块集成,该生物传感器对目标细菌病原体的AHLs具有高灵敏度。此外,β-半乳糖苷酶系统构建的大肠埃希菌生物传感菌亦有相应的报道。Struss等[18]开发了一种基于pSDB908质粒的大肠埃希菌的便携式检测方法,将含有此生物传感器的悬浮液直接加到滤纸条上,干燥后将滤纸条浸入样品液以检测AHLs。滤纸条生物传感器为检测AHLs提供了一种快速便捷的方法,可用于各种环境和临床标本的初次筛选。
除了细菌生物传感器,分子印迹技术和纳米粒子也广泛应用于检测AHLs的生物传感器领域。分子印迹本质是模仿受体与配体结合的过程,将目标分子作为模板添加到聚合物中形成复合物。随着聚合物的形成,目标分子被包围并困在三维聚合物网络中,然后去除模板分子,留下与目标物种互补的选择性识别位点[29]。这种生物传感器对目标分子(AHLs)表现出的高灵敏度、重现性良好和快速响应的性质,在临床诊断和食品分析领域都具有良好的潜在应用价值[30-33]。Vasudevan等[9, 34]基于光致发光(photoluminescence),分别开发了半胱氨酸封端(cysteamine-capped)的TiO2和ZnO纳米粒子,在人工尿液介质中模拟临床尿路感染环境,检测铜绿假单胞菌的AHLs。
2.1.2 AI-2的检测方法与AHLs的检测方法类似,检测AI-2的方法通常也是构建出不能生产AI-2,但能响应外源性AI-2的生物传感器,响应后激活特定的基因,产生生物发光、β-半乳糖苷酶等产物,从而定性或定量地检测AI-2。哈维氏弧菌是一种在海洋中广泛分布的革兰阴性菌,最早由Bassler等[35]构建了哈维氏弧菌BB170作为生物传感器。用BB170检测AI-2时,只需将待测液加入到BB170培养基中,就能通过观测BB170诱导发光是否提前和强度来检测AI-2的存在。但这种方法对试验条件要求相对苛刻,结果易受培养基的pH、葡萄糖含量等因素干扰[36]。因此,Jing等[37]通过优化培养基、检测时间等因素,建立了一种BB170检测AI-2的优化方法。此外,有研究[38]构建了luxN和AI-2合成基因luxS双缺失的哈维氏弧菌BB32,该菌无法内源性合成AI-2,故能更准确检测AI-2。
基于大肠埃希菌构建检测AI-2的生物传感器也有报道。大肠埃希菌CT104是一种对AI-2高度敏感的生物传感器,其引入了质粒pCT6和pET200/DsRed,并删除了AI-2的合成(luxS)与磷酸化降解(lsrFG)的基因。质粒pCT6通过噬菌体T7 RNA聚合酶的表达来感知磷酸化AI-2的存在并对其作出反应,之后激活噬菌体T7 RNA聚合酶介导的质粒pET200/DsRed的DsRed过表达,从而产生红色的荧光蛋白用于检测外源性的AI-2[39]。Keizers等[40]在最新研究中构建了PsrA模块,克服了目前AI-2难以定量检测的局限性,对于复杂样品中的AI-2检测也适用,且相较于之前的方法操作更为简便与迅捷。
基于荧光共振能量转移的生物传感器技术是一种快速、有效的检测方法,这种方法中使用一种名为CLPY的融合蛋白,这种蛋白由AI-2的受体蛋白LuxP、青色荧光蛋白(cyan fluorescent protein, CFP)和黄色荧光蛋白(yellow fluorescent protein, YFP)组成。被检样品中AI-2与CLPY结合后,CFP和YFP之间的荧光共振能量转移会发生变化,可通过计算440 nm荧光激发后,527 nm和485 nm之间的荧光共振能量转移比例来检测AI-2。如果制备好CLPY蛋白,这种方法能快速对AI-2进行有效检测。但由于需要提纯和标记受体蛋白与额外的荧光染料,使得这种检测方式价格昂贵,且不方便进行定量测定[16]。
2.1.3 AIP的检测方法AIP检测研究主要有两个方向:通过质粒构建相应的报告菌和酶联免疫吸附测定(ELISA)检测相应的信号分子。
Lubkowicz等[41]将益生菌罗伊斯乳酸杆菌DSM20016作为载体构建了一种可以检测AIP-1的生物传感器。其原理是在P3启动子的下游插入控制葡萄糖醛酸酶表达的gusA基因。当AIP存在时,AIP与AgrC受体结合,促进转录激活因子AgrA磷酸化,随后磷酸化的AgrA与组氨酸激酶竞争结合P3,从而抑制GusA的转录,最终抑制葡萄糖醛酸酶产生。由于葡萄糖醛酸酶的表达受到抑制,无法将硝基苯β-D-葡糖苷酸转化葡萄糖醛酸。葡萄糖醛酸本身呈现为黄色,当存在AIP时,含有β-D-葡糖苷酸的溶液由黄变浅,故可通过比色的方法对AIP进行定性和定量分析。
Montagut等[42]设计合成了As380/AIPIVS-BSA抗体,该抗体对AIP-Ⅳ有高选择性,基于该抗体的酶联免疫吸附检测(ELISA)的检测能力高于质谱方法,且可应用于复杂环境,不需要任何预处理,适用于临床痰标本的诊断,也能用于高通量样品分析。各种细菌生物传感器总结见表 1。
| 表 1 细菌生物传感器检测范围及特点 |
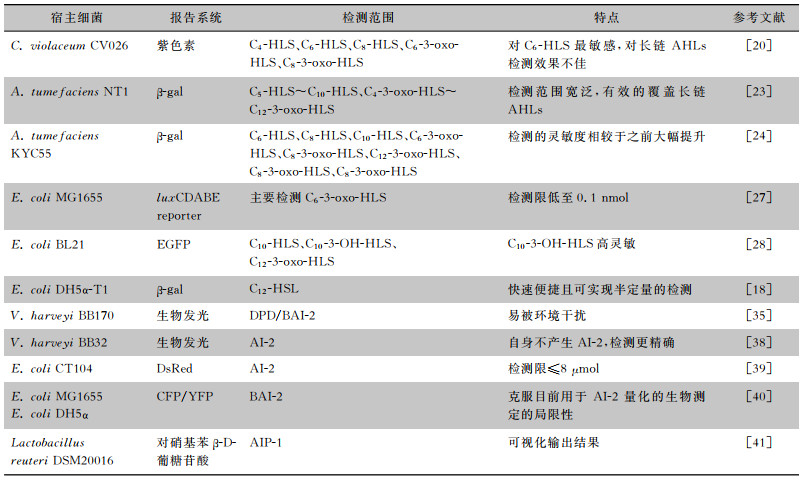
|
仪器检测法具有更高的灵敏度,并且在获取信号分子的分子式、官能团(即性质信息)的情况下,与已知QS信号分子结构进行比对可推测未知信号分子的结构,从而鉴定出新的信号分子。
2.2.1 TLC检测法TLC是分析化学中一种分离鉴定小分子化合物的常用方法,在对QS信号分子进行检测时,通常与生物传感器偶联,将报告菌、培养基和相应的显色剂混合后铺在TLC板上。改良传统的TLC方法后,显色斑点更加清晰,线性迁移率效果更好,检测分辨率更高[43]。
2.2.2 高效液相色谱-串联质谱(HPLC-MS/MS)法HPLC-MS/MS已被广泛应用于QS信号分子检测领域。HPLC-MS/MS结合了HPLC的分离能力和MS的检测技术,即使在复杂的组分中,QS信号分子也能得到有效的分离和检测。
针对AHLs的检测,由于AHL分子在第三个碳上是否有氧和侧链长度不同(见图 1)导致各AHLs分子极性不同,故能使用HPLC达到分离的目的;而质谱检测中,由于内酯环结构m/z在102处有特征离子碎片存在,且AHLs的分子量往往为172+14n,因此HPLC-MS/MS成为AHLs分子表征的良好手段。郭沐晗等[44]应用HPLC-MS/MS对副溶血弧菌的AHLs进行检测,发现在流动相中加入乙酸铵可提高分子检测的分辨率。Dal Bello等[45]基于HPLC-MS/MS开发了一种靶向和非靶向对铜绿假单胞菌细胞培养物和脓毒血症患者血浆的AHLs分子及假单胞菌喹诺酮类信号分子的定量测试。
检测AI-2的方法中,Campagna等[46]最早基于HPLC-MS/MS构建了检测临床培养物或复杂环境中DPD的方法,利用DPD与DPD标记剂(二氨基苯衍生物)反应形成喹喔啉衍生物(见图 3)并进行检测。然而,传统反应产物的化学分离特性不佳,不能有效检测。通过优化DPD标记试剂的分子结构构建DPD-M1CQ,引入醚键,可加速喹喔啉的形成,并增加MS检测过程中质子化的分子比例。随后,Xu等[47]用易商购的试剂4, 5-二甲基苯-1, 2-二胺(4, 5-dimethylbenzene-1, 2-diamine, DMBDM)作为DPD标记剂,与DPD发生反应生成1-(3, 6, 7-三甲基喹喔啉-2-基)乙烷-1, 2-二醇[(R)-1-(3, 6, 7-trimethylquinoxalin-2-yl)ethane-1, 2-diol, TMQED](见图 4)进行检测,同样显示出良好的分辨率与灵敏度。但这种方法也存在争议,因为针对AI-2的检测使用的检测指标是其前体DPD,而非AI-2本身。
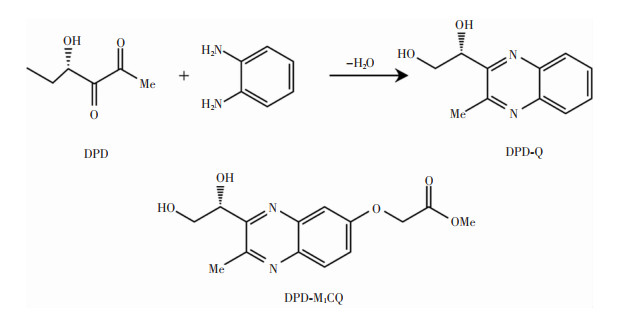 |
| 图 3 喹喔啉的形成和使用的DPD标记试剂 |
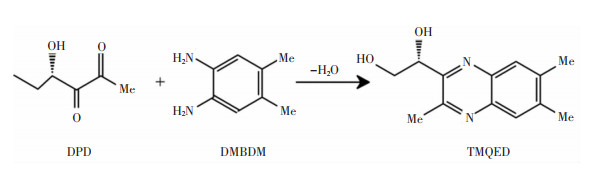 |
| 图 4 DPD与DMBDM生成TMQED |
超高效液相色谱(ultra performance liquid chromatography, UPLC)作为新一代液相色谱技术,其分辨率、分离度、分析速度和灵敏度相较于HPLC有大幅提升[48]。现如今,越来越多的QS信号分子的研究开始联用UPLC与MS来检测和表征信号分子,进行如废水[49]、微塑料[50]、小鼠胃肠道[51]等复杂环境的AHLs的检测。对在化学介质中不稳定,易受到其他化合物干扰且分泌水平本身很低的AIP,联用UPLC与MS也实现了有效检测[52-53]。最近,Rodrigues等[54]基于UPLC-MS建立了一种从细胞培养基中检测、自动识别AHLs的方法,并在此基础上应用特征分子网络(FBMN)平台和全球自然产品社交分子网络(GNPS)平台识别已知和未知的AHLs。
HPLC-MS/MS和UPLC-MS由于其良好的分离度与分辨率已经成为鉴别未知或已知QS信号分子的良好方法。但这种方法操作繁琐、耗时,且需要专业的操作人员和大型仪器设备,难以实现信号分子的实时快检,限制了其在各领域的广泛应用。
2.2.3 气相色谱串联质谱(GC-MS)法这种方法和HPLC-MS/MS的原理相似,通过气相色谱分离相应的小分子,再采用质谱检测小分子化合物的特征峰来鉴别相应的小分子化合物。GC-MS技术灵敏度高,抗干扰能力强,检测复杂样品具有很大优势[55]。Cataldi等[56]使用GC-MS法对多种细菌产生的AHLs进行检测,证明了不稳定的3-oxo-HLS的存在。Thiel等[57]采用两步衍化和同位素稀释分析方法对变形链球菌的AI-2进行检测。对于QS信号分子的检测来讲,这种方法操作较为复杂,且检测范围较窄,应用受限。
2.2.4 柱前衍生化高效液相色谱荧光检测器(HPLC-FLD)法这种方法是针对AI-2检测的特定方法,利用DPD与2, 3-二氨基萘(2, 3-diamino-naphthalene, DAN)发生衍生化反应(见图 5),生成具有特征激发和发射波长的荧光物质,然后使用HPLC-FLD对该衍生化产物进行检测。该方法具有操作简单、价格低廉、灵敏精准、线性定量分析范围较宽的优点。这种方法最早由Song等[58]报道,后经黄晓遇等[59]对试验条件进行了优化处理,建立了柱前衍生-固相萃取-高效液相色谱荧光检测法,实现了对生物脱氮工艺中痕量AI-2的定量检测。
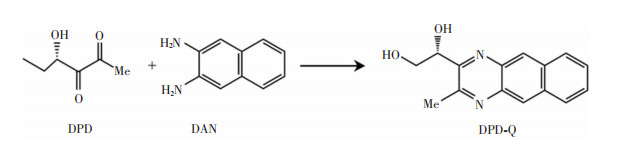 |
| 图 5 DPD与DAN的衍生化反应 |
QS信号分子种类繁多,含量低,检测难度较大,虽然目前有多种检测方法,但都存在一定的局限性(见表 2),常常需要两种方法联合使用才能实现全面精确的检测[19, 60-62]。新的检测技术如分子印迹技术、纳米粒子、酶联免疫吸附剂等方法弥补了传统方法的不足,但也存在检测范围窄、不易制备和获取等缺点。因此,进一步开发高效稳定的QS信号分子检测方法不仅对细菌QS系统机制研究具有重大科学价值,也在药学、环境、食品、临床等诸多领域具有重大的应用前景。
| 表 2 生物传感器法与仪器检测法比较 |

|
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Wang MZ, Lian YL, Wang YJ, et al. The role and mechanism of quorum sensing on environmental antimicrobial resis-tance[J]. Environ Pollut, 2023, 322: 121238. DOI:10.1016/j.envpol.2023.121238 |
| [2] |
Papenfort K, Bassler BL. Quorum sensing signal-response systems in Gram-negative bacteria[J]. Nat Rev Microbiol, 2016, 14(9): 576-588. DOI:10.1038/nrmicro.2016.89 |
| [3] |
Tobias NJ, Brehm J, Kresovic D, et al. New vocabulary for bacterial communication[J]. Chembiochem, 2020, 21(6): 759-768. DOI:10.1002/cbic.201900580 |
| [4] |
Zhao XH, Yu ZX, Ding T. Quorum-sensing regulation of antimicrobial resistance in bacteria[J]. Microorganisms, 2020, 8(3): 425. DOI:10.3390/microorganisms8030425 |
| [5] |
Yan SM, Wu G. Can biofilm be reversed through quorum sensing in Pseudomonas aeruginosa?[J]. Front Microbiol, 2019, 10: 1582. DOI:10.3389/fmicb.2019.01582 |
| [6] |
Azimi S, Klementiev AD, Whiteley M, et al. Bacterial quorum sensing during infection[J]. Annu Rev Microbiol, 2020, 74: 201-219. DOI:10.1146/annurev-micro-032020-093845 |
| [7] |
何伟佳, 岳思远, 王翔, 等. 食源性致病菌群体感应信号分子的检测[J]. 生物工程学报, 2019, 35(9): 1707-1714. He WJ, Yue SY, Wang X, et al. Progress in detection and modeling of quorum sensing molecules of foodborne pathogens[J]. Chinese Journal of Biotechnology, 2019, 35(9): 1707-1714. |
| [8] |
Li YY, Hu Y, Chen T, et al. Advanced detection and sensing strategies of Pseudomonas aeruginosa and quorum sensing biomarkers: A review[J]. Talanta, 2022, 240: 123210. DOI:10.1016/j.talanta.2022.123210 |
| [9] |
Vasudevan S, Srinivasan P, Neelakantan P, et al. Photoluminescence-based bioassay with cysteamine-capped TiO2 nano-particles for the selective recognition of N-Acyl homoserine lactones[J]. Front Bioeng Biotechnol, 2021, 9: 750933. DOI:10.3389/fbioe.2021.750933 |
| [10] |
O'Connor G, Knecht LD, Salgado N, et al. Whole-cell biosensors as tools for the detection of quorum-sensing molecules: Uses in diagnostics and the investigation of the quorum-sensing mechanism[M]//Thouand G, Marks R. bioluminescence: fundamentals and applications in biotechnology-Volume 3[M], Cham: Springer, 2015: 181-200.
|
| [11] |
刘芷旭, 谭浩兰, 何红, 等. 细菌群体感应信号分子的光电检测技术研究进展[J]. 生物化学与生物物理进展, 2023, 50(11): 2670-2683. Liu ZX, Tan HL, He H, et al. Photoelectric detection of bacterial quorum sensing signal molecules[J]. Progress in Biochemistry and Biophysics, 2023, 50(11): 2670-2683. |
| [12] |
Zhang Q, Li SZ, Hachicha MH, et al. Heterocyclic chemistry applied to the design of N-Acyl homoserine lactone analogues as bacterial quorum sensing signals mimics[J]. Molecules, 2021, 26(17): 5135. DOI:10.3390/molecules26175135 |
| [13] |
Kumar L, Patel SKS, Kharga K, et al. Molecular mechanisms and applications of N-Acyl homoserine lactone-mediated quorum sensing in bacteria[J]. Molecules, 2022, 27(21): 7584. DOI:10.3390/molecules27217584 |
| [14] |
Decho AW, Frey RL, Ferry JL. Chemical challenges to bacterial AHL signaling in the environment[J]. Chem Rev, 2011, 111(1): 86-99. DOI:10.1021/cr100311q |
| [15] |
Wang Y, Liu BB, Grenier D, et al. Regulatory mechanisms of the luxS/AI-2 system and bacterial resistance[J]. Antimicrob Agents Chemother, 2019, 63(10): e01186-19. |
| [16] |
Taga ME, Xavier KB. Methods for analysis of bacterial autoinducer-2 production[J]. Curr Protoc Microbiol, 2011, Chapter 1: Unit1C.1. |
| [17] |
Thoendel M, Kavanaugh JS, Flack CE, et al. Peptide signaling in the Staphylococci[J]. Chem Rev, 2011, 111(1): 117-151. DOI:10.1021/cr100370n |
| [18] |
Struss A, Pasini P, Ensor CM, et al. Paper strip whole cell biosensors: a portable test for the semiquantitative detection of bacterial quorum signaling molecules[J]. Anal Chem, 2010, 82(11): 4457-4463. DOI:10.1021/ac100231a |
| [19] |
Gui M, Liu L, Wu RY, et al. Detection of new quorum sen-sing N-Acyl homoserine lactones from Aeromonas veronii[J]. Front Microbiol, 2018, 9: 1712. DOI:10.3389/fmicb.2018.01712 |
| [20] |
McClean KH, Winson MK, Fish L, et al. Quorum sensing and Chromobacterium violaceum: exploitation of violacein production and inhibition for the detection of N-acylhomoserine lactones[J]. Microbiology (Reading), 1997, 143(Pt 12): 3703-3711. |
| [21] |
Blosser RS, Gray KM. Extraction of violacein from Chromobacterium violaceum provides a new quantitative bioassay for N-acyl homoserine lactone autoinducers[J]. J Microbiol Methods, 2000, 40(1): 47-55. DOI:10.1016/S0167-7012(99)00136-0 |
| [22] |
Harrison AM, Soby SD. Reclassification of Chromobacterium violaceum ATCC 31532 and its quorum biosensor mutant CV026 to chromobacterium subtsugae[J]. AMB Express, 2020, 10(1): 202. DOI:10.1186/s13568-020-01140-1 |
| [23] |
Farrand SK, Qin YP, Oger P. Quorum-sensing system of Agrobacterium plasmids: analysis and utility[J]. Methods Enzymol, 2002, 358: 452-484. |
| [24] |
Zhu J, Chai YR, Zhong ZT, et al. Agrobacterium bioassay strain for ultrasensitive detection of N-acylhomoserine lactone-type quorum-sensing molecules: detection of autoinducers in Mesorhizobium huakuii[J]. Appl Environ Microbiol, 2003, 69(11): 6949-6953. DOI:10.1128/AEM.69.11.6949-6953.2003 |
| [25] |
Kawaguchi T, Chen YP, Norman RS, et al. Rapid screening of quorum-sensing signal N-acyl homoserine lactones by an in vitro cell-free assay[J]. Appl Environ Microbiol, 2008, 74(12): 3667-3671. DOI:10.1128/AEM.02869-07 |
| [26] |
Shrestha A, Hernández-Reyes C, Grimm M, et al. AHL-pri-ming protein 1 mediates N-3-oxo-tetradecanoyl-homoserine lactone priming in Arabidopsis[J]. BMC Biol, 2022, 20(1): 268. DOI:10.1186/s12915-022-01464-3 |
| [27] |
Bazhenov S, Novoyatlova U, Scheglova E, et al. Influence of the luxR regulatory gene dosage and expression level on the sensitivity of the whole-cell biosensor to acyl-homoserine lactone[J]. Biosensors (Basel), 2021, 11(6): 166. |
| [28] |
Wu Y, Wang CW, Wang D, et al. A whole-cell biosensor for point-of-care detection of waterborne bacterial pathogens[J]. ACS Synth Biol, 2021, 10(2): 333-344. DOI:10.1021/acssynbio.0c00491 |
| [29] |
Fresco-Cala B, Batista AD, Cárdenas S. Molecularly imprinted polymer microand nano-particles. A review[J]. Molecules, 2020, 25(20): 4740. DOI:10.3390/molecules25204740 |
| [30] |
Yang XX, Sun JD, Cui FC, et al. An eco-friendly sensor based on CQD@MIPs for detection of N-acylated homoserine lactones and its 3D printing applications[J]. Talanta, 2020, 219: 121343. DOI:10.1016/j.talanta.2020.121343 |
| [31] |
Jiang H, Jiang DL, Shao JD, et al. Magnetic molecularly imprinted polymer nanoparticles based electrochemical sensor for the measurement of Gram-negative bacterial quorum signaling molecules (N-acyl-homoserine-lactones)[J]. Biosens Bioelectron, 2016, 75: 411-419. DOI:10.1016/j.bios.2015.07.045 |
| [32] |
Cui ZM, Li ZY, Jin YT, et al. Novel magnetic fluorescence probe based on carbon quantum dots-doped molecularly imprinted polymer for AHLs signaling molecules sensing in fish juice and milk[J]. Food Chem, 2020, 328: 127063. DOI:10.1016/j.foodchem.2020.127063 |
| [33] |
Habimana JD, Ji J, Pi FW, et al. A class-specific artificial receptor-based on molecularly imprinted polymer-coated quantum dot centers for the detection of signaling molecules, N-acyl-homoserine lactones present in Gram-negative bacteria[J]. Anal Chim Acta, 2018, 1031: 134-144. DOI:10.1016/j.aca.2018.05.018 |
| [34] |
Vasudevan S, Srinivasan P, Rayappan JBB, et al. A photoluminescence biosensor for the detection of N-acyl homoserine lactone using cysteamine functionalized ZnO nanoparticles for the early diagnosis of urinary tract infections[J]. J Mater Chem B, 2020, 8(19): 4228-4236. DOI:10.1039/C9TB02243K |
| [35] |
Bassler BL, Wright M, Silverman MR. Multiple signalling systems controlling expression of luminescence in Vibrio harveyi: sequence and function of genes encoding a second sensory pathway[J]. Mol Microbiol, 1994, 13(2): 273-286. DOI:10.1111/j.1365-2958.1994.tb00422.x |
| [36] |
Zhao J, Quan CS, Jin LM, et al. Production, detection and application perspectives of quorum sensing autoinducer-2 in bacteria[J]. J Biotechnol, 2018, 268: 53-60. DOI:10.1016/j.jbiotec.2018.01.009 |
| [37] |
Jing Y, Zuo J, Phouthapane V, et al. An optimized method for detecting AI-2 signal molecule by a bioassay with Vibrio harveyi BB170[J]. Microbiology (NY), 2021, 90(3): 383-391. |
| [38] |
Blair WM, Doucette GJ. The Vibrio harveyi bioassay used routinely to detect AI-2 quorum sensing inhibition is confoun-ded by inconsistent normalization across marine matrices[J]. J Microbiol Methods, 2013, 92(3): 250-252. DOI:10.1016/j.mimet.2012.12.023 |
| [39] |
Servinsky MD, Terrell JL, Tsao CY, et al. Directed assembly of a bacterial quorum[J]. ISME J, 2016, 10(1): 158-169. DOI:10.1038/ismej.2015.89 |
| [40] |
Keizers M, Dobrindt U, Berger M. A simple biosensor-based assay for quantitative autoinducer-2 analysis[J]. ACS Synth Biol, 2022, 11(2): 747-759. DOI:10.1021/acssynbio.1c00459 |
| [41] |
Lubkowicz D, Ho CL, Hwang IY, et al. Reprogramming probiotic Lactobacillus reuteri as a biosensor for Staphylococcus aureus derived AIP-I detection[J]. ACS Synth Biol, 2018, 7(5): 1229-1237. DOI:10.1021/acssynbio.8b00063 |
| [42] |
Montagut EJ, Acosta G, Albericio F, et al. Direct quantitative immunochemical analysis of autoinducer peptide Ⅳ for dia-gnosing and stratifying Staphylococcus aureus infections[J]. ACS Infect Dis, 2022, 8(3): 645-656. DOI:10.1021/acsinfecdis.1c00670 |
| [43] |
王艳, 张士春, 周进. 一种改良型检测群体感应信号分子的TLC方法[J]. 生物学杂志, 2020, 37(1): 97-100. Wang Y, Zhang SC, Zhou J. A modified TLC method for detecting quorum sensing signal molecules of N-acyl-homoserine lactones in bacteria[J]. Journal of Biology, 2020, 37(1): 97-100. |
| [44] |
郭沐晗, 廖建萌, 孙力军, 等. 高效液相色谱-串联质谱法检测副溶血弧菌生物被膜形成过程中的N-酰基高丝氨酸内酯信号分子[J]. 食品工业科技, 2018, 39(12): 261-266. Guo MH, Liao JM, Sun LJ, et al. Detecting of quorum sen-sing signal molecules N-acyl-homoserine lactones during the biofilm formation of V.parahaemolyticus by high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS)[J]. Science and Technology of Food Industry, 2018, 39(12): 261-266. |
| [45] |
Dal Bello F, Zorzi M, Aigotti R, et al. Targeted and untarge-ted quantification of quorum sensing signalling molecules in bacterial cultures and biological samples via HPLC-TQ MS techniques[J]. Anal Bioanal Chem, 2021, 413(3): 853-864. DOI:10.1007/s00216-020-03040-6 |
| [46] |
Campagna SR, Gooding JR, May AL. Direct quantitation of the quorum sensing signal, autoinducer-2, in clinically relevant samples by liquid chromatography-tandem mass spectrometry[J]. Anal Chem, 2009, 81(15): 6374-6381. DOI:10.1021/ac900824j |
| [47] |
Xu F, Song XN, Cai PJ, et al. Quantitative determination of AI-2 quorum-sensing signal of bacteria using high performance liquid chromatography-tandem mass spectrometry[J]. J Environ Sci (China), 2017, 52: 204-209. DOI:10.1016/j.jes.2016.04.018 |
| [48] |
毛琼丽, 石豪, 严玲, 等. 超高效液相色谱仪的应用及前景展望[J]. 化学分析计量, 2021, 30(11): 95-102. Mao QL, Shi H, Yan L, et al. Application and prospect of ultra-high performance liquid chromatography[J]. Chemical Analysis and Meterage, 2021, 30(11): 95-102. |
| [49] |
Huang SJ, Zhang H, Albert Ng TC, et al. Analysis of N-Acy-L-homoserine lactones (AHLs) in wastewater treatment systems using SPE-LLE with LC-MS/MS[J]. Water Res, 2020, 177: 115756. DOI:10.1016/j.watres.2020.115756 |
| [50] |
喻红霞, 刘晓薇, 汪慧香, 等. 微塑料生物膜11种AHLs类群体感应信号分子测定及其分泌特征[J]. 环境化学, 2022, 41(3): 785-792. Yu HX, Liu XW, Wang HX, et al. Determination and secretion characteristics of 11 N-acyl-homoserine lactones signal molecules of quorum sensing in microplastic biofilms[J]. Environmental Chemistry, 2022, 41(3): 785-792. |
| [51] |
Xue JC, Chi L, Tu PC, et al. Detection of gut microbiota and pathogen produced N-acyl homoserine in host circulation and tissues[J]. NPJ Biofilms Microbiomes, 2021, 7(1): 53. |
| [52] |
Verbeke F, Debunne N, Janssens Y, et al. Detection and quantification of Enterococcus faecalis RNPP-type quorum sensing peptides in bacterial culture media by UHPLC-MS[J]. J Pharm Biomed Anal, 2018, 160: 55-63. |
| [53] |
Junio HA, Todd DA, Ettefagh KA, et al. Quantitative analysis of autoinducing peptide Ⅰ (AIP-I) from Staphylococcus aureus cultures using ultrahigh performance liquid chromatography-high resolving power mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2013, 930: 7-12. |
| [54] |
Rodrigues AMS, Lami R, Escoubeyrou K, et al. Straightforward N-Acyl homoserine lactone discovery and annotation by LC-MS/MS-based molecular networking[J]. J Proteome Res, 2022, 21(3): 635-642. |
| [55] |
孙静. 气相色谱-质谱联用技术研究进展及前处理方法综述[J]. 当代化工研究, 2017(9): 4-5. Sun J. Review of research progress and pretreatment methods of gas chromatography-mass spectrometry technology[J]. Modern Chemical Research, 2017(9): 4-5. |
| [56] |
Cataldi TRI, Bianco G, Palazzo L, et al. Occurrence of N-acyl-L-homoserine lactones in extracts of some Gram-negative bacteria evaluated by gas chromatography-mass spectrometry[J]. Anal Biochem, 2007, 361(2): 226-235. |
| [57] |
Thiel V, Vilchez R, Sztajer H, et al. Identification, quantification, and determination of the absolute configuration of the bacterial quorum-sensing signal autoinducer-2 by gas chromatography-mass spectrometry[J]. Chembiochem, 2009, 10(3): 479-485. |
| [58] |
Song XN, Qiu HB, Xiao X, et al. Determination of autoindu-cer-2 in biological samples by high-performance liquid chromatography with fluorescence detection using pre-column deriva-tization[J]. J Chromatogr A, 2014, 1361: 162-168. |
| [59] |
黄晓遇, 谭炳琰, 李淳峰, 等. 柱前衍生-固相萃取-高效液相色谱荧光测定生物脱氮反应器中痕量信号分子AI-2[J]. 环境工程学报, 2019, 13(1): 109-115. Huang XY, Tan BY, Li CF, et al. Detection of AI-2 signal molecules of quorum sensing in biological nitrogen removal processes by pre-column derivatization-solid phase extraction-high performance liquid chromatography with fluorescence detector[J]. Chinese Journal of Environmental Engineering, 2019, 13(1): 109-115. |
| [60] |
Ramić D, Klančnik A, Možina SS, et al. Elucidation of the AI-2 communication system in the food-borne pathogen Campylobacter jejuni by whole-cell-based biosensor quantification[J]. Biosens Bioelectron, 2022, 212: 114439. |
| [61] |
Laj N, Elayadeth-Meethal M, Huxley VAJ, et al. Quorum-sensing molecules: sampling, identification and characterization of N-acyl-homoserine lactone in Vibrio sp[J]. Saudi J Biol Sci, 2022, 29(4): 2733-2737. |
| [62] |
Girard L, Blanchet é, Intertaglia L, et al. Characterization of N-Acyl homoserine lactones in Vibrio tasmaniensis LGP32 by a biosensor-based UHPLC-HRMS/MS method[J]. Sensors (Basel), 2017, 17(4): 906. |



