2. 烟台毓璜顶医院神经内科, 山东 烟台 264099;
3. 烟台毓璜顶医院重症医学科, 山东 烟台 264099;
4. 中日友好医院呼吸与危重症医学科, 北京 100029;
5. 烟台毓璜顶医院感染科, 山东 烟台 264099
2. Department of Neurology, Yantai Yuhuangding Hospital, Yantai 264099, China;
3. Department of Critical Care Medicine, Yantai Yuhuangding Hospital, Yantai 264099, China;
4. Department of Respiratory and Critical Care Medicine, China-Japan Friendship Hospital, Beijing 100029, China;
5. Department of Infectious Diseases, Yantai Yuhuangding Hospital, Yantai 264099, China
利奈唑胺(linezolid, LZD)是一种
患者1,女性,28岁,因“恶心1 d,突发意识不清半天”急诊入院。患者1 d前无明显诱因出现恶心,伴脐周疼痛,无呕吐、腹泻,无发热。半天前突发意识不清,急诊送入烟台某医院。1个月前诊断为肺动脉瓣感染性心内膜炎,血培养阴性,血二代基因组测序提示中华链球菌,先后使用青霉素G、头孢曲松、万古霉素治疗,仍有反复高热且伴肾功能损伤,更换LZD静脉治疗2周余,病情好转,院外继续口服LZD治疗。急诊查患者血压80/40 mmHg,血气分析提示代谢性酸中毒,血乳酸15 mmol/L,以“脓毒性休克、感染性心内膜炎、代谢性酸中毒”收入该院重症监护病房(ICU)。入院后立刻给予血管活性药物维持血压、补液并给予连续性静脉-静脉血液滤过(continuous veno-venous hemofiltration, CVVH)治疗,请感染科医生会诊,考虑感染指标及病情转归与脓毒症休克诊断不匹配,为LZD诱导的乳酸中毒及乳酸中毒后出现的休克状态,建议立刻停用LZD。经补液、床旁CVVH治疗,该患者乳酸中毒、低血压纠正,复查血培养阴性、心脏彩超未见复发倾向,考虑抗感染治疗已4周,心脏超声未见反复,暂停止使用抗菌药物出院。出院随访半年,患者感染性心内膜炎未复发,乳酸中毒未反复。
患者2,男性,48岁,因“发热7 d,呼吸困难2 d”急诊送入北京某医院。患者7 d前受凉后出现发热,体温最高39.4℃,伴咽痛、流涕,逐步出现咳嗽、咳痰,5 d前在当地医院住院,咽拭子检测诊断为甲型流行性感冒(简称甲流),胸部CT提示肺炎,痰培养为甲氧西林敏感金黄色葡萄球菌,给予奥司他韦+莫西沙星抗感染治疗,仍发热并出现呼吸困难,调整为奥司他韦+美罗培南+LZD抗感染治疗,仍发热。2 d前出现I型呼吸衰竭,无创呼吸机不能纠正,遂给予气管插管机械通气。病情持续进展,血培养为甲氧西林敏感金黄色葡萄球菌,合并肝肾功能损伤及休克,给予去甲肾上腺素维持血压。既往有2型糖尿病病史。以“脓毒性休克、金黄色葡萄球菌肺炎继发血流感染、重症甲流、2型糖尿病”转入该院ICU。转入后急查血气分析,显示乳酸13 mmol/L,立刻给予补液、血管活性药维持血压及CVVH等对症支持治疗。经抗感染治疗多学科诊治(multidisciplinary treatment, MDT), 确诊患者为金黄色葡萄球菌感染,考虑为甲流后金黄色葡萄球菌肺炎继发血流感染,存在肝肾功能受损。抗菌药物选择方面,LZD虽然对肝肾功能损伤小,但存在的高乳酸血症不排除为LZD所致,调整为头孢曲松抗感染治疗。该患者入院后血培养18 h阳性报警,涂片考虑为葡萄球菌属细菌,复查甲型流感病毒核酸阴性,联合万古霉素抗金黄色葡萄球菌感染治疗,并给予CVVH治疗。患者血乳酸水平仍较高(见图 1),入院48 h突发室颤,经积极抢救治疗无效死亡。
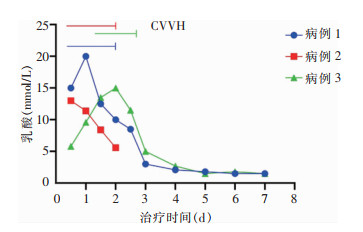 |
| 图 1 3例LZD诱导的乳酸中毒患者给予CVVH治疗前后血乳酸变化趋势 Figure 1 Changes in blood lactate levels before and after CVVH treatment in 3 patients with linezolid-induced lactic acidosis |
患者3,男性,16岁,因“恶心1 d”入院。患者2个月前诊断为“二尖瓣感染性心内膜炎、自体瓣膜、屎肠球菌”,在上级医院进行机械瓣膜置换术,术后应用万古霉素,因合并“红人综合征”停用万古霉素,改用LZD抗感染治疗,静脉治疗1周后,序贯口服治疗。出院2个月内病情稳定。1 d前患者疑似不洁饮食后出现恶心,无呕吐、腹痛、腹泻,门诊血常规提示血小板计数为40×109/L,遂急诊送入烟台某医院。感染科医生会诊分析:患者血白细胞计数、C反应蛋白、降钙素原均正常,急查粪便常规未见异常,与急性胃炎表现不相符。血小板计数重度减少考虑为LZD所致,应警惕药物不良反应,建议急查血气分析,结果提示血乳酸高达5.8 mmol/L。立刻停用LZD,给予补液、利尿、升血小板、纠正酸中毒等对症支持治疗,患者乳酸进行性升高(见图 1),遂给予CVVH治疗(无肝素)。CVVH治疗24 h患者乳酸中毒纠正,观察5 d无反复,血小板计数恢复至正常水平,出院。出院时考虑人工瓣膜术后抗感染治疗已足6周,可停用LZD,继续门诊随访。随访半年,患者病情稳定,血小板计数及血乳酸水平未见异常。
2 讨论LZD是一种恶唑烷酮类抗生素,用于治疗严重的革兰阳性细菌感染和耐多药结核病。LZD最常见的毒性事件是胃肠道功能障碍,其次是骨髓抑制,尤其是血小板减少症,也有周围和视神经病变及血清素综合征的报道[4]。LZD诱导的乳酸中毒于2003年首次发表在《新英格兰医学杂志》上,此种不良反应十分罕见,临床结局极差,且发病率呈逐年增加趋势[5]。在我国,LZD诱导的乳酸中毒最早在关于LZD的临床安全性问题中提及[6],2012年赵新菊等[7]最早报道了1例终末期肾疾病患者,使用LZD后出现转氨酶升高、血小板计数减少和乳酸中毒,该患者在停药后病情获得缓解。至今国内相关报道共8例。检索PubMed文献,我国仅有3例相关报道[8-10]。因此,LZD诱导的乳酸中毒尚未被临床医生广泛认识,容易被误诊为脓毒性休克引起的高乳酸血症,特别是在抗感染治疗期间[11]。
据报道,脓毒症引起的乳酸升高为(2.4±2.1) mmol/L,脓毒性休克引起乳酸升高为(3.3±2.1)mmol/L[12]。已知与发生乳酸中毒相关的药物有核苷类逆转录酶抑制剂、二甲双胍、异烟肼、四环素、丙泊酚、丙二醇及LZD。本文报告的3例患者,乳酸升高值难以用脓毒性休克解释,且排除引起乳酸升高的其他药物,停止使用LZD后患者乳酸下降,最终考虑为LZD诱导的乳酸中毒。
LZD通过与细菌核糖体结合来抑制细菌蛋白质合成。细菌核糖体和人类线粒体核糖体之间有明显的相似之处。原核生物和真核生物的核糖体有三个功能位点:A、P和E,LZD可与A位点结合。这种交联干扰了原始氨基酸与核糖体的结合过程,阻止人线粒体蛋白的合成,从而降低线粒体呼吸链酶的含量,并加速无氧糖酵解,有别于因缺氧导致的乳酸增多[13]。
LZD诱导乳酸中毒的危险因素包括高龄、肝功能不全、肾功能不全[14]、LZD长程治疗、线粒体DNA A2706G[15-18]和G3010A[15]多态性。但另一项研究[19]结果显示,即使是短期使用LZD也有乳酸中毒的风险。因此,LZD诱导的乳酸中毒可发生在治疗过程中的任何时间[18]。本报告中,病例2 LZD诱导的乳酸中毒发生在治疗后一周内,而病例1和病例3发生在治疗后6周。
LZD诱导的乳酸中毒诊断目前主要为临床诊断,即考虑症状、使用药物史,且排除导致乳酸中毒的其他因素。LZD诱导的乳酸中毒症状非特异,如恶心、呕吐、精神状态改变、心动过速、低血压等[20],加之临床医生对其认知不足,很可能会延误患者的诊治从而危及生命。因此,在LZD使用期间应注意监测血药浓度及乳酸水平,但目前此项目国内开展非常有限。如果在LZD暴露后出现无法采用常见的乳酸中毒原因(如感染性休克或肝衰竭)解释的临床表现,并且没有二甲双胍、核苷类似物或已知会导致乳酸中毒的其他药物使用史[21],则应该考虑可能是LZD对线粒体的毒性作用导致。
治疗方面,停药是首要处理措施,但需要联合肾替代治疗。本次报告的3例病例均停药后加床旁CVVH治疗。此外,目前已有尝试使用呼吸链辅助因子,如硫胺素、核黄素、左旋肉碱或辅酶Q10作为乳酸中毒治疗策略的报道,但还缺乏支持系统使用呼吸链辅助因子的证据[18]。
综上所述,LZD使用期间突发休克,应警惕LZD诱发的乳酸中毒,及时检测血乳酸水平,根据药物使用时间顺序相关性、停药后患者状况改善,以及不能采用其他原因解释的乳酸中毒来诊断LZD诱发的乳酸中毒[22]。因临床医生对LZD诱导乳酸中毒认知尚不足,容易误诊其为感染加重或脓毒性休克,而延误停用LZD与积极抢救。期望此文能够提高感染及危重症相关的专业医生对此种不良反应的认知与识别,及时采取有效的治疗措施,改善此类患者预后。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Im JH, Baek JH, Kwon HY, et al. Incidence and risk factors of linezolid-induced lactic acidosis[J]. Int J Infect Dis, 2015, 31: 47-52. DOI:10.1016/j.ijid.2014.12.009 |
| [2] |
Mao YY, Dai DP, Jin HY, et al. The risk factors of linezolid-induced lactic acidosis: a case report and review[J]. Medicine (Baltimore), 2018, 97(36): e12114. DOI:10.1097/MD.0000000000012114 |
| [3] |
Stalker DJ, Jungbluth GL. Clinical pharmacokinetics of line-zolid, a novel oxazolidinone antibacterial[J]. Clin Pharmaco-kinet, 2003, 42(13): 1129-1140. DOI:10.2165/00003088-200342130-00004 |
| [4] |
Wigen CL, Goetz MB. Serotonin syndrome and linezolid[J]. Clin Infect Dis, 2002, 34(12): 1651-1652. DOI:10.1086/340710 |
| [5] |
Apodaca AA, Rakita RM. Linezolid-induced lactic acidosis[J]. N Engl J Med, 2003, 348(1): 86-87. DOI:10.1056/NEJM200301023480123 |
| [6] |
韦志英, 魏兆甫. 利奈唑胺的临床安全性研究概述[J]. 中国药物滥用防治杂志, 2010, 16(4): 227-229. Wei ZY, Wei ZF. Overview of the clinical safety study of line-zolid[J]. Chinese Journal of Drug Abuse Prevention and Treatment, 2010, 16(4): 227-229. |
| [7] |
赵新菊, 王梅. 利奈唑胺致慢性肾脏病患者转氨酶升高、血小板减少、乳酸酸中毒一例并文献复习[J]. 实用药物与临床, 2012, 15(10): 665-668. Zhao XJ, Wang M. Linezolid induced elevated transaminases, thrombocytopenia and lactic acidosis in a CKD patient: a case report and literature review[J]. Practical Pharmacy and Clinical Remedies, 2012, 15(10): 665-668. |
| [8] |
Xiao B, Deng P, Jin HY, et al. Lactic acidosis and thrombocytopenia associated with linezolid therapy: a case report[J]. Am J Case Rep, 2018, 19: 1117-1120. DOI:10.12659/AJCR.911362 |
| [9] |
Zhang NJ, Zhang F, Chen Z, et al. Successful treatment of linezolid-induced severe lactic acidosis with continuous venovenous hemodiafiltration: a case report[J]. Saudi Pharm J, 2022, 30(2): 108-111. DOI:10.1016/j.jsps.2021.12.021 |
| [10] |
Chen CC, Liu WT, Lin SH. Lactic acidosis associated with standard dose linezolid in a kidney recipient with impaired renal function[J]. Braz J Infect Dis, 2022, 26(1): 101701. DOI:10.1016/j.bjid.2021.101701 |
| [11] |
Mishra R, Patel H, Goel B, et al. A case of linezolid toxicity presenting as a sepsis mimic[J]. Case Rep Crit Care, 2019, 2019: 2157674. |
| [12] |
王军宇, 王宏伟, 刘温馨, 等. 降钙素原和血乳酸及病情严重程度评分对脓毒症患者预后的评估价值[J]. 中华危重病急救医学, 2019, 31(8): 938-941. Wang JY, Wang HW, Liu WX, et al. Assessment values of procalcitonin, lactic acid, and disease severity scores in patients with sepsis[J]. Chinese Critical Care Medicine, 2019, 31(8): 938-941. |
| [13] |
Santini A, Ronchi D, Garbellini M, et al. Linezolid-induced lactic acidosis: the thin line between bacterial and mitochondrial ribosomes[J]. Expert Opin Drug Saf, 2017, 16(7): 833-843. DOI:10.1080/14740338.2017.1335305 |
| [14] |
Dai Y, Wang YY, Zeng YF, et al. Linezolid and the risk of lactic acidosis: data mining and analysis of the FDA adverse event reporting system[J]. J Clin Pharm Ther, 2020, 45(6): 1422-1426. DOI:10.1111/jcpt.13245 |
| [15] |
Palenzuela L, Hahn NM, Nelson RP Jr, et al. Does linezolid cause lactic acidosis by inhibiting mitochondrial protein synthesis?[J]. Clin Infect Dis, 2005, 40(12): e113-e116. DOI:10.1086/430441 |
| [16] |
Carson J, Cerda J, Chae JH, et al. Severe lactic acidosis associated with linezolid use in a patient with the mitochondrial DNA A2706G polymorphism[J]. Pharmacotherapy, 2007, 27(5): 771-774. DOI:10.1592/phco.27.5.771 |
| [17] |
Sawyer AJ, Haley HL, Baty SR, et al. Linezolid-induced lactic acidosis corrected with sustained low-efficiency dialysis: a case report[J]. Am J Kidney Dis, 2014, 64(3): 457-459. DOI:10.1053/j.ajkd.2014.04.032 |
| [18] |
Velez JCQ, Janech MG. A case of lactic acidosis induced by linezolid[J]. Nat Rev Nephrol, 2010, 6(4): 236-242. |
| [19] |
Lee YR, Powell N, Bonatti H, et al. Early development of lactic acidosis with short term linezolid treatment in a renal recipient[J]. J Chemother, 2008, 20(6): 766-767. |
| [20] |
Nightingale S, Austin C, Agarwal KK, et al. Linezolid induced lactic acidosis: the side effect, clinician should be aware of[J]. Cureus, 2020, 12(11): e11514. |
| [21] |
Djibré M, Pham T, Denis M, et al. Fatal lactic acidosis associated with linezolid therapy[J]. Infection, 2015, 43(1): 125-126. |
| [22] |
Zuccarini NS, Yousuf T, Wozniczka D, et al. Lactic acidosis induced by linezolid mimics symptoms of an acute intracranial bleed: a case report and literature review[J]. J Clin Med Res, 2016, 8(10): 753-756. |



