2. 上海市第一人民医院检验科, 上海 201620;
3. 上海市第一人民医院临床药学科, 上海 201620
2. Department of Laboratory Medicine, Shanghai General Hospital, Shanghai 201620, China;
3. Department of Clinical Pharmacy, Shanghai General Hospital, Shanghai 201620, China
细菌耐药性(AMR, antimicrobial resistance)已成为全球公认最大的公共卫生问题之一。世界卫生组织呼吁全球各国采取系统性措施遏制AMR,否则人类健康将受到严重威胁,并给社会带来巨大的经济负担[1]。我国在2015、2021年分别颁布了“遏制细菌耐药国家行动计划(2016—2020年)”[2]和“遏制微生物耐药国家行动计划(2021—2025年)”[3],要求分步骤、全方位地实施抗菌药物管理和控制耐药的综合措施来应对AMR,维护人民群众健康,促进经济社会协调发展。
作为抗菌药物的主要使用场所,各级医疗机构密切关注微生物耐药性的进展,并积极防止抗菌药物过度使用导致的AMR增加。细菌耐药在医疗机构仍然普遍发生,一方面由于抗菌药物使用不合理,造成细菌基因突变及耐药基因转移,导致AMR增加;另一方面,污染环境中,医务人员手的接触传播可导致耐药细菌的交叉传播。因此,应对医疗机构细菌耐药的策略要求,只有将感染预防控制(IPC, infection prevention and control)措施与抗菌药物管理(AMS,antimicrobial stewardship)相结合,才能最大限度地发挥医疗机构细菌耐药控制作用,遏制细菌耐药[4]。本研究采用IPC措施联合AMS,减少细菌耐药的产生和耐药菌的传播,从而达到AMR逐步下降的目标。
1 资料与方法 1.1 资料来源收集某三级甲等医院2015年1月1日—2022年12月31日所有住院患者医院感染管理相关指标、抗菌药物相关指标和多重耐药菌(MDRO, multidrug-resistant organism)检出率。
1.2 相关指标定义及公式 1.2.1 医院感染管理相关指标包括医院感染发病率、MDRO医院感染发病率及手卫生依从率,其定义及公式参照《医疗机构住院患者感染监测基本数据集及质量控制指标集实施指南》[5]。
1.2.2 抗菌药物相关指标包括抗菌药物使用强度、抗菌药物使用率、Ⅰ类切口手术预防性抗菌药物使用率、抗菌药物治疗前病原学送检率、限制使用级抗菌药物治疗前病原学送检率、特殊使用级抗菌药物治疗前病原学送检率,其定义及公式参照《关于进一步加强抗菌药物临床应用管理工作的通知》[6]。
1.2.3 MDRO检出率MDRO检出率的定义和公式参照《医疗机构住院患者感染监测基本数据集及质量控制指标集实施指南》[5],同一患者相同部位分离的相同菌株不重复计数。重点监测的MDRO包括耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)、耐万古霉素肠球菌(vancomycin-resistant Enterococcus, VRE)中的粪肠球菌(VRE-FS)和屎肠球菌(VRE-FM)、耐碳青霉烯类鲍曼不动杆菌(carbapenem-resistant Acinetobacter baumannii, CRAB)、耐碳青霉烯类铜绿假单胞菌(carbapenem-resistant Pseudomonas aeruginosa, CRPA)、耐碳青霉烯类肠杆菌(carbapenem-resistant Enterobacterales, CRE)中的肺炎克雷伯菌(KP)和大肠埃希菌(EC)、产广谱β-内酰胺酶(extended-spectrum β-lactamase, ESBLs) KP和EC,以及耐氟喹诺酮类肠杆菌(fluoroquinolone-resistant Enterobacterales, FQRE)中的KP和EC。
1.3 方法 1.3.1 IPC与AMS组织架构的协同IPC管理委员会与AMS工作小组均在分管医疗副院长的共同领导下开展工作,均以维护患者安全为共同目标。在组织架构上,临床药事委员会下属的AMS工作小组,其成员包括医务、护理、医院感染、临床药学、检验、信息及部分重点科室负责人,均在医院感染防控管理委员会中担任职位,且大部分成员在IPC管理委员会与AMS工作小组有重叠(见图 1),因此具备两者协同工作的机制和能力。
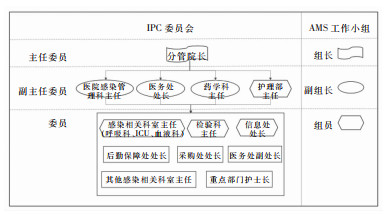 |
| 图 1 医院IPC与AMS组织架构 Figure 1 Organizational structure of hospital IPC and AMS |
医院感染管理科既承担感染防控管理工作,也承担抗菌药物管理中围手术期抗菌药物合理使用、病原微生物标本采集与送检管理、抗菌药物核心指标制定、MDRO数据监测的工作职责;因其具备一定的行政职能权力,且医院感染管理科负责人也具有多年临床医疗的实践经验,故具备跨部门协作的行政管理优势和临床专业技术能力。
该院自2015年起率先由医院感染管理科负责人牵头,与AMS工作小组下设的临床药师团队协作,同时直接对接微生物实验室数据的采集和监测,联合各个行政管理部门及临床科室,从感染的发生、发展和预防控制多维度提高感染的防控和诊治能力;并建立临床与行政部门持续沟通机制,加强抗菌药物的使用点评、培训及评估,提高抗菌药物指标和微生物检测指标的监测与反馈,打破了临床与行政、行政与行政部门之间的壁垒,提高了抗菌药物多部门协同管理效率,为实现医院抗菌药物管理目标提供了可靠的组织行为保障。
1.3.2 细菌耐药的事前源头管控建立针对AMR增加的事前源头管控的综合措施,主要包括多学科参与的AMS管理行动及医院感染管理科推动的MDRO主动筛查。
1.3.2.1 多学科参与的AMS管理行动医院建立了多学科的AMS团队,并明确了团队成员的主要职责,分工协作,各司其职;医院感染管理科负责协调组织相关工作,以减少抗菌药物滥用导致的耐药。具体措施包括:①医务处负责临床医生的抗菌药物分级授权和特殊类抗菌药物的审批,借助信息化建设重点控制特殊类抗菌药物的开具,实施科室主任-临床药师-院内专家三级审批制度,并指派专人进行审批再监督。②临床药学科组建了一支由AMS工作小组带领下的临床药师团队,覆盖全院大部分临床住院科室,开展驻科实时跟踪查房,与临床医生形成治疗团队,参加多学科联合会诊,与临床医生共同优化用药方案;审核所在科室用药医嘱,严格限制无指征广谱抗菌药物的使用,缩短抗菌药物使用的疗程;每年开展全院在岗和新进临床医生抗菌药物合理使用的培训,并纳入三基考核中。③医院感染管理科每月将临床药学科点评出不合理用药医嘱点对点反馈至科主任,联合医务处每月进行科室及医疗组的绩效考评,建立行政与临床常态化反馈监督机制;组织医务人员抗菌药物使用前微生物标本采集与送检相关的培训,并开展其质量持续改进工作等。
1.3.2.2 MDRO主动筛查主动筛查作为防控MDRO感染的一项重要举措。该院从2012年由医院感染管理科牵头,逐步推进高危科室[如重症监护病房(ICU)、骨髓移植病房、心胸外科病房]全部患者的MDRO入科主动筛查。对高危科室所有患者,开展从单部位(咽拭子)逐步过渡到双部位(咽拭子联合肛拭子)MDRO主动筛查,提高了对各类MDRO定植患者的发现率,同时对MDRO定植及感染患者进行严格的单间隔离,加强手卫生、接触隔离、环境清洁消毒等措施落实,实现了对无症状MDRO患者源头的管控。
1.3.3 细菌耐药的事中传播防控住院患者检出MDRO后,临床药师和临床医生共同参与MDRO患者感染判定及治疗评价,多部门联合建立MDRO监测预警机制,实现院科两级的MDRO医院感染防控综合措施监督及管理。
1.3.3.1 临床药师参与下的MDRO感染判定及治疗评价医院感染管理科与临床药学科联动,每周两次发送在院MDRO患者临床资料至临床药师团队。由AMS工作小组的临床药师至病房现场查看,与临床医生一起判定该MDRO为感染还是定植,审核MDRO感染患者抗菌药物治疗指征、用药疗程、用药的品种和剂量,指导临床医生联合用药方案,并跟踪其治疗效果,提醒临床医生及时开具炎性指标检测医嘱评估感染情况,调整抗菌药物使用。
1.3.3.2 MDRO监测预警建立按照危急值管理的MDRO监测预警制度,实现检验-临床-院感三方MDRO信息实时共享。当微生物室检出MDRO时,第一时间致电MDRO患者所在病区进行接触隔离登记,同时在院内危急值上报信息系统传输MDRO患者信息至临床使用界面进行提醒。医院感染管理科通过医院感染监测系统实时监测MDRO患者,并至临床科室监督MDRO防控措施是否到位,微生物检测标本采集送检是否合适,并统计MDRO菌种信息。
1.3.3.3 MDRO感染预防与控制措施医院感染管理科及临床科室感控小组负责院科两级的MDRO防控措施的指导和监督。具体措施包括:①接触隔离登记及标识。检验科将MDRO作为危急值报告临床,临床医生第一时间开具接触隔离医嘱,护士在床边及隔离房间入口挂蓝色接触隔离标识,科室工作台黑板标注MDRO患者床号和菌种类型,同时将该患者手环加戴黄色纽扣。②患者安置。严格执行ICU内MDRO患者尽早转床至单间隔离。无单间时,可将相同MDRO患者安置在同一房间。普通病房MDRO患者做好床边接触隔离。③手卫生。MDRO患者每床必备免洗手消毒剂,并做好患者及家属宣教,加强院科两级对MDRO患者的手卫生管理核查,定期督查科室人员手卫生依从性并反馈。④隔离预防措施。医院感染管理科制定接触隔离措施执行的核查表,定期到临床科室进行督查,要求医务人员进入隔离病房近距离接触患者、环境及患者体液分泌物时,执行穿隔离衣、戴手套等接触隔离措施,离开后须脱去隔离衣及手套,做好手卫生。⑤环境和物品的清洁消毒。增加日常环境物体表面清洁与消毒频次,特别是高频接触环境。患者出院后隔离房间进行彻底的终末环境清洁和消毒。⑥外出检查或转床时隔离措施。外出检查或转床前先致电告知对方科室,提醒器械设备在MDRO患者使用或污染后应使用一次性消毒湿巾进行转运床或轮椅的擦拭消毒。⑦织物处置。MDRO患者出院后,必须将其床隔帘、床单拆卸,与被芯、枕芯一起送洗消毒。
1.3.4 细菌耐药后的监测分析及反馈建立每季度全院细菌耐药监测分析反馈机制,医院感染管理科和AMS工作小组协同将医院细菌耐药情况、发展趋势报告及时反馈至院领导和临床科室,并联合对耐药严重的科室进行科学分析、反馈和宣教。
1.3.4.1 多部门联动的细菌耐药监测分析及反馈具体包括:①微生物耐药数据监测。检验科微生物室每季度及每年发布全院细菌耐药监测分析报告,包括检出菌株构成比、主要检出细菌的分布科室及耐药情况、主要耐药菌检出率等,每季度通过院内公告版信息系统将数据监测报告公示给临床科室,对细菌耐药率高的抗菌药物进行预警提醒。每年制作年度微生物耐药手册,分析全年全院细菌耐药数据并发放至所有临床科室。②AMS管理。由临床药学科牵头每季度召开AMS工作小组例会,由医务、护理、院感、检验多部门讨论抗菌药物合理使用相关问题,分析耐药菌发生和发展趋势,制定更有效的抗菌药物管控计划。③IPC管理。医院感染管理科负责报送,对MDRO感染发生、治疗性抗菌药物使用前微生物检测标本送检、MDRO感染防控情况及细菌耐药趋势与抗菌药物使用情况向感染防控管理委员会报告,查找感染防控的问题和漏洞,并制定或调整MDRO防控的重点关注环节。
1.3.4.2 IPC和AMS团队协同临床宣教和科学分析医院感染管理科与临床药师团队协同,利用临床科室早交班或业务学习时间,定期到临床科室分析抗菌药物指标完成情况,指出该科室抗菌药物使用常见问题,提出改进策略,分析该科室主要耐药菌检出和细菌耐药变化,纠正微生物标本采集与送检的误区,结合该科室主要发生的医院感染类型进行感染控制培训及指导。由临床药师团队持续跟踪抗菌药物合理使用的改进,医院感染管理科持续跟踪医院感染防控措施执行到位情况。
1.4 统计分析应用SPSS 21.0统计分析软件进行数据分析,率的比较采用卡方检验,以P≤0.05为差异有统计学意义。
2 结果 2.1 医院感染管理相关指标与2015—2016年比较,2021—2022年MDRO医院感染发病率从0.22%下降至0.16%(P<0.05);手卫生依从率从64.22% 上升至94.95%(P<0.05)。见表 1。
| 表 1 2015—2022年IPC与AMS协同模式下医院感染管理相关指标趋势分析 Table 1 Trend analysis of HAI-related indicators under the collaborative mode of IPC and AMS, 2015—2022 |
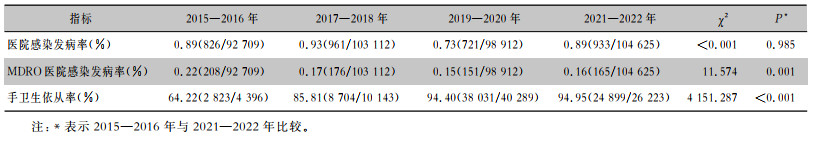
|
与2015—2016年比较,2021—2022年住院患者抗菌药物使用强度从48.48下降至42.17,抗菌药物使用率从49.45%下降至45.21%(P<0.05);Ⅰ类切口手术预防性抗菌药物使用率从48.62%下降至33.13%(P<0.05)。与2017—2018年比较,2021—2022年抗菌药物治疗前病原学送检率从60.73%上升至72.18%(P<0.05);限制使用级抗菌药物治疗前病原学送检率从54.24% 上升至70.31%(P<0.05);特殊使用级抗菌药物治疗前病原学送检率从90.81%上升至95.27%(P<0.05)。见表 2。
| 表 2 2015—2022年IPC与AMS协同模式下抗菌药物相关指标趋势分析 Table 2 Trend analysis of antimicrobial-related indicators under the collaborative mode of IPC and AMS, 2015—2022 |
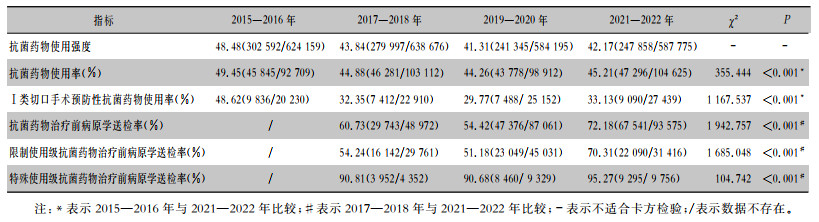
|
与2015—2016年比较,2021—2022年MRSA检出率从34.31%下降至26.49%(P<0.05);CRAB检出率从60.90%下降至41.36%(P<0.05);CRPA检出率从31.15%下降至21.93%(P<0.05);KP (ESBLs+) 检出率从32.72%下降至16.35%(P<0.05);EC(ESBLs+)检出率从57.45%下降至35.04%(P<0.05);FQR-EC检出率从51.18%下降至46.67%(P<0.05)。VRE-FS检出率略有上升趋势,VRE-FM、CRKP、CREC、FQR-KP检出率数值均有下降,但差异均无统计学意义(均P>0.05)。
| 表 3 2015—2022年IPC与AMS协同模式下MDRO检出率趋势分析(%) Table 3 Trend analysis of detection rates of MDRO under the collaborative mode of IPC and AMS, 2015-2022 (%) |
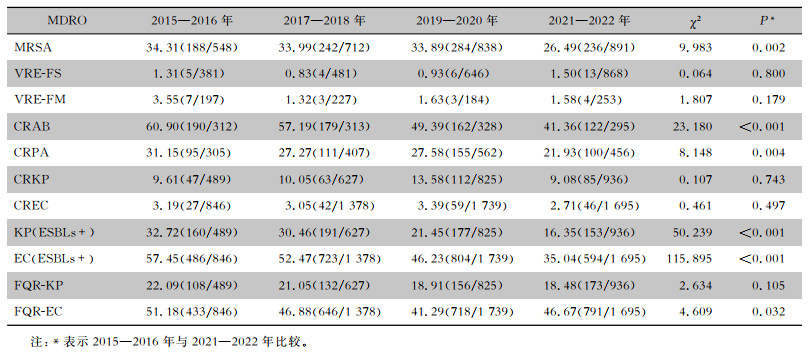
|
耐药性增加一方面由于抗菌药物选择性压力导致携带耐药基因的细菌增加,另一方面由于耐药菌在医疗机构内部的流行和播散[7]。因此,世界卫生组织在低收入和中等收入国家卫生保健机构的AMS规划中指出,IPC委员会和AMS工作小组在遏制AMR的产生和传播、优化抗菌药物使用和提供优质医疗保健方面,缺一不可[8]。
虽然IPC委员会和AMS工作小组在抗菌药物管理方面工作内容不同,但承担了共同的责任,彼此需要互相协作,为共同的目标投入时间和精力。美国疾病预防控制中心、美国医疗保健流行病学学会的指南提出了医院IPC管理和AMS核心要素的相似性大于差异性[9-10]。因此,该院抗菌药物管理实现了由医院感染管理科负责人牵头的IPC委员会和AMS工作小组的组织架构协同,打破了一贯以医务部门牵头作为抗菌药物管理主要负责部门的传统,从组织保障上发挥了IPC与AMS的专业融合、职责共担及结果共赢,并充分发挥了多学科团队合作促进改善AMR的目标。
本研究发现,细菌耐药的事前源头管控、细菌耐药的事中传播防控和细菌耐药后的监测分析及反馈都需要多学科团队合作,建立有效的沟通和协同管理模式,特别是感控-微生物-临床药学三方的联合,这也是国内医疗机构感染防控协同抗菌药物管理促进遏制微生物耐药的管理方向[11-12]。
多学科参与的AMS计划中,抗菌药物预授权、前瞻性审核和反馈在世界卫生组织和美国疾病预防控制中心的循证指南中被视为两项基础干预措施并得到强烈推荐[8-9]。因为预授权可以帮助优化抗菌药物的启用,而前瞻性审核和反馈可以帮助优化抗菌药物持续治疗。本研究发现,IPC成员与AMS工作小组协同的AMS计划使抗菌药物使用强度从2015—2016年的48.48%下降至2021—2022年的42.17%,Ⅰ类切口手术预防性抗菌药物使用率从48.62%下降至33.13%,控制了抗菌药物使用对细菌耐药的筛选压力,也使常见的大部分MDRO检出率逐年下降,MDRO医院感染发病率从0.22%下降至0.16%,这与美国和欧洲的系统综述和荟萃分析的结果基本一致[13-15]。同时本研究也发现,随着医院感染管理科参与抗菌药物使用前病原学送检质量持续改进,使抗菌药物治疗前病原学送检率各项指标上升明显,也使敏感菌检出增加和耐药菌检出率下降,这与朱榕生等[16]研究结果也基本一致。
感染控制领域主导推动的高危患者耐药菌主动筛查作为耐药菌传染源的核心防控策略,已得到国内外感染控制专家的认可[17-18]。因为无症状耐药菌定植患者可成为潜在的传染源,对其开展主动筛查有助于早发现、早隔离。因此,该院对ICU和骨髓移植患者采取入科后的CRE主动筛查,对心胸外科手术患者开展术前MRSA主动筛查。2022年起采用肛拭子联合咽拭子对ICU入院患者进行CRE主动筛查,增加了ICU CRE定植患者的检出,也降低了MDRO医院感染率[19]。另外,通过建立耐药预警机制、MDRO患者及早治疗、MDRO感染预防控制措施来实现对感染链的三个主要环节(即控制传染源、切断传播途径及保护易感者)[20]的闭环管理和干预,也体现了IPC联合AMS在MDRO防控中的有效作用。
本研究将耐药菌检出作为危急值管理,采取耐药监测信息化预警机制,医院感染管理科与临床药学科联合开展MDRO感染者早期规范抗菌药物治疗,缩短了治疗周期,保证了及早发现MDRO感染源;在切断传播途径和保护易感人群上,强调对ICU患者严格执行MDRO单间隔离。虽然接触传播是MDRO最常见和最重要的传播方式,但飞沫传播和空气传播也可能在气道开放的MDRO患者间传播[21-22],而单间隔离可以有效阻止MDRO在多人病房内通过飞沫或空气传播给其他患者,并能从硬件条件和人力分配上更好地帮助临床医务人员执行接触隔离措施。
本研究结果显示,随着手卫生依从率上升和环境清洁消毒等基础IPC措施的落实,抗菌药物使用减少,从而减少细菌耐药和MDRO感染,形成良性循环。这与文献[23]报道相符合,当IPC措施与AMS相结合时,AMS效果更显著,细菌耐药水平随之下降。作为ICU检出耐药菌株占比最高的CR-AB,由于其能在医院环境内长时间生存,可以广泛定植在医疗机构环境表面。医疗机构环境清洁消毒直接影响ICU中CRAB感染发生和克隆传播。该院自2017年起在全院推广一次性环境消毒湿巾作为环境物体表面消毒用品,2019年起在ICU推广一次性地巾和无纺布布巾联合含有效氯500 mg/L消毒剂,用于MDRO患者环境的清洁消毒,即擦即弃,减少了因重复使用抹布地巾导致的二次污染,较一次性消毒湿巾的成本也有所降低,并且严格落实规定的环境消毒频次,对控制CRAB起到重要作用。这也可能是该院MDRO,特别是CRAB检出率从2015—2016年的60.9%下降至2021—2022年的41.36% 的关键因素。
本研究具有一定的局限性,包括未对IPC联合AMS的各种措施与微生物耐药数据的直接相关性因素进行分析,也未对具体菌株的耐药性变化与限制使用抗菌药物类别的相关性进行分析。
综上所述,8年IPC措施联合AMS的临床实践对细菌耐药产生、传播、发展全过程进行管理和监控,在一定程度上促进了抗菌药物合理使用,减少了MDRO的产生和播散,降低了细菌耐药水平,可为其他医疗机构进行IPC措施联合AMS提供借鉴。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
World Health Organization. Global action plan on antimicro-bial resistance[EB/OL]. (2016-01-01)[2023-03-15]. https://www.who.int/publications/i/item/9789241509763.
|
| [2] |
中华人民共和国国家卫生健康委员会医政医管局. 关于印发遏制细菌耐药国家行动计划(2016—2020年)的通知: 国卫医发〔2016〕43号[EB/OL]. (2016-08-25)[2023-03-15]. http://www.nhc.gov.cn/yzygj/s3593/201608/f1ed26a0c8774e1c8fc89dd481ec84d7.shtml. Medical Administration Bureau of the National Health Commission of the People's Republic of China. Notice on issuing the national action plan for combating bacterial drug resistance (2016-2020): Medical department of the national health office: [2016] No. 43[EB/OL]. (2016-08-25)[2023-03-15]. http://www.nhc.gov.cn/yzygj/s3593/201608/f1ed26a0c8774e1c8fc89dd481ec84d7.shtml. |
| [3] |
中华人民共和国国家卫生健康委员会医政医管局. 关于印发遏制微生物耐药国家行动计划(2022—2025年)的通知: 国卫医函〔2022〕185号[EB/OL]. (2022-10-28)[2023-03-15]. http://www.nhc.gov.cn/yzygj/s7659/202210/2875ad7e2b2e46a2a672240ed9ee750f.shtml. Medical Administration Bureau of the National Health Commission of the People's Republic of China. Notice on issuing the national action plan for combating bacterial drug resistance (2022-2025): Medical department of the National Health Office: [2016] No. 185[EB/OL]. (2022-10-28)[2023-03-15]. http://www.nhc.gov.cn/yzygj/s7659/202210/2875ad7e2b2e46a2a672240ed9ee750f.shtml. |
| [4] |
Majumder MAA, Rahman S, Cohall D, et al. Antimicrobial stewardship: fighting antimicrobial resistance and protecting global public health[J]. Infect Drug Resist, 2020, 13: 4713-4738. DOI:10.2147/IDR.S290835 |
| [5] |
付强, 刘运喜, 霍瑞, 等. 医疗机构住院患者感染监测基本数据集及质量控制指标集实施指南(2021版)[M]. 北京: 人民卫生出版社, 2021. Fu Q, Liu YX, Huo R, et al. Implementation guidelines for the basic dataset and quality control indicator set of infection monitoring for hospitalized patients in medical institutions(version 2021)[M]. Beijing: People's Medical Publishing House, 2021. |
| [6] |
中华人民共和国国家卫生健康委员会医政医管局. 关于进一步加强抗菌药物临床应用管理工作的通知: 国卫办医发〔2015〕42号[EB/OL]. (2015-08-27)[2023-03-15]. http://www.nhc.gov.cn/yzygj/s3593/201508/f0fdf1f52df14b87aa97be53819f1036.shtml. Medical Administration Bureau of the National Health Commission of the People's Republic of China. Notice on further strengthening the management of clinical application of antibiotics. medical department of the national health office: [2015] No. 42[EB/OL]. (2015-08-27)[2023-03-15]. http://www.nhc.gov.cn/yzygj/s3593/201508/f0fdf1f52df14b87aa97be53819f1036.shtml. |
| [7] |
Center for Disease Control and Prevention. How antimicrobial resistance happens[EB/OL]. (2022-12-05)[2023-03-15]. https://www.cdc.gov/drugresistance/about/how-resis-tance-happens.html.
|
| [8] |
World Health Organization. Antimicrobial stewardship programmes in health-care facilities in low- and middle-income countries: a WHO practical toolkit[EB/OL]. (2019-10-22)[2023-03-15]. https://www.who.int/publications-detail-redirect/9789241515481.
|
| [9] |
Centers for Disease Control and Prevention. Core elements of hospital antibiotic stewardship programs[EB/OL]. (2023-09-07)[2023-03-15]. https://www.cdc.gov/antibiotic-use/core-elements/hospital.html.
|
| [10] |
Centers for Disease Control and Prevention. CDC's core infection prevention and control practices for safe healthcare deli-very in all settings[EB/OL]. (2022-11-29)[2023-03-15]. https://www.cdc.gov/infectioncontrol/guidelines/core-practices/index.html.
|
| [11] |
黄勋, 吴安华, 尹桃, 等. 多学科协作抗菌药物管理模式的实践与思考[J]. 中国护理管理, 2019, 19(8): 1138-1141. Huang X, Wu AH, Yin T, et al. Practice and reflection on the multi-disciplinary cooperative antibacterial drug management model[J]. Chinese Nursing Management, 2019, 19(8): 1138-1141. |
| [12] |
肖永红. 感染控制与抗菌药物管理齐头并进有效遏制细菌耐药[J]. 中国感染控制杂志, 2021, 20(7): 583-585. Xiao YH. Implementing infection control and antimicrobial stewardship, hand in hand to curb antimicrobial resistance[J]. Chinese Journal of Infection Control, 2021, 20(7): 583-585. |
| [13] |
Karanika S, Paudel S, Grigoras C, et al. Systematic review and Meta-analysis of clinical and economic outcomes from the implementation of hospital-based antimicrobial stewardship programs[J]. Antimicrob Agents Chemother, 2016, 60(8): 4840-4852. DOI:10.1128/AAC.00825-16 |
| [14] |
Baur D, Gladstone BP, Burkert F, et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and Meta-analysis[J]. Lancet Infect Dis, 2017, 17(9): 990-1001. DOI:10.1016/S1473-3099(17)30325-0 |
| [15] |
Sarma JB, Marshall B, Cleeve V, et al. Effects of fluoroquino-lone restriction (from 2007 to 2012) on resistance in Entero-bacteriaceae: interrupted time-series analysis[J]. J Hosp Infect, 2015, 91(1): 68-73. DOI:10.1016/j.jhin.2015.05.006 |
| [16] |
朱榕生, 宋姣姣, 徐领城, 等. 2015—2018年住院患者治疗性抗菌药物使用前分离菌株及药敏情况[J]. 中国感染控制杂志, 2020, 19(11): 981-989. Zhu RS, Song JJ, Xu LC, et al. Isolated strains and antimicrobial susceptibility of strains from hospitalized patients before therapeutic antimicrobial use in 2015-2018[J]. Chinese Journal of Infection Control, 2020, 19(11): 981-989. |
| [17] |
黄勋, 邓子德, 倪语星, 等. 多重耐药菌医院感染预防与控制中国专家共识[J]. 中国感染控制杂志, 2015, 14(1): 1-9. Huang X, Deng ZD, Ni YX, et al. Chinese experts' consensus on prevention and control of multidrug resistance organism healthcare-associated infection[J]. Chinese Journal of Infection Control, 2015, 14(1): 1-9. |
| [18] |
杨启文, 吴安华, 胡必杰, 等. 临床重要耐药菌感染传播防控策略专家共识[J]. 中国感染控制杂志, 2021, 20(1): 1-14. Yang QW, Wu AH, Hu BJ, et al. Expert consensus on strategies for the prevention and control of spread of clinically important antimicrobial-resistant organisms[J]. Chinese Journal of Infection Control, 2021, 20(1): 1-14. DOI:10.12138/j.issn.1671-9638.20218124 |
| [19] |
江一帆, 费凯红, 邹妮, 等. 咽拭子联合肛拭子作为ICU多重耐药菌入院筛查的有效性评估[J]. 中国感染控制杂志, 2023, 22(12): 1493-1498. Jiang YF, Fei KH, Zou N, et al. Effectiveness evaluation of pharyngeal swabs combined with anal swabs as multidrug-resistant organisms admission screening in intensive care unit[J]. Chinese Journal of Infection Control, 2023, 22(12): 1493-1498. DOI:10.12138/j.issn.1671-9638.20234082 |
| [20] |
孟秀娟, 吴安华. 如何应对多重耐药菌医院感染的严峻挑战[J]. 中国感染控制杂志, 2019, 18(3): 185-192. Meng XJ, Wu AH. How to deal with severe challenge of healthcare-associated infection due to multidrug-resistant organisms[J]. Chinese Journal of Infection Control, 2019, 18(3): 185-192. |
| [21] |
Yakupogullari Y, Otlu B, Ersoy Y, et al. Is airborne transmission of Acinetobacter baumannii possible: a prospective molecular epidemiologic study in a tertiary care hospital[J]. Am J Infect Control, 2016, 44(12): 1595-1599. DOI:10.1016/j.ajic.2016.05.022 |
| [22] |
Mousa M, Schwartz D, Carmeli Y, et al. Droplet aerosol dissemination of carbapenem-resistant Acinetobacter baumannii surrounding ventilated patients[J]. Infect Control Hosp Epidemiol, 2019, 40(3): 365-367. DOI:10.1017/ice.2018.335 |
| [23] |
Gentry EM, Kester S, Fischer K, et al. Bugs and drugs: collaboration between infection prevention and antibiotic stewardship[J]. Infect Dis Clin North Am, 2020, 34(1): 17-30. DOI:10.1016/j.idc.2019.10.001 |



