耐药结核病的出现和广泛传播是2035年实现无结核病世界的主要障碍[1]。耐药结核病治疗周期长、费用高、治愈率低[2-3],造成患者传播时间延长。虽然耐药基因检测技术已广泛应用于耐药结核病快速筛查,但检测药物种类有限以及耐药性分子机制尚不完全清楚[4],故表型药敏方法仍发挥着重要作用。目前罗氏比例法药敏试验被世界卫生组织(WHO)推荐为检测耐药结核的金标准[5],但该方法操作繁琐、检测周期较长且药物种类有限[6],仅能根据临床实验室标准化协会提供临界浓度判断“敏感”和“耐药”,无法监测药物治疗期间耐药浓度变化。肉汤微量稀释(broth microdilution, BMD)法药敏试验是一种比较有前景的解决方案,其操作简便,检测时间较短,仪器设备简单,可同时定量检测多种抗结核药物最低抑菌浓度(minimum inhibitory concentration, MIC)值[7-8],从而提供定量的耐药性水平,指导临床个体化用药。然而目前我国仍缺乏BMD法标准化的方法,其商品化BMD法药敏板包含药物种类、操作方法及判读标准等均有明显差异,影响其推广使用,并且BMD法药敏试验在海南省耐多药结核分枝杆菌(multidrug-resistant Mycobacterium tuberculosis, MDR-MTB)的研究相对缺乏。因此,本研究以罗氏比例法药敏试验为标准,评估商品化BMD法药敏板在海南省耐药结核分枝杆菌耐药性检测中临床应用效果。
1 对象与方法 1.1 研究对象选取2019年12月—2021年3月海南医学院第二附属医院(即海南省结核病医院)就诊疑似肺结核患者的痰、支气管肺泡灌洗液等呼吸道标本进行分离培养,经罗氏比例法药敏试验筛查,共筛选纳入108株MDR-MTB和11株非MDR-MTB。结核分枝杆菌(Mycobacterium tuberculosis, MTB)敏感标准株H37Rv(ATCC 27294)由中国疾病预防控制中心(CDC)国家结核病参比实验室提供。
1.2 仪器与试剂 1.2.1 仪器BSC-1600 ⅡB2型生物安全柜均由苏州安泰空气技术有限公司生产,电热恒温培养箱由上海博迅公司生产,Neofuge 15R高速冷冻离心机由上海力申科学仪器有限公司生产,多通道移液器由德国eppendorf公司生产。
1.2.2 试剂MTB药敏试剂盒(MIC法)、罗氏比例法药敏培养基、对硝基苯甲酸(P-nitrobenzoic acid, PNB)/噻吩-2-羧酸肼(2-thiophenecarboxylic acid hydrazide, TCH)鉴定培养基均由珠海贝索公司提供,基因组DNA提取试剂盒由广东体必康生物科技有限公司提供。
1.3 试验方法 1.3.1 菌悬液配制使用一次性接种环刮取培养2~3周的新鲜MTB菌株,移到含玻璃珠和无菌盐水的磨菌管中进行研磨,用无菌生理盐水稀释,与1麦氏单位比浊管比浊,配成1 mg/mL的预处理菌悬液。
1.3.2 罗氏比例法药敏试验吸取预处理菌悬液按照《结核病实验室检验规程》[9]操作配制成浓度为10-2 mg/mL和10-4 mg/mL的菌悬液,分别接种于对照培养基(中性罗氏培养基)和药敏培养基上,倒置于(36±1)℃培养箱中培养24 h后,再拧紧,直立培养4周后观察结果。罗氏比例法药敏培养基药物浓度分别为异烟肼(isoniazid, INH)0.2 μg/mL、利福平(rifampicin, RFP)40 μg/mL、乙胺丁醇(Ethambutol, EMB)2.0 μg/mL、莫西沙星(moxifloxacin, MFX)2.0 μg/mL、卡那霉素(kanamycin, KM)30.0 μg/mL、卷曲霉素(capreomycin, CPM)40.0 μg/mL、丙硫异烟胺(protionamide, PTO)40.0 μg/mL和对氨基水杨酸(para-aminosalicylic acid, PAS)1.0 μg/mL。
1.3.3 BMD法药敏试验使用结核分枝杆菌药敏试剂盒(MIC法)中培养液将预处理菌1 mg/mL悬液稀释100倍,分别以100 μL/孔加入BMD法药敏板中,加样后加盖并用封口膜密封,正面向上置于(36±1)℃培养,以对照孔MTB生长良好时观察对应孔各药物并判读浓度,最佳判读时间为7~14 d,最长不超过21 d。耐药判断标准(临界浓度)[7]为INH 0.2 μg/mL,RFP 1.0 μg/mL,EMB 5.0 μg/mL,MFX 0.5 μg/mL,KM 5.0 μg/mL,CPM 2.0 μg/mL,PTO 2.5 μg/mL,PAS 2.0 μg/mL。
1.3.4 全基因组测序罗氏比例法药敏试验和BMD法药敏试验检测结果不一致的菌株进一步进行全基因组测序(whole genome sequencing, WGS)。采用十六烷基三甲基溴化铵-溶菌酶(cetyltrimethylammonium bromide-lysozyme, CTAB)法[10]提取DNA组,DNA组通过广东体必康生物科技有限公司进行高通量测序和生物信息分析来获得目标基因组。使用TB Profiler (v2.8.12, https://github.com/jodyphelan/TB Profiler)[11-12]对测序MTB菌株耐药性进行分析。
1.3.5 质量控制每批次罗氏比例法和BMD法药敏试验均以MTB标准株H37Rv为敏感参考菌株进行室内质控;MTB分离培养、药敏试验及结核病分子诊断参加中国CDC国家结核病参比实验室或结核病防治临床中心的室间质评活动。
1.4 数据处理应用SPSS 26.0统计软件对数据进行分析。采用卡方检验或Fisher确切概率法分析罗氏比例法和BMD法药敏结果的差异。以P≤0.05为差异有统计学意义。
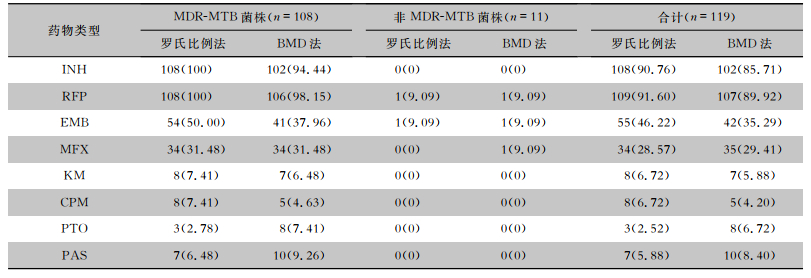
2 结果 2.1 两种方法药敏检测结果罗氏比例法和BMD法药敏结果平均判读时间分别为28.0、8.5 d,BMD法药敏结果中仅有2株MDR-MTB菌株判读时间超过14 d(分别为15.0、18.0 d)。MTB药敏试验结果显示,罗氏比例法检测INH、RFP、EMB、KM和CPM的耐药率高于BMD法(均P<0.001);BMD法检测PTO和PAS的耐药率高于罗氏比例法(均P<0.001)。见表 1。共有9株MTB使用罗氏比例法对EMB耐药MIC值为EMB临界浓度(5.0 μg/mL)。见图 1。
| 表 1 罗氏比例法和BMD法检测MTB的耐药结果[株(%)] Table 1 Drug resistance results of MTB tested by Roche's proportional method and BMD method (No. of strains [%]) |
|
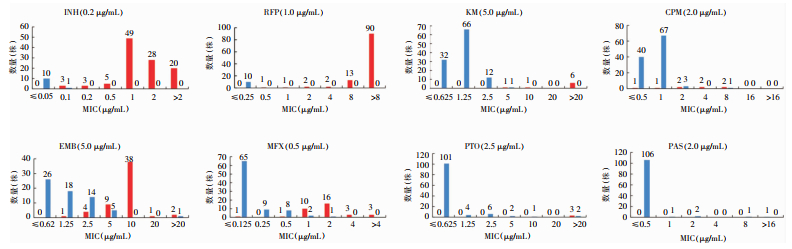 |
| 注:红色条形柱表示比例法耐药菌株,蓝色条形柱表示比例法敏感菌株。 图 1 MTB药敏试验MIC分布 Figure 1 MIC distribution of drug susceptibility testing of MTB |
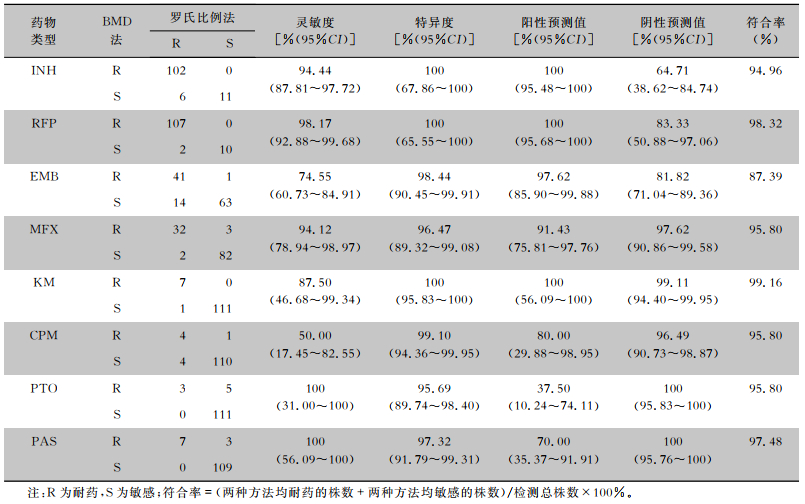
以罗氏比例法药敏结果为金标准,BMD法检测耐药性的灵敏度和特异度分别为50.00%~100%、95.69%~100%,其中灵敏度最低的药物为CPM(50.00%),其次为EMB(74.55%),特异度最低的药物为PTO(95.69%)。除EMB(87.39%)、INH(94.96%)外,BMD法检测其他药物的耐药性符合率均≥95%。见表 2。
| 表 2 罗氏比例法和BMD法药敏结果一致性分析 Table 2 Consistency of drug susceptibility results between Roche's proportional method and BMD method |
|
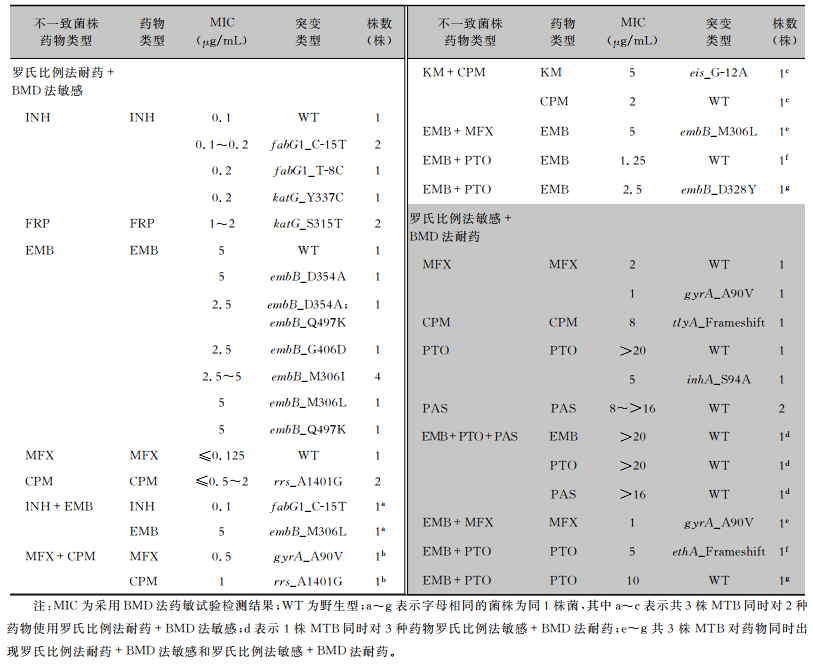
罗氏比例法和BMD法药敏试验检测结果不一致的MTB共34株,有26株MTB药敏检测使用罗氏比例法耐药+BMD法敏感,有11株MTB对药物使用罗氏比例法敏感+BMD法耐药,其中有3株MTB对2种不同药物同时分别出现使用罗氏比例法耐药+BMD法敏感和使用罗氏比例法敏感+BMD法敏感。罗氏比例法药敏结果与WGS总符合率为76.19%(32/42),BMD法药敏结果与WGS总符合率为23.81%(10/42),差异具有统计学意义(χ2=23.048,P<0.001)。
84.62 %(22/26)使用罗氏比例法耐药+BMD法敏感的MTB在相关耐药基因中发生突变,其中1株同时对KM和CPM罗氏比例法耐药+BMD法敏感的MTB仅对KM在eis启动子区域发生突变,而对CPM相关耐药基因未发生突变;4株MTB对INH在fabG1启动子区域发生突变,BMD法药敏检测MIC值在0.1~0.2 μg/mL;12株MTB对EMB在embB基因上发生突变,BMD法药敏检测MIC值均≤临界浓度(5.0 μg/mL)。
45.45%(5/11)使用罗氏比例法敏感+BMD法耐药的MTB在相关耐药基因中发生突变,其中2株MTB对MFX在gyrA基因中发生突变,1株对CPM在tlyA基因中发生移码,2株对PTO低浓度耐药(5 μg/mL)分别在inhA和ethA发生突变。有3株MTB对于PTO表现为野生型;有3株MTB均未发现对PAS有相关耐药基因突变。见表 3。
| 表 3 BMD法和罗氏比例法药敏检测存在差异的MTB菌株WGS结果 Table 3 WGS results of strains with different drug susceptibility results tested by BMD method and Roche's proportional method |
|
我国耐药结核病流行严重,经济、有效和快速检测结核病耐药性对于结核病防治至关重要。当前我国常用的基于罗氏培养基的比例法药敏试验操作繁琐、检测时间至少4周[13-14]。该方法使用一个或两个临界浓度来确定药物耐药性。然而,一些研究报告,在耐药MTB菌株中观察到的异质性MIC水平可能具有重要的治疗意义[15]。Heysell等[16]研究表明,为了应对MIC参考临界浓度,临床医生可能会增加药物的剂量,如左氧氟沙星或MFX,甚至考虑减少具有毒性的药物剂量。因此,了解耐药程度对临床治疗更有意义。BMD法药敏试验不仅可以提供定量药敏结果,还可以提供耐药程度(MIC值)。
本研究发现使用BMD法药敏试验检测平均周期仅为8.5 d,短于罗氏比例法检测周期28.0 d,BMD法药敏试验可更快地检出耐药菌株。本研究显示以罗氏比例法药敏试验为标准,除了EMB(87.39%)、INH(94.96%)外,BMD法检测其他药物耐药性的符合率均高于95%。BMD法检测对大部分药物的灵敏度和特异度均>90%,但对CPM的灵敏度仅为50.00%,其主要原因是罗氏比例法对CPM耐药的菌株仅为8株,BMD法对CPM药敏结果分别为4株耐药、4株敏感,由于耐药菌株数量过少不具有代表性。本研究中有使用罗氏比例法发现9株对EMB耐药的MTB菌株MIC值在EMB临界浓度(5.0 μg/mL)上,导致BMD法对EMB检测灵敏度、阴性预测值和符合率较低。研究[17]表明,EMB的表型药敏方法不如INH或RFP等其他药物准确,实验室间或方法学一致性低。因此,需要更多基于大样本的研究来评估BMD法在检测这种药物的敏感性方面的性能。
本研究还对两种表型方法总体不一致菌株进行全基因组测序分析,发现罗氏比例法药敏结果与WGS总符合率高于BMD法(P<0.001),显示出WGS结果更支持罗氏比例法药敏结果。在使用罗氏比例法耐药+BMD法敏感菌株中,有84.62%的MTB菌株在相关耐药基因中发生突变,与抗结核药物耐药性密切相关,其中12株MTB对EMB在embB基因上发生突变,MIC值均≤临界浓度(5.0 μg/mL),说明BMD法药敏在对EMB的临界浓度(5.0 μg/mL)应需要更多数据验证及调整。使用罗氏比例法敏感+BMD法耐药MTB菌株中,仅45.45%的MTB菌株发生了相关耐药基因的突变,说明BMD法药敏对PAS、PTO等二线药物可靠性有待进一步验证。
本研究具有一定的局限性。由于患者数据及研究时间有限,某些药物耐药率低,如KM、CPM、PTO及PAS耐药率<10%,这些药物的高特异性可能导致结果偏倚,不具有代表性。应增加研究菌株数量及耐药性,进一步研究、验证。
综上所述,BMD法是一种准确、快速检测耐药MTB敏感性的方法,具有广泛的应用前景。与传统罗氏比例法相比,BMD法能够更快地检出耐药菌株,并提供耐药菌株的MIC,有助于指导个体化治疗。然而,BMD法在某些药物的检测上还存在一定的限制,需要进一步优化和改进。所以还需要继续开展更多的研究,以进一步验证BMD法在耐药MTB敏感性检测中的应用价值,并探索其他新的检测方法,以提高结核病的治疗效果和控制策略。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Liu DX, Huang F, Zhang GL, et al. Whole-genome sequencing for surveillance of tuberculosis drug resistance and determination of resistance level in China[J]. Clin Microbiol Infect, 2022, 28(5): 731. |
| [2] |
Gandhi NR, Nunn P, Dheda K, et al. Multidrug-resistant and extensively drug-resistant tuberculosis: a threat to global control of tuberculosis[J]. Lancet, 2010, 375(9728): 1830-1843. DOI:10.1016/S0140-6736(10)60410-2 |
| [3] |
He WC, Tan YH, Liu CF, et al. Drug-resistant characteristics, genetic diversity, and transmission dynamics of rifampicin-resistant Mycobacterium tuberculosis in Hunan, China, revealed by whole-genome sequencing[J]. Microbiol Spectr, 2022, 10(1): e0154321. DOI:10.1128/spectrum.01543-21 |
| [4] |
夏辉, 郑扬, 宋媛媛. 世界卫生组织《优化肉汤微孔板法结核分枝杆菌复合群药物敏感性试验方法学》解读[J]. 中国防痨杂志, 2022, 44(7): 641-645. Xia H, Zheng Y, Song YY. Interpretation of the optimized broth microdilution plate methodology for drug susceptibility testing of Mycobacterium tuberculosis complex issued by World Health Organization[J]. Chinese Journal of Antituberculosis, 2022, 44(7): 641-645. |
| [5] |
吴敏, 周洪经, 李志媛, 等. 最低抑菌浓度法在耐药结核分枝杆菌药敏试验中的应用[J]. 山东医药, 2021, 61(12): 42-46. Wu M, Zhou HJ, Li ZY, et al. Application of minimum inhi-bitory concentration method in drug sensitivity test of drug-resistant Mycobacterium tuberculosis[J]. Shandong Medical Journal, 2021, 61(12): 42-46. |
| [6] |
Macedo R, Nunes A, Portugal I, et al. Dissecting whole-genome sequencing-based online tools for predicting resistance in Mycobacterium tuberculosis: can we use them for clinical decision guidance?[J]. Tuberculosis (Edinb), 2018, 110: 44-51. DOI:10.1016/j.tube.2018.03.009 |
| [7] |
Clinical&Laboratory Standards Institute. Susceptibility testing of Mycobacteria, Nocardia spp., and other aerobic actinomycetes: M243rd edition[S]. Malvern, PA, USA: CLSI, 2018.
|
| [8] |
Clinical & Laboratory Standards Institute. Performance stan-dards for susceptibility testing of Mycobacteria, Nocardia spp., and other aerobic actinomycetes: M62[S]. Malvern, PA, USA: CLSI, 2018.
|
| [9] |
赵雁林, 逄宇. 结核病实验室检验规程[M]. 北京: 人民卫生出版社, 2015. Zhao YL, Pang Y. Rules for laboratory examination of tuberculosis[M]. Beijing: People's Medical Publishing House, 2015. |
| [10] |
Wang JY, Yu CC, Xu YN, et al. Analysis of drug-resistance characteristics and genetic diversity of multidrug-resistant tuberculosis based on whole-genome sequencing on the Hainan island, China[J]. Infect Drug Resist, 2023, 16: 5783-5798. DOI:10.2147/IDR.S423955 |
| [11] |
Phelan JE, O'Sullivan DM, Machado D, et al. Integrating informatics tools and portable sequencing technology for rapid detection of resistance to anti-tuberculous drugs[J]. Genome Med, 2019, 11(1): 41. DOI:10.1186/s13073-019-0650-x |
| [12] |
Coll F, McNerney R, Preston MD, et al. Rapid determination of anti-tuberculosis drug resistance from whole-genome sequences[J]. Genome Med, 2015, 7(1): 51. DOI:10.1186/s13073-015-0164-0 |
| [13] |
王为娜, 龙波, 高文凤, 等. 微量MIC法和罗氏比例法对结核分枝杆菌药敏检测比对分析[J]. 寄生虫病与感染性疾病, 2019, 17(1): 52-54. Wang WN, Long B, Gao WF, et al. Comparing analysis of MIC microtiter and Lowenstein-Jensen DST of Mycobacterium tuberculosis[J]. Parasitoses and Infectious Diseases, 2019, 17(1): 52-54. |
| [14] |
刘金娜. 微量液体培养基最低抑菌浓度法与罗氏比例法在结核分枝杆菌药敏试验中的价值比较[J]. 实用临床医药杂志, 2020, 24(17): 28-30, 40. Liu JN. Value of minimum inhibitory concentration method of microliquid culture medium versus Roche's proportional me-thod in drug susceptibility test of Mycobacterium tuberculosis[J]. Journal of Clinical Medicine in Practice, 2020, 24(17): 28-30, 40. |
| [15] |
Xia H, Zheng Y, Zhao B, et al. Assessment of a 96-well plate assay of quantitative drug susceptibility testing for Mycobacterium tuberculosis complex in China[J]. PLoS One, 2017, 12(1): e0169413. DOI:10.1371/journal.pone.0169413 |
| [16] |
Heysell SK, Moore JL, Peloquin CA, et al. Outcomes and use of therapeutic drug monitoring in multidrug-resistant tuberculosis patients treated in Virginia, 2009-2014[J]. Tuberc Respir Dis (Seoul), 2015, 78(2): 78-84. DOI:10.4046/trd.2015.78.2.78 |
| [17] |
Angra PK, Taylor TH, Iademarco MF, et al. Performance of tuberculosis drug susceptibility testing in U.S. laboratories from 1994 to 2008[J]. J Clin Microbiol, 2012, 50(4): 1233-1239. DOI:10.1128/JCM.06479-11 |



