2. 中日友好江西医院国家区域医疗中心,江西 南昌 330052;
3. 南昌大学第一附属医院检验科,江西 南昌 330006;
4. 江西省中医药大学,江西 南昌 330004
2. National Regional Medical Center, China-Japan Friendship Jiangxi Hospital, Nanchang 330052, China;
3. Department of Laboratory Medicine, The First Affiliated Hospital of Nanchang University, Nanchang 330006, China;
4. Jiangxi University of Chinese Medicine, Nanchang 330004, China
高毒力肺炎克雷伯菌(hypervirulent Klebsiella pneumoniae, hvKP)能够在健康群体中引起侵袭性社区获得性感染,同时可导致肺炎、脓毒血症、肝脓肿、眼内炎、泌尿系统感染,以及血流感染等多种感染性疾病[1],具有较高的流行率及病死率,对公共卫生系统造成了巨大负担。同时,多重耐药hvKP的出现与传播已成为亟待解决的难题,其耐药机制复杂,包括抗菌药物渗透障碍、灭活酶产生、外排泵系统过表达、生物被膜形成等[2]。细菌在恶劣的生存环境下形成的一种高度结构化的、以微菌落为基本单位的膜状结构即生物被膜,其不仅可帮助细菌定植,提高对抗菌药物的耐药性,还能够为细菌提供养分并搭建信息交流桥梁[3]。hvKP生物被膜形成能力极强,而生物被膜形成能力被证实与hvKP的耐药性、致病性及侵袭力高度相关[4]。因此,深入了解hvKP生物被膜形成相关因素并找到有效控制和清除hvKP生物被膜的药物尤为重要。
近年研究[5]发现,在抗细菌生物被膜方面天然药物较化学合成药物有一定的优势,但具体的作用机制仍缺乏系统性研究。某些植物中的精油成分在细菌菌毛初始黏附、胞外基质合成及建立群体感应系统等方面发挥重要作用,并通过上述作用抑制生物被膜的形成[6-7]。香芹酚是牛至和百里香等植物精油的主要成分[8],可以减少粪肠球菌、金黄色葡萄球菌、大肠埃希菌、沙门氏菌、口腔致病菌等众多细菌生物被膜的形成[9-13]。目前有关香芹酚对hvKP及其生物被膜抑制方面的研究较少,本研究以hvKP模式菌株NTUH-K2044为研究对象,了解香芹酚抑制hvKP生物被膜形成的可能机制,为hvKP感染治疗的新途径提供理论依据。
1 材料与方法 1.1 材料 1.1.1 菌株和试剂hvKP NTUH-K2044为课题组保存的复旦大学附属华山医院蒋晓飞教授惠赠菌株,香芹酚(MCE,纯度>98%,批号#104908),磷酸盐缓冲液(PBS)、结晶紫染液、刚果红、2.5%戊二醛固定液(Solarbio公司,货号分别为P1020、#G1062、C8450、#P1126),无水乙醇(西陇科学,批号2303289),D-葡萄糖醛酸溶液(北京索莱宝公司,10 mg/mL,批号F619BA0021);RNAprep Pure Cell/Bacteria Kit(DP430;北京天根生化科技有限公司,批号Y1317),PrimeScriptTM RT reagent Kit、荧光定量PCR试剂盒TB Green Premix Ex TaqTM(TaRaKa公司,批号分别为#AMG1420A、#AM81836A)。所用引物均由上海生工生物技术有限公司合成。
1.1.2 仪器设备紫外分光光度计(美国宝特ELX808),高速冷冻离心机(湖南湘鑫仪器仪表有限公司,TGL-16M),高速离心机(力辰邦西仪器有限公司,LC-LX-HL2100),PCR仪(西安天隆生物科技有限公司Gentier 96R),扫描电子显微镜(JEOL,JSM-6701F)。
1.2 方法 1.2.1 最低抑菌浓度(MIC)测定及细菌生长曲线的绘制将过夜活化的菌液与香芹酚按比例混合,依照二倍稀释法使香芹酚最终浓度为0~2 048 μg/mL,每梯度浓度样本量均为5 mL,摇床培养24 h后观察菌液的浑浊度,澄清试管中香芹酚浓度为MIC,取200 μL菌液测定A540值,无菌生长的香芹酚浓度为MIC;按上述方法制备各梯度香芹酚的菌液后,于37℃ 200 r/min条件下培养24 h,每隔2 h取200 μL菌液,测定A540值,绘制细菌生长曲线。
1.2.2 生物被膜的测定采用结晶紫染色测定法。制备上述含梯度浓度香芹酚的菌液5 mL,分别加入96微孔板内,每孔加入200 μL,设置三组平行试验,温箱培养24 h后吸出菌液,使用PBS冲洗3次,晾干后以1%的结晶紫染液染色15 min,蒸馏水洗板至无色,晾干。为充分溶解残留结晶紫,每孔加入200 μL无水乙醇并将其移至新的微孔板中,测定阴性对照A540值。以阴性对照值x±3s为对照区间,>该值则定为生物被膜阳性。
1.2.3 生物被膜胞外基质多糖含量的测定采用刚果红吸附试验测定法。制备含0、32、64、128、256 μg/mL香芹酚的菌液各5 mL,培养24 h后按照马倩倩等[14]的方法离心将菌体及其吸附的刚果红沉淀到底部,取上清液部分测量吸光值A490,用于评价培养基中剩余的刚果红量。另外用含40 μg/mL刚果红的LB培养基的A490作正对照,正对照值减去培养基中剩余刚果红的值为菌体吸附的刚果红量,即胞外基质中多糖含量。
1.2.4 荚膜多糖含量的测定采用间羟基联苯比色测定法。按上述方法制备梯度香芹酚菌液各5 mL,培养至对数中期;参照Qiu等[15]的方法测得荚膜多糖含量。
1.2.5 生物被膜内菌体聚集状态的观测采用扫描电子显微镜(SEM)观测法。选取含0、64 μg/mL香芹酚的菌液各5 mL,加入已放置无菌细胞爬片的6孔板中,培养24 h后吸出菌液,PBS去除游离菌,戊二醛固定后使用PBS洗板3次,晾干后采用50%、70%、80%、90%、95%、100%梯度浓度的乙醇脱水,每次脱水10 min。将制作的标本干燥后离子喷金镀膜,置于SU-8010冷场SEM下观察,并拍照、存图。
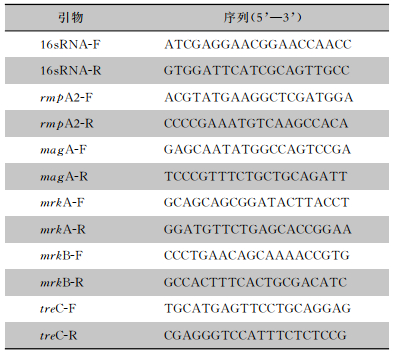
1.2.6 生物被膜相关基因表达的测定采用逆转录聚合酶链反应(RT-PCR)法测定。以上述方法制备0、64 μg/mL香芹酚的菌液各3 mL,37℃培养至对数中期,参照提取RNA试剂盒说明书提取细菌RNA,将RNA逆转录成cDNA后,以cDNA为模板,16sRNA为内参基因,利用荧光定量PCR试剂盒定量测定在香芹酚作用下NTUH-K2044菌生物被膜相关基因(rmpA2、magA、mrkA、mrkB、treC)的表达量,采用2-△△Ct法分析试验数据。NTUH-K2044生物被膜相关基因RT-PCR的引物序列见表 1。
| 表 1 NTUH-K2044生物被膜相关基因RT-PCR的引物序列 Table 1 Primer sequences for RT-PCR of NTUH-K2044 biofilm-related genes |
|
本研究中涉及的试验平行重复3次。应用Graphpad Prism 8.0及OriginPro 2022对数据进行分析,多组间比较采用单因素方差分析,两两比较采用非配对t检验,结果采用均值±标准差表示,P≤0.05为差异有统计学意义。
2 结果 2.1 MIC测定结果肉眼观察梯度浓度香芹酚作用NTUH-K2044后菌株的生长情况,并测定其A540值,最终确定香芹酚对NTUH-K2044的MIC值为512 μg/mL。
2.2 香芹酚对hvKPNTUH-K2044生长的影响当香芹酚浓度为512 μg/mL时,明显抑制细菌生长;而当香芹酚浓度为256 μg/mL,细菌前6 h生长过程被抑制,之后逐渐生长,但其最终生长情况与阳性对照相比仍受抑制;当香芹酚浓度为128 μg/mL时,细菌前期生长过程不受抑制,但其最大生长量与阳性对照相比略受抑制;当香芹酚浓度为64 μg/mL时,细菌的生长情况与未加香芹酚的阳性对照基本一致。因此,后续试验过程拟以128、64 μg/mL的香芹酚进行干预处理,探究其对生物被膜的抑制作用。NTUH-K2044在不同浓度香芹酚作用下的生长曲线见图 1。
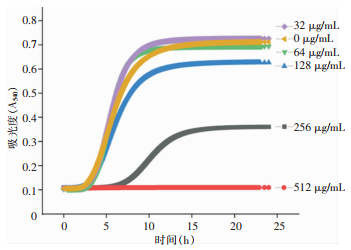 |
| 图 1 NTUH-K2044在不同浓度香芹酚作用下的生长曲线 Figure 1 Growth curves of NTUH-K2044 under the effect of different concentrations of carvacrol |
采用结晶紫染色定量检测法比较在不同亚抑菌浓度香芹酚作用下,NTUH-K2044生物被膜的形成能力,结果显示在亚抑菌浓度64、128、256 μg/mL香芹酚作用24 h后,NTUH-K2044生物被膜形成能力分别为0.681±0.169、0.380±0.042、0.120±0.003,较对照组(2.782±0.372)降低(均P<0.001),并呈现浓度依赖性。见图 2。
 |
| 注:*表示与对照组比较,P<0.001。 图 2 不同浓度香芹酚对NTUH-K2044生物被膜形成能力的影响 Figure 2 Effect of different concentrations of carvacrol on the biofilm formation ability of NTUH-K2044 |
NTUH-K2044胞外基质多糖与荚膜多糖的影响当加入香芹酚的浓度为32、64、128、256 μg/mL时,其刚果红吸附量即胞外基质中多糖含量分别为1.375±0.080、1.403±0.005、1.378±0.007、0.541±0.002,香芹酚浓度为256 μg/mL时胞外基质中多糖含量低于对照组(1.386±0.088,P<0.001),其余浓度下,多糖含量与对照比较无明显变化(均P>0.05),见图 3。当加入64、128 μg/mL亚抑菌浓度的香芹酚时,荚膜多糖含量分别为0.035±0.003、0.031±0.003,低于对照组(0.053±0.003,均P<0.001),见图 4。说明亚抑菌浓度的香芹酚可降低hvKP荚膜多糖含量,但对细菌胞外多糖总量无明显影响。
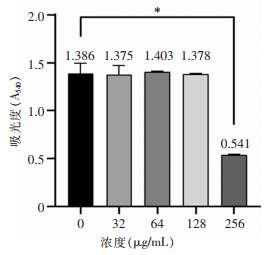 |
| 注:*表示与对照组比较,P<0.001。 图 3 NTUH-K2044在不同浓度香芹酚作用下胞外多糖总含量变化 Figure 3 Changes in total extracellular polysaccharide content of NTUH-K2044 under the effect of different concentrations of carvacrol |
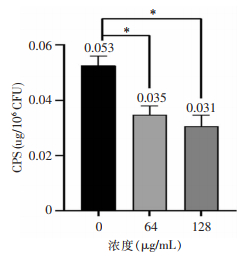 |
| 注:*表示与对照组比较,P<0.001。 图 4 NTUH-K2044在不同浓度香芹酚作用下菌荚膜多糖含量变化 Figure 4 Changes in capsule polysaccharide content of NTUH-K2044 under the effect of different concentrations of carvacrol |
NTUH-K2044生物被膜内菌体微观形态学的影响NTUH-K2044培养24 h后,采用SEM观察其生物被膜内菌体的形态学,可见菌体较大且聚集联结,细胞层数较厚。而经64 μg/mL香芹酚干预处理后的NTUH-K2044生物被膜,在同一时间则呈现出菌体间连接松散,细胞层数薄的特点。见图 5。
 |
| 注:a、b、c为NTUH-K2044野生株;d、e、f为加入64 μg/mL香芹酚作用后。 图 5 NTUH-K2044培养24 h后SEM下的生物被膜形态图 Figure 5 Morphology of biofilm under scanning electron microscope after 24 hours of NTUH-K2044 cultivation |
64 μg/mL香芹酚与NTUH-K2044混合培养24 h后,NTUH-K2044生物被膜菌体中的rmpA2、magA、mrkA、mrkB、treC 5种目标基因的表达量分别为0.327、0.295、0.218、0.210、0.151,较对照组(1.000)均明显下降(均P<0.001)。见图 6。
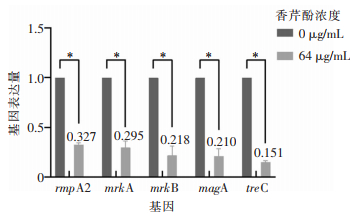 |
| 注:*表示与对照组比较,P<0.001。 图 6 香芹酚作用下NTUH-K2044生物被膜相关基因表达水平 Figure 6 Expression levels of NTUH-K2044 biofilm-related genes under the effect of carvacrol |
近年来,抗菌药物的使用使得细菌耐药问题愈发突出,而生物被膜作为细菌耐药机制中的重要一环[16],也愈发受到关注。天然药物相对于化学合成药物具有安全性高、疗效独特、多靶点调控、环保可持续等优势,其对耐药细菌作用的研究备受重视。药用植物中提取的天然成分可逆转对抗菌药物的耐药性,并与抗菌药物协同抗菌,其抑菌机制是多方面的,其中重要的是抑制和破坏菌体生物被膜形成[17]。董士华等[18]总结了天然药物对金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、表皮葡萄球菌等菌体生物被膜的作用,但其具体抑制机制依然不明确。
hvKP已被证实极易形成生物被膜[4],给其感染的诊治及医院感染防控带来了极大的挑战,其有关中药方面的研究甚少。香芹酚作为植物精油的主要成分,在抗菌、抗炎、抗氧化、调节血糖和增强机体免疫力等方面功效明确,低剂量香芹酚可有效降低细菌运动性,减少多种微生物生物被膜的形成。本研究选取香芹酚处理hvKP模式菌株NTUH-K2044,初步探究香芹酚抑制hvKP生物被膜形成的潜在作用机制,试图为临床治疗及医院感染防控找到新的靶点。结果显示,香芹酚对NTUH-K2044的MIC为512 μg/mL,亚抑菌浓度香芹酚可明显抑制NTUH-K2044生物被膜形成,且其抑制作用存在浓度依赖。通过SEM也观察到,香芹酚作用后NTUH-K2044生物被膜结构变得松散,细胞之间连接不致密。
荚膜多糖作为肺炎克雷伯菌的重要毒力因子,与hvKP致病性相关。荚膜多糖基因簇的突变可影响生物被膜形成[19]; 而糖转运系统相关调控基因可编码磷酸转移酶(EIIB/EIIC)参与调控糖转运,进而影响肺炎克雷伯菌生物被膜的形成,敲除后菌株不能形成生物被膜[20]。本研究中荧光定量PCR结果显示,亚抑菌浓度香芹酚明显下调了荚膜多糖与糖转运系统相关基因rmpA2、magA、treC的表达,且通过测定生物被膜内多糖含量也表明亚抑菌浓度的香芹酚明显降低了荚膜多糖含量,提示香芹酚对生物被膜作用机制可能为通过调控荚膜基因,影响糖转运系统进而降低荚膜多糖含量,最终抑制生物被膜形成,但具体调控机制与通路有待进一步研究。同时,香芹酚对生物被膜的作用机制并不单一,本试验发现其同样可调控Ⅲ型菌毛黏附基因mrkA、mrkB的表达,而Ⅲ型菌毛有利于肺炎克雷伯菌定植进而促进生物被膜早期有效生长[21],此意味着香芹酚抑制生物被膜形成过程中,菌毛黏附作用的减弱也许发挥一定作用,应进一步关注c-di-GMP通路[22]。
本研究选取植物精油中提取的单体成分香芹酚作为切入点,发现其对hvKP生物被膜具有明显的抑制作用,再次验证了天然药物在细菌耐药的防治中拥有巨大的潜力,且本试验初步探究了香芹酚对hvKP生物被膜的作用机制可能与调控荚膜多糖及糖转运系统、菌毛黏附的基因表达相关,为下一步深入研究其作用机制的靶点奠定了理论基础。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Tang MR, Kong X, Hao JC, et al. Epidemiological characte-ristics and formation mechanisms of multidrug-resistant hypervirulent Klebsiella pneumoniae[J]. Front Microbiol, 2020, 11: 581543. DOI:10.3389/fmicb.2020.581543 |
| [2] |
Russo TA, Marr CM. Hypervirulent Klebsiella pneumoniae[J]. Clin Microbiol Rev, 2019, 32(3): e00001-19. |
| [3] |
Guerra MES, Destro G, Vieira B, et al. Klebsiella pneumo-niae biofilms and their role in disease pathogenesis[J]. Front Cell Infect Microbiol, 2022, 12: 877995. DOI:10.3389/fcimb.2022.877995 |
| [4] |
Dan BZ, Dai HP, Zhou DG, et al. Relationship between drug resistance characteristics and biofilm formation in Klebsiella pneumoniae strains[J]. Infect Drug Resist, 2023, 16: 985-998. DOI:10.2147/IDR.S396609 |
| [5] |
陈君灏, 张雯霞, 张珏. 中药对肺炎克雷伯菌的抗菌作用的研究进展[J]. 吉林中医药, 2020, 40(4): 546-549. Chen JH, Zhang WX, Zhang J. Research progress on antibacterial activity of traditional Chinese medicine against Klebsiella pneumoniae[J]. Jilin Journal of Traditional Chinese Medicine, 2020, 40(4): 546-549. |
| [6] |
戚建锋, 滕贤麟, 叶玉玲. 花青素降低肺炎克雷伯菌生物膜的作用及机制研究[J]. 中国药师, 2021, 24(12): 2167-2170. Qi JF, Teng XL, Ye YL. Study on the effects and mechanism of cyanidin on the biofilm of Klebsiella pneumoniae[J]. China Pharmacist, 2021, 24(12): 2167-2170. |
| [7] |
周燕霞, 金东芳. 单宁酸抑制肺炎克雷伯菌生物膜形成的作用及其机制[J]. 检验医学, 2021, 36(10): 1070-1073. Zhou YX, Jin DF. Inhibition and mechanism of tannic acid on biofilm formation in Klebsiella pneumoniae[J]. Laboratory Medicine, 2021, 36(10): 1070-1073. |
| [8] |
Mączka W, Twardawska M, Grabarczyk M, et al. Carvacrol-a natural phenolic compound with antimicrobial properties[J]. Antibiotics (Basel), 2023, 12(5): 824. DOI:10.3390/antibiotics12050824 |
| [9] |
靳盼盼, 刘亚文, 邵美丽, 等. 香芹酚对食源粪肠球菌生物膜形成的抑制作用[J]. 中国食品学报, 2020, 20(7): 18-26. Jin PP, Liu YW, Shao ML, et al. Inhibition effect of carvacrol to biofilm formation of foodborne Enterococcus faecalis[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(7): 18-26. |
| [10] |
戴雨芸, 李超, 袁中伟, 等. 香芹酚抑制金黄色葡萄球菌生物被膜的形成[J]. 微生物学通报, 2020, 47(3): 813-820. Dai YY, Li C, Yuan ZW, et al. Inhibition of Staphylococcus aureus biofilm by carvacrol[J]. Microbiology China, 2020, 47(3): 813-820. |
| [11] |
Heckler C, Sant'anna V, Brandelli A, et al. Combined effect of carvacrol, thymol and nisin against Staphylococcus aureus and salmonella enteritidis[J]. An Acad Bras Cienc, 2021, 93(Suppl 4): e20210550. DOI:10.1590/0001-3765202120210550 |
| [12] |
Asadi S, Nayeri-Fasaei B, Zahraei-Salehi T, et al. Antibacterial and anti-biofilm properties of carvacrol alone and in combination with cefixime against Escherichia coli[J]. BMC Microbiol, 2023, 23(1): 55. DOI:10.1186/s12866-023-02797-x |
| [13] |
Fernández-Babiano I, Navarro-Pérez ML, Pérez-Giraldo C, et al. Antibacterial and antibiofilm activity of carvacrol against oral pathogenic bacteria[J]. Metabolites, 2022, 12(12): 1255. DOI:10.3390/metabo12121255 |
| [14] |
马倩倩, 周洋, 张永安. 嗜水气单胞菌双组分系统FlrBC的功能探究[J]. 华中农业大学学报, 2022, 41(3): 221-228. Ma QQ, Zhou Y, Zhang YA. Functional analysis of two-component system FlrBC in Aeromonas hydrophila[J]. Journal of Huazhong Agricultural University, 2022, 41(3): 221-228. |
| [15] |
Qiu JH, Wei DD, Ma JX, et al. Covert dissemination of pLVPK-like virulence plasmid in ST29-K54Klebsiella pneumoniae: emergence of low virulence phenotype strains[J]. Front Cell Infect Microbiol, 2023, 13: 1194133. DOI:10.3389/fcimb.2023.1194133 |
| [16] |
贾雯, 郭瑞林. 肺炎克雷伯菌生物膜形成及调控机制的研究进展[J]. 中国医学科学院学报, 2021, 43(6): 936-944. Jia W, Guo RL. Research advance on the factors influencing Klebsiella pneumoniae biofilm formation and the regulation mechanisms[J]. Acta Academiae Medicinae Sinicae, 2021, 43(6): 936-944. |
| [17] |
周凯仁, 李冰, 张继瑜. 植物源性天然药物抑菌机制的研究进展[J]. 中兽医医药杂志, 2021, 40(2): 84-88. Zhou KR, Li B, Zhang JY. Research progress of antibacterial mechanism of plant-derived natural medicine[J]. Journal of Traditional Chinese Veterinary Medicine, 2021, 40(2): 84-88. |
| [18] |
董士华, 曲狄, 刘铭然. 天然药物防治生物膜的研究进展[J]. 中药材, 2015, 38(4): 862-865. Dong SH, Qu D, Liu MR. Research progress of natural drug control biofilm[J]. Journal of Chinese Medicinal Materials, 2015, 38(4): 862-865. |
| [19] |
Peng D, Li X, Liu P, et al. Transcriptional regulation of galF by RcsAB affects capsular polysaccharide formation in Klebsiella pneumoniae NTUH-K2044[J]. Microbiol Res, 2018, 216: 70-78. |
| [20] |
Shadkam S, Goli HR, Mirzaei B, et al. Correlation between antimicrobial resistance and biofilm formation capability among Klebsiella pneumoniae strains isolated from hospitalized patients in Iran[J]. Ann Clin Microbiol Antimicrob, 2021, 20(1): 13. |
| [21] |
Gual-de-Torrella A, Delgado-Valverde M, Pérez-Palacios P, et al. Prevalence of the fimbrial operon mrkABCD, mrkA expression, biofilm formation and effect of biocides on biofilm formation in carbapenemase-producing Klebsiella pneumoniae isolates belonging or not belonging to high-risk clones[J]. Int J Antimicrob Agents, 2022, 60(4): 106663. |
| [22] |
Zhang CL, Wang C, Xiu ZL. Regulation of c-di-GMP in biofilm formation of Klebsiella pneumoniae in response to antibio-tics and probiotic supernatant in a chemostat system[J]. Curr Microbiol, 2021, 78(1): 133-143. |



