2. 绵阳市第三人民医院(四川省精神卫生中心)肾病内科,四川 绵阳 621000
2. Department of Nephrology, The Third Hospital of Mianyang [Sichuan Mental Health Center], Mianyang 621000, China
胃肠道穿孔是指胃壁或肠道壁发生完全性破裂,造成胃或肠内容物和气体进入腹腔,临床常表现为剧烈腹痛、呕吐、腹部肌肉紧张和压痛等[1]。如未得到及时处理,胃肠道穿孔可引发腹腔感染、脏器炎症、脏器功能障碍,甚至全身性感染等严重并发症[2]。胃肠道穿孔修补术是一种用于修复胃肠道穿孔部位的手术,能够有效关闭穿孔,防止胃或肠内容物进入腹腔[3]。手术部位感染(surgical site infection, SSI)是一种最为常见的并发症,指在手术过程中或手术后,手术切口或手术操作区域发生的组织感染[4]。据报道[5],SSI占所有医疗相关感染的14%~17%。SSI可发生于一切手术类型,其中腹部手术发生率较高[6]。由于胃肠道内分布有大量病原菌,因此穿孔修补术相较于一般腹部手术发生SSI的风险更高。SSI会影响手术切口的愈合,增加患者的痛苦和疾病负担[7],因此,辨析影响胃肠道穿孔修补术后SSI发生的具体因素和如何早期预测SSI的发生风险一直是临床研究的热点。近年研究[8-9]显示,虽然医护人员对SSI预防工作的态度十分积极,但总体认知不足,缺乏完善的专门针对术后SSI风险预测的评估工具。基于此,本研究拟应用决策树和logistic回归模型分析胃肠道穿孔修补术后并发SSI的影响因素,旨在为临床防控SSI、改善胃肠道穿孔患者预后提供参考依据。
1 对象与方法 1.1 研究对象前瞻性选取2018年1月—2023年1月于绵阳市某医院进行胃肠道穿孔修补术的患者为研究对象。纳入标准:①年龄≥18岁,经影像学确诊为胃肠道穿孔;②可耐受胃肠道修补手术;③临床资料完整;④患者及其家属均知情同意。排除标准:①阑尾手术者;②合并精神障碍性疾病、免疫系统疾病、血液系统疾病;③合并严重心肝肺肾功能不全;④妊娠期、哺乳期妇女。
1.2 方法 1.2.1 分组标准和随访参照《医院感染诊断标准(试行)》[10]中SSI的相关诊断标准,将入组患者分为SSI(+)组和SSI(-)组。随访时间为术后30 d,若住院时间低于30 d,则后续采用电话、微信等方式进行随访跟踪,随访终点事件为患者发生SSI。
1.2.2 观察指标收集患者的临床资料:性别、年龄、身体质量指数(body mass index, BMI)、吸烟史、高血压、糖尿病、冠心病、高血脂、清蛋白水平、血红蛋白水平、穿孔位置、术前休克、术前应用抗菌药物、术前腹痛时间(自腹痛起到手术开展的时间)、手术时间、术中肠造口和无菌单种类。
1.3 统计学分析应用SPSS 24.0统计软件对数据进行分析,计数资料采用χ2检验。采用logistic回归方程筛选影响因素,P≤0.05为差异有统计学意义。应用SPSS Modeler软件构建决策树模型,应用R软件绘制模型的受试者工作特征(receiver operating characteristic, ROC)曲线,并计算曲线下面积(area under curve, AUC)评估模型的预测能力。
2 结果 2.1 胃肠道穿孔修补术后SSI的发生情况共入组363例胃肠道穿孔修补术患者,男性240例,女性123例,胃十二指肠穿孔194例,空回肠穿孔96例,大肠穿孔73例。术后发生SSI 41例,其中表浅切口感染12例,深部感染29例,总发病率11.29%。分泌物及脓培养阳性26例(63.41%)。病原菌分布情况见表 1。
| 表 1 胃肠道穿孔修补术后SSI病原菌分布情况 Table 1 Pathogen distribution of SSI after gastrointestinal perforation repair surgery |
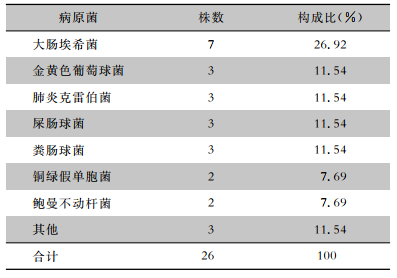
|
基于SSI发生情况将患者分为SSI(+)组(n=41)和SSI(-)组(n=322)。单因素分析结果显示,两组患者性别、年龄、吸烟史、高血压、糖尿病、冠心病、高血脂、血红蛋白水平、穿孔位置、术前休克、术中肠造口和无菌单种类比较,差异均无统计学意义(均P>0.05);两组患者BMI、清蛋白水平、术前应用抗菌药物、术前腹痛时间和手术时间比较,差异均有统计学意义(均P < 0.05)。见表 2。
| 表 2 胃肠道穿孔修补术后患者并发SSI的单因素分析[例(%)] Table 2 Univariate analysis on SSI in patients after gastrointestinal perforation repair surgery (No. of cases [%]) |
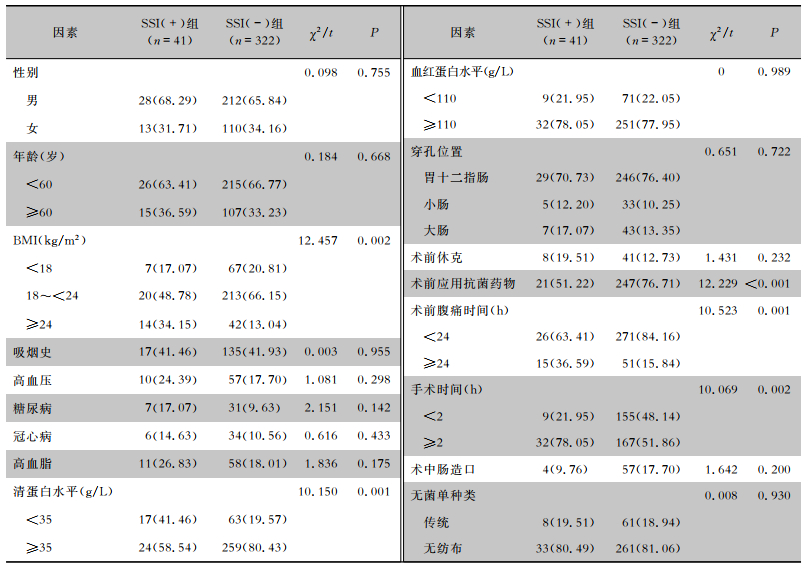
|
以SSI发生情况为因变量,以单因素分析中有统计学差异的项目为自变量,进行多因素logistic回归分析。结果显示,BMI较高、清蛋白水平<35 g/L、术前腹痛时间≥24 h和手术时间≥2 h是胃肠道穿孔修补术后并发SSI的独立危险因素(均P < 0.05),术前应用抗菌药物是其保护因素(P < 0.05)。见表 3。
| 表 3 胃肠道穿孔修补术后患者并发SSI的多因素logistic回归分析 Table 3 Multivariate logistic regression analysis on SSI in patients after gastrointestinal perforation repair surgery |
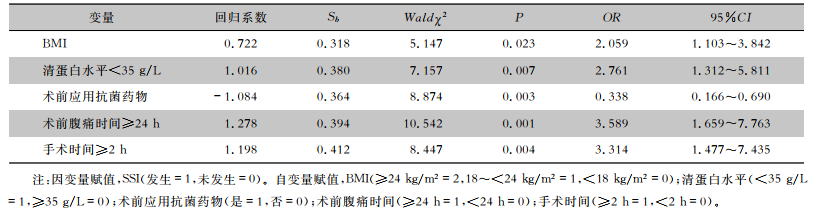
|
基于筛选出的影响因素建立预测胃肠道穿孔修补术后患者并发SSI风险的决策树模型,见图 1。其中术前应用抗菌药物、手术时间、BMI、清蛋白水平和术前腹痛时间的预测变量重要性分别为0.29、0.27、0.17、0.16、0.11,见图 2。模型的AUC为0.811(95%CI:0.794~0.825),见图 3。
 |
| 图 1 预测胃肠道穿孔修补术后患者并发SSI的决策树模型 Figure 1 Decision tree model for predicting postoperative SSI in patients after gastrointestinal perforation repair surgery |
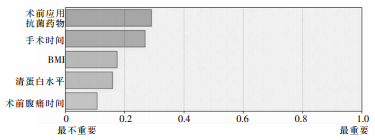 |
| 图 2 模型预测胃肠穿孔修补术后患者并发SSI变量的重要性 Figure 2 Importance of model variables for predicting SSI in patients after gastrointestinal perforation repair surgery |
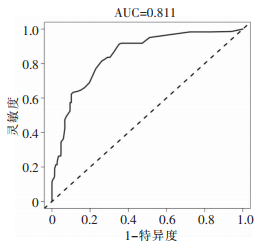 |
| 图 3 预测胃肠穿孔修补术后患者并发SSI模型的ROC曲线 Figure 3 ROC curve of model for predicting SSI in patients after gastrointestinal perforation repair surgery |
胃肠道穿孔是一种可能由溃疡病、外伤、恶性肿瘤、炎症性肠病等多种原因造成的急症[11]。胃肠道穿孔修补术是胃肠道穿孔患者最有效的治疗手段。SSI是腹部手术最常见的并发症[12],国内外研究[13-14]显示腹部手术后SSI的发病率为4.8%~16.3%,本研究中胃肠道穿孔修补术后患者SSI的发病率为11.3%,处于腹部手术后SSI的较高水平。张国强等[15]报道胃肠道穿孔SSI的发病率为38.9%,显著高于本研究,这可能是因为该报道中29.2%的患者发生了术前休克,而本研究中休克患者仅有13.5%。休克会造成免疫功能受损、组织灌注减少、代谢紊乱等,从而导致SSI风险增加。此外,研究样本量、手术类型、随访方式和时间等差异也会导致不同研究中SSI的发病率不同,但均显示胃肠道穿孔患者是SSI的高发人群,因此探讨胃肠道穿孔修补术后患者SSI的影响因素具有重要临床价值。
logistic回归是一种用于处理二分类问题的广义线性分析方法。本研究通过单因素和多因素logistic回归分析筛选出BMI较高、清蛋白水平<35 g/L、术前腹痛时间≥24 h和手术时间≥2 h是胃肠道穿孔修补术后患者并发SSI的独立危险因素,术前应用抗菌药物是其保护因素。本文结果与周星星等[16]报道BMI较高会增加术后并发SSI风险的结论一致。BMI较高的患者通常腹部脂肪沉积较多,影响胃肠道修补术后切口周围组织的血流灌注,并增加切口部位的张力,导致切口边缘血供不足和切口塌陷,增加SSI的发生风险。清蛋白在体内参与细胞因子介导的免疫反应和细胞增殖过程,具有调节免疫细胞功能和修复受损组织的作用。王燕等[17]报道低蛋白血症与术后SSI密切相关,本文结果与其一致。低蛋白血症可导致患者免疫功能下降,并影响切口部位的愈合,从而增加SSI发生风险。此外,清蛋白在血液循环中维持着适当的血容量和血浆渗透压,并通过维持正常的血管内皮屏障功能防止病原菌侵入组织。低蛋白血症会导致血管内皮屏障功能受损,使病原菌更易穿过血管壁进入切口部位,从而诱发SSI。腹痛时间较长意味着胃肠道穿孔未能及时被发现和处理,胃肠道内的细菌通过穿孔口进入腹腔并扩散到手术切口部位的概率更高,更易诱发SSI[15]。此外,胃肠道穿孔未得到及时修复会造成炎症反应持续存在并加重,导致组织水肿、血管扩张和细胞因子释放等,从而破坏切口愈合环境,抑制免疫细胞功能,增加SSI发生风险。张学娟等[18]报道手术时间较长是胃肠道术后SSI的危险因素。手术时间延长会增加切口的暴露时间,为病原菌侵袭提供了更多的机会[19]。此外,手术时间延长会导致持续性创伤应激反应,削弱患者的免疫力,并导致手术部位组织缺血缺氧加重,以上因素均可能是手术时间延长导致SSI发生风险增加的原因[20]。本文结果显示预防性使用抗菌药物是SSI的保护因素,与贺子强等[21]报道一致。抗菌药物能够直接杀灭或抑制细菌的生长和繁殖,减少经穿孔处进入腹腔的致病菌数量,可有效降低切口周围的细菌负荷,减少感染发生。胃肠道穿孔修补术中,细菌在胃肠道内扩散,可能会通过腹腔扩散到手术切口周围。术前使用抗菌药物可以降低体内细菌数量,减少细菌在手术切口周围的扩散和定植。
决策树通过对数据集中的特征进行分割,逐步构建一个可以对新数据进行分类的模型[22]。logistic回归分析无法直观的反映变量,且对预测结果的计算不够简便,而决策树最大的优势在于可视化,易于理解和解释。本文在logistic回归分析结果的基础上构建了预测胃肠道穿孔修补术后并发SSI风险的决策树模型,模型共5层,16个节点,使用人员可根据患者的实际情况,沿着路径从根节点到叶节点进行逐级决策,最终获得胃肠道穿孔修补术后并发SSI的个体化预测风险值。同时,决策树还可评估出每个特征的重要性,帮助选择最相关的特征。本模型显示术前应用抗菌药物、手术时间、BMI、清蛋白水平和术前腹痛时间的预测变量重要性分别为0.29、0.27、0.17、0.16、0.11,提示临床应格外重视术前抗菌药物的使用和对手术时间的控制。为避免模型过度拟合,对输入数据的小变动敏感,导致预测结果不稳定,本研究采用ROC曲线验证模型的预测能力,结果显示ACU为0.811(95%CI:0.794~0.825),表明模型能够较为准确地在胃肠道穿孔修补术患者中区分出术后并发SSI的高风险患者。
综上所述,临床应重视BMI较高、清蛋白水平<35 g/L、术前腹痛时间≥24 h、手术时间≥2 h和术前未使用抗菌药物的胃肠道修补术患者,警惕其术后发生SSI。此次构建的决策树模型能够有效预测胃肠道穿孔修补术后SSI的发生风险。本研究的不足之处在于单中心入组的胃肠道穿孔患者数量有限,数据代表性不足;收集的临床资料有限,可能遗漏影响SSI发生的变量;随访时间有限,未对发生SSI患者的预后进行追踪。因此,今后应针对这些不足之处进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Al Taweel B, Cassese G, Chanques G, et al. Gastrointestinal perforation in liver transplantation recipients: risk factors analysis from a 10-year retrospective study with an internatio-nal multicenter survey about management strategies[J]. Updates Surg, 2023, 75(3): 553-561. DOI:10.1007/s13304-022-01419-x |
| [2] |
范青, 刘斌, 彭双姣. 加味桃核承气汤对胃肠道穿孔患者术后炎症性肠梗阻的干预效果[J]. 世界中西医结合杂志, 2022, 17(5): 936-940. Fan Q, Liu B, Peng SJ. Intervention effect of modified TaoheChengqi decoction on postoperative inflammatory ileus in patients with gastrointestinal perforation[J]. World Journal of Integrated Traditional and Western Medicine, 2022, 17(5): 936-940. |
| [3] |
陈俊辉, 王晨, 徐庆春, 等. 腹腔镜修补术和传统修补术对上消化道穿孔患者的治疗效果及对胃肠道功能的影响[J]. 中华保健医学杂志, 2022, 24(1): 72-74. Chen JH, Wang C, Xu QC, et al. The therapeutic effect of laparoscopic repair and traditional repair on patients with upper gastrointestinal perforation and their impact on gastrointestinal function[J]. Chinese Journal of Health Care and Medicine, 2022, 24(1): 72-74. |
| [4] |
Ellsworth M, Peneza D, Ostrosky-Zeichner L. Perioperative nurses: key to surgical site infection prevention[J]. AORN J, 2023, 117(5): 267-269. DOI:10.1002/aorn.13920 |
| [5] |
Martinez-Sobalvarro JV, Júnior AAP, Pereira LB, et al. Antimicrobial stewardship for surgical antibiotic prophylaxis and surgical site infections: a systematic review[J]. Int J Clin Pharm, 2022, 44(2): 301-319. DOI:10.1007/s11096-021-01358-4 |
| [6] |
Fuglestad MA, Tracey EL, Leinicke JA. Evidence-based prevention of surgical site infection[J]. Surg Clin North Am, 2021, 101(6): 951-966. DOI:10.1016/j.suc.2021.05.027 |
| [7] |
Whitehead-Clarke T, Windsor A. Surgical site infection: the scourge of abdominal wall reconstruction[J]. Surg Infect (Larchmt), 2021, 22(4): 357-362. DOI:10.1089/sur.2020.325 |
| [8] |
Horgan S, Saab MM, Drennan J, et al. Healthcare profe-ssionals' knowledge and attitudes of surgical site infection and surveillance: a narrative systematic review[J]. Nurse Educ Pract, 2023, 69: 103637. DOI:10.1016/j.nepr.2023.103637 |
| [9] |
Sandy-Hodgetts K, Assadian O, Wainwright TW, et al. Cli-nical prediction models and risk tools for early detection of patients at risk of surgical site infection and surgical wound dehiscence: a scoping review[J]. J Wound Care, 2023, 32(Sup8a): S4-S12. DOI:10.12968/jowc.2023.32.Sup8a.S4 |
| [10] |
中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320. Ministry of Health of the People's Republic of China. Diagnostic criteria for nosocomial infections(proposed)[J]. Natio-nal Medical Journal of China, 2001, 81(5): 314-320. |
| [11] |
Pouli S, Kozana A, Papakitsou I, et al. Gastrointestinal perforation: clinical and MDCT clues for identification of aetiology[J]. Insights Imaging, 2020, 11(1): 31. DOI:10.1186/s13244-019-0823-6 |
| [12] |
Mengistu DA, Alemu A, Abdukadir AA, et al. Global incidence of surgical site infection among patients: systematic review and Meta-analysis[J]. Inquiry, 2023, 60: 469580231162549. DOI:10.1177/00469580231162549 |
| [13] |
段飞, 李学民, 段希斌, 等. 腹部手术后手术部位感染的影响因素分析[J]. 中华消化外科杂志, 2022, 21(12): 1539-1546. Duan F, Li XM, Duan XB, et al. Analysis of influencing factors of surgical site infection after abdominal surgery[J]. Chinese Journal of Digestive Surgery, 2022, 21(12): 1539-1546. DOI:10.3760/cma.j.cn115610-20220920-00537 |
| [14] |
Alkaaki A, Al-Radi OO, Khoja A, et al. Surgical site infection following abdominal surgery: a prospective cohort study[J]. Can J Surg, 2019, 62(2): 111-117. DOI:10.1503/cjs.004818 |
| [15] |
张国强, 王平, 赵东明, 等. 胃肠道穿孔手术切口感染相关因素分析[J]. 中华全科医师杂志, 2019, 18(2): 178-181. Zhang GQ, Wang P, Zhao DM, et al. Risk factors of surgical incision infection in patients with gastrointestinal perforation[J]. Chinese Journal of General Practitioners, 2019, 18(2): 178-181. |
| [16] |
周星星, 刘善善, 周晓敏, 等. 胃癌术后手术部位感染危险因素的Meta分析[J]. 中国感染控制杂志, 2023, 22(2): 181-188. Zhou XX, Liu SS, Zhou XM, et al. Meta-analysis on risk factors for post-operative surgical site infection in patients with gastric cancer[J]. Chinese Journal of Infection Control, 2023, 22(2): 181-188. DOI:10.12138/j.issn.1671-9638.20233507 |
| [17] |
王燕, 韩佳慧, 徐策, 等. 开放性骨折患者低白蛋白血症与手术部位感染的相关性[J]. 中国病原生物学杂志, 2022, 17(1): 110-113. Wang Y, Han JH, Xu C, et al. Relationship of hypoalbumi-nemia and surgical site infections in patients with open fractures[J]. Journal of Parasitic Biology, 2022, 17(1): 110-113. |
| [18] |
张学娟, 吴冬寒, 张学政, 等. 四种常见胃肠道手术后手术部位感染情况及相关危险因素分析[J]. 安徽医药, 2021, 25(4): 785-788. Zhang XJ, Wu DH, Zhang XZ, et al. Analysis of surgical site infections and related risk factors after four common gastrointestinal surgery[J]. Anhui Medical and Pharmaceutical Journal, 2021, 25(4): 785-788. |
| [19] |
韩冰, 张晟, 张智, 等. 老年患者手术部位感染的危险因素分析[J]. 老年医学与保健, 2022, 28(5): 1142-1146. Han B, Zhang S, Zhang Z, et al. Analysis of risk factors for the postoperative surgical site infection in elderly patients[J]. Geriatrics & Health Care, 2022, 28(5): 1142-1146. |
| [20] |
李泽, 高俊茹, 宋莉, 等. 急诊腹部手术后手术部位感染情况及其危险因素分析: 全国多中心横断面研究[J]. 中华胃肠外科杂志, 2020, 23(11): 1043-1050. Li Z, Gao JR, Song L, et al. Risk factors for surgical site infection after emergency abdominal surgery: a multicenter cross-sectional study in China[J]. Chinese Journal of Gastrointestinal Surgery, 2020, 23(11): 1043-1050. |
| [21] |
贺子强, 袁水斌, 王勋松, 等. 基于倾向性评分匹配的手术部位感染影响因素分析: 一项真实世界研究[J]. 中国感染控制杂志, 2023, 22(2): 189-194. He ZQ, Yuan SB, Wang XS, et al. Influencing factors for surgical site infection based on propensity score matching: a real-world study[J]. Chinese Journal of Infection Control, 2023, 22(2): 189-194. DOI:10.12138/j.issn.1671-9638.20232299 |
| [22] |
Luo XD, Wen XH, Zhou MC, et al. Decision-tree-initialized dendritic neuron model for fast and accurate data classification[J]. IEEE Trans Neural Netw Learn Syst, 2022, 33(9): 4173-4183. |



