2. 南昌大学护理学院,江西 南昌 330006
2. School of Nursing, Nanchang University, Nanchang 330006, China
软式内镜是用于疾病诊断、治疗的可弯曲的内镜,包括胃镜、肠镜、十二指肠镜等,以下简称“内镜”。随着内镜诊疗技术的不断发展,以及全民健康意识和需求的提高,该技术现已普及到县市级医院。《2021年国家消化内镜诊疗服务与质量安全报告》[1]显示,各医院完成消化内镜诊疗3 562.5例次,消化内镜医生人均完成消化内镜诊疗操作900例次。据调查,我国内镜中心单条内镜每日最高诊疗量可达4.4人次[2]。三级医院内镜洗消员人均每天需要清洗内镜31条[3]。面对内镜高诊疗量,洗消员必须同时兼顾再处理质量与时间以提高周转率。但内镜预处理后转运至清洗消毒间需要时间,且部分医院采取集中管理方式,消毒供应中心很难做到第一时间回收器械,洗消员工作量大时无法及时清洗内镜,清洗延迟时常发生。而相关研究[4-5]表明,清洗延迟已被确定为内镜检查相关感染的一个重要因素。
各国指南关于内镜诊疗结束后至开始人工清洗的时间为0~3 h[6-11],预处理后多长时间内应进行清洗的报道较少。此外,对预处理用清洗液各指南也均未作出详细要求。为了解床旁预处理后到开始再处理期间所延迟的时间及清水预处理对内镜整体清洗消毒质量的影响,本研究将使用后污染程度相近的胃镜在预处理后分别留置0 min、30 min、1 h、3 h再进行清洗,并在预处理时采用清水与多酶清洗液进行对比,各延迟清洗时间内使用管腔检测仪观察活检腔道内部情况,同时微生物学监测再处理过程中胃镜残留菌落数,为今后的胃镜再处理工作提供理论依据,现报告如下。
1 材料与方法 1.1 材料胃镜(OLYMPUS,GIF-HQ290/GIF-HQ260,有效长度1 030 mm,活检孔道内径2.8 mm,日本),管腔检测仪(高精度超细管腔检测仪,美国Healthmark工业公司),移动工作车(美国Healthmark工业公司),营养琼脂培养基(北京索莱宝生物科技有限公司),恒温培养箱(南京远拓科学仪器有限公司),滤膜(0.45 μm,德国赛多利斯公司),硫代硫酸钠(天津市大茂化学试剂厂),生理盐水,全能强效多酶清洗液(明尼苏达矿业制造医用器材有限公司),无菌注射器,磷酸盐缓冲液,震荡仪。
1.2 分组根据析因设计表,将预处理清洗液(A因素):多酶清洗液(A1)、清水(A2);延迟清洗时间(B因素):预处理后0 min(B1)、预处理后30 min(B2)、预处理后1 h(B3)、预处理后3 h(B4)两因素交叉后随机分为8组,见表 1。96条胃镜按照随机数字表法分配至组,每组12条胃镜。于预处理后、清洗前、清洗后和消毒后四个时间点采样,除A1B1、A2B1组缺少放置时间后清洗前采样外(两组胃镜各采样3次),其余每组所有胃镜均采样4次,共计360份标本。
| 表 1 析因设计表 Table 1 Factorial design table |
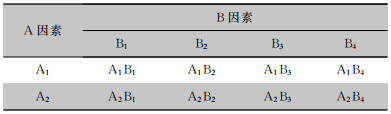
|
选用使用年限1~2年的胃镜,试验时仅进行无痛胃镜检查,除一次活组织检查外无其他诊疗项目,插管时间5 min左右。固定执行胃镜再处理人员,所有清洗液现配现用,一用一换,对所有参与胃镜再处理人员实行单盲,由专人实施胃镜采样。
1.3.2 处理方法预处理按照我国《软式内镜清洗消毒技术规范》WS 507—2016[6](以下简称“规范”)进行:内镜从患者体内取出后,在与光源和视频处理器拆离之前,应立即用含有清洗液的湿巾或湿纱布擦去外表面污物,擦拭用品一次性使用;反复送气与送水至少10 s;将内镜先端置入装有清洗液的容器中,启动吸引功能,抽吸清洗液直至其流入吸引管;盖好防水盖;放入运送容器,送至清洗消毒室。
延迟清洗时间段内将胃镜置于22~24℃、湿度70%~80%的洗消间,封闭保存,其余再处理流程均按照规范进行,即清洗-漂洗-过氧乙酸高水平消毒-终末漂洗-干燥,清洗阶段所使用清洗液为多酶清洗液。
1.3.3 管腔检测仪检测在观察每条胃镜前使用含75%乙醇的无菌纱布擦拭管腔检测仪和移动工作车,干燥5 min后,移动工作车铺上无菌巾,以便放置待检测胃镜。研究人员手持管腔检测仪先从胃镜先端部活检出口进入,直到管腔检测仪全部进入钳子管道,再从胃镜操作部的活检腔道入口推进,根据管腔内部的具体情况控制观察速度,以确保观察到清晰、完整的活检腔道内部。
1.3.4 采样方法按GB 15982—2012对胃镜活检腔道进行采样。预处理后、清洗前、清洗后的采样洗脱液为50 mL生理盐水,消毒后采样使用0.1%硫代硫酸钠作为中和剂,所有采样液收集后立即送检,4 h内培养。
1.3.5 微生物培养预处理后、清洗前的采样液采用磷酸盐缓冲液进行10倍系列稀释后培养,所有采样液分别采用滤膜法与倾注法接种于营养琼脂培养皿,(36±1)℃恒温箱培养48 h后计算菌落数(CFU/件)。菌落总数≤20 CFU/件作为消毒合格标准。
1.4 统计分析应用Excel 2013录入数据,SPSS 26.0统计软件对数据进行统计学分析。计量资料用(x±s)表示,采用析因分析比较各组清洗前后、消毒后活检腔道菌落情况,预处理后菌落数采用两独立样本t检验进行比较;计数资料用%表示,消毒后各组间合格情况对比采用非参数秩和检验,P≤0.05为差异有统计学意义。
2 结果 2.1 胃镜各阶段菌落负载情况消毒前各组胃镜菌落数取对数值进行描述。结果显示,预处理后胃镜残留菌落数为104~106 CFU/件,延迟清洗时间内胃镜腔道菌落数下降1~2个对数值,延迟清洗时间内菌落数变化差异无统计学意义(F=0.976,P=0.439)。人工清洗可以将细菌数降低2~5个对数值。A1B1、A1B3、A1B4、A2B1、A2B2、A2B3组消毒合格率均达到100%,秩和检验结果显示,A1、A2两组胃镜消毒后合格率比较,差异无统计学意义(P>0.05),见表 2。
| 表 2 胃镜各阶段菌落负载情况 Table 2 Bacterial colony load at each treatment stage of gastroscopes |
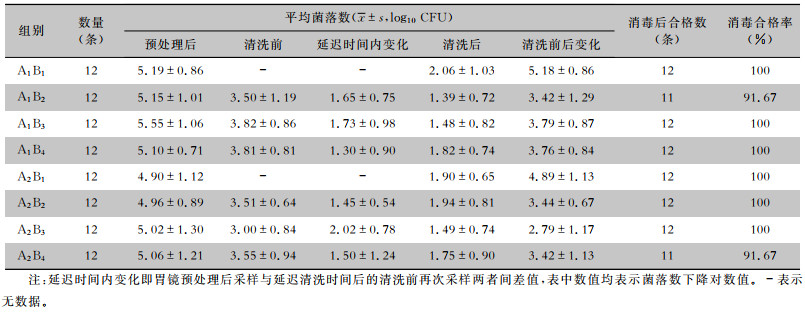
|
预处理后胃镜菌落数t检验结果显示,不同清洗液对预处理的影响,差异无统计学意义(P>0.05),即A1、A2组在延迟清洗前均衡性较好,差异均无统计学意义(FA1=0.582,FA2=0.044, 均P>0.05)。析因分析结果显示,A因素与B因素在清洗前、清洗后、消毒后差异均无统计学意义(均P>0.05),且A、B间不具有交互作用(P>0.05),见表 3。
| 表 3 胃镜清洗及消毒前后腔道菌落数析因分析 Table 3 Factorial analysis of bacterial colony numbers in gastroscope cavity before and after cleaning and disinfection of gastroscopes |
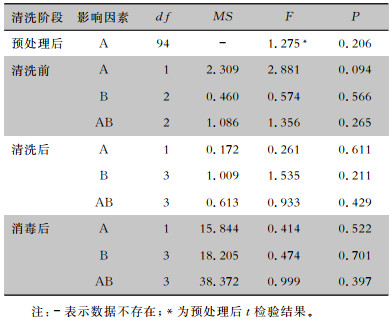
|
按照消毒后胃镜检出菌落数0、1~20、>20 CFU/件进行分组,以规范要求菌落总数≤20 CFU/条作为消毒合格标准。A1B2组与A2B4组各有1条胃镜消毒不合格(菌落数均为24 CFU)。胃镜菌落数为1~20 CFU/条的组中,A1B1、A1B2、A1B4、A2B2、A2B4组均只有1条,菌落数分别为5、2、2、9、9 CFU;A1B3、A2B1、A2B3组均有2条,菌落数分别为1、6,5、6,2、2 CFU。秩和检验结果显示,两组预处理后胃镜消毒后菌落数分布差异无统计学意义(H=0.084,P>0.05),两组内各时间段菌落数分布比较差异均无统计学意义(HA=0.813,P=0.846;HB=0.475,P=0.924),见表 4。
| 表 4 胃镜消毒后菌落数分布 Table 4 Distribution of bacterial colony numbers of gastroscopes after disinfection |
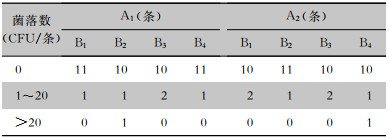
|
在管腔检测仪下可以观察到,多酶清洗液预处理与清水预处理后延迟清洗放置3 h期间,活检腔道一直处于潮湿状态,活检腔道进出口处残留水分偏多,并且在3 h内,腔道内同一部位的液滴大小及数量并没有发生变化。见图 1。
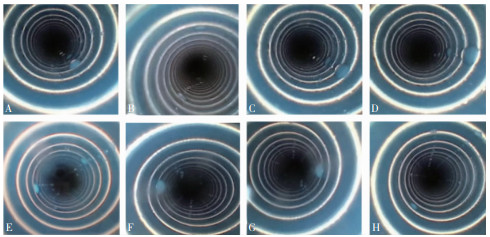 |
| 注:A~D依次表示清水预处理0 min、30 min、1 h、3 h;E~H依次表示多酶清洗液预处理0 min、30 min、1 h、3 h。 图 1 管腔检测仪下拍摄的腔道水滴情况 Figure 1 Water droplets in the gastroscope cavity taken by cavity detector |
国内外内镜再处理指南对内镜预处理后清洗时间均有要求,但不一致。我国[6]、韩国[8]和美国消化内镜学会(American Society of Gastrointestinal Endoscope, ASGE)[10]要求内镜使用后应立即清洗。世界胃肠病学组织(World Gastroenterology Organisation, WGO)在2022年提出预处理后进一步清洁前内镜不能干燥,并在30 min内及时处理[9]。而指南[11]针对软式内镜及其附件再处理建议诊疗结束后1 h内清洗,超过该时间时应遵循制造商延迟再处理说明进行保湿。英国胃肠病学会(British Society of Gastroenterology, BSG)对该时间有所延长,推荐在3 h内完成去污过程的清洁阶段[7]。但各指南中有关清洗时效的实证性研究较少。朱亭亭等[2]对15个省、市、自治区的医院调查发现,各内镜中心诊疗任务重,医生、护士、洗消员与日均诊疗量比为3∶3∶1∶21,洗消员配备严重不足。70%的洗消员都认为时间压力大[12],由此可见,内镜中心洗消员由于内镜诊疗量多、时间压力大而未及时清洗内镜已成为普遍现象,延迟再处理的问题需引起重视。
目前鲜有特定功效清洗液与水进行预处理的效果对比研究。各指南对于内镜预处理用清洗液的要求均为低泡医用清洗液或按制造商使用说明(instruction foruse, IFU)要求使用[6-11],没有对种类或其他性能的规定。因此本研究将清水预处理作为一个干预因素,与多酶清洗液进行对比,探讨使用清水进行预处理的清洗消毒效果。
时间是影响微生物生长的一个重要参数。本组研究结果显示,3 h内进行清洁,再处理各阶段微生物变化及胃镜消毒合格率并无明显差异,与陈燕娴等[13]报道的3 h内回收清洗基本一致。细菌在适宜条件下可于12 h内开始可逆性黏附[14],而生物膜的稳固形成至少需要1~4 d[15]。Eichel等[16]研究表明,生物膜可以在预处理后储存过程中形成,但并不牢固,后续的刷洗可以去除,16 h的储存时间不会对软式内镜再处理质量产生影响。一般情况下,细菌每隔20 min繁殖一代,3 h之内细菌繁殖处于平台期,数量有限,而3 h之后细菌呈对数级增长,大量繁殖。随着时间的增加,胃镜内外表面污染物容易干燥,但延迟清洗的3 h内胃镜管腔并非处于干燥状态。Perumpail等[17]报道,内镜干燥后置于存储柜24 h仍有液体残留。管腔检测仪观察发现,胃镜活检腔在预处理后3 h内仍有液滴存在,腔道一直处于潮湿状态,而这种潮湿状态对后续的清洁难度影响不大。在临床工作量大不能及时清洗的情况下,可有一定的延迟清洗时间,但应尽快清洗,建议不超过3 h,同时胃镜在诊疗结束后应及时进行预处理并转运,避免环境污染及胃镜二次污染。
理想状态下,延迟清洗时间内胃镜残留菌落数应呈对数级增长,而本研究结果显示,延迟清洗后再次采样时菌落数均下降1~2个对数值,分析可能有以下原因:首先,前次采样时对腔道的冲洗可能带走大量细菌;其次,污染物可黏附于腔道内壁,部分污染物经过一段时间可能干涸,尽管管腔检测仪没有观察到,但采样时的冲洗操作无法采集这部分污染物;此外,自然界中99%以上的微生物因处于有活力但不可培养(viable but non-culturable, VBNC)状态而无法分离培养[18],即细菌在生存环境改变时会进入一种自我保护状态,胃镜预处理后的放置期间有可能诱导细菌进入该状态。
本研究发现,使用多酶清洗液或清水进行预处理,各阶段菌落数差异与消毒后菌落分布差异均无统计学意义,与研究[19-20]结果一致。多酶清洗液含有蛋白酶、淀粉酶等多种酶组分及具有细菌抑制作用的表面活性剂[21],主要作用是分解有机物。多酶清洗液有效性发挥的最佳作用时间是20 min[22],我国规范[6]6.2.1预处理流程中,除了水气腔道送气送水10 s外,活检腔道预处理以抽吸清洗液直至其流入吸引管为准。数据显示,目前多数预处理总时间在20 s左右或更短[12],多酶清洗液在预处理阶段难以充分发挥作用。除此之外,王凌玲研究[23]还发现,多酶清洗液和碱性清洗液预处理保湿手术器械12 h后,其清洗合格率比较差异无统计学意义,即两者均有良好的清洁效果。因此,预处理清洗液的使用还有待进一步研究。
本研究只针对检查后的胃镜,后续可扩大研究范围,纳入不同的内镜类型进行延迟清洗时间的研究。同时,除监测活检腔道微生物情况外,还可以增加其他评价指标,如内镜内外表面干燥度及残留蛋白等检测,以获得更强的证据支持。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
王天骄, 辛磊, 王洛伟, 等. 2021国家消化内镜诊疗服务与质量安全报告[J]. 中华消化内镜杂志, 2022, 39(11): 879-884. Wang TJ, Xin L, Wang LW, et al. Endoscopy in China: a national survey on the services, quality and safety of digestive endoscopy in 2021[J]. Chinese Journal of Digestive endoscopy, 2022, 39(11): 879-884. |
| [2] |
朱亭亭, 孙惠惠, 王佳奇, 等. 59所内镜中心相关医院感染风险因素调查与分析[J]. 中华医院感染学杂志, 2018, 28(2): 309-312, 320. Zhu TT, Sun HH, Wang JQ, et al. Investigation and analysis on the risk factors of nosocomial infections in 59 endoscopic centers[J]. Chinese Journal of Nosocomiology, 2018, 28(2): 309-312, 320. |
| [3] |
陈亚飞, 王琇, 范颖, 等. 吉林省62所医院消化内镜清洗消毒现状问卷调查[J]. 中国消毒学杂志, 2017, 34(10): 932-935. Chen YF, Wang X, Fan Y, et al. Questionnaire survey on cleaning and disinfection of digestive endoscopy in 62 hospitals of Jilin province[J]. Chinese Journal of Disinfection, 2017, 34(10): 932-935. |
| [4] |
Kumarage J, Khonyongwa K, Khan A, et al. Transmission of multi-drug resistant Pseudomonas aeruginosa between two flexible ureteroscopes and an outbreak of urinary tract infection: the fragility of endoscope decontamination[J]. J Hosp Infect, 2019, 102(1): 89-94. DOI:10.1016/j.jhin.2019.02.015 |
| [5] |
Muscarella LF. Use of ethylene-oxide gas sterilisation to terminate multidrug-resistant bacterial outbreaks linked to duodenoscopes[J]. BMJ Open Gastroenterol, 2019, 6(1): e000282. DOI:10.1136/bmjgast-2019-000282 |
| [6] |
中华人民共和国国家卫生和计划生育委员会. 软式内镜清洗消毒技术规范: WS 507—2016[S]. 北京: 中国标准出版社, 2017. National Health and Family Planning Commission, People's Republic of China. Regulation for cleaning and disinfection technique of flexible endoscope: WS 507-2016[S]. Beijing: Standards Press of China, 2017. |
| [7] |
British Society of Gastroenterology. BSG guidance on decontamination of equipment for gastrointestinal endoscopy[EB/OL]. [2023-10-08]. https://www.bsg.org.uk/clinical-resource/2020-guidance-on-decontamination-of-equipment
|
| [8] |
Day LW, Muthusamy VR, Collins J, et al. Multisociety guideline on reprocessing flexible GI endoscopes and accessories[J]. Gastrointest Endosc, 2021, 93(1): 11-33. e6. DOI:10.1016/j.gie.2020.09.048 |
| [9] |
Speer T, Alfa M, Jones D, et al. WGO guideline-endoscope disinfection update[J]. J Clin Gastroenterol, 2023, 57(1): 1-9. DOI:10.1097/MCG.0000000000001759 |
| [10] |
Calderwood AH, Day LW, Muthusamy VR, et al. ASGE guideline for infection control during GI endoscopy[J]. Gastrointest Endosc, 2018, 87(5): 1167-1179. DOI:10.1016/j.gie.2017.12.009 |
| [11] |
Cheung DY, Jang BI, Kim SW, et al. Multidisciplinary and multisociety practice guideline on reprocessing flexible gastrointestinal endoscopes and endoscopic accessories[J]. Clin Endosc, 2020, 53(3): 276-285. DOI:10.5946/ce.2020.106 |
| [12] |
Sivek AD, Davis J, Tremoulet P, et al. Healthcare worker feedback on duodenoscope reprocessing workflow and ergonomics[J]. Am J Infect Control, 2022, 50(9): 1038-1048. DOI:10.1016/j.ajic.2022.01.012 |
| [13] |
陈燕娴, 郑艳芬, 潘彦龙. 消毒供应中心长时间滞留手术器械不同预处理方式对清洗质量的影响[J]. 中西医结合护理(中英文), 2020, 6(9): 192-195. Chen YX, Zheng YF, Pan YL. Influence of different pretreatment methods on cleaning quality of long-retained surgical instruments in disinfection supply center[J]. Nursing of Integrated Traditional Chinese and Western Medicine, 2020, 6(9): 192-195. |
| [14] |
Da Cunda P, Iribarnegaray V, Papa-Ezdra R, et al. Characterization of the different stages of biofilm formation and antibiotic susceptibility in a clinical Acinetobacter baumannii strain[J]. Microb Drug Resist, 2020, 26(6): 569-575. DOI:10.1089/mdr.2019.0145 |
| [15] |
Akinbobola AB, Sherry L, Mckay WG, et al. Tolerance of Pseudomonas aeruginosa in in-vitro biofilms to high-level pera-cetic acid disinfection[J]. J Hosp Infect, 2017, 97(2): 162-168. DOI:10.1016/j.jhin.2017.06.024 |
| [16] |
Eichel VM, Jabs JM, Unser S, et al. Does the reprocessing of endoscopes have to take place immediately after pre-cleaning? A first evaluation[J]. Clin Endosc, 2021, 54(4): 526-533. DOI:10.5946/ce.2020.238 |
| [17] |
Perumpail RB, Marya NB, McGinty BL, et al. Endoscope reprocessing: comparison of drying effectiveness and microbial levels with an automated drying and storage cabinet with forced filtered air and a standard storage cabinet[J]. Am J Infect Control, 2019, 47(9): 1083-1089. DOI:10.1016/j.ajic.2019.02.016 |
| [18] |
张硕, 丁林贤, 苏晓梅. 微生物VBNC状态形成及复苏机制[J]. 微生物学报, 2018, 58(8): 1331-1339. Zhang S, Ding LX, Su XM. Formation and resuscitation of the viable but non-culturable state in microorganisms[J]. Acta Microbiologica Sinica, 2018, 58(8): 1331-1339. |
| [19] |
罗万军, 徐润琳, 王文娟, 等. 污染器械预处理方式及放置时间对清洗效果的影响研究[J]. 中国消毒学杂志, 2015, 32(12): 1188-1190. Luo WJ, Xu RL, Wang WJ, et al. Investigation on cleaning effect to contaminated instruments after different pretreatment and storage time[J]. Chinese Journal of Disinfection, 2015, 32(12): 1188-1190. |
| [20] |
张静, 冯秀兰, 谢小燕. 平板类血液污染器械放置时间对清洗效果的影响[J]. 护理学报, 2012, 19(21): 64-65. Zhang J, Feng XL, Xie XY. Effect of placement time on cleaning effect of flat blood contaminated instrument[J]. Journal of Nursing (China), 2012, 19(21): 64-65. |
| [21] |
石晶金, 方溢文, 官妍. 三种表面活性剂对表皮葡萄球菌生物膜渗透性及成膜关键基因agr表达的影响[J]. 中国感染控制杂志, 2023, 22(3): 267-274. Shi JJ, Fang YW, Guan Y. Effect of three surfactants on the permeability of Staphylococcus epidermidis biofilm and the expression of key biofilm-forming gene agr[J]. Chinese Journal of Infection Control, 2023, 22(3): 267-274. |
| [22] |
唐乃梅, 姬小蔓, 宋春, 等. 3种清洗剂作用复用手术器械时间与效果的相关性研究[J]. 新疆医科大学学报, 2018, 41(9): 1163-1166. Tang NM, Ji XM, Song C, et al. Study on the correlation between time and effect of three types of cleaning agents[J]. Journal of Xinjiang Medical University, 2018, 41(9): 1163-1166. |
| [23] |
王凌玲. 不同清洗液保湿处理方法在手术室医疗器械清洗中的应用效果比较[J]. 中国医疗器械信息, 2017, 23(22): 52-53, 155. Wang LL. Comparison of the application effect of different cleaning fluid moisturizing treatment methods in the cleaning of medical instruments in operating room[J]. China Medical Devices Information, 2017, 23(22): 52-53, 155. |



