2. 玉溪市人民医院感染管理科,云南 玉溪 653100;
3. 黔西南州人民医院感染管理科,贵州 黔西南州 562400;
4. 河南省人民医院肝胆胰腺外科,河南 郑州 450001;
5. 河南省人民医院消化内镜中心,河南 郑州 450001
2. Department of Infection Management, People's Hospital of Yuxi City, Yuxi 653100, China;
3. Department of Infection Management, Qianxinan People's Hospital, Qianxinan 562400, China;
4. Department of Hepatobiliary Pancreatic Surgery, Henan Provincial People's Hospital, Zhengzhou 450001, China;
5. Digestive Endoscopy Center, Henan Provincial People's Hospital, Zhengzhou 450001, China
胆总管结石是常见的消化系统良性疾病之一,全球发病率约为15%,饮食结构和环境压力等的改变促使其呈逐年上升趋势[1]。作为现代微创外科发展趋势的代表术式之一,经内镜逆行性胰胆管造影术(endoscopic retrograde cholangiopancreatography, ERCP)以创伤小、痛苦少、效果好等优点,被越来越广泛的在临床开展,并成为胆总管结石诊断和治疗的首选。但作为一项消化内镜四级手术,ERCP操作难度大、手术风险高,取石、支架植入和胆道引流等过程复杂,术后易发生胰腺炎、出血、穿孔、感染等并发症[2]。手术器械材质特殊、构造精细,加上独有的抬钳器设计,增加了十二指肠镜再处理压力、医院感染暴发风险、感染带来的归因病死率和疾病负担等[3-6]。胆道感染已成为临床上治疗胆总管结石的棘手问题,威胁医疗质量和患者安全,而ERCP被美国患者安全组织连续多年列入“十大医疗技术危害”之一。研究[2, 7]显示,胆总管结石患者ERCP后胆道感染的发病率为0.5%~20%,且主要集中在术后一周内。尽管不同研究均证实了ERCP术后早期胆道感染(post-ERCP early biliary tract infection, PEEBI)的高发病率,但其确切危险因素尚不清楚,无法精准识别高危感染患者,并对其进行包括强化标准预防、围手术期预防性使用抗菌药物等在内的早期干预。本研究分析了胆总管结石患者ERCP后发生PEEBI的流行病学特征,并建立了简单有效的预测工具,旨在帮助临床进行ERCP术前决策和术后早期个性化干预。
1 对象与方法 1.1 研究对象采用观察性双向队列研究方法,选取2020年1月1日—2023年9月30日在某院接受ERCP的胆总管结石住院患者,并以2022年12月31日为节点,将之前回顾性收集的数据作为训练队列,用于模型拟合和内部验证,将之后前瞻性获取的数据作为验证队列,对基于训练队列开发的模型进行时序外部验证。用于建库的患者临床资料来自该医院信息系统(HIS),微生物及其药敏结果来自该院实验室信息系统(LIS),PEEBI流行病学特征来自该院感染实时监测系统(NISS)。
纳入标准:(1)成人;(2)临床确诊为胆总管结石;(3)符合ERCP手术指征;(4)近30 d未发生胆胰系统感染。排除标准:(1)术前合并其他部位的急、慢性感染;(2)术后7 d内失访。
本研究已通过该院伦理委员会批准(注册号: HNSRY2023-37)。
1.2 相关定义胆总管结石包括由胆囊或肝内胆管进入胆总管的继发性结石和在胆总管内形成的原发性胆总管结石。患者出现典型Charcot三联征或间歇性右上腹痛,并结合超声、腹部CT、ERCP或磁共振胰胆管成像等影像学检查示胆总管内结石作为诊断依据[8]。
PEEBI指ERCP术后7 d内出现上腹部压痛或黄疸加重,发热(>38℃),白细胞计数升高(>10.0×109/L),胆红素及胆道酶系生化指标异常升高,同时排除其他系统的感染即可确诊[2]。引流胆汁的微生物培养结果阳性为非必要条件。
1.3 ERCP操作过程患者术前6 h禁水禁食,麻醉后取俯卧位或左侧卧位,应用十二指肠镜(生产商:Olympus,型号:TJF260)入十二指肠至降部,镜头正对十二指肠乳头后观察有无水肿并寻找乳头最佳插管位置。插入造影导管至胆总管内,注入造影剂,通过X线影像观察结石分布、数量、大小及胆总管扩张程度等,随后进行十二指肠乳头括约肌切开术,并根据结石大小选择取石方案:若直径<10 mm,球囊扩张后网篮直接取石;若直径≥10 mm,则体外碎石后再取残余石。取石后进行鼻胆管引流。术后禁食24 h。
1.4 统计方法本研究的样本量未进行事先估算,而是基于队列中可供挖掘的有效数据,其中缺失值的处理采用众数或中位数填充。胆总管结石患者基线中的定性数据用频率表示,定量数据依其分布特征用x±s或M(P25,P75)表示。单因素分析中,分类变量采用χ2检验或Fisher确切概率法,连续变量采用Student’s t检验或Mann-Whitney U检验。分别采用有向无环图(DAGs)和L1正则化的最小绝对收缩与选择算子法(LASSO)进行基于logistic回归构建预测模型前的变量选择。对模型的内部及外部验证通过:(1)绘制受试者工作特征(ROC)曲线,测量曲线下面积(AUC)来评价其对PEEBI分类的精度; (2)基于Bootstrap法绘制Loess-based校准曲线,比较PEEBI偏差校正预测概率与实际诊断频率之间的差距。比较基于不同变量和方法构建的模型性能:(1)采用DeLong检验比较两模型的区分能力; (2)采用Hosmer-Lemeshow拟合优度检验比较两模型的校准能力; (3)计算基于个体患者预测概率的综合判别改善指数(IDI),比较两模型预测性能的整体变化。使用shinyapps部署基于网络的PEEBI动态预测工具。本研究的实施遵循TRIPOD声明。数据整理、统计分析及绘图过程均采用R软件(4.3.0),检验水准α设为0.05(双侧)。
2 结果 2.1 流行情况2020年1月1日—2023年9月30日,该院共2 296例患者开展ERCP,其中,未成年患者69例,术前合并有其他部位的急、慢性感染患者95例,前瞻性研究中术后7 d内失访患者11例,最终纳入符合标准的患者2 121例(92.4%),包括前瞻性获得的627例。患者基线特征见表 1。
| 表 1 接受ERCP的胆总管结石患者的基本情况 Table 1 Basic conditions of patients with choledocholithiasis underwent ERCP |
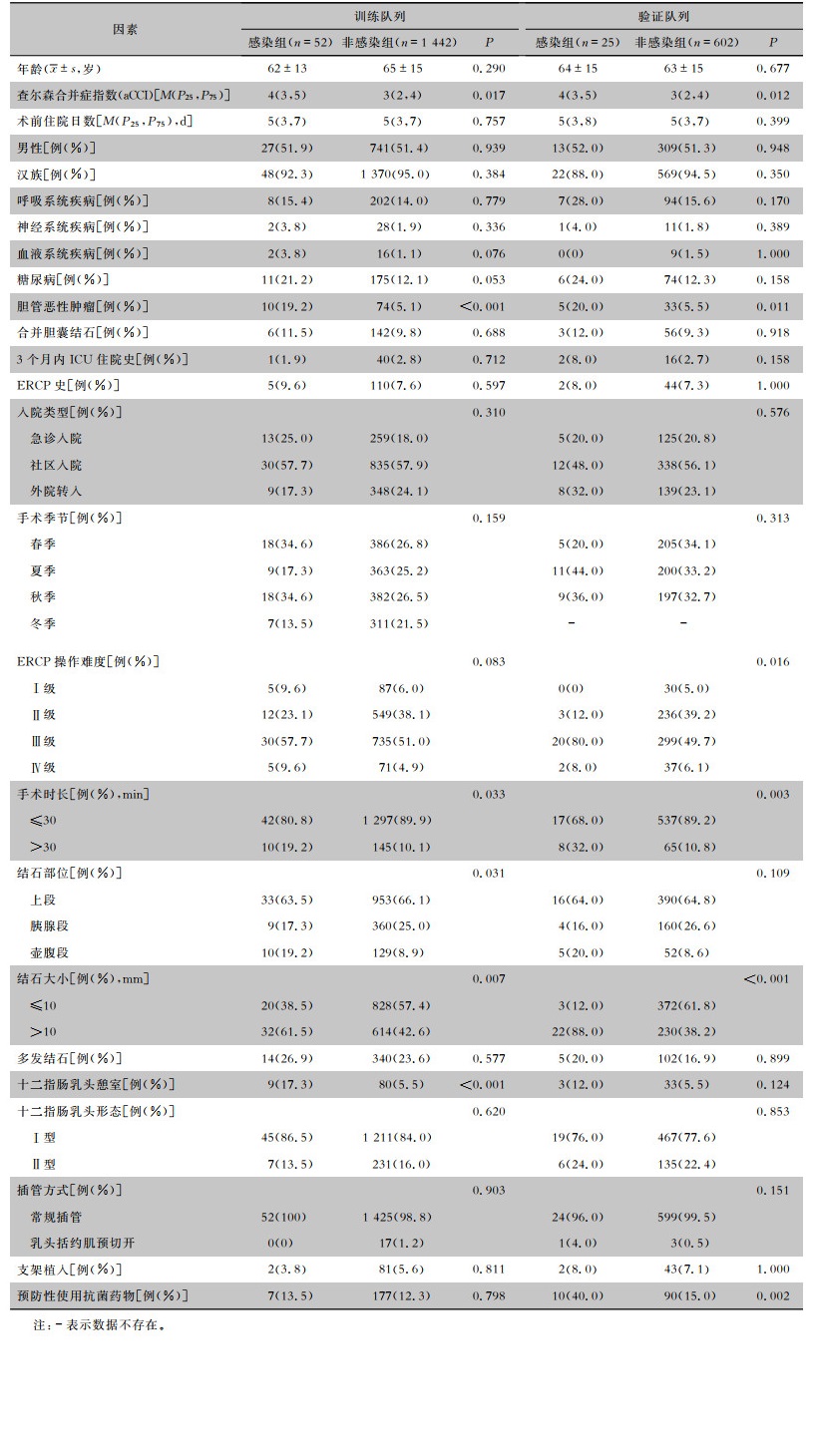
|
77例(3.6%)患者ERCP术后一周发生了PEEBI,且主要集中在术后2 d内(66.2%)。PEEBI的年发病率无显著时间趋势特征(χ2=0.086, P=0.769)。见图 1。
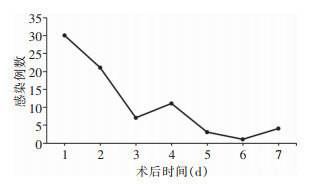 |
| 图 1 胆总管结石患者PEEBI发生的时间分布 Figure 1 Temporal distribution of PEEBI occurrence in patients with choledocholithiasis |
剔除中介变量后,DAGs法筛选出与PEEBI相关的4个暴露因素(糖尿病、胆管恶性肿瘤、预防性使用抗菌药物和十二指肠乳头憩室)和2个混杂因素(年龄校正aCCI和ERCP操作难度)。而当均方误差(MSE)达到最小值时,LASSO法最终筛选出6个预测变量(糖尿病、胆管恶性肿瘤、手术时长、结石大小、十二指肠乳头憩室和aCCI)。变量选择过程见图 2、3,其在两个模型中对PEEBI的效应见图 4。
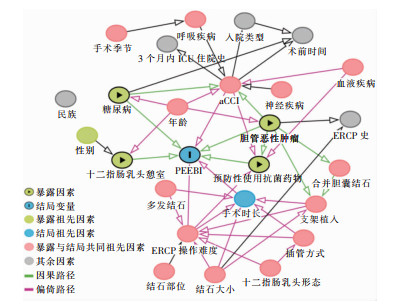 |
| 图 2 基于DAGs的PEEBI预测变量选择过程 Figure 2 Selection process of PEEBI predictors based on DAGs |
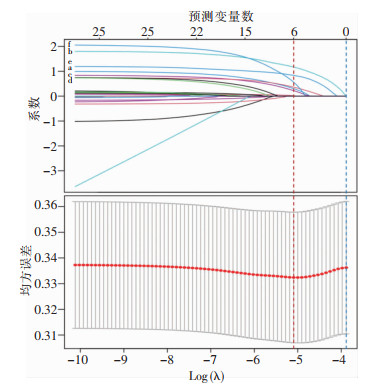 |
| 注:红色、蓝色虚线分别表示最小均方误差、最小均方误差+标准误时的预测变量数;字母a~f分别代表变量糖尿病、胆管恶性肿瘤、手术时长、结石大小、十二指肠乳头憩室和aCCI。 图 3 基于LASSO的PEEBI预测变量选择过程 Figure 3 Selection process of PEEBI predictors based on LASSO |
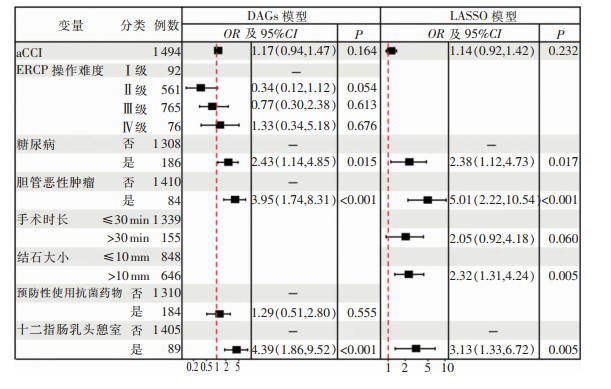 |
| 图 4 不同模型中的预测变量对PEEBI效应的森林图 Figure 4 Forest plots of the effects of predictors on PEEBI in different models |
区分能力方面,经DeLong检验,基于训练队列绘制的DAGs模型与LASSO模型的ROC AUC比较差异无统计学意义(AUC=0.756、0.737, Z=1.129,P=0.259);校准能力方面,经200次重复抽样Bootstrap法绘制的校准曲线显示,对PEEBI发生概率为0.4~0.6的患者,LASSO模型的预测结果略低于实际发生PEEBI的比例,DAGs模型则无此表现。经Hosmer-Lemeshow拟合优度检验,两模型预测的PEEBI发病率与其在训练队列中实际发病率之间的差异均无统计学意义(χ2=14.972、4.608,P=0.060、0.708)。而IDI计算结果显示,DAGs模型对ERCP术后PEEBI发生与否的分类性能优于LASSO模型,其综合判别能力提高3.0% (P=0.007)。
将预测性能较优的DAGs模型进行外部验证,其结果显示,同基于DAGs模型在训练队列中计算的AUC(0.756)相比,其在验证队列中的AUC降至0.728,经DeLong检验,两者差异无统计学意义(D=0.133,P=0.894)。此外,DAGs模型在外部验证中的校准曲线与理想曲线拟合良好,经Hosmer-Lemeshow拟合优度检验,其预测的PEEBI发病概率与验证队列中PEEBI的实际发病比例之间差异无统计学意义(χ2=5.499,P=0.703)。见图 5。
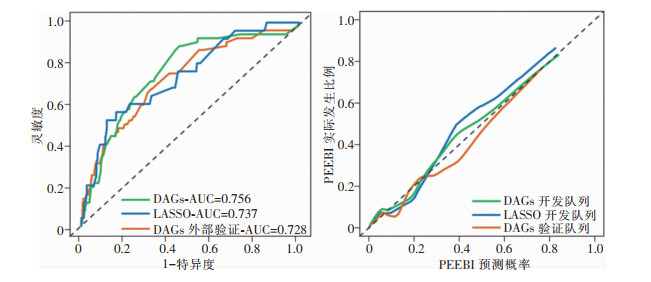 |
| 图 5 不同模型预测胆总管结石患者发生PEEBI的ROC曲线(左)和校准曲线(右) Figure 5 ROC curves (left) and calibration curves (right) for predicting PEEBI occurred in patients with choledocholithiasis by different models |
为了方便临床应用和后期的干预效果评价,将预测PEEBI发生的DAGs模型开发为一个基于网络的交互式动态列线图应用程序,该小程序可以通过“https://no79.shinyapps.io/PEEBI/”访问或者通过手持终端设备扫码应用,二维码见图 6。
 |
| 图 6 PEEBI预测工具二维码 Figure 6 Quick response code of PEEBI prediction tool |
胆总管结石患者ERCP术后发生胆道感染的机制较为复杂。正常情况下,胆道系统的解剖特点及机体免疫防御系统能够有效抵抗病原菌侵犯。但十二指肠镜的逆行过程破坏了胆道正常的生理防御系统,易引起胃肠道细菌移位,加上无菌操作不熟练、不规范造成的胆管系统损伤和内镜再处理不合格导致的外源性病原体入侵等,使PEEBI时有发生,甚至引起医院感染暴发[2, 4]。因此,准确识别PEEBI相关的患者、环境和操作等方面的高危因素,进行ERCP术前和术后早期预防性干预至关重要。然而,影响PEEBI的因素较多(本研究通过文献检索和专家讨论法,共筛选出25个潜在协变量),部分协变量之间还存在多重共线性;此外,作为国内学者进行风险分析与预测研究中使用较多的数据驱动法之一,逐步回归法在变量自动选择中容易引入偏倚,所选变量的系数估算偏大而置信区间往往较短,致使部分真实预测变量的效应被掩盖而易产生不充分的推论。因此,美国医师协会等组织在《内科学年鉴》《欧洲流行病学杂志》等期刊中已不再推荐逐步回归法在医学预测模型中的应用[9]。本研究采用了两种既能对多变量有效消除多重共线性和降维,又能提高模型解释性的变量自动选择方法,试图从变量选择和模型评价两方面寻找预测变量简洁、预测性能合适的最优模型。其中,LASSO法利用收缩特性来选择更简洁和稳定的预测变量;而DAGs法作为理论驱动法,通过后门路径直观地识别出能够控制混杂的最小充分调整集,并将PEEBI与不同变量之间的潜在关系可视化,使模型更具临床意义[10]。虽然本研究中两模型的区分能力差异无统计学意义,但DAGs模型校准曲线与实际发生PEEBI的比例更相符,综合判别能力更高,因此最终选择DAGs模型作为开发PEEBI的预测工具。
本研究发现,由于先天解剖缺陷或后天胆胰系统的慢性炎症黏连所致的十二指肠乳头憩室易引起PEEBI。这可能是在受到侵入性操作等外界影响时,由憩室内潴留的内容物引发[11]。胆管恶性肿瘤导致的PEEBI发病率增加则可能主要由免疫因素所致,放射治疗、化学治疗可导致机体中性粒细胞减少,加之部分患者本身免疫力较差,在此基础上侵入性操作导致的机体黏膜损伤则极易诱发感染[12]。糖尿病亦是导致PEEBI的独立危险因素。高血糖内环境不仅利于病原微生物的繁殖,还能升高血浆渗透压,抑制白细胞的趋化、黏附和杀伤作用。作为一种免疫调节激素,胰岛素还具有独立抑制肿瘤坏死因子-α(TNF-α)等炎症因子转录的直接抗炎作用[13]。另外,本研究未发现预防性使用抗菌药物能够降低PEEBI的发病率,与去年一项对相关随机对照试验进行独立荟萃分析的研究[14]结论类似,即抗菌药物不仅无法降低术后胆道感染和败血症的发生,反而增加了胆汁中多重耐药菌的检出率。因此,目前国内外指南也均不推荐在ERCP围手术期常规预防性使用抗菌药物。而对于不能完全引流的胆道梗阻患者,如原发性硬化性胆管炎、胆管恶性肿瘤及肝移植术后患者,建议在行ERCP前至少1~2 h预防性给予抗菌药物[2, 8]。
本研究的不足包括: (1)作为单中心回顾性研究,样本量有限,可能存在选择偏倚,因此尚需开展多中心前瞻性的大样本研究,以验证本模型的地域外推性并进行优化; (2)未能考量患者围手术期环境特征、不同医生的操作差异、十二指肠镜的再处理等参数,尤其是十二指肠镜的再处理,虽然目前国内外公认其与ERCP术后感染存在潜在关系,但2000年以来的国内外ERCP相关感染聚集性事件或暴发的报告和研究均显示,十二指肠镜再处理中的失误较罕见,与相关的医院感染暴发关系并不明确[15]。与其他内镜相关感染不同,即使遵循了制造商的说明和专业指南,十二指肠镜感染甚至暴发依然可能发生[16]。至今尚缺乏足够的证据表明任何目前推荐的十二指肠镜再处理策略可以保证其安全。因此,本研究虽未能对十二指肠镜的再处理参数进行评估预测,但通过对国内外相关研究的系统评价,仍然建议将加强内镜再处理后的微生物学主动监测,采用重复两次的手工清洗,使用环氧乙烷气体和(或)过氧乙酸等液体低温灭菌,以及改进设计和生产一次性先端帽、抬钳器甚至十二指肠镜等措施作为卫生监管部门、消化内镜中心和制造商共同致力于PEEBI防控的当前策略。
综上所述,胆总管结石患者PEEBI的风险因素为包括糖尿病、胆管恶性肿瘤和十二指肠乳头憩室在内的非医源的患者相关因素。基于糖尿病、胆管恶性肿瘤、预防性使用抗菌药物、十二指肠乳头憩室、aCCI和ERCP操作难度构建的DAGs模型具有良好的预测性能,临床可在该预测工具的协助下采取针对性的围手术期早期预防措施,以减少PEEBI的发生。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Li SQ, Guizzetti L, Ma C, et al. Epidemiology and outcomes of choledocholithiasis and cholangitis in the United States: trends and urban-rural variations[J]. BMC Gastroenterol, 2023, 23(1): 254. DOI:10.1186/s12876-023-02868-3 |
| [2] |
Dumonceau JM, Kapral C, Aabakken L, et al. ERCP-related adverse events: European Society of Gastrointestinal Endoscopy (ESGE) Guideline[J]. Endoscopy, 2020, 52(2): 127-149. DOI:10.1055/a-1075-4080 |
| [3] |
Pineau L. Endoscope reprocessing: Retrospective analysis of 90, 311 samples[J]. Endosc Int Open, 2023, 11(3): E247-E257. DOI:10.1055/a-1991-1391 |
| [4] |
Higa JT, Ross AS. Duodenoscope as a vector for transmission[J]. Gastrointest Endosc Clin N Am, 2020, 30(4): 653-663. DOI:10.1016/j.giec.2020.05.002 |
| [5] |
Chang PW, Bui A, Zhou S, et al. Increasing antibiotic-resis-tant infections with inpatient endoscopic retrograde cholangioscopies (ERCP) is associated with higher mortality in the Uni-ted States: a cross-sectional cohort study[J]. J Clin Gastroenterol, 2024, 58(5): 487-493. DOI:10.1097/MCG.0000000000001874 |
| [6] |
绽丽, 杨冬华, 马晓丽, 等. 经内镜逆行胰胆管造影术后发生感染影响因素分析及患者经济负担研究[J]. 西北国防医学杂志, 2020, 41(5): 297-302. Zhan L, Yang DH, Ma XL, et al. Analysis of influencing factors of infection after endoscopic retrograde cholangiopancreatography and study on economic burden of patients[J]. Medical Journal of National Defending Forces in Northwest China, 2020, 41(5): 297-302. |
| [7] |
Hutfless S, Shiratori Y, Chu D, et al. Risk factors for infections after endoscopic retrograde cholangiopancreatography (ERCP): a retrospective cohort analysis of US Medicare Fee-For-Service claims, 2015-2021[J]. BMJ Open, 2022, 12(9): e065077. DOI:10.1136/bmjopen-2022-065077 |
| [8] |
中华医学会消化内镜学分会ERCP学组, 中国医师协会消化医师分会胆胰学组, 国家消化系统疾病临床医学研究中心. 中国ERCP指南(2018版)[J]. 中国医刊, 2018, 53(11): 1185-1215. ERCP Group of Digestive Endoscopy Branch of Chinese Medical Association, Biliary and Pancreatic Group of Gastroentero-logist Branch of Chinese Medical Doctor Association, National Clinical Medical Research Center for Digestive Diseases. Chinese guidelines for ERCP (2018)[J]. Chinese Journal of Medicine, 2018, 53(11): 1185-1215. DOI:10.3969/j.issn.1008-1070.2018.11.001 |
| [9] |
Talbot D, Massamba VK. A descriptive review of variable selection methods in four epidemiologic journals: there is still room for improvement[J]. Eur J Epidemiol, 2019, 34(8): 725-730. DOI:10.1007/s10654-019-00529-y |
| [10] |
Tennant PWG, Murray EJ, Arnold KF, et al. Use of directed acyclic graphs (DAGs) to identify confounders in applied health research: review and recommendations[J]. Int J Epidemiol, 2021, 50(2): 620-632. DOI:10.1093/ije/dyaa213 |
| [11] |
姚晓群, 武勋. ERCP术后胆道感染危险因素及ENBD预防效果[J]. 中华医院感染学杂志, 2021, 31(24): 3757-3761. Yao XQ, Wu X. Risk factors for biliary tract infection and preventive effect of ENBD after ERCP[J]. Chinese Journal of Nosocomiology, 2021, 31(24): 3757-3761. |
| [12] |
Valle JW, Kelley RK, Nervi B, et al. Biliary tract cancer[J]. Lancet, 2021, 397(10272): 428-444. DOI:10.1016/S0140-6736(21)00153-7 |
| [13] |
Van Niekerk G, Christowitz C, Conradie D, et al. Insulin as an immunomodulatory hormone[J]. Cytokine Growth Factor Rev, 2020, 52: 34-44. DOI:10.1016/j.cytogfr.2019.11.006 |
| [14] |
Merchan MFS, de Moura DTH, de Oliveira GHP, et al. Antibiotic prophylaxis to prevent complications in endoscopic retrograde cholangiopancreatography: a systematic review and Meta-analysis of randomized controlled trials[J]. World J Gastrointest Endosc, 2022, 14(11): 718-730. DOI:10.4253/wjge.v14.i11.718 |
| [15] |
Rahman MR, Perisetti A, Coman R, et al. Duodenoscope-associated infections: update on an emerging problem[J]. Dig Dis Sci, 2019, 64(6): 1409-1418. DOI:10.1007/s10620-018-5431-7 |
| [16] |
Wendorf KA, Kay M, Baliga C, et al. Endoscopic retrograde cholangiopancreatography-associated AmpC Escherichia coli outbreak[J]. Infect Control Hosp Epidemiol, 2015, 36(6): 634-642. DOI:10.1017/ice.2015.66 |



