2. 空军军医大学西京医院检验科,陕西 西安 710032;
3. 空军军医大学基础医学院神经生物学教研室,陕西 西安 710032;
4. 空军军医大学西京医院耳鼻咽喉头颈外科,陕西 西安 710032
 唑耐药,另一菌株对所有检测抗菌药物均敏感。结论 NOVC所致的血流感染在中国少有报道,完善血培养标本分离霍乱弧菌的准确鉴定、分型和耐药表型检测,对诊断、治疗和防控霍乱弧菌感染具有重要价值。
唑耐药,另一菌株对所有检测抗菌药物均敏感。结论 NOVC所致的血流感染在中国少有报道,完善血培养标本分离霍乱弧菌的准确鉴定、分型和耐药表型检测,对诊断、治疗和防控霍乱弧菌感染具有重要价值。2. Department of Clinical Laboratory, Xijing Hospital, Xijing Hospital, Air Force Military Medical University, Xi'an 710032, China;
3. Department of Neurobiology and Institute of Neurosciences, School of Basic Medicine, Xijing Hospital, Air Force Military Medical University, Xi'an 710032, China;
4. Department of Otolaryngology/Head and Neck Surgery, Xijing Hospital, Air Force Military Medical University, Xi'an 710032, China
霍乱弧菌(Vibrio cholerae, V. cholerae)属于弧菌科弧菌属,为一种存在于自然界淡水和海水水体中的环境微生物[1]。该菌革兰阴性,呈杆状或弯曲状,兼性厌氧,在血平板上形成的菌落呈灰色,有周生鞭毛及动力。易感人群饮用霍乱弧菌污染的淡水,或摄食受污染的贝类或其他海产品时可引起感染。大多数感染无症状[2],少数引发肠道和肠道外疾病,临床表现多为霍乱,有胃肠炎、恶心、呕吐、腹泻、腹痛、低热、畏寒等全身症状。
霍乱弧菌有200多个血清群,包括O1群、O139群和非O1非O139群。O1群菌株染色体ctxAB编码的霍乱肠毒素是最重要的毒力因子,可导致肠道分泌大量水和电解质,是引起烈性肠道传染病霍乱的重要原因。霍乱属于甲类传染病,严重者伴有特征性“米泔水”样暴发性腹泻,导致体液丢失和严重脱水。自1817年起,全球范围共发生7次霍乱大流行,造成大规模人群感染和伤亡。携带表面抗原O1或O139的菌株通常产生霍乱肠毒素,而非O1非O139群霍乱弧菌(non-O1, non-O139 V. cholerae, NOVC;也可简称为非O1群)不产生该肠毒素,不引发霍乱,导致的胃肠道感染症状比霍乱轻[3]。近年来,NOVC引发肠道外感染和血流感染的报道[4-6]日益增多,应提高NOVC对人体健康潜在危害的认识。本研究对2022年度某院患者血培养标本分离的两株NOVC进行微生物学和患者临床特征分析,为霍乱弧菌相关血流感染提供诊断依据,规范临床对霍乱弧菌感染的防控措施。
1 对象与方法 1.1 细菌分离培养患者阳性血培养标本,根据微生物检验操作流程直接涂片进行革兰染色镜检,并接种于羊血、麦康凯琼脂培养基(郑州安图生物),孵箱35℃过夜培养,筛选可疑病原菌进行初步鉴定。
1.2 基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)鉴定根据MALDI-TOF MS检测操作规程,将涂布待测菌株的靶板装载入Vitek MS质谱仪(法国Biomerieux)进行鉴定,获得待测菌的鉴定结果。
1.3 显色培养基鉴定分离菌初步鉴定结果为弧菌属,将菌落分离至VIB弧菌显色培养基(法国Chromagar),同时将霍乱弧菌质评菌株传代至显色培养基作为对照,35℃过夜培养。
1.4 生化鉴定使用API 20E和20NE鉴定卡(法国Biomerieux)检测分离菌的生化反应特性,并使用VITEK 2 Compact微生物鉴定药敏仪配套的GN鉴定卡(法国Biomerieux)进行细菌鉴定。
1.5 血清学凝集试验使用O1群、O139群霍乱弧菌诊断血清(宁波天润生物)分别对菌株进行玻片法血清学凝集试验,以生理盐水作为阴性对照。
1.6 16S rRNA基因测序提取细菌基因组,聚合酶链式反应(PCR)、产物纯化及测序均由擎科生物科技有限公司完成,并进行Blast比对分析。
1.7 ctxAB PCR检测按照霍乱弧菌CTXAB核酸检测试剂盒(深圳生科原生物)说明,针对ctxAB毒力基因的TaqMan探针进行实时荧光检测。
1.8 药敏试验采用E-test法药敏试验,检测菌株对氨苄西林、阿奇霉素、多西环素、四环素、复方磺胺甲
患者1,女性,92岁,因“间断头昏15年,加重1个月余”于2022年8月入该院老年病科住院治疗。患者既往有高血压病史7年,曾进行膀胱恶性肿瘤绿激光治疗和化学治疗,有反流性食管炎、骨质疏松和动脉粥样硬化等基础疾病。住院期间食用家属外带食物后自觉腹部胀痛,进食后加重伴食欲不振,随后出现发热,体温最高38.6℃,伴有寒战,物理降温后维持在38℃,精神不佳,无腹泻。急查血常规白细胞计数16.23×109/L,中性粒细胞百分比82.7%,C反应蛋白106 mg/L,白细胞介素698.41 pg/mL,降钙素原1.12 ng/mL,血清淀粉样蛋白A 1 200 mg/L,血培养提示“查见革兰阴性杆菌”。根据患者发热、血培养阳性和炎症指标升高,考虑“败血症”,给予比阿培南经验性抗感染治疗,并适当补液、调整血压和通便治疗。抗感染治疗3 d后,患者精神和食欲逐渐好转,体温正常,停用抗菌药物。血培养回报“NOVC”。
患者2,女性,84岁,因“腹痛伴发热12 h”于2022年9月入该院急诊科就诊。患者既往因胆囊结石进行胆囊切除术,因“肝内胆管结石、肝脓肿”进行肝左叶切除术,并进行胃部分切除术(原因不详),有2型糖尿病等基础疾病。患者无明显诱因出现腹痛,以上腹部疼痛为主,发热,体温最高39.2℃,伴有寒战,有恶心、呕吐、气短,无腹泻和尿路刺激征,急诊以“发热待查,急性胆管炎待排,急性胰腺炎待排,2型糖尿病”收入院。血常规白细胞计数5.49×109/L,中性粒细胞百分比72.1%,淋巴细胞百分比14.9%,红细胞计数2.77×1012/L,血红蛋白86 g/L,C反应蛋白77.9 mg/L,白细胞介素6 231.9 pg/mL,降钙素原0.499 ng/mL,丙氨酸转氨酶(ALT)98 IU/L,天冬氨酸转氨酶(AST)120 IU/L,γ-谷氨酰基转移酶264 IU/L,血清淀粉酶、脂肪酶正常,血培养提示“查见革兰阴性杆菌”。根据患者发热、血培养阳性和炎症指标升高,给予比阿培南抗感染和对症支持治疗。患者体温逐渐恢复正常,神志清,精神差,家属拒绝在院继续治疗,患者出院居家观察。血培养回报“NOVC”。
2.2 血培养细菌分离情况患者1送检的需氧血培养瓶报警时间为10 h 4 min,厌氧培养瓶报警时间为8 h 44 min;患者2送检的需氧血培养瓶报警时间为9 h 19 min,厌氧培养瓶报警时间为8 h 28 min;四瓶阳性标本直接涂片革兰染色结果均为革兰阴性微弯曲状杆菌。标本接种血琼脂平板培养18 h可形成具有透明β溶血环的暗灰色菌落,麦康凯琼脂平板上形成透明菌落,单个菌落经革兰染色,镜下所见为革兰阴性杆状或弯曲状弧菌。培养菌落分散到生理盐水中制成菌悬液,压滴法观察动力(+)。分离菌传代至弧菌显色培养基,生长形成的菌落呈蓝绿色至绿松石蓝色,与对照菌株霍乱弧菌(质评菌株)的菌落颜色一致。见图 1A~C。
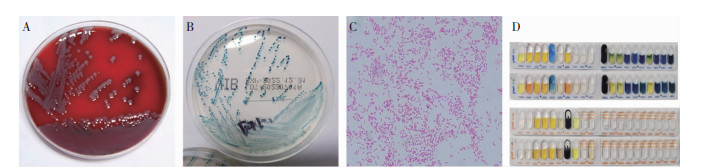 |
| 注:A.血培养阳性标本转种血琼脂培养基分离的霍乱弧菌菌落;B.霍乱弧菌接种于弧菌显色培养基,菌落呈蓝绿色至绿松石蓝色;C.霍乱弧菌纯培养物涂片革兰染色镜检见革兰阴性杆状或弯曲状弧菌(1 000×);D.两株霍乱弧菌接种API 20E和20NE生化反应鉴定卡,孵育24 h后的反应情况。 图 1 致血流感染霍乱弧菌菌株的微生物学特征 Figure 1 Microbiological characteristics of Vibrio cholerae strains causing bloodstream infection |
两株分离菌经VITEK MS鉴定为霍乱弧菌(V. cholerae),可信度均为99.9%;经API 20E、API 20NE鉴定卡均鉴定为霍乱弧菌,鉴定率分别为99.9%、99.3%(20E卡)及99.0%、99.4% (20NE卡),见图 1D;经VITEK GN卡鉴定为霍乱弧菌,鉴定率分别为98%、97%,生物编码分别为0425601151506221、0425601151507231。提取菌株DNA,PCR扩增16S rRNA并测序,应用BLAST软件将所测序列与GenBank数据库中的序列比对,进行同源性分析。结果显示两株菌16S rRNA基因与GenBank收录的霍乱弧菌V. cholerae strain W10G chromosome 1. complete sequence(序列ID号为CP 053794.1)相似性均为100%,鉴定为霍乱弧菌。
2.4 生化反应特性分离菌可在氯化钠浓度为0、1%和6%的蛋白胨水中生长,分解葡萄糖、甘露醇和蔗糖,具有葡萄糖、甘露醇、乙酰基葡萄糖胺、麦芽糖、葡萄糖酸、苹果酸和枸橼酸同化能力。硝酸盐还原(NO3)试验、邻硝基苯-β-D-半乳糖苷(ONPG)试验、赖氨酸脱羧酶试验、鸟氨酸脱羧酶试验、对硝基苯-β-D-吡喃葡萄糖苷(PNPG)试验、氧化酶试验、乙酰甲基甲醇(Voges-Proskauer, VP)试验、明胶水解试验、吲哚试验、动力试验均阳性;精氨酸双水解酶试验、色氨酸脱羧酶试验、七叶苷水解试验和脲酶试验均阴性;不产生硫化氢,不分解肌醇、山梨醇、鼠李糖、蜜二糖、苦杏仁苷和阿拉伯糖,不同化阿拉伯糖、甘露糖、葵酸、已二酸和苯乙酸。
2.5 血清学分型和毒力特征分离菌株O1群霍乱弧菌血清凝集试验、O139群霍乱弧菌血清凝集试验均阴性,排除O1、O139群霍乱弧菌,确定为NOVC。同时,荧光PCR法检测霍乱弧菌毒力基因ctxAB阴性。
2.6 耐药表型特征分离菌株对6种抗菌药物的最低抑菌浓度(MIC)和药敏试验结果见表 1。所有菌株对氨苄西林、阿奇霉素、多西环素和氯霉素均敏感;患者1分离株对四环素、复方磺胺甲
| 表 1 霍乱弧菌分离株对6种抗菌药物的药敏试验结果 Table 1 Susceptibility testing results of Vibrio cholerae strains to 6 antimicrobial agents |
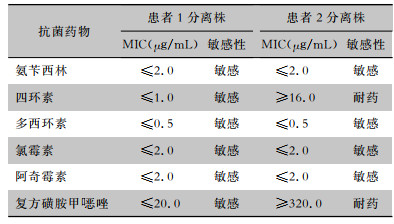
|
2例患者均为老年女性,年龄84、92岁,有基础疾病多年,1例患者肝功能异常。两例患者均在夏秋季节发病,该季节正是肠道传染病和弧菌感染的高发季节,首发症状均为发热伴腹部不适,无腹泻症状,无先泻后吐和米泔样水便等霍乱典型的临床表现。患者分离菌经质谱鉴定和复核后,检验科微生物室及时向临床科室报告,并详细解释病原体名称NOVC及其致病意义,强调了此病原体不属于引起甲类传染病霍乱的O1或O139血清型霍乱弧菌,无需进行疫情上报,注意采取及时准确地抗感染治疗,监测患者生命体征和症状变化,如出现腹泻及时送检粪便(弧菌)培养。同时联系医院感染控制科通报患者病原学情况,积极加强患者教育和医护人员手卫生宣传,完成病房清洁消毒,避免医院感染发生。
3 讨论文献显示,NOVC感染病例多见于有基础疾病和免疫力低下的人群,包括慢性肝脏疾病(肝硬化)[7-8]、血液病[9]、肿瘤患者,偶见于免疫功能正常的健康人群[10],临床表现多为肠道外感染,以血流感染为主,如菌血症和败血症[4-6],其他感染类型包括皮肤创口、软组织(脓肿、坏死性筋膜炎、蜂窝织炎)、耳部[11]感染等。需要注意的是,慢性肝病可能是NOVC系统性感染最主要的易感因素之一,有关这类群体NOVC传播并导致血流感染的具体致病机制和途径仍然不明确。本研究患者临床特征包括高龄,基础疾病多,免疫功能降低,临床表现均有发热、胃肠道不适的首发症状,无腹泻,无霍乱典型的临床表现。患者发病前可能摄入霍乱弧菌污染的食物,细菌通过消化系统侵入血液,加之患者免疫力较低,造成血流感染,这与患者血培养阳性,炎症反应标志物升高相符;两例患者均未采集粪便进行霍乱弧菌培养。
霍乱弧菌不属于人体正常微生物,属于环境微生物,一旦从人体标本分离出霍乱弧菌应视为传染性病原体。根据国家卫健委2023年发布的《人间传染的病原微生物目录》要求,霍乱弧菌的标本检测、活菌操作等可在生物安全二级的临床微生物实验室内进行。自临床标本分离的疑似霍乱弧菌,实验室在报告时应选择多种方法确保菌种鉴定正确,如MALDI-TOF MS、全自动微生物鉴定仪和16S rRNA测序。不具备以上鉴定条件的实验室,可使用商品化细菌生化反应鉴定卡(如API卡,需注意个别弧菌属需调整培养基或悬浮液的NaCl浓度以促进其生长)。鉴于O1群、O139群菌株具有强烈致病性和传染性,实验室必须具备快速分型能力,如霍乱弧菌诊断血清或分子生物学方法(ctxAB PCR检测)。血清凝集试验可快速确定其血清学型别,区分O1群、O139群和非O1非O139群,同时参考患者临床症状,做好临床沟通和必要的疫情上报。一旦确定为O1群或O139群,应及时上报医院感染监控部门并完善霍乱疫情直报,采取有力的感染控制措施,做好病区隔离、消毒工作,阻断疫情传播扩散。对于NOVC,根据患者症状采取适度的感染控制隔离及必要的监测、治疗措施,避免疫情误报,造成过度处置和医疗资源的浪费。本研究两株NOVC分离自不同时期不同科室的患者,后期也未在其他患者中分离到该致病菌,且耐药表型存在差异,理论上不具有同源性,可初步排除医院内传播的可能性,如有必要可以通过菌株多位点序列分型(MLST)或全基因组测序进行甄别。
霍乱弧菌药敏试验应依据美国CLSI M45弧菌属-霍乱弧菌标准进行检测,应报告菌株对氨苄西林、阿奇霉素、多西环素、四环素、复方磺胺甲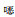
综上所述,霍乱弧菌所致的胃肠外感染报道罕见,特别是NOVC所致的血流感染在我国少有报道,加之个别实验室检验能力不足,给该疾病的诊断带来一定难度。本研究有助于开拓临床医生和微生物检验人员的诊断思路,建议血流感染疑似患者尽早送检血培养以明确病原体;特别是对从免疫力低下患者血培养标本中分离的霍乱弧菌,应在保证菌种鉴定结果准确的前提下,进行血清学分型区分O1群、O139群和NOVC,正确按照传染病分类上报和防控;根据标准报告分离株药敏结果,尽快给予目标性抗感染治疗,挽救患者生命。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Lutz C, Erken M, Noorian P, et al. Environmental reservoirs and mechanisms of persistence of Vibrio cholerae[J]. Front Microbiol, 2013, 4: 375. |
| [2] |
Nadeem A, Nagampalli R, Toh E, et al. A tripartite cytolytic toxin formed by Vibrio cholerae proteins with flagellum-facilitated secretion[J]. Proc Natl Acad Sci U S A, 2021, 118(47): e2111418118. DOI:10.1073/pnas.2111418118 |
| [3] |
Xiang YH, Hu QQ, Liu Y, et al. Etiology and clinical features of non-O1/non-O139 Vibrio cholerae infection in an inland city in China[J]. Biomol Biomed, 2023, 23(4): 698-704. |
| [4] |
Li XY, Wu YY, Sun XJ, et al. Non-O1/non-O139 Vibrio cholerae bacteraemia in mainland China from 2005 to 2019: clinical, epidemiological and genetic characteristics[J]. Epidemiol Infect, 2020, 148: e186. DOI:10.1017/S0950268820001545 |
| [5] |
邹玖明, 张爱平, 李智山, 等. 致血流感染非O1群非O139群霍乱弧菌的鉴定及毒力基因检测[J]. 中国感染与化疗杂志, 2014, 14(3): 186-189. Zou JM, Zhang AP, Li ZS, et al. Identification and virulence gene detection of non-O1 and non-O139 Vibrio Cholerae isolates causing septicemia[J]. Chinese Journal of Infection and Chemotherapy, 2014, 14(3): 186-189. |
| [6] |
马晓博, 孙艳, 许卫星, 等. 1例非O1非O139群霍乱弧菌败血症病例报道[J]. 国际检验医学杂志, 2016, 37(9): 1302-1303. Ma XB, Sun Y, Xu WX, et al. A case report of non O1, non O139 group Vibrio cholerae sepsis[J]. International Journal of Laboratory Medicine, 2016, 37(9): 1302-1303. DOI:10.3969/j.issn.1673-4130.2016.09.070 |
| [7] |
茆海丰, 金丹婷, 左春磊, 等. 肝病合并非O1非O139群霍乱弧菌败血症患者三例临床分析[J]. 中华临床感染病杂志, 2018, 11(3): 209-212. Mao HF, Jin DT, Zuo CL, et al. Non-O1 and non-O139 Vibrio cholerae septicemia in patients with hepatopathy: a report of 3 cases[J]. Chinese Journal of Clinical Infectious Diseases, 2018, 11(3): 209-212. DOI:10.3760/cma.j.issn.1674-2397.2018.03.009 |
| [8] |
孙慧冰, 李佩珊, 郭维龙, 等. 肝硬化患者血液中检出非O1非O139群霍乱弧菌1例报道[J]. 检验医学, 2020, 35(12): 1320-1322. Sun HB, Li PS, Guo WL, et al. A case report of non O1, non O139 group Vibrio cholerae detected in the blood of patients with liver cirrhosis[J]. Lab Med, 2020, 35(12): 1320-1322. |
| [9] |
Punpanich W, Sirikutt P, Waranawat N. Invasive Vibrio chole- rae non-O1 non-0139 infection in a thalassemic child[J]. J Med Assoc Thai, 2011, 94(Suppl 3): S226-S230. |
| [10] |
陈昱希, 黄健, 陈安林, 等. 一株致多器官功能衰竭非O1/O139群霍乱弧菌的鉴定[J]. 中国病原生物学杂志, 2018, 13(8): 831-834. Chen YX, Huang J, Chen AL, et al. Identification of non-O1/non-O139 Vibrio cholerae causing multiple organ dysfunction syndrome[J]. Journal of Parasitic Biology, 2018, 13(8): 831-834. |
| [11] |
Van Bonn SM, Schraven SP, Schuldt T, et al. Chronic otitis media following infection by non-O1/non-O139 Vibrio chole-rae: a case report and review of the literature[J]. Eur J Microbiol Immunol (Bp), 2020, 10(3): 186-191. DOI:10.1556/1886.2020.00013 |
| [12] |
Laviad-Shitrit S, Sharaby Y, Izhaki I, et al. Antimicrobial susceptibility of environmental non-O1/non-O139 Vibrio cho-lerae isolates[J]. Front Microbiol, 2018, 9: 1726. DOI:10.3389/fmicb.2018.01726 |



