2. 中国人民解放军南部战区总医院干部病房二科, 广东 广州 510080
2. Ward for Senior Officials, General Hospital of Southern Theatre Command of People's Liberation Army, Guangzhou 510080, China
新型冠状病毒感染(coronavirus disease 2019, COVID-19)是一种由新型冠状病毒2(severe acute respiratory syndrome coronavirus, SARS-CoV-2) 导致的急性传染病,临床表现以上呼吸道感染为主[1]。虽然COVID-19的暴发高峰期已经过去,但全球仍有数百万人感染或再次感染,每周均有数千人死亡,其仍旧是一个存在且持续发生的公共卫生问题[2]。但是国内外诊疗指南和研究报告均未提及用于中型COVID-19患者的特定治疗方案。高龄老年人一直以来都是重点公共卫生事件的高危人群[3]。高龄老年人常患有多种基础性疾病,全身机体免疫力减退,各个组织器官代偿能力下降[4-5]。COVID-19患者中,重症发生的比例和病死率都随着年龄的增长而上升,且病情变化快[6-8],易发展为重型、危重型,预后较差。因此,不管是在过去COVID-19的暴发高峰期还是现在常态化的公共卫生问题中,COVID-19高龄老年患者的治疗都是重点和难点,在疾病中型时有效地控制病情成为临床工作的关键。《新型冠状病毒感染诊疗方案(试行第十版)》[9]中指出,糖皮质激素的使用可降低重症COVID-19患者的病死率,但不推荐轻型、中型患者使用糖皮质激素。糖皮质激素作为一种抗炎和免疫调节药物,在COVID-19治疗中能缓解全身炎症反应[10],但其大剂量使用存在继发感染和远期发生严重并发症的风险[11],因此使用糖皮质激素治疗COVID-19患者的时机和剂量是目前备受关注的议题[12-13]。临床中发现,早期小剂量短期静脉使用糖皮质激素后可以有效改善中型COVID-19患者的预后,但是目前国内尚无相关的研究和报道。因此,本研究回顾性分析静脉使用糖皮质激素对中型COVID-19高龄老年患者的作用,为临床治疗提供参考,从而降低老年COVID-19患者的重症发生率。
1 对象与方法 1.1 研究对象选取某院2022年12月9日—2023年2月9日年龄≥80岁的COVID-19高龄住院患者。纳入标准:①符合《新型冠状病毒感染诊疗方案(试行第十版)》[9]中型COVID-19诊断标准;②年龄≥80岁;③临床资料完整;④住院时间>10 d。排除标准:①治疗期间因其他原因转院患者;②实验室或影像学诊断模糊。病例筛选流程见图 1。本研究经该院伦理委员会审批通过。
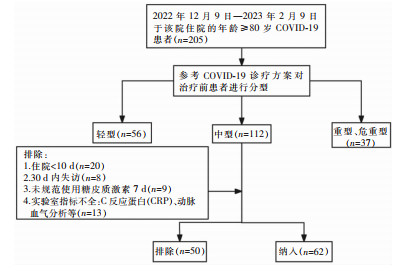 |
| 图 1 中型COVID-19高龄老年患者纳入研究筛选流程图 Figure 1 Screening flow chart of elderly patients with mode-rate COVID-19 included in the study |
参考《新型冠状病毒感染诊疗方案(试行第十版)》[9]标准,回顾性收集患者入院时临床资料,包括性别、年龄、基础疾病[糖尿病、冠心病、高血压、恶性肿瘤、慢性阻塞性肺疾病(COPD)等]、临床症状(咳嗽、咳痰、发热、纳差、恶心、肌痛等),入院当天病毒载量,实验室指标(包括动脉血气分析、淋巴细胞计数、CRP、D-二聚体等),治疗方法(全身使用糖皮质激素、抗菌药物、免疫球蛋白等)和转归情况。将患者按入院后是否小剂量静脉使用糖皮质激素,分为激素组和未使用激素组。比较两组患者入院时的一般情况、临床症状、实验室指标等,以及治疗10 d后的临床症状、实验室指标的改变情况及SARS-CoV-2核酸转阴时间。其中,COVID-19者病情由中型发展到重型、危重型甚至死亡,称为病情加重。
1.3 治疗方案常规治疗方案包括抗病毒、抗细菌感染和支持治疗。激素组患者入院后使用糖皮质激素4 mg静脉滴注,1次/d,共持续7 d。
1.4 统计学方法数据由双人核对和录入,应用SPSS 26.0软件进行分析。计数资料采用频数、百分比描述,并采用卡方检验进行组间比较;计量资料经K-S检验(Kolmogorov-Smirnov)检验其是否符合正态分布,正态分布的计量资料采用(x±s)描述,采用t检验进行组间比较;非正态分布的计量资料以中位数描述,采用秩和检验进行组间比较。以P≤0.05为差异有统计学意义。
2 结果 2.1 一般资料共纳入62例中型COVID-19高龄老年患者,其中激素组41例,平均年龄(89.56±4.91)岁;未使用激素组21例,平均年龄(89.19±4.01)岁。两组患者在年龄,性别,以及合并高血压、糖尿病、冠心病、恶性肿瘤、COPD、慢性肾病方面比较,差异均无统计学意义(均P>0.05)。两组患者的查尔森共病指数(CCI)比较,差异无统计学意义(P>0.05)。入院当天上呼吸道标本的SARS-CoV-2核酸检测循环阈值(cycle threshold, Ct)及SARS-CoV-2核酸转阴时间比较,差异均无统计学意义(均P>0.05)。在治疗方法上,除是否全身使用糖皮质激素外,两组患者采用抗病毒、抗菌药物、吸氧、免疫球蛋白治疗及俯卧位通气等方面比较,差异均无统计学意义(均P>0.05)。见表 1。
| 表 1 两组中型COVID-19高龄老年患者的基本特征 Table 1 Baseline features of elderly patients in two groups with moderate COVID-19 |
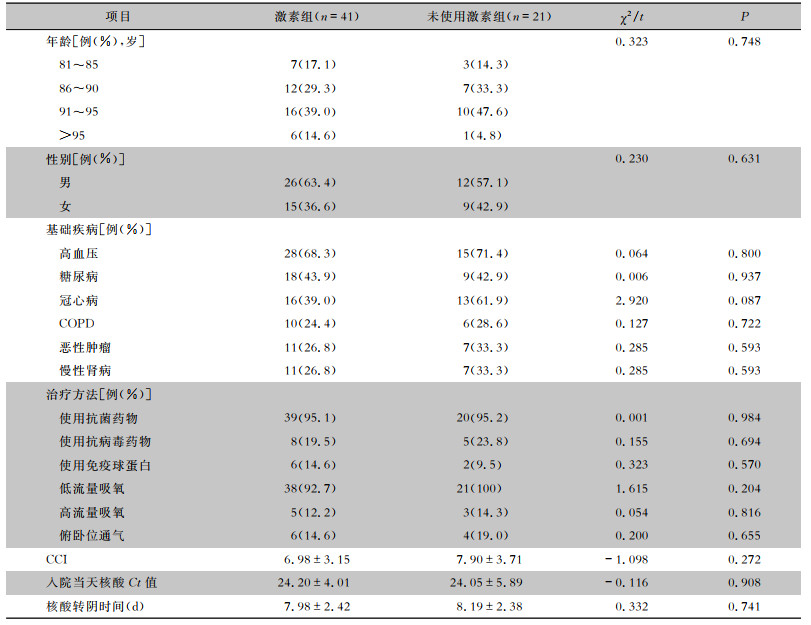
|
两组患者入院时,发热、咳嗽、咯痰、肌痛、纳差、腹泻、恶心、腹胀、乏力、咽痛、心悸、气促症状比较,差异均无统计学意义(均P>0.05)。患者治疗10 d后激素组咳嗽(34.1% VS 66.7%)、咯痰(19.5% VS 61.9%)、心悸(4.9% VS 23.8%)、气促(7.3% VS 28.6%)临床表现较未使用激素组减少,差异均有统计学意义(均P<0.05)。其他临床表现两组患者比较,差异均无统计学意义(均P>0.05)。见表 2。
| 表 2 两组中型COVID-19高龄老年患者治疗前与治疗10 d后的临床表现[例(%)] Table 2 Clinical manifestations of elderly patients in two groups with moderate COVID-19 before and 10 days after treatment (No. of cases [%]) |
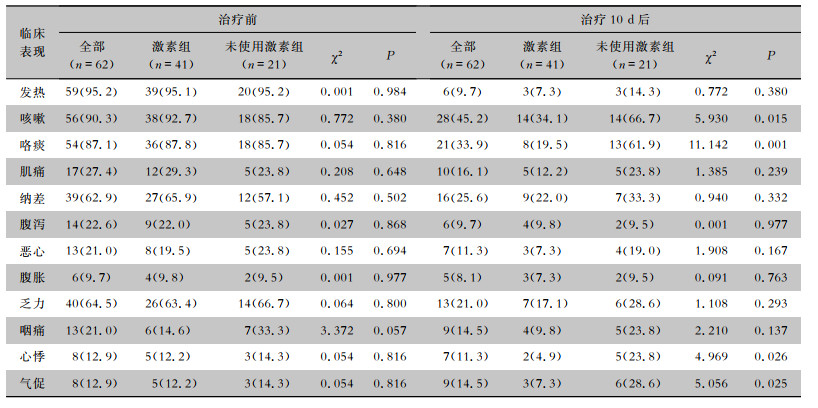
|
治疗前两组患者的氧合指数、淋巴细胞计数、CRP、D-二聚体等指标比较,差异均无统计学意义(均P>0.05);治疗10 d后,与未使用激素组患者比较,激素组患者的氧合指数、淋巴细胞计数上升,CRP、D-二聚体数值下降,差异均有统计学意义(均P<0.05)。见图 2。
 |
| 注:*表示与未使用激素组比较,差异有统计学意义(P<0.05)。 图 2 两组中型COVID-19高龄老年患者治疗前与治疗10 d后实验室检查指标的变化 Figure 2 Changes of laboratory indicators of elderly patients in two groups before and 10 days after treatment |
患者30 d内疾病转归情况,62例患者中25.8%(16例)病情加重,74.2%(46例)好转。激素组有14.6%(6例)的患者病情加重,85.4%(35例)病情好转;未使用激素组有47.6%(10例)的患者病情加重,52.4%(11例)病情好转;两组比较差异有统计学意义(χ2=7.891,P<0.05)。
3 讨论COVID-19流行以来,已有越来越多的证据表明使用小剂量糖皮质激素治疗有利于降低重型、危重型患者的病死率[14-15],但轻症COVID-19患者在接受糖皮质激素治疗后无明显获益,存在延缓病毒清除风险[13],本研究发现糖皮质激素治疗并未延长中型COVID-19高龄老年患者SARS-CoV-2核酸转阴时间。糖皮质激素主要通过诱导抗炎因子的合成从而起到抗炎的作用,对由细胞因子风暴而引发的重症疾病具有重要作用[16]。其作为一种抗炎和免疫抑制药物,在COVID-19患者治疗中缓解全身炎症反应,减少炎性渗出,使COVID-19患者获益[17]。但糖皮质激素也是“一把双刃剑”,在抗炎治疗的同时,大剂量使用存在继发感染、远期发生严重并发症的潜在风险[13-14]。
目前研究对于糖皮质激素使用时机的建议不一致,Bahl等[18]建议在出现COVID-19症状7 d内可使用糖皮质激素,住院患者可在SARS-CoV-2感染3 d内开始糖皮质激素治疗。Feldman等[19]则认为需高流量吸氧或机械通气的患者应尽早使用糖皮质激素。相较于年轻患者,老年COVID-19患者基础疾病多,免疫系统易受损,机体代偿力下降,更易演变为重型[20-21],糖皮质激素使用时机更难把握。根据《新型冠状病毒感染诊疗方案(试行第十版)》[9]意见,划分出不同严重程度的COVID-19患者,发现高龄COVID-19患者中重症比例高,还有相当一部分中型COVID-19患者短期内会病情加重,演变为重型甚至极危重型。COVID-19高龄老年患者的预后情况与其早期治疗策略密切相关。因此,本研究专门收集中型COVID-19高龄老年患者的住院资料,分析全身使用糖皮质激素的疗效。按照《新型冠状病毒感染诊疗(试行第十版)》[9],针对轻型、中型COVID-19患者不建议全身使用糖皮质激素,但本研究结果表明,相当一部分中型COVID-19高龄老年患者由于病毒侵犯肺部,导致呼吸道症状加重,患者反复咳嗽、咯痰、气促以及血氧饱和度和氧合指数下降,如果在此阶段病情得不到控制会迅速进展,发展为重症。临床上,部分医生会对这类中型COVID-19高龄老年患者,在发病早期,即发病3 d内静脉小剂量使用糖皮质激素7~10 d,能迅速控制病情,缩短病程,改善患者预后。但是考虑到糖皮质激素的不良反应,仅采用小剂量(4 mg)的地塞米松静脉滴注,且疗程为7~10 d。同时,合并肺部细菌感染时,联合使用抗菌药物治疗[22],能有效地控制病情。由于小剂量、短疗程的糖皮质激素使用,不良反应也不明显,本研究中未出现消化道出血,肝功能损伤或者感染加重的情况,也未对患者造成严重影响,且早期全身使用糖皮质激素的患者预后较好,糖皮质激素发挥着调节免疫,减轻炎症风暴,同时也减轻炎症因子对多器官功能的损伤,也避免了患者发展为重症。建议在使用糖皮质激素时,积极监测其相关的不良反应,及时处理,以使糖皮质激素的疗效最优化。如患者同时合并使用非甾体类药物,可以考虑联合给予胃黏膜保护剂,预防消化道损伤。
本研究选择氧合指数、淋巴细胞计数、CRP、D-二聚体等实验室检查指标,比较患者在使用小剂量(4 mg)的地塞米松静脉滴注和未使用者的指标变化情况。氧合指数作为COVID-19分型的重要指标[23],其高低与肺部病变的严重程度高度相关,当炎症反应过度时,患者肺部毛细血管通透性改变,肺内血液分流,氧气交换受阻,氧合指数下降。小剂量(4 mg)的地塞米松静脉滴注明显提升中型COVID-19高龄老年患者氧合指数,使患者获利。此外,D-二聚体指标差异明显,Chen等[24]研究发现,COVID-19患者常伴随凝血功能异常,其中36%的患者可出现D-二聚体增高。此在COVID-19高龄老年患者中同样适用,D-二聚体也是COVID-19主要实验室变化指标之一[25],经过全身糖皮质激素治疗后,D-二聚体明显下降并回归正常的患者,通常能平稳度过病情进展期。对于基础疾病较多的COVID-19高龄老年患者,中型时小剂量的糖皮质激素静脉滴注有利于改善咳嗽、咯痰、气促、心悸等症状,有利于D-二聚体、血氧饱和度、CRP、淋巴细胞计数等实验室检查指标的恢复。
综上所述,COVID-19高龄老年患者中型时使用糖皮质激素,疾病好转率高于未使用激素组,与北京协和医院COVID-19诊疗多学科专家组的建议一致[22],即综合考虑高龄患者人口学特征、免疫状态、病情进展速度、呼吸衰竭程度、影像特点、基础疾病等因素制定个体化方案。糖皮质激素治疗有许多不良反应,尤其是老年人、高龄老年人,如血糖升高、类固醇糖尿病、继发二重感染、消化性溃疡甚至消化道出血、血压升高、水钠猪留等,但不能否认糖皮质激素在本研究中的疗效。如合并肺部细菌感染时,联合抗菌药物治疗,能有效地控制病情,其不良反应也不明显。
本研究存在以下局限性:①为单中心回顾性研究,不能排除存在病例选择偏倚及存在其他混杂因素对结果的影响。②本研究着眼于中型COVID-19高龄患者糖皮质激素使用的疗效分析,由于样本数量有限,没有分组比较糖皮质激素吸入与注射的疗效差异,相关结论需要扩大样本量进一步证实。
作者贡献:孙雅进行数据的收集与整理,统计学处理,图、表的绘制与文字撰写;彭定江进行数据的收集与整理;张艺军提出主要研究目标,负责研究的构思,负责论文质量的控制与审查,对论文整体负责,监督管理。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Araf Y, Akter F, Tang YD, et al. Omicron variant of SARS-CoV-2: genomics, transmissibility, and responses to current COVID-19 vaccines[J]. J Med Virol, 2022, 94(5): 1825-1832. DOI:10.1002/jmv.27588 |
| [2] |
World Health Organization. WHO COVID-19 dashboard[EB/OL]. [2024-01-09]. https://data.who.int/dashboards/covid19/cases.
|
| [3] |
O'Caoimh R, Sezgin D, O'Donovan MR, et al. Prevalence of frailty in 62 countries across the world: a systematic review and Meta-analysis of population-level studies[J]. Age Ageing, 2021, 50(1): 96-104. DOI:10.1093/ageing/afaa219 |
| [4] |
Zhang L, Ma L, Sun F, et al. A multicenter study of multimorbidity in older adult inpatients in China[J]. J Nutr Health Aging, 2020, 24(3): 269-276. DOI:10.1007/s12603-020-1311-x |
| [5] |
葛延风, 王列军, 冯文猛, 等. 我国健康老龄化的挑战与策略选择[J]. 管理世界, 2020, 36(4): 86-95. Ge YF, Wang LJ, Feng WM, et al. The challenge and strategy selection of healthy aging in China[J]. Journal of Management World, 2020, 36(4): 86-95. DOI:10.3969/j.issn.1002-5502.2020.04.010 |
| [6] |
Rahman MM, Bhattacharjee B, Farhana Z, et al. Age-related risk factors and severity of SARS-CoV-2 infection: a systema-tic review and Meta-analysis[J]. J Prev Med Hyg, 2021, 62(2): E329-E371. |
| [7] |
Sablerolles RSG, Lafeber M, van Kempen JAL, et al. Associa- tion between clinical frailty scale score and hospital mortality in adult patients with COVID-19 (COMET): an international, multicentre, retrospective, observational cohort study[J]. Lancet Healthy Longev, 2021, 2(3): e163-e170. DOI:10.1016/S2666-7568(21)00006-4 |
| [8] |
Verity R, Okell LC, Dorigatti I, et al. Estimates of the seve-rity of coronavirus disease 2019: a model-based analysis[J]. Lancet Infect Dis, 2020, 20(6): 669-677. DOI:10.1016/S1473-3099(20)30243-7 |
| [9] |
中华人民共和国国家卫生健康委员会. 新型冠状病毒感染诊疗方案(试行第十版)[J]. 中国合理用药探索, 2023, 20(1): 1-11. National Health Commission of the People's Republic of China. Diagnosis and treatment of COVID-19(trial version 10)[J]. Chinese Journal of Rational Drug Use, 2023, 20(1): 1-11. DOI:10.3969/j.issn.2096-3327.2023.01.001 |
| [10] |
Longobardo A, Snow TAC, Montanari C, et al. COVID-19 and non-COVID ARDS patients demonstrate a distinct response to low dose steroids- a retrospective observational study[J]. J Crit Care, 2021, 62: 46-48. DOI:10.1016/j.jcrc.2020.11.012 |
| [11] |
Torres A, Motos A, Cillóniz C, et al. Major candidate variables to guide personalised treatment with steroids in critically ill patients with COVID-19: CIBERESUCICOVID study[J]. Intensive Care Med, 2022, 48(7): 850-864. DOI:10.1007/s00134-022-06726-w |
| [12] |
王飞龙, 冯耘. 新型冠状病毒肺炎治疗中是否推荐使用激素——上海青年呼吸学者沙龙首次活动纪要(2020)[J]. 中华结核和呼吸杂志, 2021, 44(2): 155-157. Wang FL, Feng Y. Whether hormones are recommended in the treatment of COVID-19-First summary of Shanghai Young Respiratory Scholar Salon(2020)[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2021, 44(2): 155-157. DOI:10.3760/cma.j.cn112147-20201126-01126 |
| [13] |
Zha L, Li SR, Pan LL, et al. Corticosteroid treatment of patients with coronavirus disease 2019 (COVID-19)[J]. Med J Aust, 2020, 212(9): 416-420. DOI:10.5694/mja2.50577 |
| [14] |
Horby P, Lim WS, Emberson JR, et al. Dexamethasone in hospitalized patients with COVID-19[J]. N Engl J Med, 2021, 384(8): 693-704. DOI:10.1056/NEJMoa2021436 |
| [15] |
Villar J, Ferrando C, Martínez D, et al. Dexamethasone treatment for the acute respiratory distress syndrome: a multicentre, randomised controlled trial[J]. Lancet Respir Med, 2020, 8(3): 267-276. DOI:10.1016/S2213-2600(19)30417-5 |
| [16] |
Auyeung TW, Lee JSW, Lai WK, et al. The use of corticosteroid as treatment in SARS was associated with adverse outcomes: a retrospective cohort study[J]. J Infect, 2005, 51(2): 98-102. DOI:10.1016/j.jinf.2004.09.008 |
| [17] |
Gong XL, Khan A, Wani MY, et al. COVID-19: a state of art on immunological responses, mutations, and treatment modalities in riposte[J]. J Infect Public Health, 2023, 16(2): 233-249. DOI:10.1016/j.jiph.2022.12.019 |
| [18] |
Bahl A, Johnson S, Chen NW. Timing of corticosteroids impacts mortality in hospitalized COVID-19 patients[J]. Intern Emerg Med, 2021, 16(6): 1593-1603. DOI:10.1007/s11739-021-02655-6 |
| [19] |
Feldman C, Waterer G. When should corticosteroids be used for COVID-19 infection?[J]. Eur Respir J, 2022, 60(1): 2103222. DOI:10.1183/13993003.03222-2021 |
| [20] |
Li J, Huang DQ, Zou BY, et al. Epidemiology of COVID-19: a systematic review and Meta-analysis of clinical characteristics, risk factors, and outcomes[J]. J Med Virol, 2021, 93(3): 1449-1458. DOI:10.1002/jmv.26424 |
| [21] |
Docherty AB, Harrison EM, Green CA, et al. Features of 20 133 UK patients in hospital with COVID-19 using the ISARIC WHO Clinical Characterisation Protocol: prospective observational cohort study[J]. BMJ, 2020, 369: m1985. |
| [22] |
北京协和医院新型冠状病毒感染诊疗多学科专家组. 北京协和医院成人新型冠状病毒感染实用诊疗建议(2023)[J]. 协和医学杂志, 2023, 14(1): 50-59. Multi-disciplinary Expert Team for COVID-19, Peking Union Medical College Hospital. Diagnosis and clinical management of COVID-19 infection in adults: operational recommendations of Peking Union Medical College Hospital (2023)[J]. Medical Journal of Peking Union Medical College Hospital, 2023, 14(1): 50-59. |
| [23] |
Hu B, Guo H, Zhou P, et al. Characteristics of SARS-CoV-2 and COVID-19[J]. Nat Rev Microbiol, 2021, 19(3): 141-154. DOI:10.1038/s41579-020-00459-7 |
| [24] |
Chen NS, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study[J]. Lancet, 2020, 395(10223): 507-513. DOI:10.1016/S0140-6736(20)30211-7 |
| [25] |
Poudel A, Poudel Y, Adhikari A, et al. D-dimer as a biomarker for assessment of COVID-19 prognosis: D-dimer levels on admission and its role in predicting disease outcome in hospita-lized patients with COVID-19[J]. PLoS One, 2021, 16(8): e0256744. DOI:10.1371/journal.pone.0256744 |



