2. 中南大学湘雅医院药学部,湖南 长沙 410008;
3. 南华大学附属长沙市中心医院感染性疾病科,湖南 长沙 410004;
4. 湖南省胸科医院结核病科,湖南 长沙 410013;
5. 国家老年疾病临床医学研究中心(湘雅),湖南 长沙 410008
2. Department of Pharmacy, Xiangya Hospital, Central South University, Changsha 410008, China;
3. Department of Infectious Diseases, Changsha Central Hospital Affiliated to University of South China, Changsha 410004, China;
4. Department of Tuberculosis, Hunan Chest Hospital, Changsha 410013, China;
5. National Clinical Medical Research Center for Geriatric Disorders [Xiangya], Changsha 410008, China
乙型肝炎病毒(hepatitis B virus, HBV)在全世界广泛流行,据世界卫生组织(WHO)2021年数据统计,全球慢性HBV感染患者大约有2.96亿,我国慢性乙型病毒性肝炎(chronic hepatitis B, CHB)患者为2 000万~3 000万例[1]。2019年约有82万人死于乙型病毒性肝炎,其中大部分死于肝硬化和肝细胞性肝癌[2-3]。越来越多的证据表明核苷(酸)类似物(NAs)经治的CHB患者,长期未达到临床治愈[4]。但乙型肝炎病毒表面抗原(HBsAg)水平较低的患者在加用干扰素后能够得到更高的HBsAg清除和血清学转换[5-6]。单核苷酸多态性(single nucleotide polymorphisms, SNPs)是指基因组中DNA单个核苷酸变异而引起的DNA序列的多态性,且频率至少>1%[7]。而白介素(IL)-28B与程序性死亡受体-1 (programmed death receptor-1, PD-1)的基因多态性与干扰素治疗乙型病毒性肝炎的相关性也越来越得到人们的关注。IL-28B rs12980275和rs8099917与患者乙型肝炎病毒e抗原(HBeAg)血清转换相关[8],IL-28B rs12979860CC基因型的患者血清HBsAg清除率为29%,其他基因型为13%[9]。而PD-1的rs10204525和rs2227982位点也与HBV易感性相关[10]。
本研究主要探讨Peg-IFNα-2b联合NAs治疗NAs经治HBeAg阴性CHB的疗效及其影响因素,以及IL-28B和PD-1的SNPs频率分布是否可影响干扰素的治疗应答。
1 对象与方法 1.1 研究对象回顾性收集2020年1月1日—2022年12月31日于中南大学湘雅医院感染科就诊,并以Peg-IFNα-2b联合NAs治疗或NAs单药治疗的CHB患者。纳入标准:(1)HBeAg阴性CHB患者诊断符合《慢性乙型肝炎防治指南》(2022年版)[1]。(2)HBeAg<1 IU/mL,经过NAs治疗超过48周。(3)HBV DNA<2 000 IU/mL,HBsAg<3 000 IU/mL。(4)血清丙氨酸转氨酶(alanine aminotransferase, ALT)<5倍正常上限值(40 U/L)。(5)近半年否认免疫抑制剂使用史。排除标准:(1)合并丙型肝炎病毒(HCV)、丁型肝炎病毒(HDV)、人类免疫缺陷病毒(HIV)等感染。(2)合并系统性红斑狼疮、自身免疫性肝病或其他自身免疫性疾病、酒精性肝病或其他重型肝炎等。(3)进展为肝硬化失代偿期、肝癌等。(4)存在心、肺、肾、神经系统疾病、甲状腺疾病及恶性肿瘤等。(5)存在妊娠或其他不符合使用干扰素的条件。本研究方案获得该院医学伦理委员会批准(202404093)。
1.2 病例分组按照纳入和排除标准筛选CHB患者,根据治疗方案分为Peg-IFNα-2b与NAs联合治疗(研究组)和NAs单药治疗(对照组)。研究组定义为既往使用恩替卡韦(entecavir, ETV)或富马酸替诺福韦二吡呋酯(tenofovir, TDF)1年以上,再联用Peg-IFNα-2b(厦门特宝生物工程股份有限公司,国药准字S20160001)180 μg,每周1次,皮下注射,疗程48周。对照组定义为HBeAg阴性CHB患者既往使用ETV或TDF 1年以上,维持原方案继续单药治疗。
1.3 观察指标与疗效判定收集患者的年龄、性别、用药方案、HBV血清学标志物、HBV DNA、总胆红素(TBIL)、天冬氨酸转氨酶(AST)、ALT、白细胞计数(WBC)、中性粒细胞(N)、血红蛋白(Hb)、血小板计数(PLT)等指标基线水平,以及治疗12、24、48周上述指标复查结果。48周以上复诊时收集已完成足疗程Peg-IFNα-2b联合NAs治疗的HBeAg阴性CHB患者血标本,根据应答情况分为应答组和无应答组。应答为HBV DNA低于检测下限且HBsAg清除(HBsAg≤0.05 IU/mL)、HBeAg阴性,HBV表面抗体(HBsAb)状态不限;无应答则为HBV DNA、HBeAg阳性或HBsAg未清除(HBsAg>0.05 IU/mL)。HBsAg血清学转换定义为HBsAg转阴且伴HBsAb转阳。HBV DNA的检测下限为10 IU/mL。
1.4 标本的处理与SNPs分析收集患者血标本并提取DNA。查找PD-1 rs10204525、PD-1 rs2227982及IL-28B rs12979860、IL-28B rs8099917、IL-28B rs12980275的SNPs位点序列并设计外围扩增引物。以擎科1.1×T3 Super PCR Mix进行扩增,每个位点进行单一聚合酶链反应(PCR)扩增。将PCR扩增产物进行琼脂糖凝胶电泳(2 μL样品+6 μL溴酚蓝),300 V电压下电泳12 min,获取相应的凝胶电泳图。使用Chromas分析数据,根据TSINGKE SNP1软件位点对应峰的情况进行基因分型。
1.5 统计分析方法应用SPSS 26.0统计软件进行数据整理和分析。计量资料若符合正态分布,采用x±s表示,组间比较采用两独立样本t检验;若不符合正态分布,采用M(P25,P75)表示,组间比较采用Mann-Whitney U检验。计数资料采用频数(百分比)表示,组间比较采用卡方检验。采用二元逻辑回归分析进行多因素分析。采用受试者工作特征(ROC)曲线进行预测效能分析。P≤0.05为差异具有统计学意义。
2 结果 2.1 患者基线特征研究组纳入HBeAg阴性CHB患者73例,对照组61例。两组患者的性别、年龄、NAs治疗药物、基线肝功能指标(TBIL、ALT、AST)、HBV DNA、HBsAg、WBC、N、Hb、PLT比较,差异均无统计学意义(均P>0.05)。见表 1。
| 表 1 两组HBeAg阴性CHB患者的基线特征比较 Table 1 Baseline characteristics and comparison between two groups of HBeAg-negative CHB patients |
|
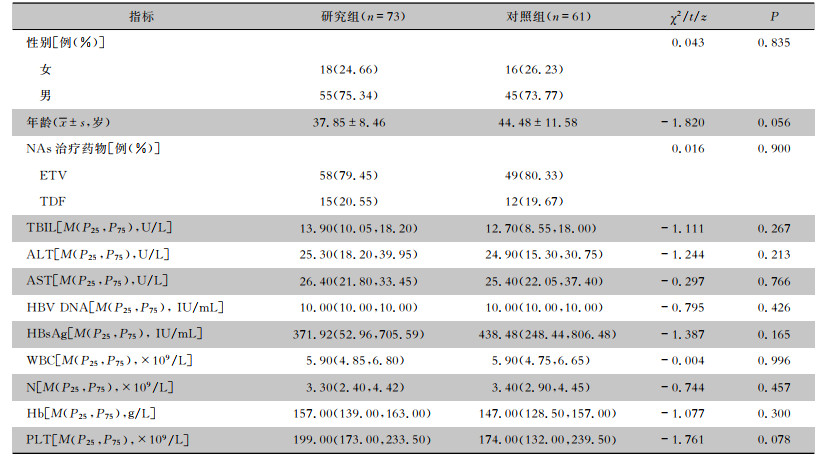
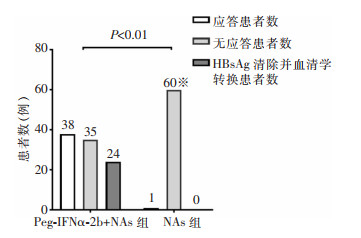
134例HBeAg阴性CHB患者治疗至48周应答39例,无应答95例,其中研究组73例患者中应答率为52.05%(38例),对照组61例患者中应答率为1.64%(1例),两组患者治疗应答率比较差异有统计学意义(P<0.01);对照组未见HBsAg血清学转换,两组患者HBsAg血清学转换率分别为32.88%(24例)、0(0例),差异有统计学意义(P<0.01),见图 1。研究组治疗第12周HBsAg清除率为8.22%(6例),血清学转换率为4.11%(3例);治疗第24周HBsAg清除率为32.88%(24例),血清学转换率为13.70%(10例),见图 2。在治疗48周后,研究组患者HBV DNA检测全部低于检测下限。
 |
| 注:※表示NAs组与Peg-IFNα-2b+NAs组的治疗应答率比较,P<0.01。 图 1 治疗第48周两组HBeAg阴性CHB患者治疗应答与HBsAg转换情况 Figure 1 Treatment response and HBsAg conversion in two groups of HBeAg-negative CHB patients at the 48th week of treatment |
 |
| 图 2 研究组HBeAg阴性CHB患者治疗第12、24、48周HBsAg清除率、HBsAg血清学转换率 Figure 2 HBsAg clearance rates and HBsAg serological conversion rates in HBeAg-negative CHB patients in the study group at the 12nd, 24th and 48th weeks of treatment |
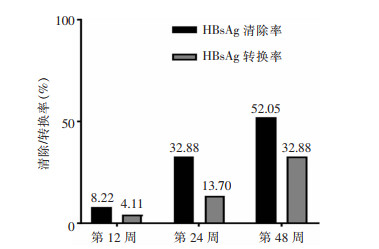
对研究组HBeAg阴性CHB的基线HBsAg水平进行分层,其中65例HBsAg<1 000 IU/mL,8例HBsAg≥1 000 IU/mL,两组患者在治疗第48周应答例数分别为37、1例,两组患者治疗应答率(56.92% VS 12.50%)比较,差异有统计学意义(P=0.024)。HBsAg<1 000 IU/mL的患者中,24例HBsAg<100 IU/mL,41例100 IU/mL≤HBsAg<1 000 IU/mL,两组患者在治疗第48周应答患者例数分别为17、20例,两组患者治疗应答率(70.83% VS 48.78%)比较,差异无统计学意义(P=0.083)。HBsAg<100 IU/mL组患者与HBsAg≥1 000 IU/mL组患者在治疗第48周应答率比较,差异有统计学意义(P=0.004);100 IU/mL≤ HBsAg<1 000 IU/mL组患者与HBsAg≥1 000 IU/mL组患者治疗第48周应答率比较,差异无统计学意义(P=0.058),见图 3。
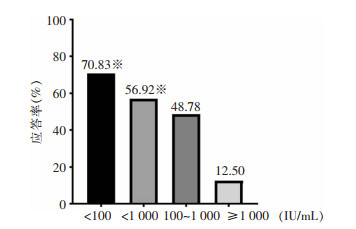 |
| 注:※表示与HBsAg≥1 000 IU/mL组比较,P<0.05。 图 3 研究组不同基线HBsAg水平CHB患者第48周的应答率比较 Figure 3 Comparison of the 48th week response rate in CHB patients with different baseline HBsAg le-vels in the study group |
单因素分析结果显示,治疗第48周应答组与无应答组CHB患者的HBsAg基线水平及第12周、第24周HBsAg下降幅度比较,差异均有统计学意义(均P<0.01),见表 2。多因素分析结果显示,两组患者HBsAg基线水平(OR=1.004, 95%CI:1.001~1.006)和治疗第24周HBsAg下降幅度(OR=0.111,95%CI:0.034~0.362)比较,差异均有统计学意义(均P<0.05),见表 3。
| 表 2 研究组CHB患者治疗第48周应答影响的单因素分析 Table 2 Univariate analysis of the 48th week treatment response of CHB patients in the study group |
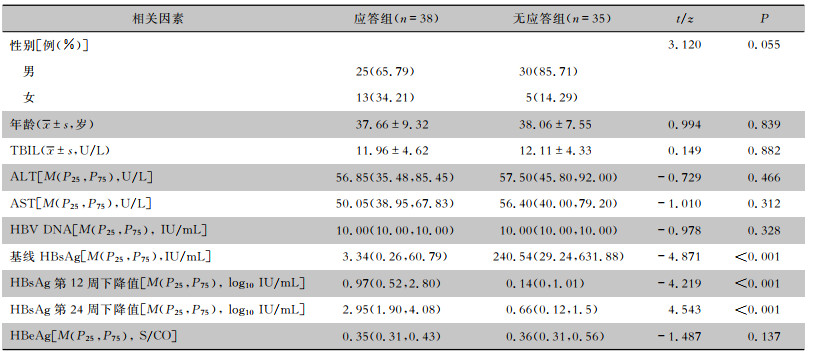
|
| 表 3 研究组CHB患者治疗第48周应答影响的多因素分析 Table 3 Multivariate analysis of the 48th week treatment response of CHB patients in the study group |
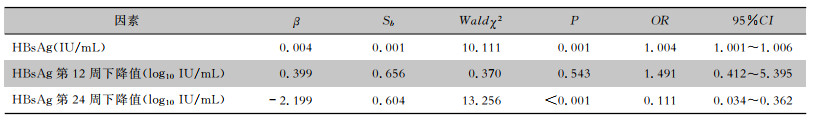
|
根据单因素分析和多因素分析结果,选择HBsAg基线水平及治疗第12、24周HBsAg下降值对治疗第48周应答进行预测。其中第24周HBsAg下降幅度ROC曲线下面积为0.910(95%CI:0.844~0.976,P<0.01),最佳截断值为1.085 log10 IU/mL,灵敏度为97.40%,特异度为73.50%,阳性预测值为80.40%,阴性预测为96.20%,提示干扰素治疗时第24周HBsAg下降幅度为相关性较好的疗效预测指标。见表 4、图 4。
| 表 4 HBsAg基线水平及下降幅度对治疗第48周应答的预测效能分析 Table 4 Predictive efficacy of HBsAg baseline level and its decline magnitude on the 48th week treatment response |
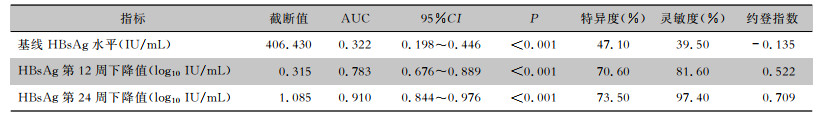
|
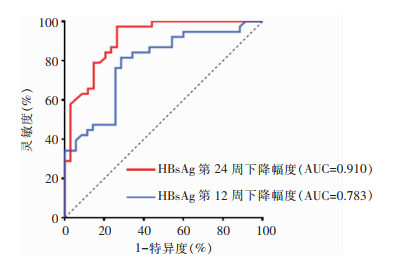 |
| 图 4 治疗第12、24周HBsAg下降幅度预测第48周治疗应答情况的ROC曲线 Figure 4 ROC curve for the prediction of treatment response at the 48th week of treatment using HBsAg decline magnitude at the 12nd and 24th weeks of treatment |
治疗第72周随访,研究组患者中,31例持续应答,1例HBsAg复阳,6例失访,35例患者无应答(其中3例HBsAg清除,32例HBsAg仍为阳性);对照组患者中,仅1例应答,随访至72周未复阳,60例患者未出现HBsAg清除。
2.7 应答组与无应答组的SNPs多态性共纳入24例患者,其中男性16例,女性8例;应答组12例,无应答组12例。基因分析结果显示,PD-1 rs2227982位点有AA纯合突变、G/A杂合突变及GG野生型,PD-1 rs10204525位点有TT纯合突变、C/T杂合突变及CC野生型。IL-28B rs8099917位点有TT野生型与G/T杂合突变,IL-28B re12979860位点有CC野生型与C/T杂合突变,IL-28B rs12980275位点有AA野生型与A/G杂合突变,见图 5。其中应答组PD-1 rs10204525 C/T基因型占比高于未应答组(66.67% VS 16.67%,P<0.05),见图 6。IL-28B的基因多态性在两组患者中差异无统计学意义(P>0.05)。
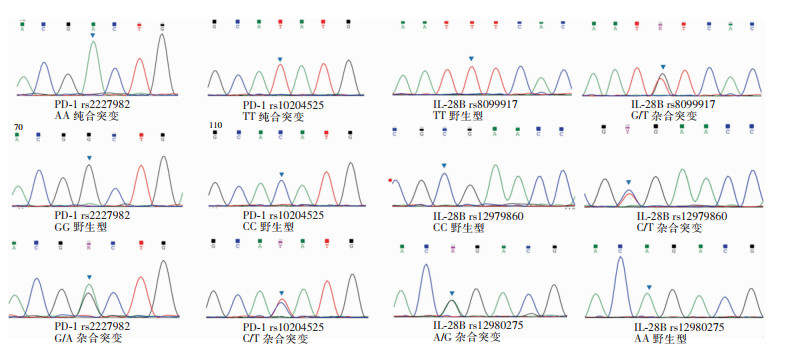 |
| 图 5 PD-1及IL-28B的基因突变位点与类型 Figure 5 PD-1 and IL-28B gene mutation sites and types |
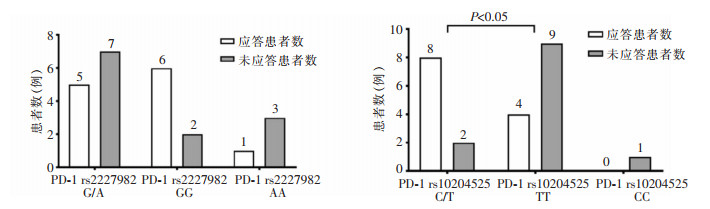 |
| 图 6 应答组与无应答组CHB患者PD-1基因型分布差异 Figure 6 Differences in PD-1 genotype distribution between response group and non-response group in CHB patients |
HBV感染引起的CHB是全球性的公共卫生问题,其治疗的关键是抗病毒。抗病毒治疗的目标主要通过病毒学、血清学和生化指标定义[11]。广泛应用的NAs能减轻肝脏炎症和减少肝纤维化,以及降低肝硬化和肝细胞癌的发病率,局限性在于HBeAg和HBsAg的血清学清除率低,因而大多数患者需要长期治疗[12]。目前HBV感染治疗方法的研发是以功能性治愈为目标的新型药物为主,评价与现有药物的协同、联合等作用是HBV感染治疗和发展的重要方向[11-12]。一项纳入1 250例患者的Meta分析[13]结果显示,ETV序贯Peg-IFNα研究组的HBsAg转换率、HBsAg清除率、HBeAg转换率、HBeAg清除率均高于ETV对照组,差异均有统计学意义(均P<0.05)。Peg-IFN联合NAs治疗可使部分NAs经治CHB患者获得临床治愈[4],但联合治疗的基线条件、最佳疗程和持久应答率等尚需进一步研究,此外,寻找影响干扰素治疗疗效的分子机制和治疗预后的预测指标具有重要意义。
本研究纳入134例HBeAg阴性CHB患者,在使用1年以上的NAs药物治疗后,61例仍继续使用NAs单药治疗48周,应答率仅1.64%;73例患者联用Peg-IFNα-2b治疗48周,HBsAg清除率为52.05%,血清学转换率为32.88%,均高于NAs单药治疗(P<0.05)。HBeAg阴性CHB患者的HBsAg水平反映了患者体内HBV共价、闭合、环状DNA分子(cccDNA)的水平,干扰素可通过载脂蛋白B mRNA编辑酶催化亚基3A(apolipoprotein B mRNA editing enzyme catalytic subunit 3A, APOBEC3A) 介导的脱氨基作用降低HBV cccDNA水平,而NAs对降低HBV cccDNA水平无明显作用[14]。单纯使APOBEC3A过表达不能降低HBV cccDNA,同样需要干扰素处理细胞。Stadler等[15]研究发现,干扰素刺激基因(interfe-ron-stimulated gene, ISG)可能在其抗病毒活性方面参与合作,而HBV cccDNA的降解则需要脱氨酶和核酸酶的协同作用。
既往研究[16]表明,病毒是影响CHB治疗的关键因素之一,较低的HBV病毒和抗原载量是Peg-IFN治疗的重要预测因素,二者可以影响先天和适应性免疫反应途径,从而降低患者对Peg-IFN的治疗反应。Mimura等[17]研究结果表明,HBeAg阴性且HBsAg滴度<120 IU/mL的患者更有可能通过Peg-IFN治疗实现HBsAg清除。本研究发现研究组中HBsAg基线水平<1 000 IU/mL的患者治疗第48周的应答率高于HBsAg≥1 000 IU/mL(56.92% VS 12.50%,P<0.05),其中HBsAg<100 IU/mL与100 IU/mL≤HBsAg<1 000 IU/mL的患者治疗48周的应答率分别为70.83%、48.78 %。组间两两比较显示,HBsAg<100 IU/mL与HBsAg≥1 000 IU/mL组间HBsAg清除率的差异有统计学意义(P<0.05),而HBsAg < 100 IU/mL与100 IU/mL≤HBsAg < 1 000 IU/mL、100 IU/mL≤HBsAg<1 000 IU/mL与HBsAg≥1 000 IU/mL组间比较,差异均无统计学意义(均P=0.058),可能与纳入病例数偏少有关。总体结果支持低HBsAg载量接受Peg-IFN治疗更可能获益。
单因素分析结果显示,治疗第12周和24周HBsAg下降幅度是治疗第48周是否应答的影响因素,多因素分析也发现治疗第24周HBsAg下降幅度是治疗第48周是否应答的影响因素。中国《慢性乙型肝炎防治指南(2022年版)》[1]将治疗第12及24周的HBsAg<200 IU/mL或下降>1 log10 IU/mL作为强烈推荐继续ETV/TDF联合干扰素治疗的依据。Li等[18]研究表明,在治疗第12周HBsAg下降>0.5 log10 IU/mL的CHB患者,在治疗第48周可达到HBsAg较高的清除率(83.3%)。Anchor研究[19]中期数据显示,序贯联合Peg-FNα-2b治疗的患者在第24周HBsAg下降>1 log10 IU/mL,62.5%的患者在治疗72周时可实现HBsAg阴转。本研究中治疗第24周HBsAg下降幅度曲线下面积为0.910(95%CI:0.844~0.976,P<0.01),最佳截断值为1.085 log10 IU/mL,灵敏度为97.40%,特异度为73.50%,阳性预测值为80.40%,阴性预测为96.20%,提示干扰素治疗时第24周HBsAg下降幅度为相关性较好的疗效预测指标。
近年来研究[20]表明特定基因的多态性与抗病毒治疗的最终结局相关,宿主因素同样可以成为影响IFN治疗反应的关键,包括患者的年龄较小、性别为女性、治疗中出现血清ALT的升高以及NAs经治基因D型HBeAg阴性CHB患者更易获得满意疗效[21-22]。
本研究检测研究组患者IL-28B与PD-1的基因多态性,发现应答人群中PD-1 rs10204525 C/T杂合突变型占比高于无应答组(66.67%VS 16.67%,P<0.05),而IL-28B SNPs在两组患者中的基因频率并无明显差异,表明携带PD-1 rs10204525C/T杂合突变基因的患者较TT纯合基因的患者更有可能因干扰素治疗获益,而IL-28B SNPs与IFN治疗的反应似乎无关,与Holmes等[23]报道结果一致。无论是在治疗结束还是随访的结果中,IL-28B SNPs与IFN治疗的反应都无关[24]。在Lampertico等[9]研究中,IL-28B SNPs可以预测与HBeAg阴性CHB患者对干扰素治疗的反应;而Domagalski等[25]证明IL-28B和OAS基因多态性与干扰素治疗CHB患儿的不同临床结局相关。因此,IL-28B SNPs与PEG-IFN-α治疗CHB疗效之间的关联仍然存在争议。
本研究存在一定的局限性。(1)共纳入134例患者,较小的样本量可能存在研究偏倚和不稳定性,因此需要扩大样本量来验证。(2)本研究采用回顾性观察对照研究设计,患者部分检查结果缺失如甲状腺功能及肝纤维化检查,因而未针对此类数据进行分析。(3)部分患者在随访的72周内出现了失访,因此完成SNPs检测的样本有限,未进一步分析PD-1以及IL-28相关SNPs位点突变导致不同治疗结局的具体机制。(4)此外,干扰素治疗期间安全性监测和及时处理十分重要[26],本研究缺乏治疗安全性相关指标的统计学分析。
综上所述,本研究表明HBeAg阴性的NAs经治CHB患者通过联用Peg-IFNa-2b治疗可达到更高的HBsAg清除率和血清学转换率,治疗第24周HBsAg下降幅度能较好地预测第48周治疗应答。低HBsAg基线水平患者及携带PD-1 rs10204525的C/T杂合突变基因的患者接受Peg-IFNa-2b治疗疗效更佳。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2022年版)[J]. 中华肝脏病杂志, 2022, 30(12): 1309-1331. Chinese Society of Hepatology, Chinese Medical Association, Chinese Society of Infectious Diseases, Chinese Medical Association. Guidelines for the prevention and treatment of chronic hepatitis B (version 2022)[J]. Chinese Journal of Hepatology, 2022, 30(12): 1309-1331. DOI:10.3760/cma.j.cn501113-20221204-00607 |
| [2] |
Nguyen MH, Wong G, Gane E, et al. Hepatitis B virus: advances in prevention, diagnosis, and therapy[J]. Clin Microbiol Rev, 2020, 33(2): e00046-19. |
| [3] |
Trépo C, Chan HLY, Lok A. Hepatitis B virus infection[J]. Lancet, 2014, 384(9959): 2053-2063. DOI:10.1016/S0140-6736(14)60220-8 |
| [4] |
Chen J, Qi M, Fan XG, et al. Efficacy of peginterferon alfa-2b in nucleoside analogue experienced patients with negative HBeAg and low HBsAg: a non-randomized clinical trial[J]. Infect Dis Ther, 2021, 10(4): 2259-2270. DOI:10.1007/s40121-021-00497-5 |
| [5] |
Bazinet M, Pantea V, Placinta G, et al. Safety and efficacy of 48 weeks REP 2139 or REP 2165, tenofovir disoproxil, and pegylated interferon alfa-2a in patients with chronic HBV infection naïve to nucleos(t)ide therapy[J]. Gastroenterology, 2020, 158(8): 2180-2194. DOI:10.1053/j.gastro.2020.02.058 |
| [6] |
Chuaypen N, Posuwan N, Chittmittraprap S, et al. Predictive role of serum HBsAg and HBcrAg kinetics in patients with HBeAg-negative chronic hepatitis B receiving pegylated interferon-based therapy[J]. Clin Microbiol Infect, 2018, 24(3): 306. |
| [7] |
Kim S, Misra A. SNP genotyping: technologies and biomedi-cal applications[J]. Annu Rev Biomed Eng, 2007, 9: 289-320. DOI:10.1146/annurev.bioeng.9.060906.152037 |
| [8] |
Takahashi T. Interleukin 28B genetic polymorphism and hepatitis B virus infection[J]. World J Gastroenterol, 2014, 20(34): 12026-12030. DOI:10.3748/wjg.v20.i34.12026 |
| [9] |
Lampertico P, Viganò M, Cheroni C, et al. IL28B polymorphisms predict interferon-related hepatitis B surface antigen seroclearance in genotype D hepatitis B e antigen-negative patients with chronic hepatitis B[J]. Hepatology, 2013, 57(3): 890-896. DOI:10.1002/hep.25749 |
| [10] |
Huang CH, Ge TT, Xia CX, et al. Association of rs10204525 genotype GG and rs2227982 CC combination in programmed cell death 1 with hepatitis B virus infection risk[J]. Medicine (Baltimore), 2019, 98(35): e16972. DOI:10.1097/MD.0000000000016972 |
| [11] |
陈学福, 张东敬, 罗晓丹, 等. 慢性乙型肝炎的治疗现状[J]. 临床肝胆病杂志, 2021, 37(5): 1011-1015. Chen XF, Zhang DJ, Luo XD, et al. Current status of the treatment of chronic hepatitis B[J]. Journal of Clinical Hepatology, 2021, 37(5): 1011-1015. DOI:10.3969/j.issn.1001-5256.2021.05.004 |
| [12] |
中华医学会感染病学分会, 中华医学会肝病学分会. 慢性乙型肝炎临床治愈(功能性治愈)专家共识[J]. 中华传染病杂志, 2019, 37(8): 461-472. The Infectious Disease Branch of the Chinese Medical Association, the Hepatology Branch of the Chinese Medical Association. Expert consensus on clinical cure (functional cure) of chronic hepatitis B[J]. Chinese Journal of Infectious Diseases, 2019, 37(8): 461-472. DOI:10.3760/cma.j.issn.1000-6680.2019.08.003 |
| [13] |
郑洲松, 黄宇琨, 杨小丽, 等. 恩替卡韦序贯聚乙二醇化干扰素-α与单用恩替卡韦治疗慢性乙型肝炎的临床疗效比较: 系统评价与分析[J]. 中国感染控制杂志, 2022, 21(11): 1110-1117. Zheng ZS, Huang YK, Yang XL, et al. Comparison of clinical efficacy of entecavir-sequential Peg-IFN-α and entecavir alone for treatment for chronic hepatitis B: systematic evaluation and analysis[J]. Chinese Journal of Infection Control, 2022, 21(11): 1110-1117. DOI:10.12138/j.issn.1671-9638.20222864 |
| [14] |
Lucifora J, Xia YC, Reisinger F, et al. Specific and nonhepatotoxic degradation of nuclear hepatitis B virus cccDNA[J]. Science, 2014, 343(6176): 1221-1228. DOI:10.1126/science.1243462 |
| [15] |
Stadler D, Kächele M, Jones AN, et al. Interferon-induced degradation of the persistent hepatitis B virus cccDNA form depends on ISG20[J]. EMBO Rep, 2021, 22(6): e49568. DOI:10.15252/embr.201949568 |
| [16] |
Lebossé F, Testoni B, Fresquet J, et al. Intrahepatic innate immune response pathways are downregulated in untreated chronic hepatitis B[J]. J Hepatol, 2017, 66(5): 897-909. DOI:10.1016/j.jhep.2016.12.024 |
| [17] |
Mimura S, Fujita K, Takuma K, et al. Effect of pegylated interferon alfa-2a in HBeAg-negative chronic hepatitis B during and 48 weeks after off-treatment follow-up: the limitation of pre-treatment HBsAg load for the seroclearance of HBsAg[J]. Intern Emerg Med, 2021, 16(6): 1559-1565. DOI:10.1007/s11739-020-02622-7 |
| [18] |
Li GJ, Yu YQ, Chen SL, et al. Sequential combination therapy with pegylated interferon leads to loss of hepatitis B surface antigen and hepatitis B e antigen (HBeAg) seroconversion in HBeAg-positive chronic hepatitis B patients receiving long-term entecavir treatment[J]. Antimicrob Agents Chemother, 2015, 59(7): 4121-4128. DOI:10.1128/AAC.00249-15 |
| [19] |
Han MF, Wu D, Tan DM, et al. Combination/sequential therapy with ETV, Peg-IFN alpha-2b and GMCSF enhanced HBsAg loss and appearance of HBsAb in NA suppressed CHB patients (the anchor a study): an interim analysis[J]. Hepatology, 2017, 66(S1): 13A. |
| [20] |
Thabet K, Asimakopoulos A, Shojaei M, et al. MBOAT7 rs641738 increases risk of liver inflammation and transition to fibrosis in chronic hepatitis C[J]. Nat Commun, 2016, 7: 12757. DOI:10.1038/ncomms12757 |
| [21] |
Lau GKK, Piratvisuth T, Luo KX, et al. Peginterferon Alfa-2a, lamivudine, and the combination for HBeAg-positive chronic hepatitis B[J]. N Engl J Med, 2005, 352(26): 2682-2695. DOI:10.1056/NEJMoa043470 |
| [22] |
Bourlière M, Rabiega P, Ganne-Carrie N, et al. Effect on HBs antigen clearance of addition of pegylated interferon alfa-2a to nucleos(t)ide analogue therapy versus nucleos(t)ide analogue therapy alone in patients with HBe antigen-negative chronic hepatitis B and sustained undetectable plasma hepatitis B virus DNA: a randomised, controlled, open-label trial[J]. Lancet Gastroenterol Hepatol, 2017, 2(3): 177-188. DOI:10.1016/S2468-1253(16)30189-3 |
| [23] |
Holmes JA, Nguyen T, Ratnam D, et al. IL28B genotype is not useful for predicting treatment outcome in Asian chronic hepatitis B patients treated with pegylated interferon-α[J]. J Gastroenterol Hepatol, 2013, 28(5): 861-866. DOI:10.1111/jgh.12110 |
| [24] |
Brouwer WP, Arends P, Rijckborst V, et al. Polymorphisms near the IL28B gene are not associated with response to peginterferon in HBeAg-negative chronic hepatitis B patients[J]. J Hepatol, 2013, 58: S299. |
| [25] |
Domagalski K, Pawłowska M, Zale s ' na A, et al. Impact of IL28B and OAS gene family polymorphisms on interferon treatment response in Caucasian children chronically infected with hepatitis B virus[J]. World J Gastroenterol, 2016, 22(41): 9186-9195. DOI:10.3748/wjg.v22.i41.9186 |
| [26] |
张文宏, 张大志, 窦晓光, 等. 聚乙二醇干扰素α治疗慢性乙型肝炎专家共识[J]. 中华肝脏病杂志, 2017, 25(9): 678-686. Zhang WH, Zhang DZ, Dou XG, et al. Consensus on pegyla-ted interferon alpha in treatment of chronic hepatitis B[J]. Chinese Journal of Hepatology, 2017, 25(9): 678-686. |



