2. 上海市东方医院血液科, 上海 200120;
3. 上海市第十人民医院院长办公室, 上海 200072
2. Department of Hematology, Shanghai Dongfang Hospital, Shanghai 200120, China;
3. Office of Hospital Director, Shanghai Tenth People's Hospital, Shanghai 200072, China
碳青霉烯类抗生素是治疗多重耐药菌的主要药物,在临床中广泛使用,特别是在高风险患者中,导致耐碳青霉烯类肠杆菌目细菌(carbapenem-resistant Enterobacterales, CRE)检出率近年来急剧升高,我国CHINET监测网监测数据显示,2018年肺炎克雷伯菌对亚胺培南和美罗培南耐药率达到最高峰,分别为25.0%、26.3%[1],之后略有下降,2022年仍分别高达20.8%、21.9%[2],甚至有三级医院耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP)检出率高达45.4%[3],CRE在国内防治形势依然非常严峻。CRE引起的定植/感染已成为全球的重要挑战,2013年美国疾病控制与预防中心(CDC)将CRE列为公众健康紧急威胁类细菌[4]。CRE医院交叉感染给临床治疗和医院感染防控带来了巨大挑战[5]。对入住重症监护病房(ICU)、造血干细胞移植、肿瘤等高危患者主动筛查发现,CRE肠道定植率高达23.0%~28.0%[6-9]。Meta分析[10]结果显示,CRKP定植发病率较高,为22.3%(95%CI:12.74%~31.87%)。
CRE定植是继发其医院感染的高危因素[11-12],特别是对免疫功能低下的实体器官和干细胞移植(HSCT)受体,构成了主要威胁[13]。CRE定植发展成医院感染的研究结果相差较大,研究[8, 14]显示,在ICU及高危科室为4.3%~4.7%,而美国及意大利研究[11-12]发现在血液科高达47.2%~57.9%,以色列Schechner等[15]研究更是高达86.4%。2016年国外有一篇关于CRE定植后感染风险的系统综述,但该研究纳入对象的定植部位不仅是肠道,且未使用Meta分析方法进行效应量合并[16]。因此,为全面了解成人CRE肠道定植病例其医院感染发生现状,本研究收集国内外相关文献进行Meta分析,为进一步加强CRE定植病例医院感染防控提供科学依据。
1 资料与方法 1.1 文献检索计算机检索Embase、Cochrane、PubMed、Web of Science、中国知网(CNKI)、万方、维普、中国生物医学文献数据库(CBM)数据库自建库至2023年6月公开发表的文献,采用自由词与主题词相结合的检索方法,未检索灰色文献,未限制语种。中文检索词包括主动筛查、耐碳青霉烯类、碳青霉烯类、耐药、肠杆菌目、定植,英文检索词包括active screening, active surveillance, carbapenems resistance, carbapenem, drug resistance, Ente-robacterales, colonization,并二次检索相关文献的参考文献,查找可能符合纳入标准的研究。本研究的方案已在国际平台INPLASY上进行注册(注册号为NPLASY202380114)。
1.2 纳入与排除标准纳入标准:①国内外公开发表的关于主动筛查CRE定植病例医院感染发病率的中英文研究;②对肠道标本做主动筛查,有CRE定植病例发生CRE医院感染的数据;③研究中明确纳入研究对象年龄≥18岁;④结局指标包括CRE定植例数、CRE医院感染例数,或者可以根据所给数据间接计算CRE医院感染发病率;⑤同一数据重复发表或研究涵盖同一人群,仅纳入信息最完整的研究。排除标准:①综述类、病例个案报告、会议摘要等文献;②无法获取全文的文献;③原始数据描述不明确、不完整或无法从文献中计算获得CRE定植病例医院感染发病率的研究;④质量较低的文献。
1.3 文献筛选及数据提取由两名研究人员独立进行,按照标准进行检索、纳入和数据提取工作,如遇意见不统一时,邀请第三名研究人员进行讨论后决定是否采用。对符合纳入标准的文献进行全文阅读并提取资料,建立数据库。提取内容包括:文献第一作者、研究地区、发表年份、研究人群调查时间段、病例科室来源、采集标本类型、研究对象年龄特征、CRE定植数量、定植组发生CRE医院感染数量、定植组CRE医院感染发病率等。
1.4 文献质量评价采用美国卫生保健研究与质量局(Agency for Healthcare Research and Quality, AHRQ)推荐的评价标准进行质量评价,该量表共有11条评价项目,每条目采用是(1分)、否(0分)和不清楚(0分)作答,总分8~11、4~7、0~3分分别代表高、中、低质量文献。
1.5 统计分析应用Stata 17.0软件中Metaprop程序进行率的Meta合并和分组分析。合并统计量为CRE定植病例中医院感染发病率,即CRE定植病例中发生CRE医院感染例数/CRE定植病例总数×100%及其95%置信区间(confidence interval, CI),并且绘制Meta分析森林图;同时对CRE定植中CRE血流感染发病率、CRE定植病例30天病死率和CRE感染病例30天病死率进行Meta合并。对各研究之间的异质性大小采用I2表示,I2>50%说明研究之间异质性较大,采用随机效应模型进行分析;反之,采用固定效应模型进行分析。亚组分析包括研究设计类型、发表年份、调查地域、调查科室、感染部位,比较亚组分析森林图中亚组间异质性的P值,判断亚组间合并效应量是否存在差异。血流感染发病率、感染部位分布、病死率等采用Meta合并率表示。应用文献逐一剔除法进行敏感性分析。采用Egger’s检验判断是否存在潜在的发表偏倚。检验水准为α=0.05。
2 结果 2.1 文献检索结果共检索到1 331篇相关文献,最终纳入16篇文献[8, 11-12, 14-15, 17-27],包括5篇中文[14, 21-23, 25],11篇英文[8, 11-12, 15, 17-20, 24, 26-27],文献筛选流程见图 1。
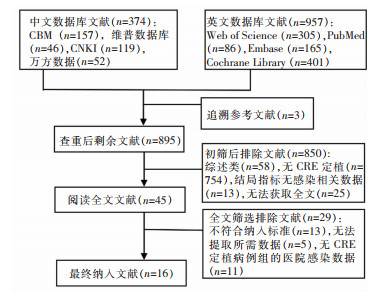 |
| 图 1 成人肠道CRE定植病例医院感染发病率Meta分析的文献筛选流程图 Figure 1 Literature screening flow chart for Meta-analysis on the incidence of HAI in adult cases with intestinal CRE colonization |
共纳入国内文献6篇,国外文献10篇,研究样本量8 840例,定植样本量2 151例,其中研究对象定植菌株为CRE的14篇[8, 12, 14-15, 18-27],共1 906例;仅为CRKP的2篇[11, 17],共245例。研究发表时间为2013—2022年,来自美国[12, 18]、意大利[11, 19]、印度[20]、希腊[17]、中国[14, 21-25]、泰国[8, 26]、巴西[27]、以色列[15]。所有文献按照AHRQ标准进行评分,其中2篇为10分,3篇为9分,9篇为8分,2篇为7分,说明纳入文献整体质量较高。见表 1。
| 表 1 成人肠道CRE定植病例医院感染发病率Meta分析纳入文献的基本特征 Table 1 Basic characteristics of included literatures for Meta-analysis on the incidence of HAI in adult cases with intestinal CRE colonization |
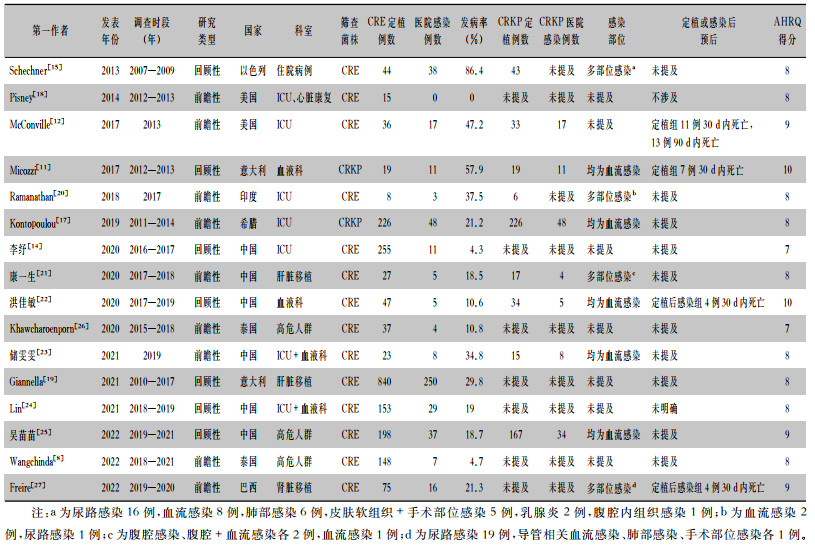
|
CRE定植病例中,CRE相关医院感染发病率在0~86.4%。由于各研究之间存在较大异质性(I2=94.473%,P < 0.001),故采用随机效应模型进行Meta分析,合并后CRE相关医院感染发病率为23.1%(95%CI:14.8%~32.5%),见图 2。
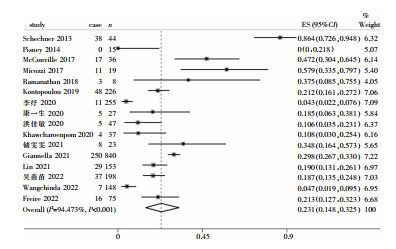 |
| 注:本研究采用Meta包中的metaprop函数,包含校正选项,因此保留了发病率为0的研究样本。 图 2 CRE定植病例中CRE医院感染发病率森林图 Figure 2 Forest plot of the incidence of HAI with CRE in CRE colonized cases |
采用亚组分析探讨异质性来源,以研究设计类型、发表年份,以及研究调查的地域、科室、感染部位分组因素进行亚组分析,且亚组间的合并效应量差异均无统计学意义(均P>0.05),提示分组因素和合并效应量之间不存在交互作用;各组内不同研究间I2>50提示存在异质性,采用随机效应模型合并效应量。见表 2。
| 表 2 CRE定植病例医院感染发病率的亚组分析结果 Table 2 Subgroup analysis results of the incidence of HAI in CRE colonized cases |
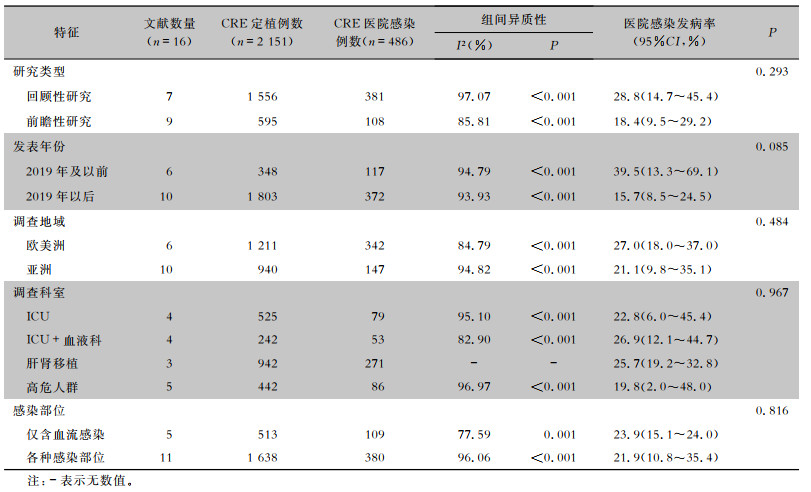
|
纳入的16篇文献中,有9篇[11-12, 15, 17, 20-23, 25]列出了CRE定植病例的菌株分布情况,分析CRE肠道定植或感染中CRKP的比例,故剔除2篇仅CRKP肠道定植的研究,7篇共383株CRE定植病例中,包含315株CRKP,CRKP定植比率为81.6%(95%CI:70.6%~90.7%)。有6篇[11, 17, 21-23, 25]报道了感染菌株分布情况,剔除2篇仅CRKP肠道定植的研究外,4篇[21-23, 25]报道了295例CRE定植患者中55例发生CRE医院感染,包括CRKP 51例,CRKP医院感染的比率为96.0%(95%CI:86.8%~100%)。
2.5.2 CRE医院感染部位分布有9篇文献[11, 15, 17, 20-23, 25, 27]报道了CRE定植后发生医院感染的部位分布情况,171例感染患者发生184例次CRE医院感染,感染部位居前3位的是血流感染、尿路感染和肺部感染;9篇文献均提及CRE定植后血流感染,感染部位中血流感染比率为78.5%(95%CI:38.0%~100%);3篇文献[11, 17, 27]提及尿路感染,感染部位中尿路感染比率为57.0% (95%CI:15.1%~94.3%);2篇文献[11, 27]提及肺部感染,感染部位中肺部感染比率为10.3%(95%CI:3.6%~19.3%)。Meta合并结果显示,CRE定植病例中血流感染发病率为18.2%(95%CI:10.3%~27.6%)。见图 3。
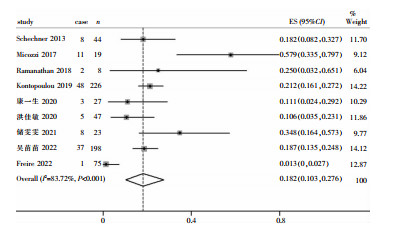 |
| 图 3 CRE定植病例中CRE血流感染发病率的Meta分析森林图 Figure 3 Forest plot of Meta-analysis on the incidence of CRE bloodstream infection in CRE colonized cases |
纳入文献中,有4篇文献报道了病例预后情况,其中2篇文献[11-12]报道了55例CRE定植病例预后,18例在30天内死亡,定植病例30天病死率为32.6%(95%CI:20.5%~45.9%);另有2篇文献[22, 27]报道了122例患者CRE定植后,21例发生CRE医院感染,其中8例在30天内死亡,CRE医院感染病例30天病死率为36.9%(95%CI:16.0%~60.2%)。
2.6 敏感性及发表偏倚分析 2.6.1 敏感性分析采用逐一剔除法进行敏感性分析,即逐个剔除纳入的研究后,合并余下研究的医院感染发病率,观察单个研究对总体合并效应量的影响,以评估Meta分析结果的稳定性。采用逐一排除法敏感性分析合并后CRE相关医院感染发病率为26.7%(95%CI:17.9%~35.5%)与总合并效应量23.1%(95%CI:14.8%~32.5%)无明显差异,提示本研究结果稳定性较好,结果可信。见图 4。
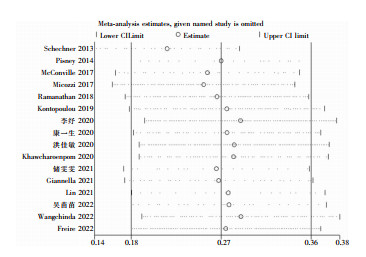 |
| 图 4 敏感性分析结果 Figure 4 Sensitivity analysis results |
应用Egger’s线性回归,对纳入的16篇文献CRE定植病例中CRE医院感染发病率进行发表偏倚检验,结果显示发表偏倚不明显(t=1.86,P=0.086)。
3 讨论CRE引起的感染/定植已成为当前全球的重要挑战,其引起的感染亦是抗感染领域最引人注目的问题之一,因此预防CRE感染及其传播已成为一个重要的感染控制目标。CRE潜在内源性宿主之一是人类肠道,目前CRE肠道定植率较高,其医院感染发生率远高于非定植组[20],肠道定植CRE已被认为是全身感染CRE的一个重要危险因素。但CRE定植病例中CRE医院感染发病率差异较大[8, 11-12, 14-15, 18],且存在研究地域局限、研究对象不同及研究样本量小等问题,不能很好地反映CRE定植病例整体医院感染现状,数据缺乏代表性。因此,评估CRE定植病例医院感染发病率整体水平至关重要,可为后期医院感染防控提供有力的数据支撑。
本研究纳入的16篇文献来源于8个国家,且纳入研究均给出了详细的样本量、病例纳入和排除标准,均为中、高质量研究,是基于已有研究证据基础之上的Meta分析,具有一定的说服力和代表性。本研究Meta分析结果显示,成人CRE肠道定植病例医院感染发病率合并后的结果为23.1%(95%CI:14.8%~32.5%),高于Tischendorf等[16]2016年综述报道的16.5%,亦高于儿童CRE肠道定植患者14.0% CRE医院感染发病率[28],与来自希腊[17]和巴西[27]的研究结果较接近(分别为21.2%、21.6%)。本研究总体Meta分析和亚组分析时均存在异质性,但未发现异质性来源因素,且无明显发表偏倚,通过敏感性分析后合并效应量和总体效应量差异无统计学意义,说明本研究结果具有一定的稳定性和可信度。
在成人CRE肠道定植病例中,CRKP定植所占的比率较大,高达81.6%,与印度[20]及国内研究[25]结果较接近,分别为75%、84.3%,是成人CRE肠道定植的最主要菌株。在成人肠道CRE定植后感染病例中,CRKP的占比高达96.0%,成为定植后感染的主导菌株。本研究发现成人CRE定植后,血流感染发病率为18.2%,与以色列和希腊研究[15, 17]结果的18.2%~21.2%较接近。2016年Tischendorf等[16]研究结果显示,CRE定植后医院感染部位中50%为肺部感染,而本研究中医院感染部位占比最高的是血流感染,肺部感染仅占10.3%。
目前有关CRE定植后的不利结局研究仍较少,一项报道合并分析了3篇文献的数据[16],发现定植或感染患者的病死率为10%,但由定植发展为感染的患者病死率更高(30%~75%);本研究有4篇文献[11-12, 22, 27]提及成人CRE定植/感染的死亡情况,Meta分析合并后定植病例30天病死率为32.6%,高于上述研究报道,可能与纳入研究病例来自于血液、肾脏移植、ICU等科室,病情危重者居多,且仅1篇文献[22]明确定植感染死亡原因为CRKP血流感染,其他3篇均为粗病死率,因此明确因CRE定植/感染导致的死亡尚需要进一步研究、证实。研究[29]显示,产碳青霉烯酶肺炎克雷伯菌(KPC-Kp)肠道定植是足部感染糖尿病患者死亡的唯一独立危险因素,30天病死率为31%,远高于非定植患者的15%[12]。肠道外感染组CRKP菌株比肠道定植组的菌株具有更强的毒力[30],在临床中应加强对肠道CRKP定植的监测和管控,以降低CRKP肠道定植进一步发展为其他部位医院感染。
研究[11, 15-16]表明,控制CRE定植和感染的效果欠佳。中国CRE感染处于较高水平,其发病率为出院者的4.0/10 000,三级医院以患者为基础的疾病负担严重,迫切需要加强感染控制[31]。因此,积极的CRE主动筛查方案至关重要,同时采取有效的预防控制措施,降低CRE定植引起医院感染的风险。2020年国内Yang等[32]研究发现,在免疫抑制个体中筛查CRE可以降低CRE血流感染发病率,可将CRE血流感染发病率降至0.5%(1/195),且无CRE相关死亡,因此主动筛查是一项有效降低CRE定植者感染的防控措施。通过积极监测、接触预防、人员配备、每日洗必泰沐浴、医护人员教育、手卫生、环境消毒和监测等措施的落实,也可降低CRE定植者感染的风险[33-34]。2017年意大利一个大型多器官移植中心进行手卫生干预研究[35]发现,手卫生依从率从49.0%上升至81.9%,CRE相关医院感染发病率从24.9%下降至5.6%(P=0.001),手卫生是减少CRE传播的有效干预措施。
主动筛查可以及时发现肠道定植病例,第一时间采取接触隔离措施,同时在条件许可情况下应去定植。2021年来自韩国的干预研究[36]显示,采用一种全面、多系统、连续的机械式去定植方案,包括使用甘油灌肠进行机械排空,每日摄入乳酸菌以替换正常肠道菌群,使用氯己定进行皮肤卫生清洁,以及每天更换床单和衣物并进行环境清洁等干预措施,直至患者解除隔离,结果显示62.5%的定植患者在该方案实施后成功去定植。
尽管本研究严格按照Meta分析的方法进行,但仍存在以下局限性,纳入文献存在较大的异质性,主要是由于单组率的Meta分析与有对照组的研究相比稳定性略差,尽管做了亚组分析,但未发现明显的异质性产生因素;纳入研究的病例有来自ICU,也有来自于非ICU病房;但所纳入文献整体质量较高,故研究结论仍有一定的科学参考价值。
综上所述,成人肠道定植CRE病例在住院过程中发生CRE医院感染的风险较高,应在ICU、血液、肿瘤及感染高危患者中实施主动筛查,筛查阴性患者可增加筛查部位和筛查频次,如每周筛查2次,对于筛查阳性患者及早落实接触隔离措施,并采取洗必泰擦浴、肠道微生态干预等方式去定植,降低CRE医院感染发生的风险。另外,在未来研究中,需要采取前瞻性、大样本研究,以进一步探索肠道定植CRE发展为医院感染的风险比率、危险因素和相关病死率,为医院感染防控提供科学的证据支持,以期降低该类人群医院感染发病率;同时探讨针对CRE定植患者如何经验性选择抗菌药物,以及建立去定植的有效方法,降低医院感染风险的同时改善患者预后。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
胡付品, 郭燕, 朱德妹, 等. 2018年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2020, 20(1): 1-10. Hu FP, Guo Y, Zhu DM, et al. CHINET surveillance of bacterial resistance in China: 2018 report[J]. Chinese Journal of Infection and Chemotherapy, 2020, 20(1): 1-10. |
| [2] |
胡付品, 郭燕, 朱德妹, 等. 2021年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2022, 22(5): 521-530. Hu FP, Guo Y, Zhu DM, et al. CHINET surveillance of antimicrobial resistance among the bacterial isolates in 2021[J]. Chinese Journal of Infection and Chemotherapy, 2022, 22(5): 521-530. |
| [3] |
刘银梅, 王璐. 2012年至2019年某三级综合医院5种重要临床病原菌的耐药性变迁[J]. 世界临床药物, 2021, 42(2): 127-134. Liu YM, Wang L. Resistance trends among five important clinical pathogens in a tertiary general hospital from 2012 to 2019[J]. World Clinical Drugs, 2021, 42(2): 127-134. |
| [4] |
Centers for Disease Control and Prevention. Antibiotic resis-tance threats in the United States, 2013[EB/OL]. [2023-09-25]. https://www.cdc.gov/drugresistance/pdf/ar-threats-2013-508.pdf.
|
| [5] |
van Loon K, Voor In't Holt AF, Vos MC. A systematic review and Meta-analyses of the clinical epidemiology of carba-penem-resistant Enterobacteriaceae[J]. Antimicrob Agents Chemother, 2018, 62(1): e01730-17. |
| [6] |
Debby BD, Ganor O, Yasmin M, et al. Epidemiology of carbapenem-resistant Klebsiella pneumoniae colonization in an intensive care unit[J]. Eur J Clin Microbiol Infect Dis, 2012, 31(8): 1811-1817. DOI:10.1007/s10096-011-1506-5 |
| [7] |
夏粉芳, 郑春梅, 姜丹, 等. 神经外科重症监护室耐碳青霉烯类肠杆菌科细菌主动筛查结果[J]. 中华医院感染学杂志, 2021, 31(22): 3427-3431. Xia FF, Zheng CM, Jiang D, et al. Survey of active screening of carbapenem-resistant Enterobacteriaceae in neurosurgery intensive care unit[J]. Chinese Journal of Nosocomiology, 2021, 31(22): 3427-3431. |
| [8] |
Wangchinda W, Thamlikitkul V, Watcharasuwanseree S, et al. Active surveillance for carbapenem-resistant Enterobacterales (CRE) colonization and clinical course of CRE colonization among hospitalized patients at a university hospital in Thailand[J]. Antibiotics (Basel), 2022, 11(10): 1401. DOI:10.3390/antibiotics11101401 |
| [9] |
Cao WJ, Zhang JY, Bian ZL, et al. Active screening of intestinal colonization of carbapenem-resistant Enterobacteriaceae for subsequent bloodstream infection in allogeneic hematopoie-tic stem cell transplantation[J]. Infect Drug Resist, 2022, 15: 5993-6006. DOI:10.2147/IDR.S387615 |
| [10] |
Tesfa T, Mitiku H, Edae M, et al. Prevalence and incidence of carbapenem-resistant K. pneumoniae colonization: syste-matic review and Meta-analysis[J]. Syst Rev, 2022, 11(1): 240. DOI:10.1186/s13643-022-02110-3 |
| [11] |
Micozzi A, Gentile G, Minotti C, et al. Carbapenem-resistant Klebsiella pneumoniae in high-risk haematological patients: factors favouring spread, risk factors and outcome of carbape-nem-resistant Klebsiella pneumoniae bacteremias[J]. BMC Infect Dis, 2017, 17(1): 203. DOI:10.1186/s12879-017-2297-9 |
| [12] |
McConville TH, Sullivan SB, Gomez-Simmonds A, et al. Carbapenem-resistant Enterobacteriaceae colonization (CRE) and subsequent risk of infection and 90-day mortality in critically ill patients, an observational study[J]. PLoS One, 2017, 12(10): e0186195. DOI:10.1371/journal.pone.0186195 |
| [13] |
Giannella M, Bartoletti M, Conti M, et al. Carbapenemase-producing Enterobacteriaceae in transplant patients[J]. J Antimicrob Chemother, 2021, 76(Suppl 1): i27-i39. |
| [14] |
李纾, 郭辅政, 赵秀娟, 等. 重症监护病房患者耐碳青霉烯类肠杆菌定植情况及对感染的危险因素分析[J]. 实用医学杂志, 2020, 36(2): 254-257. Li S, Guo FZ, Zhao XJ, et al. The value of carbapenem-resistant Enterobacteriaceae colonization for predicting infection of patients in intensive care unit[J]. The Journal of Practical Medicine, 2020, 36(2): 254-257. |
| [15] |
Schechner V, Kotlovsky T, Kazma M, et al. Asymptomatic rectal carriage of blaKPC producing carbapenem-resistant Enterobacteriaceae: who is prone to become clinically infected?[J]. Clin Microbiol Infect, 2013, 19(5): 451-456. DOI:10.1111/j.1469-0691.2012.03888.x |
| [16] |
Tischendorf J, de Avila RA, Safdar N. Risk of infection following colonization with carbapenem-resistant Enterobactericeae: a systematic review[J]. Am J Infect Control, 2016, 44(5): 539-543. DOI:10.1016/j.ajic.2015.12.005 |
| [17] |
Kontopoulou K, Iosifidis E, Antoniadou E, et al. The clinical significance of carbapenem-resistant Klebsiella pneumoniae rectal colonization in critically ill patients: from colonization to bloodstream infection[J]. J Med Microbiol, 2019, 68(3): 326-335. DOI:10.1099/jmm.0.000921 |
| [18] |
Pisney LM, Barron MA, Kassner E, et al. Carbapenem-resistant Enterobacteriaceae rectal screening during an outbreak of New Delhi metallo-β-lactamase-producing Klebsiella pneumoniae at an acute care hospital[J]. Infect Control Hosp Epidemiol, 2014, 35(4): 434-436. DOI:10.1086/675597 |
| [19] |
Giannella M, Freire M, Rinaldi M, et al. Development of a risk prediction model for carbapenem-resistant Enterobacteriaceae infection after liver transplantation: a multinational cohort study[J]. Clin Infect Dis, 2021, 73(4): e955-e966. |
| [20] |
Ramanathan YV, Venkatasubramanian R, Nambi PS, et al. Carbapenem-resistant Enterobacteriaceae screening: a core infection control measure for critical care unit in India?[J]. Indian J Med Microbiol, 2018, 36(4): 572-576. DOI:10.4103/ijmm.IJMM_18_437 |
| [21] |
康一生, 孙雁, 王卫利, 等. 主动筛查肝移植受者的耐碳青霉烯肠杆菌定植临床研究[J]. 中华器官移植杂志, 2020, 41(9): 539-543. Kang YS, Sun Y, Wang WL, et al. Surveillance culture for carbapenem-resistant Enterobacteriaceae colonization in adult liver transplant recipients[J]. Chinese Journal of Organ Transplantation, 2020, 41(9): 539-543. |
| [22] |
洪佳敏. 血液病耐碳青霉烯类肠杆菌科细菌肠道定植和血流感染的临床分析[D]. 杭州: 浙江中医药大学, 2020. Hong JM. Clinical analysis of carbapenem-resistant Enterobacteriaceae intestinal colonization and bloodstream infection in hematological diseases[D]. Hangzhou: Zhejiang Chinese Me-dical University, 2020. |
| [23] |
储雯雯, 李昕, 叶乃芳, 等. 肠道定植耐碳青霉烯类肠杆菌目细菌的主动筛查及分子流行病学[J]. 中华传染病杂志, 2021, 39(8): 485-490. Chu WW, Li X, Ye NF, et al. Active surveillance and molecular epidemiological study of intestinal colonization of carba-penem-resistant Enterobacterales[J]. Chinese Journal of Infectious Diseases, 2021, 39(8): 485-490. |
| [24] |
Lin Q, Wang Y, Yu J, et al. Bacterial characteristics of carbapenem-resistant Enterobacteriaceae (CRE) colonized strains and their correlation with subsequent infection[J]. BMC Infect Dis, 2021, 21(1): 638. |
| [25] |
吴苗苗, 杨丹红, 潘红英, 等. 碳青霉烯耐药肠杆菌科细菌定植转血流感染危险因素分析[J]. 浙江医学, 2022, 44(12): 1300-1303. Wu MM, Yang DH, Pan HY, et al. Risk factors analysis of bloodstream infection caused by colonized carbapenem-resistant Enterobacteriaceae[J]. Zhejiang Medical Journal, 2022, 44(12): 1300-1303. |
| [26] |
Khawcharoenporn T, Laichuthai W. Subsequent carbapenem-resistant Enterobacteriaceae (CRE)-associated infections among hospitalized patients with CRE colonization: impact of antibio-tic use and other factors[J]. Infect Control Hosp Epidemiol, 2020, 41(9): 1084-1089. |
| [27] |
Freire MP, de Oliveira Garcia D, Lima SG, et al. Performance of two methods of carbapenem-resistant Enterobacterales surveillance on a kidney transplant ward: selective culture of and real-time PCR directly from rectal swabs[J]. Infection, 2022, 50(6): 1525-1533. |
| [28] |
Garpvall K, Duong V, Linnros S, et al. Admission screening and cohort care decrease carbapenem-resistant Enterobacte-riaceae in Vietnamese pediatric ICU's[J]. Antimicrob Resist Infect Control, 2021, 10(1): 128. |
| [29] |
Tascini C, Lipsky BA, Iacopi E, et al. KPC-producing Klebsiella pneumoniae rectal colonization is a risk factor for morta-lity in patients with diabetic foot infections[J]. Clin Microbiol Infect, 2015, 21(8): 790.e1-3. |
| [30] |
Liao WL, Huang N, Zhang Y, et al. Comparison of carbape-nem-resistant Klebsiella pneumoniae strains causing intestinal colonization and extraintestinal infections: clinical, virulence, and molecular epidemiological characteristics[J]. Front Public Health, 2021, 9: 783124. |
| [31] |
Zhang YW, Wang Q, Yin YY, et al. Epidemiology of carba-penem-resistant Enterobacteriaceae infections: report from the China CRE network[J]. Antimicrob Agents Chemother, 2018, 62(2): e01882-17. |
| [32] |
Yang TT, Luo XP, Yang Q, et al. Different screening frequencies of carbapenem-resistant Enterobacteriaceae in patients undergoing hematopoietic stem cell transplantation: which one is better?[J]. Antimicrob Resist Infect Control, 2020, 9(1): 49. |
| [33] |
Geladari A, Karampatakis T, Antachopoulos C, et al. Epidemiological surveillance of multidrug-resistant Gram-negative bacteria in a solid organ transplantation department[J]. Transpl Infect Dis, 2017, 19(3): e12686. |
| [34] |
Chen HY, Jean SS, Lee YL, et al. Carbapenem-resistant Enterobacterales in long-term care facilities: a global and narrative review[J]. Front Cell Infect Microbiol, 2021, 11: 601968. |
| [35] |
Ragonese B, Mularoni A, Valeri A, et al. Reducing carbape-nem-resistant Enterobacteriaceae using the targeted solution tool: a quality improvement project[J]. J Nurs Care Qual, 2023, 38(1): 47-54. |
| [36] |
Choi E, Lee SJ, Lee S, et al. Comprehensive, multisystem, mechanical decolonization of vancomycin-resistant Enterococcus and carbapenem-resistant Enterobacteriacease without the use of antibiotics[J]. Medicine (Baltimore), 2021, 100(3): e23686. |



