2. 湖南省儿童医院肝病科, 湖南 长沙 410007
2. Department of Liver Diseases, Hunan Children's Hospital, Changsha 410007, China
流行性感冒(简称流感)是由流感病毒引起的一种急性呼吸道传染病,已经多次在世界范围内引起暴发和流行,并对人类健康构成巨大的威胁。儿童是流感的高发人群及重症的高危人群[1-3],部分重症病例病情进展快,易出现急性呼吸窘迫综合征和/或多脏器衰竭而死亡,免疫功能异常和基因背景的不同[4]在儿童重症流感发病中起着重要作用,但其具体发病机制迄今尚未完全阐明[3-4]。机体感染病毒时,黏膜相关恒定T细胞(mucosal-associated inva-riant T, MAIT)以不依赖主要组织相容性复合物相关蛋白1(major histocompatibility complex class I-like molecule,MHC class I-related protein 1,MR1)的方式,而通过细胞因子(如interleukin-2、12、15、18等)的激活,释放炎症细胞因子(如interferon-γ、tumor necrosis factor-α和interleukin-17)、趋化因子、溶细胞产物穿孔素和颗粒酶分泌并脱颗粒(CD107a暴露于细胞表面)等杀伤性细胞因子而介导快速免疫应答,促进炎症细胞活化和趋化的同时可调节先天免疫和适应性免疫[5],进而发挥重要的抗病毒生物学效应。研究[6-7]发现MAIT细胞在多种病毒感染中激活并起保护作用,增强病毒载体疫苗的免疫原性[8]。目前有关MAIT细胞在流感发病机制中作用的研究甚少,本研究通过分析流感儿童外周血MAIT细胞的变化,探讨其临床价值。
1 对象与方法 1.1 研究对象收集2023年1—5月就诊于湖南省儿童医院感染科门诊和住院治疗的流感患儿,参照儿童流感诊断与治疗专家共识(2020年版)中的诊断标准[3]进行诊断,并将患儿分为普通型和重症型,结合流行病学史、临床表现和流感抗原阳性(胶体金法),排除合并细菌、支原体或其他病原体的感染,心、肝、肾等器官功能缺陷,血液疾病、恶性肿瘤及自身免疫性疾病等;同时选择该院体检的健康儿童作为健康对照组,甲型、乙型流感病毒抗原阴性,无流感感染,无慢性疾病,近期无感染史等。
1.2 伦理与知情同意所有研究对象均签署知情同意书,同意参加本次研究及标本采集。本研究获得该院伦理委员会批准(伦理批准号:HCHLL-2020-4-0)。
1.3 检测方法留取对照组、普通型和重症型流感组儿童(起病初期)外周血3 mL,加入PBS,吸取稀释后的外周血缓慢加到lymphoprep表面。全血在400 g室温下离心20 min,收集第二层外周血免疫细胞并转入含有PBS的离心管中,离心机800 g室温下离心10 min。离心结束后去上清,再加入10 mL PBS,离心机400 g室温下离心5 min,清洗外周血免疫细胞以彻底去除残留的lymphoprep。根据标准方案使用以下抗体:CD279(PD-1)、CD3、TCRVα7.2、CD69、CD161、CD107α、CD4和穿孔素抗体进行染色,上流式细胞仪(三激光八色流式细胞分析仪,型号:FacsCantoll,产地:美国)进行分析。外周血中MAIT细胞定义为CD3+CD161+TCRVα7.2+细胞。
1.4 统计学方法应用SPSS 23.0软件进行统计学分析。非正态分布的计量资料采用中位数(四分位数)[M(P25,P75)]表示,组间比较采用Kruskal-Wallis检验,以P≤0.05为差异具有统计学意义。
2 结果 2.1 一般临床资料共收集流感患儿44例,其中重症型22例,普通型22例,并选择22例健康儿童作为对照组。普通型流感组中男性12例(54.55%),女性10例(45.45%),年龄2.8~7.0岁;重症型流感组中,男性11例(50.00%),女性11例(50.00%),年龄1.0~8.5岁;对照组中,男性10例(45.45%),女性12例(54.55%),年龄1.0~8.5岁;三组患儿年龄比较,差异无统计学意义(P>0.05)。所有患儿在治疗后均痊愈。
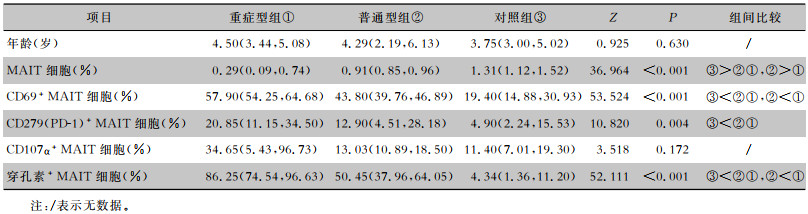
2.2 外周血MAIT细胞、表型及功能的变化与对照组相比,普通型、重症型组流感患儿外周血MAIT细胞比例下降,表达CD69和穿孔素阳性的MAIT细胞比例升高,三组间比较差异均有统计学意义(均P<0.05);三组间CD107α阳性MAIT细胞比例比较,差异无统计学意义(P>0.05);三组间PD-1阳性的MAIT细胞比例比较,差异有统计学意义(P<0.05),但普通型与重症型组间比较,差异无统计学意义(P>0.05)。见表 1。
| 表 1 普通型、重症型流感患儿外周血MAIT细胞、表型及功能的变化 Table 1 Peripheral blood MAIT cells, phenotype, and function changes in children with common and severe influenza |
|
流行性感冒起病急骤,以高热、头痛、全身肌肉酸痛、乏力和轻度呼吸道症状为主要临床表现。流感病毒的反复变异及免疫逃避机制可引起频繁季节性或世界性大流行[9]。病毒的直接炎症损伤和继发的免疫炎症反应可导致机体肺组织损伤,而炎症反应的进一步加重,可导致机体出现急性呼吸窘迫综合征、脑炎等多系统、多脏器的受累及损伤,甚至死亡[2]。因此,对机体抗流感病毒免疫反应的研究,在抗流感新药物的研究和流感流行的防控中至关重要。
MAIT细胞是最丰富的TCRαβ+T细胞,主要分布于外周血、肝、肺和肠道固有层淋巴组织中,其表面可表达激活(CD69、HLA-DR和CD38等)、免疫耗竭(PD-1和CTLA-4等)及归巢标记物等。MAIT细胞占呼吸道黏膜T细胞的10%,以MR1依赖或不依赖MR1方式被激活,在呼吸道感染早期的先天防御中发挥着重要作用[10]。研究[11-14]发现在IL-18的辅助下,流感病毒可在体外以不依赖于MR1的方式诱导MAIT细胞的活化,CD38、CD69、IFN-γ和颗粒酶B表达明显上调;MAIT细胞在H1N1和H3N2感染小鼠肺部积聚并被激活,伴CD25、CD69和颗粒酶B的表达上调;急性甲型流感病毒感染患者中,外周血MAIT细胞频率降低伴颗粒酶B表达增加[11],H7N9感染者外周血MAIT细胞水平随着病情的加重出现进行性下降[12]。本研究亦发现,与对照组相比,普通型和重症型流感患儿外周血MAIT细胞水平逐步下降,伴CD69和穿孔素阳性MAIT细胞比例逐步升高,而CD107α阳性MAIT细胞和体外刺激结果一样变化不显著[12]。由此可见,流行性感冒患儿外周血MAIT细胞减少的同时伴有免疫激活。
MAIT细胞的激活在清除病毒、限制病毒的复制和传播中起着至关重要的作用,然而,过度免疫系统反应可加重机体病理损伤。负调节因子PD-1和PD-L1之间的相互作用传递双向抑制信号,限制下游激活、增殖和细胞因子的产生,与组织保护作用有关,可防止因免疫反应加剧而造成的严重损伤[15]。目前,流行性感冒患儿体内MAIT细胞的免疫活化在体内的功能仍有待确定[16]。本研究发现,普通型流感和重症型流感组中,MAIT细胞高度活化和细胞毒性功能逐步上调的同时,PD1阳性MAIT细胞比例虽有上调,但随着病情的加重,重症型和普通型流感患儿间无明显差异,导致PD-1无法发挥有效的抑制作用,细胞毒性分子分泌水平持续升高,进而可导致严重炎症反应和组织细胞损伤,从而加重流感患儿的病情。因此,MAIT细胞的过度激活(CD69的高表达)可加重流感患儿病情,和文献[17]报道一致,并可能成为流感疾病严重程度的预测因子。
MAIT细胞在病毒感染中有助于疾病严重程度的预测和提高疫苗效力[18],研究[7]发现核黄素可增强MAIT细胞免疫和肠道菌群多样性的潜在作用,进而增强老鼠对流感的抵抗力,并有望应用于人体流感的治疗。临床上怎样平衡MAIT细胞的保护作用和过度免疫反应导致机体的损伤,从而最大限度地发挥MAIT细胞的保护作用有待进一步研究。
综上所述,流感患儿外周血MAIT细胞减少的同时伴有免疫活化,在流行性感冒发病中起着一定作用。本课题由于时间及客观因素,收集到的病例数量有限,且未对流感患儿肺部MAIT细胞情况进行研究,无法全面了解其在流感发病中的作用,且无法获得疾病严重程度判断的具体数值,有待进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Lai XZ, Rong HG, Ma XC, et al. The economic burden of influenza-like illness among children, chronic disease patients, and the elderly in China: a national cross-sectional survey[J]. Int J Environ Res Public Health, 2021, 18(12): 6277. DOI:10.3390/ijerph18126277 |
| [2] |
于芹, 周慧, 张涛, 等. 儿童流行性感冒相关死亡病例临床特点及危险因素分析[J]. 中华儿科杂志, 2020, 58(11): 910-916. Yu Q, Zhou H, Zhang T, et al. Analysis of clinical characte-ristics and risk factors of influenza-related deaths in children[J]. Chinese Journal of Pediatrics, 2020, 58(11): 910-916. |
| [3] |
国家呼吸系统疾病临床医学研究中心, 中华医学会儿科学分会呼吸学组. 儿童流感诊断与治疗专家共识(2020年版)[J]. 中华实用儿科临床杂志, 2020, 35(17): 1281-1288. China National Clinical Research Center for Respiratory Diseases, Group of Respirology, Chinese Pediatric Society, Chinese Medical Association. Expert consensus on diagnosis and treatment of influenza in children (2020 edition)[J]. Chinese Journal of Applied Clinical Pediatrics, 2020, 35(17): 1281-1288. DOI:10.3760/cma.j.cn101070-20200224-00240 |
| [4] |
奏强, 申昆玲. 儿童重症流感发病机制[J]. 中华实用儿科临床杂志, 2019, 34(2): 98-101. Zou Q, Shen KL. Pathogenesis of severe influenza in children[J]. Chinese Journal of Applied Clinical Pediatrics, 2019, 34(2): 98-101. |
| [5] |
Kurioka A, Jahun AS, Hannaway RF, et al. Shared and distinct phenotypes and functions of human CD161++ Vα7.2+ T cell subsets[J]. Front Immunol, 2017, 8: 1031. DOI:10.3389/fimmu.2017.01031 |
| [6] |
Phetsouphanh C, Phalora P, Hackstein CP, et al. Human MAIT cells respond to and suppress HIV-1[J]. Elife, 2021, 10: e50324. DOI:10.7554/eLife.50324 |
| [7] |
Li Y, Shi CW, Zhang YT, et al. Riboflavin attenuates influenza virus through cytokine-mediated effects on the diversity of the gut microbiota in MAIT cell deficiency mice[J]. Front Microbiol, 2022, 13: 916580. DOI:10.3389/fmicb.2022.916580 |
| [8] |
Provine NM, Amini A, Garner LC, et al. MAIT cell activation augments adenovirus vector vaccine immunogenicity[J]. Science, 2021, 371(6528): 521-526. DOI:10.1126/science.aax8819 |
| [9] |
黄梦婷, 张森, 李靖, 等. 流感病毒免疫逃逸机制研究进展[J]. 中华实验和临床病毒学杂志, 2020, 34(6): 671-676. Huang MT, Zhang S, Li J, et al. Progress in research on immune escape mechanisms of influenza virus[J]. Chinese Journal of Experimental and Clinical Virology, 2020, 34(6): 671-676. DOI:10.3760/cma.j.cn112866-20191223-00204 |
| [10] |
Long YQ, Hinks TSC. MAIT cells in respiratory viral infections in mouse and human[J]. Crit Rev Immunol, 2021, 41(5): 19-35. DOI:10.1615/CritRevImmunol.2021040877 |
| [11] |
Van Wilgenburg B, Scherwitzl I, Hutchinson EC, et al. MAIT cells are activated during human viral infections[J]. Nat Commun, 2016, 7: 11653. DOI:10.1038/ncomms11653 |
| [12] |
Loh L, Wang ZF, Sant S, et al. Human mucosal-associated invariant T cells contribute to antiviral influenza immunity via IL-18-dependent activation[J]. Proc Natl Acad Sci U S A, 2016, 113(36): 10133-10138. DOI:10.1073/pnas.1610750113 |
| [13] |
Luukkainen A, Puan KJ, Yusof N, et al. A co-culture model of PBMC and stem cell derived human nasal epithelium reveals rapid activation of NK and innate T cells upon influenza a virus infection of the nasal epithelium[J]. Front Immunol, 2018, 9: 2514. DOI:10.3389/fimmu.2018.02514 |
| [14] |
Loh L, Koutsakos M, Kedzierska K, et al. Influenza a virus-infected lung epithelial cell co-culture with human peripheral blood mononuclear cells[J]. Methods Mol Biol, 2020, 2098: 141-147. |
| [15] |
Yong YK, Saeidi A, Tan HY, et al. Hyper-expression of PD-1 is associated with the levels of exhausted and dysfunctional phenotypes of circulating CD161++ TCR iVα7.2+ mucosal-associated invariant T cells in chronic hepatitis B virus infection[J]. Front Immunol, 2018, 9: 472. DOI:10.3389/fimmu.2018.00472 |
| [16] |
van Wilgenburg B, Loh L, Chen ZJ, et al. MAIT cells contribute to protection against lethal influenza infection in vivo[J]. Nat Commun, 2018, 9(1): 4706. DOI:10.1038/s41467-018-07207-9 |
| [17] |
Youngs J, Provine NM, Lim N, et al. Identification of immune correlates of fatal outcomes in critically ill COVID -19 patients[J]. PLoS Pathog, 2021, 17(9): e1009804. DOI:10.1371/journal.ppat.1009804 |
| [18] |
Rashu R, Ninkov M, Wardell CM, et al. Targeting the MR1-MAIT cell axis improves vaccine efficacy and affords protection against viral pathogens[J]. PLoS Pathog, 2023, 19(6): e1011485. DOI:10.1371/journal.ppat.1011485 |



