2. 吐鲁番市人民医院重症二区, 新疆维吾尔自治区 吐鲁番 838000;
3. 吐鲁番市人民医院急诊科, 新疆维吾尔自治区 吐鲁番 838000;
4. 中南大学湘雅医院急诊科, 湖南 长沙 410008
2. Department of General Intensive Care Unit Ⅱ, The People's Hospital of Turpan, Xinjiang Uygur Autonomous Region, Turpan 838000, China;
3. Department of Emergency, The People's Hospital of Turpan, Xinjiang Uygur Autonomous Region, Turpan 838000, China;
4. Department of Emergency, Xiangya Hospital, Central South University, Changsha 410008, China
脓毒症是宿主对感染反应失调导致的危及生命的器官功能障碍,是重症监护病房(ICU)常见的临床综合征及死亡的主要原因之一[1]。肠道处于脓毒症发生发展的中心环节,也被认为是多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)的“始动器官”[2]。多重应激可引起肠道黏膜屏障损伤,引起肠道微生态失衡,上皮通透性增加,细菌和内毒素移位,导致MODS,甚至死亡[3-4]。肠功能障碍是导致脓毒症疾病快速发展、住院日数延长、病死率升高的重要原因,也是影响其预后的独立危险因素[5]。保护肠道功能是减少脓毒症并发症,降低病死率的重要手段,是临床急危重症领域的研究重点。
虾青素是从藻类、酵母、鱼虾等海产品中发现和提取的类胡萝卜素含氧衍生物,具有抗炎、抗氧化、抗肿瘤、降血脂、调控机体免疫等药理效应[6-8]。虾青素在自然界中广泛存在,来源丰富,安全无毒,美国食品药物监督管理局及欧盟委员会相继批准其作为饲料、食品及化妆品的添加剂[6-8]。近年来,研究[9-11]表明虾青素可缓解小鼠炎症性肠病及溃疡性结肠炎,改善机制可能与抑制炎症,调控巨噬细胞极化,保护黏膜屏障及维持微生物稳态有关;虾青素也可通过抗炎、抗氧化减轻缺血再灌注所致的大鼠肠道损伤[12];但有关虾青素能否保护脓毒症肠道损伤鲜有报道。核因子kappa B (nuclear factor kappa B, NF-κB)是经典炎症信号通路,其活化后可促进多种炎症因子释放,介导炎症反应的发生[13]。过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)属于Ⅱ型核激素受体超家族成员,为配体活化型的核转录因子,可负调控NF-κB通路而发挥抑炎效应[14-15]。研究[16-17]表明,虾青素对NF-κB信号通路及PPARγ信号通路均具有调控作用。但脓毒症时,虾青素是否影响PPARγ/NF-κB信号通路,目前未见报道。本研究拟采用盲肠结扎穿刺(cecum ligation and puncture, CLP)构建小鼠脓毒症模型,检测小鼠肠道组织形态学、肠道功能损伤指标、肠组织氧化应激指标及炎症因子表达的变化,旨在了解虾青素对脓毒症小鼠肠道损伤的作用,并围绕PPARγ/NF-κB信号通路初步探讨其可能机制,为拓展虾青素的药理学作用及防治脓毒症肠道损伤提供理论依据。
1 材料与方法 1.1 主要试剂虾青素(美国Sigma公司),吸入用七氟烷(上海恒瑞医药有限公司),TNF-α、IL-6、IL-1β、肠型脂肪酸结合蛋白(intestinal fatty acid binding protein, I-FABP)酶联免疫吸附测定(ELISA)试剂盒(武汉博士德公司),血清D-乳酸试剂盒(美国BioVision公司),二胺氧化酶(diamine oxidase, DAO)检测试剂盒(北京索莱宝公司),超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)试剂盒(南京建成生物公司),荧光异硫氰酸盐葡聚糖(FD-40,美国Sigma公司),抗PPARγ抗体、p65抗体、p-p65抗体、IKBα抗体、p-IKBα抗体、β-actin抗体(美国CST公司),实验室常规试剂(无锡耐思生物公司)。
1.2 试验动物与分组无特定病原体(specific pathogen free, SPF)级雄性Balb/c小鼠62只,7周龄,饲养于中南大学实验动物学部,预适应1周,饲养条件为:温度23~25℃,湿度50%~60%,昼夜节律。依据试验动物的“3Rs”原则—Reduction(减少)、Replacement(替代)、Refinement(优化),及考虑到前期大量动物试验及文献均提示CLP实施假手术后几乎无死亡发生,最终确定试验分组及样本量如下:假手术+溶剂对照组(Sham+Vehi组,n=11)、假手术+虾青素组(Sham+Asta组,n=11)、脓毒症模型+溶剂对照组(CLP+Vehi组,n=20)、脓毒症模型+虾青素组(CLP+Asta组,n=20)。采用随机数字法将62只雄性Balb/c小鼠分为四组,简要操作如下。①编号:将小鼠从1~62编号。②获取随机数字:从随机数字表中任意一个数开始,沿同一方向顺序获取62个随机数。③求余数:随机数除以组数(4)求余数。④分组:按余数分组,若余数为1归Sham+Vehi组,余数为2归Sham+Asta组,余数为3归CLP+Vehi组,除尽则归CLP+Asta组;若随机数目小于除数4,则按随机数目归组。⑤调整:初次分组后各组动物数目不等,且本研究需要把假手术组多余小鼠调往手术组。继续按顺序取一个随机数字(若随机数为0,则后推一个随机数),除数变为假手术组动物数(假设为a),得到的余数b作为假手术组被抽的动物序号(若整除则认为序号为a),即将假手术组第b号动物调到手术组,直到调到各组数目符合要求为止。
本研究经过该院伦理委员会审批,对试验动物的所有处置均符合国家及本单位《实验动物管理办法》。
1.3 造模、给药及标本采集采用CLP模型制作方法:小鼠术前8 h禁饮禁食;采用七氟烷吸入麻醉,腹部正中作一长约0.8 cm的切口,游离肠系膜和盲肠,在距盲肠盲端1.5 cm处结扎,20号针头对穿2次,确保穿孔通畅后缝合伤口。Sham组不做盲肠结扎穿孔,余操作同CLP术。虾青素溶于食用橄榄油中(40 mg/mL),术前连续7 d 100 mg/(kg·d)灌胃;溶剂采用等量食用橄榄油灌胃(2.5 mL/kg)。选取的虾青素处理剂量依据前期研究[18]确定。假手术组随机选5只小鼠,模型组随机选取12只小鼠,观察术后7天生存情况。剩余小鼠于术后18 h采用FD-40灌胃,24 h麻醉后心脏采血留取血清冻存于-80℃低温冰箱;断颈处死小鼠留取小肠组织用于组织形态学及相关指标检测。
1.4 观察指标检测 1.4.1 小鼠7天生存率假手术组随机选取5只小鼠、模型组随机选取12只小鼠,每6 h观察一次,观察术后7天生存情况,计算各组生存率,并绘制生存曲线。
1.4.2 肠道形态学检测依据文献[18]常规制作小肠组织石蜡切片及镜下观察。采用Chiu’s的6级评分法评价肠道组织形态学损伤,评分标准见表 1。
| 表 1 Chiu’s肠黏膜损伤评分法 Table 1 Chiu's scoring for intestinal mucosal injury |
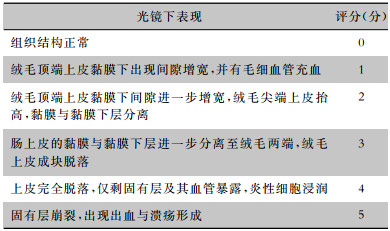
|
基于D-乳酸脱氢酶可特异性氧化D-乳酸产生有色氧化产物这一原理,采用酶偶联紫外分光光度法检测D-乳酸水平,操作按说明书进行,酶标仪于450 nm处测定吸光度,标准曲线法计算D-乳酸浓度。
1.4.4 血清DAO活性检测采用多胺氧化比色法测定血清DAO活性,操作按说明书进行,可见分光光度计于500 nm处测定吸光度,标准曲线法计算DAO活性。
1.4.5 肠道SOD活性及MDA含量检测采用黄嘌呤氧化法及硫代巴比妥酸比色法分别检测肠道组织SOD活性与MDA含量。取低温保存的小肠组织,冰浴碾磨制成组织匀浆,离心取上清液,按说明书所述步骤进行操作,可见分光光度计/BioRad550酶标仪测定吸光度,计算SOD活性及MDA含量。
1.4.6 肠道黏膜通透性的检测小鼠术后18 h予750 mg/kg FD-40灌胃,灌胃6 h后心脏采血,分离血清,荧光分光光度仪测定吸光度(激发光490 nm、发射光520 nm),标准曲线法计算血FD-40浓度。
1.4.7 小肠组织TNF-α、IL-1β、IL-6及I-FABP的检测采用ELISA法检测TNF-α、IL-1β、IL-6及I-FABP的水平,具体操作按说明书所述步骤进行,酶标仪测定吸光度,标准曲线法计算出上述因子浓度。
1.4.8 PPARγ/NF-κB信号通路相关蛋白表达采用Western blotting检测相关蛋白表达。蛋白裂解液RIPA(0.1 mg/mL)匀浆裂解小肠组织,提取蛋白并定量。经10% SDS-PAGE电泳分离、转膜和非特异性封闭后,加入特异性一抗4℃孵育过夜,加入二抗孵育1 h,漂洗,显色并扫描,计算相对灰度。
1.5 统计学处理数据采用均数±标准差(x±s)表示,应用Graph Prism 5进行数据分析及作图,采用Kaplan-Meier法进行多组生存率比较。组间分析采用单因素方差分析(one-way ANOVA)。方差齐性时采用LSD-t法两两比较;方差不齐时采用Dunnett T3检验。P≤0.05为差异有统计学意义。
2 结果 2.1 虾青素对脓毒症小鼠7天生存率的影响观察小鼠CLP术后7天生存情况发现,Sham+Vehi组及Sham+Asta组小鼠7天生存率均为100%;CLP+Vehi组7天生存率为25.00%;CLP+Asta组7天生存率为66.67%。与Sham+Vehi组比较,CLP+Vehi组小鼠7天生存率明显降低(P<0.01);与Sham+Asta组比较,CLP+Asta组小鼠7天生存率明显降低(P<0.05);与CLP+Vehi组相比,CLP+Asta组小鼠7天生存率明显升高(P<0.05)。见图 1。说明脓毒症模型复制成功,且虾青素可改善脓毒症小鼠7天生存率。
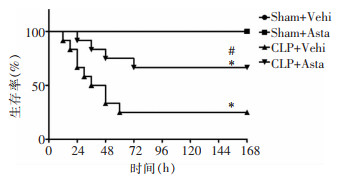 |
| 注:*表示与Sham+Vehi组或Sham+Asta组比较,P<0.01;#表示与CLP+Vehi组比较,P<0.05。 图 1 虾青素对脓毒症小鼠7天生存率的影响 Figure 1 Effect of astaxanthin on 7-day survival rate of septic mice |
CLP术后24 h,对小鼠血清I-FABP水平、血DAO活性、血D-乳酸及FD-40进行检测,结果显示:Sham+Vehi组与Sham+Asta组小鼠血清DAO活性及I-FABP、D-乳酸、FD-40水平比较,差异均无统计学意义(均P>0.05);与Sham+Vehi组比较,CLP+Vehi组小鼠血清DAO活性及I-FABP、D-乳酸、FD-40水平均明显升高(均P<0.01);与CLP+Vehi组相比,CLP+Asta组小鼠血清DAO活性及I-FABP、D-乳酸、FD-40水平均出现不同程度的降低,且差异均有统计学意义(均P<0.01)。见图 2。说明脓毒症小鼠CLP术后24 h即出现了明显的肠道损伤,而虾青素可有效改善脓毒症小鼠肠道功能。
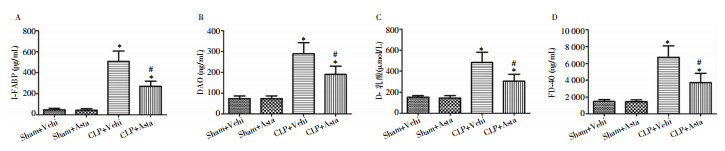 |
| 注:A为血清I-FABP水平;B为血清DAO活性;C为血清D-乳酸水平;D为血清FD-40水平。*表示与Sham+Vehi组或Sham+Asta组比较,P<0.01;#表示与CLP+Vehi组比较,P<0.01。 图 2 虾青素对脓毒症小鼠肠道损伤的影响 Figure 2 Effect of astaxanthin on intestinal injury of septic mice |
CLP术后24 h,对小鼠小肠组织炎症因子TNF-α、IL-1β及IL-6进行检测,结果显示:Sham+Vehi组及Sham+Asta组小鼠小肠组织TNF-α、IL-1β及IL-6均处于基线低水平,且两组比较差异均无统计学意义(均P>0.05,);与Sham+Vehi组比较,CLP+Vehi组小鼠小肠组织TNF-α、IL-1β及IL-6水平均升高(均P<0.01);与CLP+Vehi组相比,CLP+Asta组小鼠小肠组织各炎症因子均下降(均P<0.01)。见表 2。说明脓毒症小鼠CLP术后24 h肠道组织已发生明显炎症反应,而虾青素可有效抑制肠道局部炎症。
| 表 2 虾青素对脓毒症小鼠肠道组织TNF-α、IL-1β及IL-6水平的影响(x±s) Table 2 Effect of astaxanthin on the levels of TNF-α, IL-1β and IL-6 in intestinal tissue of septic mice (x±s) |
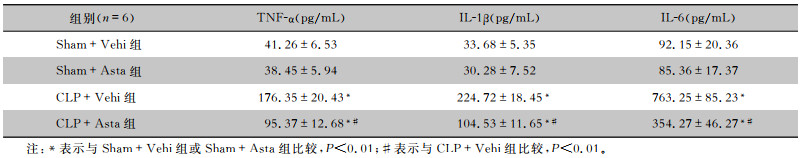
|
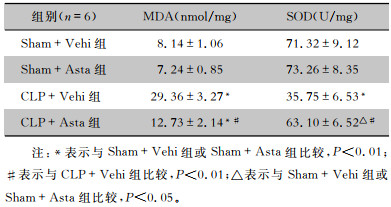
CLP术后24 h,对小鼠小肠组织MDA含量及SOD活性进行检测,结果显示:Sham+Vehi组与Sham+Asta组小鼠小肠组织MDA含量及SOD活性比较,差异均无统计学意义(均P>0.05);与Sham+Vehi组比较,CLP+Vehi组小鼠小肠组织MDA含量明显升高(P<0.01),SOD活性却明显下降(P<0.01);与CLP+Vehi组相比,CLP+Asta组小鼠小肠组织MDA含量明显下降(P<0.01),而SOD活性明显上升(P<0.05)。见表 3。说明虾青素能有效抑制脓毒症小鼠肠道氧化应激反应。
| 表 3 虾青素对脓毒症小鼠肠道组织MDA含量及SOD活性的影响(x±s) Table 3 Effect of astaxanthin on MDA content and SOD activity in intestinal tissue of septic mice (x±s) |
|
CLP术后24 h,观察各组小鼠小肠组织损伤情况并进行Chiu’s损伤评分,结果显示:Sham+Vehi组及Sham+Asta组小鼠小肠组织光镜下结构未见异常,肠绒毛结构正常,未见明显组织水肿;两组Chiu’s评分比较差异无统计学意义(P>0.05)。与Sham+Vehi组比较,CLP+Vehi组小鼠小肠组织出现了明显形态学损伤,表现为肠壁变薄,黏膜明显萎缩甚至断裂、脱落,部分区域出现绒毛断裂缺失,大量炎性细胞浸润;Chiu’s评分上升(P<0.01)。见图 3。与CLP+Vehi组相比,CLP+Asta组小鼠小肠组织损伤相对较轻,肠黏膜、绒毛病变及炎性细胞浸润均相对轻微;Chiu’s评分明显下降(P<0.01)。
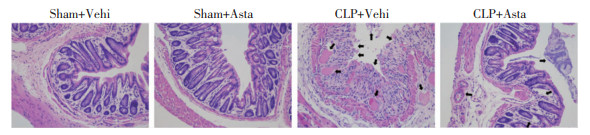 |
| 图 3 虾青素对脓毒症小鼠肠道组织形态学的影响(HE-染色,200×) Figure 3 Effect of astaxanthin on the morphology of intestinal tissue in septic mice (HE staining, 200×) |
采用Western blotting检测小鼠肠道PPARγ/NF-κB信号通路相关蛋白的表达,包括PPARγ、p65、p-p65、IKBα、p-IKBα,结果显示:与Sham+Vehi组比较,Sham+Asta组、CLP+Vehi组及CLP+Asta组小鼠小肠组织PPARγ表达均增加(均P<0.05);与CLP+Vehi组相比,CLP+Asta组小鼠小肠组织PPARγ表达进一步增加(P<0.05)。Sham+Vehi与Sham+Asta组小鼠小肠组织p65、p-p65、IκBα、p-IκBα表达比较,差异均无统计学意义(均P>0.05);与Sham+Vehi组比较,CLP+Vehi组小鼠小肠组织p65及IκBα表达差异均无统计学意义(均P>0.05),p-p65、p-IκBα表达及p-IκBα/IκBα及p-p65/p65比值却均上升(均P<0.05);与CLP+Vehi组相比,CLP+Asta组小鼠小肠组织p65及IKBα表达差异亦均无统计学意义(均P>0.05),p-p65、p-IKBα表达及p-IκBα/IκBα、p-p65/p65比值却均下降(均P<0.05)。见图 4。说明虾青素可能通过促进脓毒症小鼠肠道PPARγ信号、抑制NF-κB信号通路发挥保护作用。
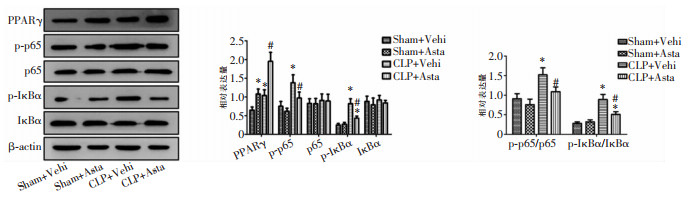 |
| 注:*表示与Sham+Vehi组或Sham+Asta组比较,P<0.05;#表示与CLP+Vehi组比较,P<0.05。 图 4 虾青素对脓毒症小鼠小肠组织PPARγ/NF-κB信号通路的影响 Figure 4 Effect of astaxanthin on PPARγ/NF-κB signaling pathway of intestinal tissue in septic mice |
脓毒症是临床常见复杂综合征,病情进展快,病死率高。脓毒症时,肠道既是受累的主要器官,也是导致MODS的始动器官[2]。脓毒症可引起全身炎症免疫紊乱,释放的炎症介质反过来也影响肠道免疫功能,可导致肠道上皮细胞凋亡增加、黏液产生减少、上皮细胞通透性增加;肠道菌群失调,潜在致病微生物增多和致病力增强;肠道产生的脂类及蛋白类损伤因子增多;这些致病介质均可通过肠系膜淋巴结-胸导管-下腔静脉途径进入循环系统,诱发或加重全身炎症反应及器官功能障碍,导致病情恶化[5]。本研究采用经典动物模型CLP构建脓毒症小鼠模型。结果发现,CLP小鼠7天病死率高达70%;且CLP术后24 h,肠道组织即发生了明显的病理学改变,包括肠壁变薄、绒毛损伤或脱落、黏膜与黏膜下层分离、出血,以及炎性细胞浸润等;肠黏膜受损致屏障功能障碍,通透性增加,反映肠道功能/损伤的指标血清DAO活性及I-FABP、D-乳酸、FD-40水平均较假手术组明显上升。同时肠道组织中TNF-α、IL-1β及IL-6水平增加,MDA含量上升,SOD活性下降,表明肠道局部炎症及氧化应激反应明显。说明脓毒症所致肠道损伤模型制备成功。虾青素可有效提升CLP小鼠7天生存率,明显降低血清DAO活性及I-FABP、D-乳酸、FD-40水平,减轻CLP小鼠肠道组织病理损伤。
炎症和氧化应激在脓毒症肠道损伤过程中起重要作用。脂多糖(lipoplysacharide, LPS)可激发各种炎症介质,如TNF-α、IL-1β和IL-6的级联反应,引起肠道上皮细胞损伤、凋亡甚至坏死,肠道黏膜通透性增高、屏障破坏,导致细菌移位,引起远隔器官损伤[19]。各种危重症情况下,机体为维持重要脏器,如心、脑、肺的血供可出现选择性内脏血管痉挛,肠道缺血缺氧,肠道上皮细胞及免疫细胞水肿、凋亡或坏死,导致肠黏膜机械屏障及免疫屏障功能均明显受损[20]。而且肠道黏膜内表达丰富的黄嘌呤氧化酶,在缺血缺氧时可催化产生大量氧自由基,引发膜脂质过氧化反应,加重肠黏膜功能损伤[20-21]。天然虾青素为共轭双键长,且其两侧的紫罗酮环上均有羟基和不饱和酮基侧链,可向自由基提供电子或吸引自由基的未配对电子[22]。因为其独特的化学结构,虾青素有超群的抗氧化活性,其抗氧化活性分别是β类胡萝卜素和维生素E的10、550倍[22]。本研究也发现虾青素可明显降低小肠组织早期炎症因子包括TNF-α、IL-1β和IL-6的水平,降低MDA水平,上调SOD活性,表明其可抑制脓毒症小鼠肠道组织局部炎症反应及氧化应激,与既往报道[6-8]的虾青素抗炎抗氧化药理学效应相符。
NF-κB信号通路,是调控细胞炎症和免疫反应的重要转导通路,也是对氧化应激最敏感的胞内信号转导通路之一,是调控转录众多炎症介质的共同通路[13]。NF-κB抑制子(inhibitor of NF-κB, IκB)是NF-κB最重要的抑制蛋白。静息状态时,胞质中NF-κB与IκB结合,呈失活状态;当受到氧化应激等因素刺激时,IκB磷酸化,与NF-κB解离并降解,NF-κB活化,从胞质移位到胞核内,与相应炎症相关基因启动子区结合,促进炎症因子转录表达[13]。活化的PPARγ可通过抑制NF-κB的激活及转录活性,从而抑制炎症反应,PPARγ/NF-κB通路可作为调控肠道炎症/氧化应激的重要靶点[23-24]。本研究发现虾青素干预可使假手术组小鼠肠道组织中PPARγ表达增强,也发现与假手术组相比CLP小鼠肠道组织中PPARγ表达增强,p-IκBα和p-p65蛋白表达明显上调,p-IκBα/IκBα及p-p65/p65比值明显增加,表明脓毒症小鼠肠道组织PPARγ信号通路激活,同时NF-κB信号通路过度活化;而虾青素干预组脓毒症小鼠肠道组织PPARγ表达进一步增强,同时伴p-IκBα和p-p65蛋白表达下降,p-IκBα/IκBα及p-p65/p65比值降低,表明虾青素可逆转脓毒症所致的PPARγ信号通路受抑现象,上调PPARγ并发挥对NF-κB信号的抑制作用。
综上所述,本研究首次表明虾青素可保护脓毒症小鼠肠道损伤,其机制可能与其调控PPARγ/NF-κB信号通路,抑制炎症及氧化应激有关,为虾青素防治脓毒症肠道损伤提供了理论依据。但本研究仍存在以下局限:仅采用单一治疗剂量及预防性灌胃给药方式,对于最佳剂量、给药时间及给药方式仍需进一步研究;虽研究结果显示虾青素影响脓毒症PPARγ/NF-κB信号通路,对肠道损伤发挥抗炎、抗氧化效应,但其中的具体靶点及机制仍需探究。此外,尚需开展相关临床试验,以期为脓毒症肠道损伤防治及虾青素的临床应用提供更为可靠的理论依据。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Angus DC, van der Poll T. Severe sepsis and septic shock[J]. N Engl J Med, 2013, 369(9): 840-851. DOI:10.1056/NEJMra1208623 |
| [2] |
Clark JA, Coopersmith CM. Intestinal crosstalk: a new paradigm for understanding the gut as the "motor" of critical illness[J]. Shock, 2007, 28(4): 384-393. DOI:10.1097/shk.0b013e31805569df |
| [3] |
Tang AL, Shen MJ, Zhang GQ. Intestinal microcirculation dysfunction in sepsis: pathophysiology, clinical monitoring, and therapeutic interventions[J]. World J Emerg Med, 2022, 13(5): 343-348. |
| [4] |
Haak BW, Wiersinga WJ. The role of the gut microbiota in sepsis[J]. Lancet Gastroenterol Hepatol, 2017, 2(2): 135-143. DOI:10.1016/S2468-1253(16)30119-4 |
| [5] |
Deitch EA, Xu DZ, Kaise VL. Role of the gut in the development of injury- and shock-induced SIRS and MODS: the gut-lymph hypothesis, a review[J]. Front Biosci, 2006, 11: 520-528. DOI:10.2741/1816 |
| [6] |
Hussein G, Sankawa U, Goto H, et al. Astaxanthin, a carote-noid with potential in human health and nutrition[J]. J Nat Prod, 2006, 69(3): 443-449. DOI:10.1021/np050354+ |
| [7] |
Pashkow FJ, Watumull DG, Campbell CL. Astaxanthin: a novel potential treatment for oxidative stress and inflammation in cardiovascular disease[J]. Am J Cardiol, 2008, 101(10A): 58D-68D. |
| [8] |
Guerin M, Huntley ME, Olaizola M. Haematococcus astaxanthin: applications for human health and nutrition[J]. Trends Biotechnol, 2003, 21(5): 210-216. DOI:10.1016/S0167-7799(03)00078-7 |
| [9] |
Sakai S, Nishida A, Ohno M, et al. Astaxanthin, a xanthophyll carotenoid, prevents development of dextran sulphate sodium-induced murine colitis[J]. J Clin Biochem Nutr, 2019, 64(1): 66-72. DOI:10.3164/jcbn.18-47 |
| [10] |
Zhang XD, Zhao X, Tie SS, et al. A smart cauliflower-like carrier for astaxanthin delivery to relieve colon inflammation[J]. J Control Release, 2022, 342: 372-387. DOI:10.1016/j.jconrel.2022.01.014 |
| [11] |
Zhang XM, Su WT, Chen YN, et al. Bi-functional astaxanthin macromolecular nanocarriers to alleviate dextran sodium sulfate-induced inflammatory bowel disease[J]. Int J Biol Macromol, 2024, 256(Pt 2): 128494. |
| [12] |
Yilmaz AS, Badak B, Erkasap N, et al. The effect of antioxidant astaxanthin on intestinal ischemia reperfusion damage in rats[J]. J Invest Surg, 2023, 36(1): 2182930. DOI:10.1080/08941939.2023.2182930 |
| [13] |
Li QT, Verma IM. NF-kappaB regulation in the immune system[J]. Nat Rev Immunol, 2002, 2(10): 725-734. DOI:10.1038/nri910 |
| [14] |
Reddy AT, Lakshmi SP, Reddy RC. PPAR γ in bacterial infections: a friend or foe?[J]. PPAR Res, 2016, 2016: 7963540. |
| [15] |
Wahli W. A gut feeling of the PXR, PPAR and NF-kappaB connection[J]. J Intern Med, 2008, 263(6): 613-619. DOI:10.1111/j.1365-2796.2008.01951.x |
| [16] |
Davinelli S, Saso L, D'Angeli F, et al. Astaxanthin as a modu-lator of Nrf2, NF-κB, and their crosstalk: molecular mechanisms and possible clinical applications[J]. Molecules, 2022, 27(2): 502. DOI:10.3390/molecules27020502 |
| [17] |
Choi CI. Astaxanthin as a peroxisome proliferator-activated receptor (PPAR) modulator: its therapeutic implications[J]. Mar Drugs, 2019, 17(4): 242. DOI:10.3390/md17040242 |
| [18] |
Zhou LP, Gao M, Xiao ZM, et al. Protective effect of astaxa-nthin against multiple organ injury in a rat model of sepsis[J]. J Surg Res, 2015, 195(2): 559-567. DOI:10.1016/j.jss.2015.02.026 |
| [19] |
Izadparast F, Riahi-Zajani B, Yarmohammadi F, et al. Protective effect of berberine against LPS-induced injury in the intestine: a review[J]. Cell Cycle, 2022, 21(22): 2365-2378. DOI:10.1080/15384101.2022.2100682 |
| [20] |
Li GY, Wang S, Fan Z. Oxidative stress in intestinal ischemia-reperfusion[J]. Front Med (Lausanne), 2022, 8: 750731. |
| [21] |
Circu ML, Aw TY. Intestinal redox biology and oxidative stress[J]. Semin Cell Dev Biol, 2012, 23(7): 729-737. DOI:10.1016/j.semcdb.2012.03.014 |
| [22] |
Goto S, Kogure K, Abe K, et al. Efficient radical trapping at the surface and inside the phospholipid membrane is responsible for highly potent antiperoxidative activity of the carotenoid astaxanthin[J]. Biochim Biophys Acta, 2001, 1512(2): 251-258. DOI:10.1016/S0005-2736(01)00326-1 |
| [23] |
Dammann K, Khare V, Lang M, et al. PAK1 modulates a PPARγ/NF-κB cascade in intestinal inflammation[J]. Biochim Biophys Acta, 2015, 1853(10 Pt A): 2349-2360. |
| [24] |
Liu CL, Ding RW, Huang WJ, et al. Sevoflurane protects against intestinal ischemia-reperfusion injury by activating pero-xisome proliferator-activated receptor gamma/nuclear factor-κB pathway in rats[J]. Pharmacology, 2020, 105(3-4): 231-242. DOI:10.1159/000503727 |



