2. 伊犁州友谊医院重症医学一科, 新疆 伊犁哈萨克自治州 835000;
3. 广东省中国人民解放军南部战区总医院重症医学科, 广东 广州 440104
2. Department of Critical Care MedicineⅠ, Yili Friendship Hospital, Ili Kazak Autonomous Prefecture 835000, China;
3. Department of Critical Care Medicine, Southern Theater Command General Hospital of PLA, Guangzhou 440104, China
急性肾损伤(acute kidney injury, AKI)是脓毒症严重的并发症之一,脓毒症患者发生AKI的概率约20%,当脓毒症患者发生休克时合并AKI的概率高达51%,死亡风险也会继之加大[1-2]。铁死亡是一种依赖铁和活性氧(reactive oxygen species, ROS)的新型程序性细胞死亡形式[3]。在脓毒症相关AKI中,脂多糖(lipopolysaccharide, LPS)诱导的AKI会引起铁代谢紊乱、ROS和脂质过氧化物的增多[4-5]。Kim等[6]研究发现,在肾小管上皮细胞损伤中发生铁死亡,溶质载体家族7成员11(solute carrier family 7 member 11, SLC7A11)和谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)显著降低,抑制铁死亡可有效减轻肾损伤。因此,铁死亡可能参与调控AKI后肾小管上皮细胞(human kidney-2, HK-2细胞)死亡,在脓毒症所致的AKI中扮演着重要的角色。
穿心莲内酯(andrographolide, AG)是一种天然的二萜内酯类化合物,其在抗炎、抗氧化、抗癌、免疫调节等方面发挥着重要作用[7]。在对脓毒症小鼠的研究中,AG可通过调节多个信号通路减轻炎症反应及肝肺损伤,提高实验性脓毒症小鼠的存活率[8]。Liu等[9]研究发现,AG还可以减少肾小管上皮细胞的凋亡和纤维化,对肾小管上皮细胞起一定的保护作用。然而,AG对脓毒症所致AKI的保护作用,是否与铁死亡机制有一定的联系,目前国内外仍未有相关研究。因此,本研究采用LPS诱导的HK-2细胞脓毒症损伤模型,探讨AG抑制铁死亡的有效性以及可能的作用机制。
1 材料与方法 1.1 试验材料 1.1.1 细胞与试剂HK-2细胞(武汉普诺赛生命科技有限公司,批号:CL-0109);AG(美国Sigma公司,批号:365645);LPS(北京索莱宝科技有限公司,批号:L8880);丙二醛(malondialdehyde, MDA)试剂盒、还原型谷胱甘肽(glutathione, GSH)试剂盒(北京索莱宝科技有限公司,货号分别为BC0025、BC1175);中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin, NGAL)、肾损伤分子-1(kidney injury molecule-1, KIM-1)ELISA检测试剂盒(杭州联科生物技术股份有限公司,批号分别为EK1116、EK1118);CCK-8细胞活力检测试剂盒(上海东仁化学科技有限公司,批号:CK04);胎牛血清(美国Gibcog公司,批号:C0232);DMEM培养基(美国Gibcog公司,批号:8122691);胰蛋白酶-EDTA消化液(北京索莱宝科技有限公司,批号:T1320);二甲亚砜(dimethyl sulfoxide, DMSO,北京索莱宝科技有限公司,货号:D8370);DHE染色试剂盒(苏州宇恒生物技术公司,批号:D1008);SLC7A11、GPX4、Ferritin抗体(上海Abmart医药科技有限公司,批号分别为T57046、T56959、T55648);辣根过氧化物酶标记山羊抗兔二抗、辣根过氧化物酶标记山羊抗鼠二抗、β-actin单克隆抗体(北京中山金桥生物科技有限公司,批号分别为TA130003、TA328071)。
1.1.2 试验仪器二氧化碳培养箱(美国Thermo公司);光学显微镜(日本HIRAYAMA公司);双稳定时电泳仪电源(北京六一科技有限公司);四版转印/转膜电泳槽(北京六一科技有限公司);紫外分光光度计(美国Thermo公司);凝胶成像仪(上海天能公司)。
1.2 试验方法 1.2.1 细胞培养与分组HK-2细胞采用含有10%胎牛血清、1%青链霉素双抗的DMEM培养基在含5%CO2、37℃恒温培养箱中培养。细胞70%~80%融合时,按照1∶4比例转移细胞至新的培养瓶培养,换液频率为每周2~3次。将细胞分为4组,对照组(Control)、LPS组(用10 μg/mL LPS处理22 h构建脓毒症细胞模型[10])、LPS+DMSO组(DMSO作为AG的溶液,排除DMSO对细胞的影响)、AG组(10 μmol/L AG预处理细胞1 h)。
1.2.2 CCK-8检测细胞的活性将各组细胞以每孔3×104个细胞的密度接种96孔板,贴壁后每孔中加入10 μL CCK-8溶液,培养箱继续孵育2 h后,酶标仪分析450 nm处各孔光密度(OD)值。
1.2.3 NGAL和KIM-1的测定收集各组HK-2细胞中的上清液,采用酶联免疫吸附测定(ELISA)法检测肾损伤标志物NGAL和KIM-1的水平。将100 μL标准品或样品一式三份加入到微孔板中,再加入50 μL稀释的检测抗体,在室温下孵育2 h。随后,加入100 μL稀释后的链霉亲和素HRP,孵育45 min。再加入100 μL底物溶液,20 min,避光。最后,使用微孔板读取器在450、630 nm处读取吸光度。
1.2.4 MDA、GSH的测定收集各组细胞至离心管内,弃去细胞培养液,加入提取液超声破碎细胞,离心收集上清液后置于冰上。按照MDA含量、GSH活性检测试剂盒步骤测定各组HK-2细胞中MDA含量及GSH活性。
1.2.5 ROS测定使用二氢乙锭(dihydroethidium, DHE)作为探针评估细胞ROS水平。将HK-2细胞接种于6孔板中,与6 μmol DHE孵育30 min,然后用2 mL磷酸盐缓冲液洗涤3次。用荧光显微镜拍摄细胞的所有荧光图像,所有图像拍摄倍数×200。
1.2.6 Western blot用含1 mmol/L苯甲基磺酰氟的冰冷RIPA裂解缓冲液提取蛋白后进行配平,100℃煮沸10 min,分装放-80℃冰箱中保存备用。配制分离胶和浓缩胶后,在每孔中加入10 μL蛋白,首先分别用80、120 V恒压电泳,接着用200 mA恒流“三明治”法转膜,封闭2 h,孵一抗和二抗后进行曝光,采用Image J定量分析蛋白灰度值。
1.3 统计学方法应用SPSS 26.0软件进行统计分析。试验结果采用x±s描述;两组数据比较采用t检验,多组间的比较采用方差分析,以P≤0.05为差异具有统计学意义。
2 结果 2.1 AG对LPS诱导的HK-2细胞的影响分别用1、5、10、20、40 μg/mL的LPS处理细胞22 h,与Control组相比,随着LPS浓度的增加,细胞活力逐渐下降,在10 μg/mL时活力下降最为明显(P<0.05),故选用10 μg/mL浓度的LPS构建脓毒症细胞损伤模型,见图 1A。分别用DMSO和不同浓度的AG(5、10、20、40 μmol/L)干预HK-2细胞12 h,与Control组相比,以上浓度AG干预后细胞活力比较,差异无统计学意义(均P>0.05),表明DMSO作为AG的溶剂对细胞无损害作用,且5~40 μmol/L AG单纯干预对HK-2细胞活力无明显影响,见图 1B。为研究AG是否对LPS诱导的HK-2细胞损伤具有保护作用,进一步采用5、10、20 μmol/L AG联合LPS处理细胞24 h,与LPS组相比,5、10、20 μmol/L AG处理的HK-2细胞存活率均有不同程度的升高(均P<0.05),且10 μmol/L AG处理的HK-2细胞存活率升高较为明显(P<0.05),见图 1C。因此,以下试验选用10 μmol/L AG进行干预。
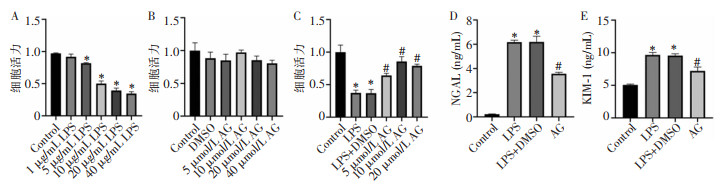 |
| 注:A为不同浓度LPS处理HK-2细胞对细胞活力的影响;B为不同浓度AG处理HK-2细胞对细胞活力的影响;C为不同浓度LPS和AG处理HK-2细胞对细胞活力的影响;D为各组细胞中NGAL水平;E为各组细胞中KIM-1水平;*表示与Control组比较,P<0.05;#表示与LPS组比较,P<0.05。 图 1 LPS和AG对细胞活力的影响 Figure 1 Effect of LPS and AG on cell viability |
对肾损伤标志物进行检测,与Control组相比,在LPS组中,NGAL和KIM-1水平升高(P<0.05),而AG组较LPS组降低,见图 1D、1E,因此,AG在一定程度上可减轻脓毒症所致的HK-2细胞损伤。
2.2 AG对HK-2细胞形态结构的影响光镜观察细胞形态,Control组HK-2细胞形态呈圆形铺路石样,细胞生长状态良好;与Control组相比,LPS组的HK-2细胞变形呈梭形,轮廓模糊,贴壁能力下降;与LPS组相比,AG组细胞状态有明显改善,与Control组细胞形态基本相似,见图 2。
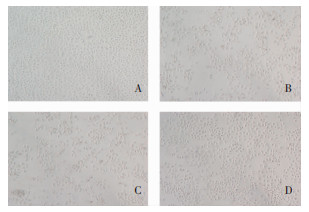 |
| 注:A为Control组;B为LPS组;C为LPS+DMSO组;D为AG组。 图 2 光镜下观察不同处理组HK-2细胞形态(100×) Figure 2 HK-2 cell morphology of different treatment groups observed under light microscope (100×) |
检测各组的氧化应激指标,与LPS组相比,AG组中MDA含量均降低(P<0.05),见图 3A,GSH水平也显著升高(P<0.05),见图 3B;AG组较LPS组,Fe2+含量明显减低(P<0.05),见图 3C,说明AG可有效降低HK-2细胞的铁代谢障碍;ROS荧光结果显示,与Control组相比,LPS组荧光强度增强,而AG组相比于LPS组荧光强度有明显减弱,见图 3D。表明AG可降低细胞内MDA和ROS的含量,提高GSH含量,减少胞内的脂质过氧化和铁死亡。
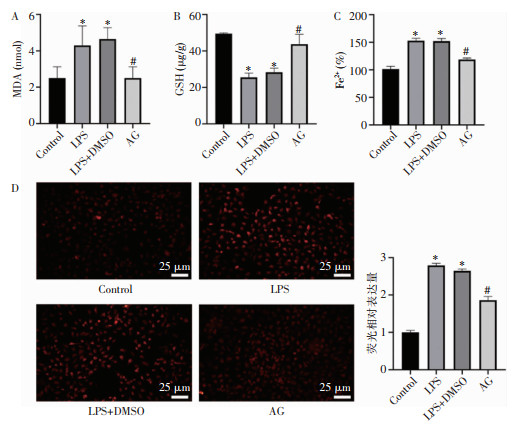 |
| 注:A为各组细胞中MDA水平;B为各组细胞中GSH水平;C为各组细胞中Fe2+水平;D为各组细胞中ROS水平;*表示与Control组比较,P<0.05;#表示与LPS组比较,P<0.05。 图 3 HK-2细胞内MDA、GSH含量及ROS荧光强度 Figure 3 Contents of MDA and GSH in HK-2 cells and ROS fluorescence intensity |
进一步进行Xc-系统关键蛋白SLC7A11、GPX4表达水平的检测,结果发现,与Control组相比,LPS组SLC7A11、GPX4蛋白水平降低,Ferritin蛋白水平升高(均P<0.05);经AG处理后,SLC7A11和GPX4蛋白水平升高,Ferritin蛋白水平表达降低(均P<0.05),见图 4。表明AG通过SLC7A11/GPX4通路上调Xc-系统活性,降低Ferritin蛋白的表达,减轻胞内铁死亡的发生。
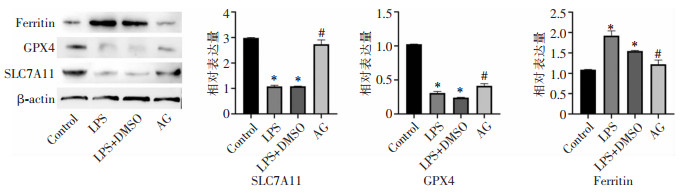 |
| 注:*表示与Control组比较,P<0.05;#表示与LPS组比较,P<0.05。 图 4 HK-2细胞中SLC7A11、GPX4、Ferritin蛋白表达情况 Figure 4 Expression of SLC7A11, GPX4 and ferritin protein in HK-2 cells |
脓毒症急性肾损伤是指原未患有肾脏疾病的患者,在发生脓毒症后出现了血、尿、组织学及影像学可见的肾脏结构或功能的障碍[1]。脓毒症并发肾损伤时,集束治疗效果不明显,患者预后不佳,因此迫切需要了解其发病机制及治疗靶点[11-12]。本研究采用LPS诱导HK-2细胞建立脓毒症损伤模型,细胞存活率下降,且肾细胞损伤加重,而给予AG干预后,细胞存活率有所恢复,肾细胞损伤减轻,表明AG对脓毒症HK-2细胞具有保护作用。
AG具有强大的抗氧化作用,在心血管疾病、肾脏疾病、癌症等人类主要疾病方面发挥治疗作用[13-14]。相关研究[15]报道,AG可增加脓毒症小鼠腹腔中巨噬细胞的百分比和吞噬活性,降低促炎因子水平,增强细菌清除率来提高小鼠的存活率。Lee等[16]研究表明,AG通过抑制HMGB1信号通路减轻炎症反应,治疗脓毒症所致的血管炎性反应。另有研究[17]表明AG在肾脏疾病方面具有保护作用,AG可通过Akt/NF-kB通路减轻高血糖介导的肾脏氧化应激和炎症,从而改善肾功能障碍。本研究发现AG对脓毒症HK-2细胞具有保护作用,肾损伤标志物NGAL和KIM-1显著减低,并且能够逆转LPS干预下的HK-2细胞铁死亡的特征,包括降低MDA、ROS水平以及Fe2+含量,下调Ferritin蛋白表达水平,提高GSH含量,因此AG可能抑制HK-2细胞的铁死亡。
铁死亡是近年来发现的新的细胞死亡机制,研究[18-19]表明,其参与了不同形式的肾损伤进展。本研究发现AG可调控铁死亡,铁死亡相关靶点可能成为改善肾损伤的调节机制之一。Xc-系统和GPX4是调节铁死亡的主要成分。Xc-系统是由SLC7A11和溶质载体家族3成员2(solute carrier family 3 member 2, SLC3A2)组成的胱氨酸-谷氨酸逆向转运蛋白,可将细胞外的胱氨酸与细胞内的谷氨酸1∶1进行交换,为GSH的合成提供底物[20]。GSH是体内重要的抗氧化剂,也是合成GPX4的重要因子[21]。Xc-系统中的SLC7A11与下游的GPX4形成对抗铁死亡的主要抗氧化屏障,激活Xc-系统,将增加GSH的合成,进而促进与GPX4的协同作用,有效清除活性氧ROS,减少脂质过氧化物的产生,抑制铁死亡[22]。本研究发现,LPS损伤后的HK-2细胞中SLC7A11、GPX4蛋白表达降低,Ferritin蛋白水平增加,抗氧化物GSH含量显著减少,故细胞内的抗氧化系统已遭到破坏,从而导致细胞内Fe2+含量、活性氧ROS以及脂质过氧化产物MDA大量增加。给予AG后,上调GSH、铁死亡标志蛋白SLC7A11、GPX4表达,下调Fe2+含量、Ferritin蛋白、活性氧ROS、脂质过氧化物MDA的表达。因此,抑制铁死亡可能改善脓毒症肾损伤。
综上所述,本研究发现,AG可以激活HK-2细胞中的SLC7A11/GPX4通路,减少氧化应激,上调抗氧化酶活性,减轻LPS诱导的细胞铁死亡,从而减轻细胞损伤,提高存活率。然而,铁死亡在脓毒症肾损伤中是多种因素参与的复杂过程,AG是否可以通过其他途径抑制铁死亡,是否参与了其他死亡形式的调节,仍需进一步的探讨和研究。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Peerapornratana S, Manrique-Caballero CL, Gómez H, et al. Acute kidney injury from sepsis: current concepts, epidemiology, pathophysiology, prevention and treatment[J]. Kidney Int, 2019, 96(5): 1083-1099. DOI:10.1016/j.kint.2019.05.026 |
| [2] |
张志雄, 姜南, 赵忠岩, 等. 脓毒症所致急性肾损伤的发病机制研究进展[J]. 中国实验诊断学, 2019, 23(10): 1853-1857. Zhang ZX, Jiang N, Zhao ZY, et al. Advances in pathogenesis of acute kidney injury caused by sepsis[J]. Chinese Journal of Laboratory Diagnosis, 2019, 23(10): 1853-1857. DOI:10.3969/j.issn.1007-4287.2019.10.061 |
| [3] |
Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [4] |
Xiao J, Yang Q, Zhang Y, et al. Maresin conjugates in tissue regeneration-1 suppresses ferroptosis in septic acute kidney injury[J]. Cell Biosci, 2021, 11(1): 221. DOI:10.1186/s13578-021-00734-x |
| [5] |
Zhang HZ, Wu H, Qian J, et al. The regulation of LPCAT3 by miR-124-3p.1 in acute kidney injury suppresses cell prolife-ration by disrupting phospholipid metabolism[J]. Biochem Biophys Res Commun, 2022, 604: 37-42. DOI:10.1016/j.bbrc.2022.03.009 |
| [6] |
Kim S, Kang SW, Joo J, et al. Characterization of ferroptosis in kidney tubular cell death under diabetic conditions[J]. Cell Death Dis, 2021, 12(2): 160. DOI:10.1038/s41419-021-03452-x |
| [7] |
Jiang MY, Sheng FY, Zhang Z, et al. Andrographis paniculata (Burm.f.) Nees and its major constituent andrographolide as potential antiviral agents[J]. J Ethnopharmacol, 2021, 272: 113954. DOI:10.1016/j.jep.2021.113954 |
| [8] |
Guo WJ, Liu W, Chen G, et al. Water-soluble andrographo-lide sulfonate exerts anti-sepsis action in mice through down-regulating p38 MAPK, STAT3 and NF-κB pathways[J]. Int Immunopharmacol, 2012, 14(4): 613-619. DOI:10.1016/j.intimp.2012.09.002 |
| [9] |
Liu WW, Liang LM, Zhang Q, et al. Effects of andrographo-lide on renal tubulointersticial injury and fibrosis. Evidence of its mechanism of action[J]. Phytomedicine, 2021, 91: 153650. DOI:10.1016/j.phymed.2021.153650 |
| [10] |
Zhang QY, Yang X, Meng P, et al. Post-treatment with irisin attenuates acute kidney injury in sepsis mice through anti-ferroptosis via the SIRT1/Nrf2 pathway[J]. Front Pharmacol, 2022, 13: 857067. DOI:10.3389/fphar.2022.857067 |
| [11] |
李晨辉, 王念慈, 刘颖, 等. 脓毒症急性肾损伤诊疗进展[J]. 内科急危重症杂志, 2021, 27(5): 422-427. Li CH, Wang NC, Liu Y, et al. Progress in diagnosis and treatment of acute kidney injury in sepsis[J]. Journal of Internal Intensive Medicine, 2021, 27(5): 422-427. |
| [12] |
Caironi P, Latini R, Struck J, et al. Circulating proenkephalin, acute kidney injury, and its improvement in patients with severe sepsis or shock[J]. Clin Chem, 2018, 64(9): 1361-1369. DOI:10.1373/clinchem.2018.288068 |
| [13] |
Islam MT, Ali ES, Uddin SJ, et al. Andrographolide, a diterpene lactone from andrographis paniculata and its therapeutic promises in cancer[J]. Cancer Lett, 2018, 420: 129-145. DOI:10.1016/j.canlet.2018.01.074 |
| [14] |
Zhang H, Li SF, Si YS, et al. Andrographolide and its derivatives: current achievements and future perspectives[J]. Eur J Med Chem, 2021, 224: 113710. DOI:10.1016/j.ejmech.2021.113710 |
| [15] |
Yu LC, Liu Y, Cao C, et al. Andrographolide attenuates inflammation due to intra-abdominal sepsis by enhancing bacte-rial clearance in mice[J]. J Inflamm Res, 2023, 16: 4413-4423. DOI:10.2147/JIR.S422342 |
| [16] |
Lee W, Ku S, Yoo H, et al. Andrographolide inhibits HMGB1-induced inflammatory responses in human umbilical vein endothelial cells and in murine polymicrobial sepsis[J]. Acta Physiol (Oxf), 2014, 211(1): 176-187. DOI:10.1111/apha.12264 |
| [17] |
Ji XQ, Li CZ, Ou YT, et al. Andrographolide ameliorates diabetic nephropathy by attenuating hyperglycemia-mediated renal oxidative stress and inflammation via Akt/NF-κB pathway[J]. Mol Cell Endocrinol, 2016, 437: 268-279. DOI:10.1016/j.mce.2016.06.029 |
| [18] |
Guerrero-Hue M, García-Caballero C, Palomino-Antolín A, et al. Curcumin reduces renal damage associated with rhabdo-myolysis by decreasing ferroptosis-mediated cell death[J]. FASEB J, 2019, 33(8): 8961-8975. DOI:10.1096/fj.201900077R |
| [19] |
Ding CG, Ding XM, Zheng J, et al. miR-182-5p and miR-378a-3p regulate ferroptosis in I/r-induced renal injury[J]. Cell Death Dis, 2020, 11(10): 929. DOI:10.1038/s41419-020-03135-z |
| [20] |
Lei PX, Bai T, Sun YL. Mechanisms of ferroptosis and relations with regulated cell death: a review[J]. Front Physiol, 2019, 10: 139. DOI:10.3389/fphys.2019.00139 |
| [21] |
Liu YT, Tan SC, Wu YB, et al. The emerging role of ferroptosis in sepsis[J]. DNA Cell Biol, 2022, 41(4): 368-380. DOI:10.1089/dna.2021.1072 |
| [22] |
Tang DL, Chen X, Kang R, et al. Ferroptosis: molecular mechanisms and health implications[J]. Cell Res, 2021, 31(2): 107-125. DOI:10.1038/s41422-020-00441-1 |



