2. 电子科技大学医学院附属绵阳医院绵阳市中心医院肾病科, 四川 绵阳 621000;
3. 凉山州布拖县人民医院感染科, 四川 布拖 615350
2. Department of Nephrology, Mianyang Central Hospital, The Affiliated Mianyang Hospital of School of Medicine, University of Electronic Science and Technology of China, Mianyang 621000, China;
3. Department of Infection, Butuo People's Hospital of Liangshan Prefecture, Butuo 615350, China
艾滋病(acquired immunodeficiency syndrome, AIDS)是由人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染人体后导致细胞免疫功能进行性下降,引起机体产生多种机会性感染及肿瘤的综合征[1]。HIV和丙型肝炎病毒(hepatitis C virus, HCV)具有相似的传播途径,均可通过性接触、血液及母婴垂直途径传播感染,故重叠感染情况非常普遍[2]。目前,凉山州报告现存活HIV感染者中超过50%合并HCV感染,大多数HCV/HIV合并感染患者家庭经济困难,在接受免费抗反转录病毒治疗(anti-retroviral therapy, ART)时,HCV感染未得到及时有效治疗,导致这部分患者ART效果也不理想,进而增加疾病负担和死亡风险。
近年来,丙型病毒性肝炎(丙肝)已经成为可以治愈的疾病。直接抗病毒药物(direct antiviral agent, DAA)的出现,彻底改变了丙肝的治疗模式,且具有较高的持续病毒学应答(sustained virological response, SVR)[3]。其中,格卡瑞韦/哌仑他韦是由NS3/4A蛋白酶抑制剂和NS5A抑制剂组成的固定复合制剂,被用于治疗基因1~6型HCV感染[4-5]。本研究拟通过观察格卡瑞韦/哌仑他韦治疗HCV/HIV合并感染患者的临床疗效及安全性,为其临床治疗提供依据。
1 对象与方法 1.1 研究对象选择2021年1月—2022年1月凉山州某医院收治的HCV/HIV合并感染患者为研究对象,患者均符合《中国艾滋病诊疗指南》[1]和《丙型肝炎防治指南(2019年版)》[3]中的相关诊疗标准。所有患者均自愿签署知情同意书。
纳入标准:(1)确诊的HIV-1型感染者;(2)无肝硬化HCV感染初治者;(3)年龄18~65岁。
排除标准:(1)肝硬化、肝衰竭、肝癌等终末期肝病患者;(2)肝移植患者;(3)合并乙型肝炎病毒感染者;(4)合并严重机会性感染者;(5)合并严重心脑血管等疾病者;(6)哺乳或妊娠妇女;(7)对研究药物严重过敏者。
1.2 方法 1.2.1 给药方案所有患者予以格卡瑞韦/哌仑他韦复合片剂(100 mg/40 mg)3片,每日1次,随餐口服,疗程8周,随访12周。本研究丙肝药物均由艾伯维医药贸易(上海)有限公司免费捐赠。若ART方案中含有洛匹那韦/利托那韦或依非韦伦等药物,在开始本研究前均更换为其他相关药物,避免药物间相互作用。
1.2.2 观察指标收集患者基线资料,包括:性别、婚姻、年龄、CD4+T淋巴细胞、HCV基因型、HIV和HCV病毒载量等。于治疗4、8周和停药后随访12周时,分别检测患者总胆红素(total bilirubin, TBIL)、丙氨酸转氨酶(alanine transaminase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)、清蛋白(albumin, ALB)、血清肌酐(serum creatinine, SCR)、甲胎蛋白(alpha-fetoprotein, AFP)、血白细胞(white blood cell, WBC)、血小板(platelet, PLT)、血红细胞(red blood cell, RBC)、CD4+T淋巴细胞、HIV病毒载量(HIV RNA)和HCV病毒载量(HCV RNA)水平。治疗有效性评价包括治疗结束12周后持续病毒学应答率(SVR12)和治疗结束时病毒学应答率;安全性评价为药物相关不良反应的发生情况。
1.3 统计学方法应用SPSS 19.0统计软件进行数据资料分析,计量资料用(x±s)表示,计数资料用百分率(%)表示。检验水准α=0.05。
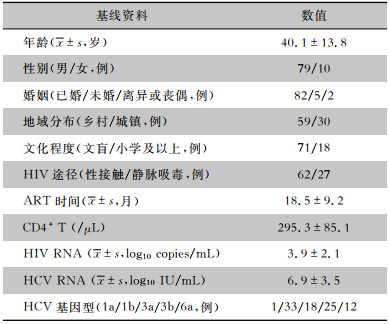
2 结果 2.1 一般资料本研究共纳入HCV/HIV合并感染患者89例,均为彝族,多为中青年已婚男性,多来自经济不发达的乡村地区,受教育程度低。HIV感染主要经性接触传播和静脉注射毒品传播,HIV和HCV病毒载量均较高,HCV基因型以基因1b型和基因3b型最为常见,见表 1。合并高血压者5例(5.6%),合并糖尿病者4例(4.5%),合并消化道溃疡者4例(4.5%),合并高脂血症者1例(1.1%)。
| 表 1 HCV/HIV合并感染患者基线特征 Table 1 Baseline characteristics of patients with HCV/HIV co-infection |
|
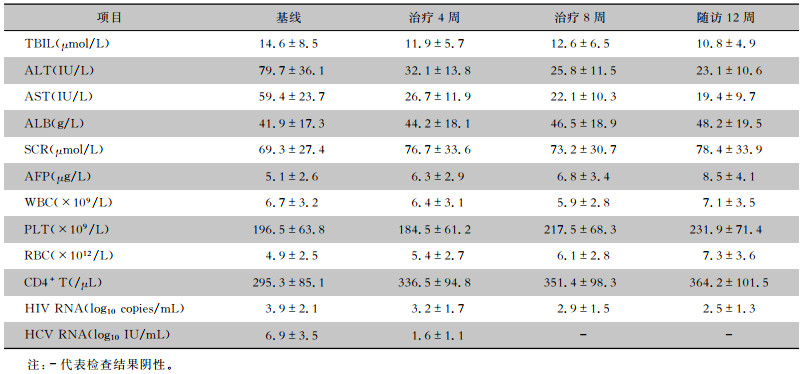
89例HCV/HIV合并感染患者均完成了格卡瑞韦/哌仑他韦方案的8周治疗,95.5%(85例)的患者在治疗第4周时病毒学检测结果为阴性(HCV RNA<25 IU/mL),100%(89例)的患者在治疗第8周时病毒学检测结果为阴性。81例患者完成12周随访,且均获得SVR,8例患者在随访期间失去联系或拒绝完成随访。实验室检查结果见表 2。
| 表 2 HCV/HIV合并感染患者实验室检查结果(x±s) Table 2 Laboratory examination results of patients with HCV/HIV co-infection (x±s) |
|
89例HCV/HIV合并感染患者的肝脏彩超检查表现不典型,缺乏特异性,变化多样,多表现为肝脏大小和形态均正常,肝包膜光滑,实质回声增粗,不均匀,门静脉内径检测值在正常范围。
2.4 药物不良反应治疗中观察到11例患者出现不良反应,包括头痛4例,乏力、头晕各2例,恶心、腹泻和皮肤瘙痒各1例,多数不良反应持续时间短,均在2周内消失或经对症处理后消失,无因出现不良反应退出治疗的病例。
3 讨论截至2020年底,全球现存活艾滋病患者3 770万,当年新发HIV感染者150万,2 750万人正在接受ART[6]。全球慢性HCV感染者约有7 100万,其中因HCV感染导致肝硬化或肝细胞癌死亡人数约有39.9万[7]。据估算,我国HCV感染者约1 000万,且发病率逐年上升[3]。研究[8]显示,全国一般人群抗-HCV阳性率为0.60%,吸毒人群抗-HCV阳性率为48.67%,男男同性恋人群抗-HCV阳性率为0.84%。数据[9]显示,全球HCV/HIV合并感染者约230万,其中82.4%为静脉注射毒品所致,而我国静脉注射毒品人群中HCV/HIV合并感染流行率为53.4%~92.7%。HCV与HIV合并感染时,其传播的危险性增加20%,且病毒载量越高, 传播的危险性越大。此外,HCV/HIV合并感染还可能促进肝脏纤维化,增加终末期肝病发生的风险,特别是免疫功能低下患者[10]。因此,HCV/HIV合并感染正成为我国公共卫生健康的严重威胁与挑战。
格卡瑞韦/哌仑他韦是全新的泛基因型抗HCV药物,于2019年被我国药品监督管理局批准用于治疗各种基因型HCV感染。格卡瑞韦/哌仑他韦是由两种DAA药物组成的单片复方制剂,靶向作用于HCV复制过程中的多个步骤。研究[11]表明,格卡瑞韦/哌仑他韦治疗非肝硬化HCV感染亚裔患者的SVR12达97.2%,代偿性肝硬化HCV感染亚裔患者的SVR12达99.4%。与格卡瑞韦/艾尔巴韦方案相比,格卡瑞韦/哌仑他韦方案可用于晚期慢性肾病患者的丙肝治疗,两者间差异无统计学意义[12]。荟萃分析[13]显示,格卡瑞韦/哌仑他韦8周或12周方案对于基因1~6型HCV感染患者的治疗安全有效,且该方案可能是HCV/HIV合并感染患者的一个不错选择。然而,美国食品药品监督管理局有报告称使用格卡瑞韦/哌仑他韦可能会导致中到重度的肝损伤。格卡瑞韦/哌仑他韦在治疗HCV感染过程中可能出现轻微的药物性肝损伤,以高胆红素血症最为多见,尤其是在肝硬化患者中,但其仍然是慢性肾病或终末期肾病患者合并HCV感染的首选治疗方案[14]。
本研究中,应用格卡瑞韦/哌仑他韦8周方案治疗HCV/HIV合并感染的患者均获得SVR,且该方案的安全性及耐受性良好,临床效果并未受到HIV感染病毒载量及患者免疫状态的影响,这与最新指南[15]描述的总体治疗效果一致。HCV基因1b型占比最高,与我国一般人群流行的基因型一致;HCV基因3b型比例较高,这与该地区早期毒品泛滥、静脉注射吸毒流行等因素密切相关[16]。患者多为中青年已婚男性,分布区域以发展相对落后的乡村地区为主;性接触和静脉吸毒是该地区HIV感染传播的主要途径,且HCV与HIV的基线病毒载量均较高,这与该地区病毒耐药、受教育水平低、治疗依从性差及医疗服务能力低等多因素有关[17]。不良反应主要表现为头痛、乏力、皮肤瘙痒等,但未出现患者因药物不良反应而停药的事件。
综上所述,格卡瑞韦/哌仑他韦8周治疗方案具有良好的有效性和安全性,可以作为基因1、3、6型HCV/HIV合并感染无肝硬化初治患者的有效治疗方案之一,但仍需进行大样本、多中心的前瞻性研究来进一步验证。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
中华医学会感染病学分会艾滋病丙型肝炎学组, 中国疾病预防控制中心. 中国艾滋病诊疗指南(2018年版)[J]. 中华内科杂志, 2018, 57(12): 867-884. AIDS and Hepatitis C Professional Group Society of Infectious Diseases Chinese Medical Association, Chinese Center for Di-sease Control and Prevention. Chinese guidelines for diagnosis and treatment of HIV/AIDS (2018)[J]. Chinese Journal of Internal Medicine, 2018, 57(12): 867-884. DOI:10.3760/cma.j.issn.0578-1426.2018.12.002 |
| [2] |
马洁琼, 邢文革, 蒋岩. 我国HIV HCV及TP的流行现状[J]. 中国艾滋病性病, 2019, 25(12): 1294-1298. Ma JQ, Xing WG, Jiang Y. Current status of HIV, HCV and TP infection and clinical diagnosis[J]. Chinese Journal of AIDS & STD, 2019, 25(12): 1294-1298. |
| [3] |
中华医学会肝病学分会, 中华医学会感染病学分会. 丙型肝炎防治指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35(12): 2670-2686. Chinese Society of Infectious Diseases, Chinese Medical Association. Guidelines for the prevention and treatment of hepatitis C (2019 version)[J]. Journal of Clinical Hepatology, 2019, 35(12): 2670-2686. |
| [4] |
Chayama K, Suzuki F, Karino Y, et al. Efficacy and safety of glecaprevir/pibrentasvir in Japanese patients with chronic ge-notype 1 hepatitis C virus infection with and without cirrhosis[J]. J Gastroenterol, 2018, 53(4): 557-565. DOI:10.1007/s00535-017-1391-5 |
| [5] |
Toyoda H, Chayama K, Suzuki F, et al. Efficacy and safety of glecaprevir/pibrentasvir in Japanese patients with chronic genotype 2 hepatitis C virus infection[J]. Hepatology, 2018, 67(2): 505-513. DOI:10.1002/hep.29510 |
| [6] |
World Health Organization. HIV and AIDS[EB/OL]. (2021-07-17)[2023-05-05]. https://www.who.int/news-room/fact-sheets/detail/hiv-aids.
|
| [7] |
World Health Organization. Guidelines for the care and treatment of persons diagnosed with chronic hepatitis C virus infection[EB/OL]. (2018-07-01)[2023-05-05]. https://www.who.int/publications/i/item/9789241550345.
|
| [8] |
庄辉. 中国丙型肝炎感染现状及防治对策研究报告[M]. 北京: 人民卫生出版社, 2017. Zhuang H. Hepatitis C infection status and prevention and treatment report in China[M]. Beijing: People's Medical Publishing House, 2017. |
| [9] |
马仲慧, 陈兵, 宫赛赛, 等. 云南省红河州静脉吸毒人群中HIV感染者的HCV共感染调查[J]. 中国艾滋病性病, 2019, 25(11): 1109-1112, 1116. Ma ZH, Chen B, Gong SS, et al. Investigation of HCV/HIV co-infection in injecting drug users in Honghe prefecture, Yunnan province[J]. Chinese Journal of AIDS & STD, 2019, 25(11): 1109-1112, 1116. |
| [10] |
肖宏, 卢洪洲. HIV/HCV合并感染的治疗新进展[J]. 肝脏, 2017, 22(1): 69-72. Xiao H, Lu HZ. New advances in the treatment of HIV/HCV co-infection[J]. Chinese Hepatology, 2017, 22(1): 69-72. |
| [11] |
Wei L, Wang GQ, Alami NN, et al. Glecaprevir-pibrentasvir to treat chronic hepatitis C virus infection in Asia: two multicentre, phase 3 studies-a randomised, double-blind study (VOYAGE-1) and an open-label, single-arm study (VOYAGE-2)[J]. Lancet Gastroenterol Hepatol, 2020, 5(9): 839-849. DOI:10.1016/S2468-1253(20)30086-8 |
| [12] |
Stein K, Stoehr A, Klinker H, et al. Hepatitis C therapy with grazoprevir/elbasvir and glecaprevir/pibrentasvir in patients with advanced chronic kidney disease: data from the German hepatitis C-registry (DHC-R)[J]. Eur J Gastroenterol Hepatol, 2022, 34(1): 76-83. DOI:10.1097/MEG.0000000000001923 |
| [13] |
Zhang YG, Jiang XF, Zhao YY, et al. Effect of baseline resistance-associated substitutions on the efficiency of glecaprevir/pibrentasvir in chronic hepatitis C subjects: a Meta-analysis[J]. J Viral Hepat, 2021, 28(1): 177-185. DOI:10.1111/jvh.13409 |
| [14] |
Hung HY, Hung WL, Shih CL, et al. Drug-induced liver injury by glecaprevir/pibrentasvir treatment for chronic hepatitis C infection: a systematic review and Meta-analysis[J]. Ann Med, 2022, 54(1): 108-120. DOI:10.1080/07853890.2021.2012589 |
| [15] |
中华医学会感染病学分会艾滋病丙型肝炎学组, 中国疾病预防控制中心. 中国艾滋病诊疗指南(2021年版)[J]. 中国艾滋病性病, 2021, 27(11): 1182-1201. AIDS and Hepatitis C Professional Group, Society of Infectious Diseases, Chinese Medical Association, Chinese Center for Disease Control and Prevention. Chinese guidelines for dia-gnosis and treatment of HIV/AIDS (2021 edition)[J]. Chinese Journal of AIDS & STD, 2021, 27(11): 1182-1201. |
| [16] |
中华医学会肝病学分会, 中华医学会感染病学分会. 丙型肝炎防治指南(2022年版)[J]. 中华肝脏病杂志, 2022, 30(12): 1332-1348. Chinese Society of Hepatology and Chinese Society of Infectious Diseases, Chinese Medical Association. Guideline for the prevention and treatment of hepatitis C (2022 version)[J]. Chinese Journal of Hepatology, 2022, 30(12): 1332-1348. DOI:10.3760/cma.j.cn501113-20221220-00605 |
| [17] |
杨先碧, 朱梦蓉, 陈丹镝, 等. 凉山州5个彝族聚居地区居民艾滋病知识知晓情况及歧视态度调查分析[J]. 中国艾滋病性病, 2018, 24(10): 1012-1015. Yang XB, Zhu MR, Chen DD, et al. Analysis of AIDS-related knowledge and discrimination among five residential areas of Yi people in Liangshan Prefecture[J]. Chinese Journal of AIDS & STD, 2018, 24(10): 1012-1015. |



