随着耐碳青霉烯类革兰阴性菌(carbapenem-resistant Gram-negative bacteria, CR-GNB)检出率不断增加,近几年对头孢他啶/阿维巴坦(ceftazidime/avibactam, CZA)耐药的CR-GNB感染也逐渐成为临床上新的治疗难点[1]。CZA于2018年在中国获批,是我国目前治疗CR-GNB感染仅有的新型β-内酰胺酶抑制剂复方制剂,对多数产KPC和OXA-48样碳青霉烯酶肠杆菌目细菌具有活性[2-3]。然而,随着该药在国内外临床应用的增加,越来越多CR-GNB对CZA耐药。美国一项研究[4]对74株耐碳青霉烯类肠杆菌进行碳青霉烯酶基因型鉴定,结果显示,纸片扩散法与微量肉汤稀释法检测CZA药物敏感性(药敏)结果一致性仅为72%,考虑原因为纸片扩散法测定CZA药敏结果可能会出现假敏感和假耐药现象。我国指南[5]建议CZA纸片扩散法的抑菌圈直径在20~22 mm时,需用使用微量肉汤稀释法测试最低抑菌浓度(MIC)进行复核。由于CZA药敏试验无法在自动化系统上进行,目前国内临床微生物室检测时以纸片扩散法为主。某中心临床CR-GNB分离株CZA纸片扩散法药敏试验结果显示,抑菌圈直径范围在20~22 mm的菌株占比较大,但尚无针对此情形的抗感染治疗推荐。我国2014—2021年血流感染的细菌耐药监测数据[6]显示,多黏菌素B对临床常见的CR-GNB菌株敏感率保持在90%以上,成为临床治疗CZA耐药菌感染的重要选择药物。因此,研究多黏菌素类药物治疗耐CZA的CR-GNB感染临床疗效并总结优化现有抗感染治疗方案,具有重要临床指导意义,同时为多黏菌素类药物的临床合理应用提供参考。
1 对象与方法 1.1 病例筛选本研究纳入2021年6月—2023年5月就诊于某医院并使用多黏菌素类药物治疗的75例住院患者,根据CR-GNB分离株的CZA纸片扩散法药敏结果分为抑菌圈直径20~22 mm组(41例)和抑菌圈直径<20 mm组(34例)。纳入标准:①静脉注射多黏菌素类药物,且疗程>3 d;②符合血流感染、医院获得性肺炎或腹腔感染等临床诊断;③从患者血、下呼吸道分泌物、腹腔引流液或其他标本中分离出CR-GNB菌株;④采用纸片扩散法对CR-GNB分离株进行CZA药敏试验,且CZA抑菌圈直径≤22 mm。排除标准:①年龄<18岁;②CR-GNB为定植菌;③CR-GNB分离株对多黏菌素B天然耐药。见图 1。
 |
| 图 1 多黏菌素联合治疗CZA感染病例筛选流程图 Figure 1 Screening process for CZA infection cases treated with polymyxin combination |
75例患者使用多黏菌素类药物品种包括多黏菌素E甲磺酸钠注射剂(规格:150 mg/支,江苏正大天晴药业有限公司,中国)、硫酸多黏菌素B注射剂(规格:50万U/支,上海上药第一生化药业有限公司,中国)、硫酸黏菌素注射剂(也称为硫酸多黏菌素E,规格:50万U/支,上海上药新亚药业有限公司,中国)。
1.3 资料收集收集纳入患者的人口统计学特征,包括年龄、性别、体重、合并症、感染部位等,抗菌药物的品种、给药剂量、用药疗程、抗感染联合方案、分离菌株、药敏试验结果等药物相关信息,以及体温、实验室检验检查指标、临床有效率、微生物学清除率、病死率和多黏菌素停药后的住院时长等相关资料。
1.4 抗菌药物的敏感性测定使用VITEK自动化微生物鉴定系统进行菌株鉴定。根据美国临床实验室标准化协会(CLSI)标准[7],通过VITEK系统或纸片扩散法测定抗菌药物的敏感性。CZA纸片扩散法的抑菌圈直径≥21 mm为敏感,≤20 mm为耐药,若为20~22 mm应采用肉汤稀释法复核结果。但由于检测条件有限,均采用纸片扩散法测定CZA的敏感性,未进行肉汤稀释法检测MIC。
1.5 临床疗效评价临床有效率(%)=(治愈例数+改善例数)/总例数×100%。抗菌药物的疗效观察时间定义为停药后24 h内。临床结局分为治愈、改善和失败3种情况。治愈定义为感染的临床症状和体征完全消失,白细胞计数(total white blood cell, WBC)、中性粒细胞比值(neutrophil ratio, NE%)、C反应蛋白(C-reactive protein, CRP)、降钙素原(procalcitonin, PCT)正常,影像学和病原学检查正常。改善定义为未完全达到治愈标准,但至少有两项临床症状和体征改善,并且上述炎症指标和影像学/病原学检查结果与治疗前相比部分改善,其余指标未进展。失败定义为临床症状和体征无改善或加重,炎症指标无明显降低或升高,影像学检查提示感染性疾病进展,微生物学检查显示临床标本中持续分离出病原菌,或临床疗效评估前患者已死亡。微生物学疗效定义为多黏菌素用药疗程结束后临床标本中CR-GNB的清除情况,分为清除、假定清除、未清除和假定未清除,并采用清除和假定清除合并计算清除率[8]。炎症指标的降低定义为从多黏菌素类药物治疗开始之日起±2 d至7±2 d,WBC、NE%、CRP或PCT降低程度大于10%。根据28天病死率和出院病死率评估患者预后。
1.6 安全性评估多黏菌素类药物治疗结束后24 h内收集相关实验室指标,并评价多黏菌素类药物的肾脏安全性,包括血肌酐、血尿素氮和尿量。基线定义为开始使用多黏菌素类药物前24 h内报告的结果。
1.7 统计分析应用SPSS 26.0软件进行数据的统计分析。连续变量表示为均数±标准差(x ± s)或中位数(四分位数间距)[M(Q1, Q3)],并采用t检验(正态分布变量)或Mann-Whitney U检验(非正态分布变量)进行比较;分类变量表示为频率分布的百分比,并采用χ2检验或Fisher确切概率法进行比较。以P≤0.05为差异有统计学意义。
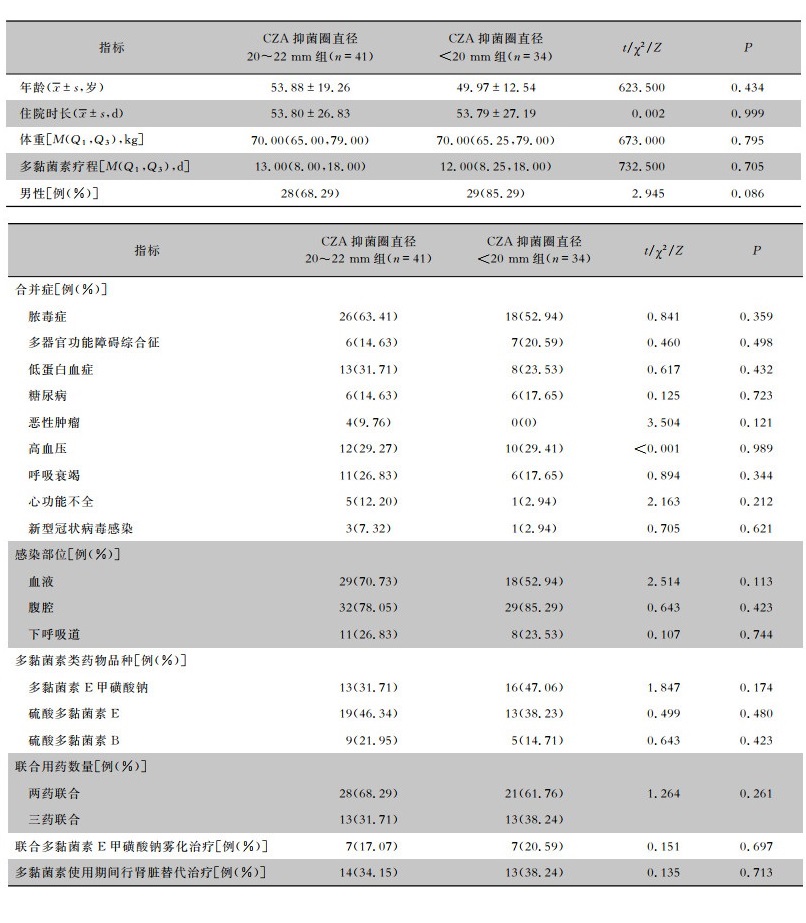
2 结果 2.1 一般资料75例患者的合并症以脓毒症为主,为58.67%(44例);感染部位以腹腔为主(81.33%,61例),其次为血液(62.67%,47例)和下呼吸道(25.33%,19例);抗感染方案为多黏菌素类药物为基础的联合治疗,其中,65.33%(49例)患者使用两药联合,34.67%(26例)患者使用三药联合;36.00% (27例)患者在多黏菌素类药物用药期间行肾脏替代治疗。CZA抑菌圈直径20~22 mm组和CZA抑菌直径圈<20 mm组患者的一般资料比较,差异均无统计学意义(均P>0.05)。见表 1。
| 表 1 两组患者一般资料比较 Table 1 Comparison of general data between two groups of patients |
|
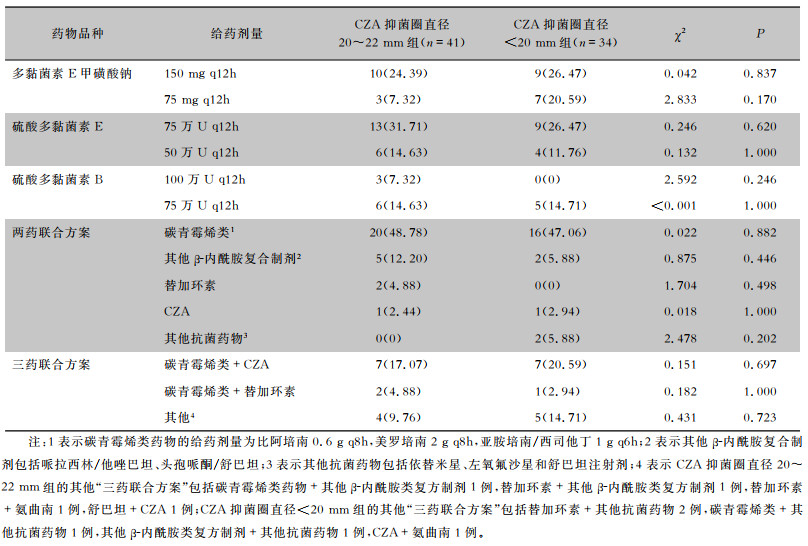
75例患者共使用3种多黏菌素类药物,其中29例(38.67%)使用多黏菌素E甲磺酸钠,32例(42.67%)使用硫酸多黏菌素E,14例(18.66%)使用硫酸多黏菌素B。多黏菌素E甲磺酸钠给药剂量以150 mg q12h为主(65.52%,19例),硫酸多黏菌素E(68.75%,22例)和硫酸多黏菌素B给药剂量(78.57%,11例)均以75万U q12h为主。两药联合方案以多黏菌素类药物联合碳青霉烯类药物最常见(73.47%,36/49),三药联合方案以多黏菌素类药物联合碳青霉烯类药物和CZA最常见(53.85%,14/26)。两组患者选用的多黏菌素类药物品种、剂量,以及联合用药方案比例均相近,差异均无统计学意义(均P>0.05)。见表 2。
| 表 2 两组患者使用多黏菌素类药物的情况[例(%)] Table 2 Characteristics of polymyxin use in two groups of patients (No. of cases[%]) |
|
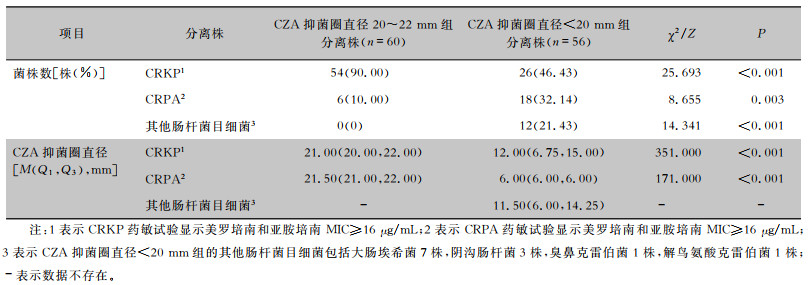
两组患者共分离出116株CR-GNB,其中CZA抑菌圈直径20~22 mm组分离出60株,CZA抑菌圈直径<20 mm组分离出56株。CZA抑菌圈直径20~22 mm组CR-GNB分离株以耐碳青霉烯类肺炎克雷伯菌(CRKP)为主(90.00%),其次为耐碳青霉烯类铜绿假单胞菌(CRPA), 占比10.00%;CZA抑菌圈直径<20 mm组CR-GNB分离株中CRKP、CRPA、其他肠杆菌目细菌占比分别为46.43%、32.14%、21.43%。两组间不同CR-GNB分离株的菌株数和CZA抑菌圈直径比较,差异均具有统计学意义(均P<0.05)。见表 3。
| 表 3 两组患者CR-GNB分离株的菌种分布和CZA抑菌圈直径比较 Table 3 Distribution of species of CR-GNB and comparison of CZA inhibition zone diameter between two groups of patients |
|
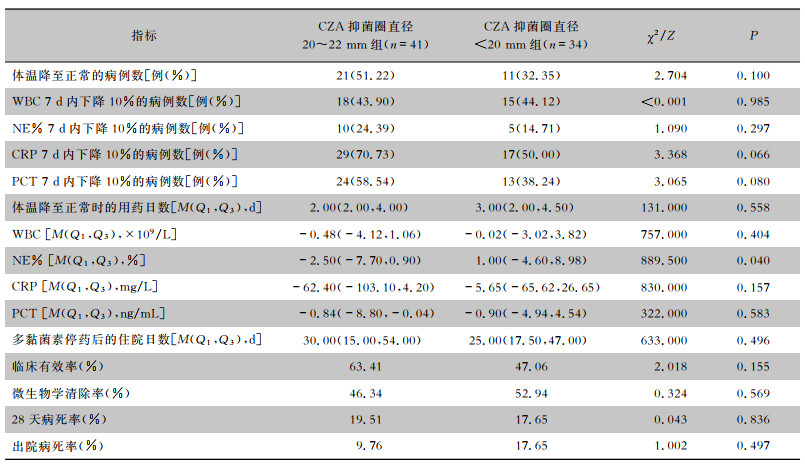
CZA抑菌圈直径20~22 mm组、CZA抑菌圈直径<20 mm组患者使用多黏菌素类药物治疗后的临床有效率(63.41% VS 47.06%)、微生物学清除率、28天病死率、出院病死率和多黏菌素停药后的住院日数均相近,差异均无统计学意义(均P>0.05)。体温和炎症指标中,除NE%值(P<0.05)外,其余指标差异均无统计学意义(均P>0.05)。见表 4。
| 表 4 两组患者联合应用多黏菌素类药物治疗后的临床疗效比较 Table 4 Comparison of clinical efficacy after polymyxin combination treatment between two groups of patients |
|
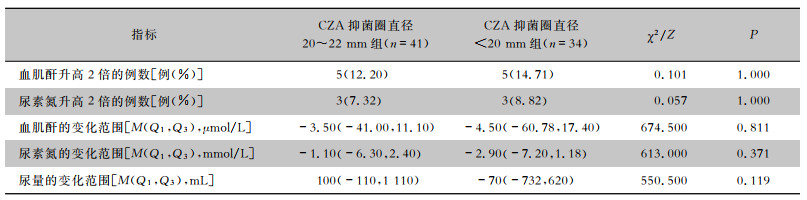
肾脏安全性指标比较结果显示,两组患者应用多黏菌素类药物治疗前后的血肌酐、尿素氮和尿量变化均相近,差异均无统计学意义(均P>0.05),见表 5。
| 表 5 两组患者应用多黏菌素类药物治疗前后的肾脏安全性指标比较 Table 5 Comparison of renal safety indexes before and after polymyxin treatment between two groups of patients |
|
据国外文献[9-10]报道,临床使用CZA后出现耐药性的概率为10%~20%。我国也有越来越多CZA耐药菌感染的病例报道[11-12]。严峻的耐药现状及有限的治疗药物选择下,对多数CR-GNB有效的多黏菌素类药物重新回归临床并用于一线治疗[13-14]。目前我国有3种多黏菌素类药物,包括多黏菌素E甲磺酸钠、硫酸多黏菌素B和硫酸多黏菌素E。但迄今为止,对多黏菌素类药物的研究主要集中在CR-GNB感染的治疗[15-17],鲜有针对CZA耐药菌感染的多黏菌素类药物临床疗效评价。
我国临床分离的耐碳青霉烯类肠杆菌目细菌(carbapenem-resistant Enterobacterales, CRE)中最常见的碳青霉烯酶基因型是KPC-2、NDM和OXA-48,分离自成人患者的肺炎克雷伯菌中最普遍的碳青霉烯酶基因型是blaKPC-2[18]。据文献[19-20]报道,肺炎克雷伯菌对CZA耐药最常见的原因是碳青霉烯酶blaKPC发生基因突变或拷贝数增加,铜绿假单胞菌对CZA耐药的原因是携带部分产金属β-内酰胺酶[21]。中国细菌耐药监测网2023年上半年监测数据[22]显示,CRKP和CRPA对CZA耐药率分别为9.8%、23%。本研究中,CZA抑菌圈直径20~22 mm组患者CR-GNB分离株大多数(90.00%) 为CRKP,而CZA抑菌圈直径<20 mm组患者CRKP明显减少(仅46.43%),此外,还分离出32.14%的CRPA和21.43%的其他肠杆菌目细菌。两组患者临床CR-GNB分离株的菌种分布和CZA抑菌圈直径的范围差异明显,推测主要由CRKP和CRPA对CZA的耐药率和耐药机制不同导致。
国内外最新指南[1, 13, 23]指出多黏菌素治疗CR-GNB感染的联合疗法优于单一疗法。针对CRE和非发酵菌(如CRPA),多黏菌素可与一种或多种对其敏感的抗菌药物联合使用;如无敏感药物,优先联用敏感性折点最低的药物(如碳青霉烯类)。体外研究显示多黏菌素对细胞外膜具有快速穿透性,有利于其他抗菌药物穿透外膜进入细胞内,从而达到杀灭细菌的作用。此外,指南还建议若美罗培南对CRE的MIC≤8 μg/mL,或对耐碳青霉烯类鲍曼不动杆菌(CRAB)的MIC≤32 μg/mL,则可采用多黏菌素和碳青霉烯类药物(延长输注时间)的组合方案治疗CR-GNB感染。本研究中,65.33%的患者采用以多黏菌素类药物为基础的两药联合治疗,其余均为三药联合治疗,CZA抑菌圈直径20~22 mm组患者选用的多黏菌素类药物品种、剂量及联合用药方案与CZA抑菌圈直径<20 mm组患者相比均无明显差异。本研究最常见的两药联合方案是多黏菌素联合碳青霉烯类药物,与指南推荐一致;最常见的三药联合方案是多黏菌素联合碳青霉烯类药物和CZA。目前已有关于CZA耐药菌株治疗选择的体外研究[24-27],联合方案中多含有CZA,但是相关临床研究较少,只有少数个案报道[28-29],需进一步研究证实该三药联合方案的有效性和安全性。
2023年美国感染病学会(IDSA)指南[23]指出,CRE、难治性铜绿假单胞菌等对头孢地尔敏感性高,建议当新型β-内酰胺酶抑制剂复方制剂无活性、无法耐受或无法获得时,头孢地尔可作为替代治疗的选择。2020年一项临床试验[30]比较了碳青霉烯类耐药菌感染的患者使用头孢地尔与替代疗法(主要由基于多黏菌素的疗法组成)的临床疗效,分离出的碳青霉烯耐药菌分别为鲍曼不动杆菌(54例,46%),肺炎克雷伯菌(39例,33%)和铜绿假单胞菌(22例,19%),结果显示接受头孢地尔、替代疗法的患者临床有效率分别为53%(42/80)、50%(19/38),微生物学清除率分别为31%(25/80)、24%(9/38),28天病死率分别为25%(25/101)、18%(9/49)。本研究中CZA抑菌圈直径20~22 mm组(分离菌CRKP占比90.00%,CRPA占比10.00%)的临床有效率为63.41%,CZA抑菌圈直径<20 mm组(分离菌CRKP占比46.43%,CRPA占比32.14%,其他肠杆菌占比21.43%)的临床有效率为47.06%,两组差异无统计学意义(P>0.05)。两组患者微生物学清除率(46.34%和52.94%)较上述研究(24%)更高,推测原因可能是本研究未纳入鲍曼不动杆菌(已知CZA对CRAB的抗菌活性较差,且CLSI、美国食品药品监督管理局和欧洲抗微生物药物敏感试验委员会均无针对该菌的药敏折点),且鲍曼不动杆菌定植的可能性大。两组患者28天病死率(19.51% 和17.65%)与上述研究(18%)相近。
多黏菌素类药物引起的肾毒性报道较多,根据不同的肾毒性定义,其发生率为0~76%,多数集中在30%~60%[31]。大多数报道[32]的肾毒性为轻度,停药后肾功能会逐步恢复,其发生机制与肾近端小管膜蛋白上受体介导的多黏菌素累积摄入导致细胞凋亡有关。与多黏菌素E甲磺酸钠比较,硫酸多黏菌素B急性肾损伤发生率相对较低。但本研究中,CZA抑菌圈直径20~22 mm组和CZA抑菌圈直径<20 mm组患者多黏菌素类药物使用品种和剂量方案均匹配良好,两组的肾脏安全性相关指标变化差异无统计学意义。
本研究具有一定的局限性。首先,作为单中心回顾性研究,样本量小且混杂因素多,重要的基线特征无法平衡,因此本研究仅对多黏菌素治疗CZA耐药菌感染患者临床疗效进行初步探索性分析,有待收集更多的临床病例平衡基线特征或进行亚组分析。其次,未检测CZA耐药的CR-GNB菌株的碳青霉烯酶基因型,且未对CR-GNB分离株进行多黏菌素的药敏试验。第三,危重患者应根据PK/PD靶标优化抗菌药物的给药剂量,但本研究未监测多黏菌素、碳青霉烯类药物和CZA的血药浓度,因此无法实现个体化的精准治疗。第四,本研究纳入的病例约50%为脓毒症患者,病情较重,且约35%患者行肾脏替代治疗,多黏菌素致肾损伤的因果关系不易判断,因此未统计多黏菌素相关肾损伤的发生率。本研究结果尚需设计严格的多中心临床试验进一步验证。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Zeng M, Xia J, Zong ZY, et al. Guidelines for the diagnosis, treatment, prevention and control of infections caused by carbapenem-resistant Gram-negative bacilli[J]. J Microbiol Immunol Infect, 2023, 56(4): 653-671. DOI:10.1016/j.jmii.2023.01.017 |
| [2] |
Sternbach N, Leibovici Weissman Y, Avni T, et al. Efficacy and safety of ceftazidime/avibactam: a systematic review and Meta-analysis[J]. J Antimicrob Chemother, 2018, 73(8): 2021-2029. DOI:10.1093/jac/dky124 |
| [3] |
Chen Y, Huang HB, Peng JM, et al. Efficacy and safety of ceftazidime-avibactam for the treatment of carbapenem-resis-tant Enterobacterales bloodstream infection: a systematic review and Meta-analysis[J]. Microbiol Spectr, 2022, 10(2): e0260321. DOI:10.1128/spectrum.02603-21 |
| [4] |
Shields RK, Clancy CJ, Pasculle AW, et al. Verifification of ceftazidime-avibactam and ceftolozane-tazobactam susceptibility testing methods against carbapenem-resistant Enterobacte-riaceae and Pseudomonas aeruginosa[J]. J Clin Microbiol, 2018, 56(2): e01093-17. |
| [5] |
中国医疗保健国际交流促进会临床微生物与感染分会, 中华医学会检验医学分会临床微生物学组, 中华医学会微生物学与免疫学分会临床微生物学组. 多粘菌素类与替加环素及头孢他啶/阿维巴坦药敏方法和报告专家共识[J]. 中华检验医学杂志, 2020, 43(10): 964-972. Society of Clinical Microbiology and Infection of China International Exchange and Promotion Association for Medical and Healthcare, Clinical Microbiology Group of the Laboratory Medicine Society of the Chinese Medical Association, Clinical Microbiology Group of the Microbiology and Immunology So-ciety of the Chinese Medical Association. Expert consensus on polymyxins, tigecycline and ceftazidime/avibactam susceptibi-lity testing[J]. Chin J Lab Med, 2020, 43(10): 964-972. |
| [6] |
陈云波, 嵇金如, 刘志盈, 等. 全国血流感染细菌耐药监测(BRICS)2021年度报告[J]. 中华临床感染病杂志, 2023, 16(1): 33-47. Chen YB, Ji JR, Liu ZY, et al. BRICS report of 2021: The distribution and antimicrobial resistance profile of clinical bacterial isolates from blood stream infections in China[J]. Chinese Journal of Clinical Infectious Diseases, 2023, 16(1): 33-47. |
| [7] |
Clinical and Laboratory Standards Institute. Performance Stan-dards for Antimicrobial Susceptibility Testing: M100-Ed32[S]. Clinical and Laboratory Standards Institute, USA, 2022.
|
| [8] |
Hao M, Yang Y, Guo Y, et al. Combination regimens with colistin sulfate versus colistin sulfate monotherapy in the treatment of infections caused by carbapenem-resistant Gram-ne-gative bacilli[J]. Antibiotics (Basel), 2022, 11(10): 1440. DOI:10.3390/antibiotics11101440 |
| [9] |
Shields RK, Nguyen MH, Chen L, et al. Pneumonia and renal replacement therapy are risk factors for ceftazidime-avibactam treatment failures and resistance among patients with carbapenem-resistant Enterobacteriaceae infections[J]. Antimicrob Agents Chemother, 2018, 62(5): e02497-17. |
| [10] |
Shields RK, Potoski BA, Haidar G, et al. Clinical outcomes, drug toxicity, and emergence of ceftazidime-avibactam resis-tance among patients treated for carbapenem-resistant Ente-robacteriaceae infections[J]. Clin Infect Dis, 2016, 63(12): 1615-1618. DOI:10.1093/cid/ciw636 |
| [11] |
Liu XJ, Chu YN, Yue HJ, et al. Risk factors for and clinical outcomes of ceftazidime-avibactam-resistant carbapenem-resis-tant Klebsiella pneumoniae nosocomial infections: a single-center retrospective study[J]. Infection, 2022, 50(5): 1147-1154. DOI:10.1007/s15010-022-01781-3 |
| [12] |
Zhang P, Shi Q, Hu H, et al. Emergence of ceftazidime/avibactam resistance in carbapenem-resistant Klebsiella pneumo-niae in China[J]. Clin Microbiol Infect, 2020, 26(1): 124.e1-124.e4. DOI:10.1016/j.cmi.2019.08.020 |
| [13] |
Tsuji BT, Pogue JM, Zavascki AP, et al. International consensus guidelines for the optimal use of the polymyxins: endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDSA), International Society for Anti-infective Pharmacology (ISAP), Society of Critical Care Medicine (SCCM), and Society of Infectious Diseases Pharmacists (SIDP)[J]. Pharmacotherapy, 2019, 39(1): 10-39. DOI:10.1002/phar.2209 |
| [14] |
中国医药教育协会感染疾病专业委员会, 中华医学会呼吸病学分会, 中华医学会重症医学分会, 等. 中国多粘菌素类抗菌药物临床合理应用多学科专家共识[J]. 中华结核和呼吸杂志, 2021, 44(4): 292-310. Infectious Diseases Society of China, Chinese Thoracic Society, Chinese Society of Critical Care Medicine, et al. Multi-disciplinary expert consensus on the optimal clinical use of the polymyxins in China[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2021, 44(4): 292-310. DOI:10.3760/cma.j.cn112147-20201109-01091 |
| [15] |
Yu XB, Zhang XS, Wang YX, et al. Population pharmacokinetics of colistin sulfate in critically ill patients: exposure and clinical efficacy[J]. Front Pharmacol, 2022, 13: 915958. DOI:10.3389/fphar.2022.915958 |
| [16] |
Chen N, Guo JH, Xie J, et al. Population pharmacokinetics of polymyxin B: a systematic review[J]. Ann Transl Med, 2022, 10(4): 231. DOI:10.21037/atm-22-236 |
| [17] |
Fan YX, Li Y, Chen YC, et al. Pharmacokinetics and pharmacodynamics of colistin methanesulfonate in healthy Chinese subjects after multi-dose regimen[J]. Antibiotics (Basel), 2022, 11(6): 798. DOI:10.3390/antibiotics11060798 |
| [18] |
Han R, Shi Q, Wu S, et al. Dissemination of carbapenemases (KPC, NDM, OXA-48, IMP, and VIM) among carbapenem-resistant Enterobacteriaceae isolated from adult and children patients in China[J]. Front Cell Infect Microbiol, 2020, 10: 314. DOI:10.3389/fcimb.2020.00314 |
| [19] |
Gaibani P, Re MC, Campoli C, et al. Bloodstream infection caused by KPC-producing Klebsiella pneumoniae resistant to ceftazidime/avibactam: epidemiology and genomic characte-rization[J]. Clin Microbiol Infect, 2020, 26(4): 516.e1-516.e4. DOI:10.1016/j.cmi.2019.11.011 |
| [20] |
Li XH, Zhang JS, Yang CR, et al. Increased expression and amplification of blaKPC-2 contributes to resistance to ceftazidime/avibactam in a sequence type 11 carbapenem-resistant Klebsiella pneumoniae strain[J]. Microbiol Spectr, 2022, 10(4): e0095522. DOI:10.1128/spectrum.00955-22 |
| [21] |
Hu FP, Guo Y, Yang Y, et al. Resistance reported from China Antimicrobial Surveillance Network (CHINET) in 2018[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(12): 2275-2281. DOI:10.1007/s10096-019-03673-1 |
| [22] |
CHINET中国细菌耐药监测网全体成员单位. CHINET 2023年上半年细菌耐药监测结果[EB/OL]. (2023-08-28)[2023-09-14]. http://www.chinets.com/Content/File/CHINET 2023年上半年细菌耐药监测结果. pptx. All Member Units of CHINET China Bacterial Drug Resis-tance Monitoring Network. Monitoring results of bacterial resistance in the first half of 2023 by CHINET[EB/OL]. (2023-08-28)[2023-09-14]. http://www.chinets.com/Content/File/CHINET 2023年上半年细菌耐药监测结果. pptx. |
| [23] |
Tamma PD, Aitken SL, Bonomo RA, et al. IDSA 2023 guidance on the treatment of antimicrobial resistant Gram-negative infections[EB/OL]. (2023-07-06)[2023-09-14]. https://www.idsociety.org/practice-guideline/amr-guidance/.
|
| [24] |
Yu W, Luo QX, Shen P, et al. New options for bloodstream infections caused by colistin- or ceftazidime/avibactam-resis-tant Klebsiella pneumoniae[J]. Int J Antimicrob Agents, 2021, 58(6): 106458. DOI:10.1016/j.ijantimicag.2021.106458 |
| [25] |
Papp-Wallace KM, Zeiser ET, Becka SA, et al. Ceftazidime-avibactam in combination with fosfomycin: a novel therapeutic strategy against multidrug-resistant Pseudomonas aeruginosa[J]. J Infect Dis, 2019, 220(4): 666-676. DOI:10.1093/infdis/jiz149 |
| [26] |
Montero MM, Domene Ochoa S, López-Causapé C, et al. Time-kill evaluation of antibiotic combinations containing ceftazidime-avibactam against extensively drug-resistant Pseudomonas aeruginosa and their potential role against ceftazidime-avibactam-resistant isolates[J]. Microbiol Spectr, 2021, 9(1): e0058521. DOI:10.1128/Spectrum.00585-21 |
| [27] |
Feng K, Jia N, Zhu PJ, et al. Aztreonam/avibactam effect on pharmacodynamic indices for mutant selection of Escherichia coli and Klebsiella pneumoniae harbouring serine- and New Delhi metallo-β-lactamases[J]. J Antimicrob Chemother, 2021, 76(11): 2875-2883. DOI:10.1093/jac/dkab292 |
| [28] |
Ding L, Shen SQ, Han RR, et al. Ceftazidime-avibactam in combination with imipenem as salvage therapy for ST11 KPC-33-producing Klebsiella pneumoniae[J]. Antibiotics (Basel), 2022, 11(5): 604. DOI:10.3390/antibiotics11050604 |
| [29] |
Wang L, Shen WY, Zhang R, et al. Identification of a novel ceftazidime-avibactam-resistant KPC-2 variant, KPC-123, in Citrobacter koseri following ceftazidime-avibactam treatment[J]. Front Microbiol, 2022, 13: 930777. DOI:10.3389/fmicb.2022.930777 |
| [30] |
Bassetti M, Echols R, Matsunaga Y, et al. Efficacy and safety of cefiderocol or best available therapy for the treatment of serious infections caused by carbapenem-resistant Gram-negative bacteria (CREDIBLE-CR): a randomised, open-label, multicentre, pathogen-focused, descriptive, phase 3 trial[J]. Lancet Infect Dis, 2021, 21(2): 226-240. DOI:10.1016/S1473-3099(20)30796-9 |
| [31] |
Kelesidis T, Falagas ME. The safety of polymyxin antibiotics[J]. Expert Opin Drug Saf, 2015, 14(11): 1687-1701. DOI:10.1517/14740338.2015.1088520 |
| [32] |
Manchandani P, Zhou J, Babic JT, et al. Role of renal drug exposure in polymyxin B-induced nephrotoxicity[J]. Antimicrob Agents Chemother, 2017, 61(4): e02391-16. |



