2. 广州医科大学呼吸疾病全国重点实验室,广东 广州 510030
2. State Key Laboratory of Respiratory Diseases, Guangzhou Medical University, Guangzhou 510030, China
抗菌药物耐药性对全球公共卫生造成极大的挑战,在众多耐药菌中,耐万古霉素屎肠球菌(VR-Efm)是具有代表性的病原体之一[1]。近年来,欧洲疾病预防控制中心监测数据[2]显示,VR-Efm检出率为16.2%~17.7%。全国细菌耐药监测网(CARSS)监测数据[3]显示,2014—2019年VR-Efm检出率为1.1%~2.9%,除北京外,其他各省市均<3%,远低于欧洲地区;但近期监测发现,广东省VR-Efm检出率从2019年1.3%上升至2023年16.2%,呈明显上升趋势。为此,本研究对2019—2023年广东省医疗机构分离的VR-Efm标本来源、地区分布、科室分布等情况进行分析,探寻VR-Efm检出率上升的原因。
1 资料与方法 1.1 资料来源收集来自2019—2023年各医疗机构上报至广东省细菌耐药监测网的数据,排除任何一年度数据存在缺失的单位后,共纳入38所医疗机构的细菌耐药监测资料,动态性分析耐药菌检出率;应用WHONET 5.6软件(http://www.whonet.org)录入,以保持数据一致性。所有药敏数据的统计均剔除同一患者分离的重复菌株。本研究在分析肠球菌属数据时,也同步分析世界卫生组织(WHO)重点关注的ESKAPE中其他5种细菌的检出率,即耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aures, MRSA)、耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP)、耐碳青霉烯类鲍曼不动杆菌(carbapenem-resistant Acinetobacter baumannii, CRAB)、耐碳青霉烯类铜绿假单胞菌(carbapenem-resistant Pseudomonas aeruginosa, CRPA)和耐碳青霉烯类肠杆菌属(carbapenem-resistant Enterobacter spp., CREN)。
1.2 菌株鉴定及药敏试验所有医疗机构实验室遵循中国国家卫生健康委员会的标准化程序,在血琼脂平板上培养分离菌株,使用基质辅助激光解析电离-飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry)、梅里埃VITEKⓇ 2 Compact(https://www.biomerieux.com.)或BD PhoenixTM(https://www.bd.com/) 鉴定菌种及进行抗菌药物敏感性试验。为确保医疗机构之间抗菌药物敏感性试验具有可比性,每所医疗机构都使用相同的参考菌株:金黄色葡萄球菌ATCC 25923、粪肠球菌ATCC 29212,按2023年美国临床实验室标准化协会(CLSI) M100 33rd ed[4]推荐的标准判断菌株对受试抗菌药物的敏感性。
1.3 数据分类根据《2023广东统计年鉴》区域划分[5],将广东省各地级市按珠三角(广州、深圳、珠海、佛山、惠州、东莞、中山、江门和肇庆)、粤东/东翼(汕头、汕尾、潮州和揭阳)、粤西/西翼(阳江、湛江和茂名)、粤北/山区(韶关、河源、梅州、清远和云浮)分成4个区。将不同的专科科室划分为重症监护病房(ICU,含内科监护病房、外科监护病房等)、内科、外科、门急诊及其他科室;标本类型按尿(各类尿标本)、血、无菌体液(含引流液)、分泌物、伤口(伤口和脓肿的拭子)和其他标本(如呼吸道标本、未指定)汇总分类。患者年龄按0~19、20~39、40~59、60~79、≥80岁进行分组。
1.4 统计分析应用WHONET 5.6软件分析细菌耐药监测数据,应用R 4.3.1版本,VR-Efm比例估计值采用95%置信区间(95%CI)表示。比较科室、标本类型、年龄和性别之间VR-Efm检出率,应用SPSS 26.0进行卡方检验,P≤0.05表示差异具有统计学意义。
2 结果 2.1 目标菌的时空分布2019—2023年上报至广东省细菌耐药监测网数据完整的医疗机构共38所,均为三级甲等医疗机构,覆盖了广东4个地理区域。共检出临床肠球菌属68 613株,检出率为所有监测菌种(912 725株)的第九位,占7.5%;在肠球菌属中,粪肠球菌、屎肠球菌及其他肠球菌占比分别为56.3%(38 659株)、36.5%(25 041株)、7.2%(4 913株)。5年中屎肠球菌在肠球菌属的检出率整体呈下降趋势,从2019年38.5%(4 543/11 792)降至2023年36.6%(6 345/17 327),但VR-Efm在肠球菌属的占比呈上升趋势,从2019年的0.5%(63/11 792)上升至2023年的7.8%(1 351/17 327),耐万古霉素粪肠球菌(vancomycin-resistant Enterococcus faecalis, VR-Efa)在肠球菌属的占比从2019年的0.1% (9/11 792)上升至2023年的0.3%(50/17 327)。肠球菌属区域数据分析发现,广东省4个区域VR-Efm检出率普遍上升,其中珠三角地区VR-Efm检出率首先出现增长,从2019年的1.8%(58/3 240)上升至2022年的14.7%(553/3 750),2023年达22.7%(1 045/4 602);粤北地区紧随其后,2021年明显上升[2.5%(15/602),P<0.05],2023年达22.1%(137/619);此两个区域的上升比率都高于粤东和粤西,其中粤东从2019年1.0%(5/477)上升至2023年14.4%(82/571),粤西从2019年0(0/325)上升至2023年15.7%(87/553)。VR-Efm检出率从2019年的1.4%(63/4 543)上升至2023年的21.3% (1 351/6 345),2023年VR-Efm检出率超过20%的医疗机构达44.7% (17所)。
为明确VR-Efm检出率上升是否与ESKAPE其余5种细菌的检出率变迁存在同步性,本研究同步分析了38所医疗机构在2019—2023年MRSA、CREN、CRKP、CRPA和CRAB的检出率。ESKAPE整体由2019年10.1% (17 050/168 145,分母为分离菌总株数) 升至2023年10.8%(24 524/227 907),5种病原体中,除CRKP检出率从2019年8.0% (1 452/18 056)上升至2023年15.0%(4 078/27 268)外,CRAB检出率从2019年61.6%(6 429/10 444)下降至2023年58.2%(7 443/12 783),MRSA检出率从2019年34.4%(5 447/15 854)下降至2023年31.9%(6 980/21 896),CRPA检出率从2019年21.2% (3 376/15 901)下降至2023年21.0% (4 287/20 400),CREN检出率从2019年7.9%(283/3 589) 下降至2023年7.6%(385/5 085),皆有不同程度下降。见图 1。
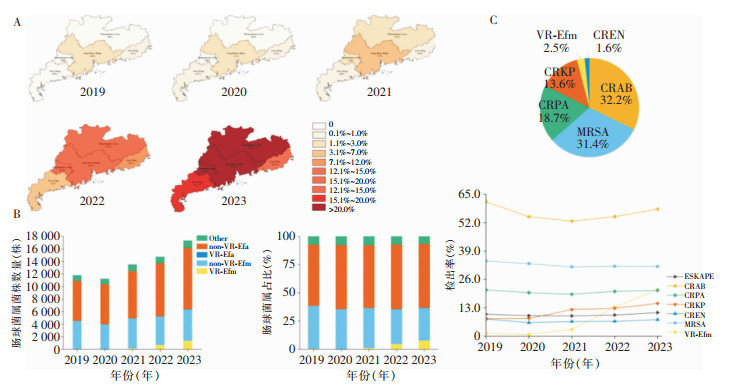 |
| 注:A为广东省不同地区每年VR-Efm检出率热图;B为2019—2023年肠球菌属中各菌种菌株数量和占比变迁,non-VR-Efm为非万古霉素耐药屎肠球菌,non-VR-Efa为非耐万古霉素粪肠球菌,Other为其他肠球菌;C中饼状图为2019—2023年ESKAPE不同病原菌的分布,折线图为ESKAPE病原菌检出率变化趋势。 图 1 广东省2019—2023年VR-Efm分布特征及ESKAPE不同病原菌分布和检出率变化趋势 Figure 1 Distribution characteristics of VR-Efm and trends in distribution and detection rates of different ESKAPE pathogens, Guangdong Province, 2019-2023 |
2019—2023年ICU VR-Efm检出率为12.2%(95%CI: 11.4%~13.0%),高于其他非ICU科室(P<0.05)。外科检出率[7.0%(95%CI: 6.4%~7.6%)]低于内科检出率[9.2%(95%CI: 8.6%~9.9%),P<0.05]。门急诊[9.4%(95%CI: 7.6%~11.6%)]与内科的检出率相当(P>0.05)。不同临床科室VR-Efm检出率均增加,尤其以ICU最突出,从2019年的1.8% 上升至2023年的27.3%,涨幅为14.2倍,而其他科室涨幅在5倍以上。见图 2A、B。
 |
| 注:A为各科室VR-Efm检出率变迁;B为不同科室VR-Efm检出率;C为不同标本VR-Efm检出率变迁;D为不同标本VR-Efm检出率。 图 2 广东省2019—2023年不同科室和标本中VR-Efm检出率及变化趋势 Figure 2 Detection rates and changing trend of VR-Efm from different departments and specimens, Guangdong Province, 2019-2023 |
2019—2023年尿标本VR-Efm检出率为9.8%(95%CI: 9.3%~10.3%),高于血液[9.1%(95%CI: 7.9%~10.4%)]、伤口[6.9%(95%CI: 5.5%~8.7%)]、无菌体液[7.3%(95%CI: 6.6%~8.2%),均P<0.05],与其他标本的检出率相当[9.6%(95%CI: 8.5%~10.8%),P>0.05]。不同标本VR-Efm检出率均有不同程度上升,其中血标本的检出率从2019年1.2%上升至2023年20.3%。不同科室各种标本VR-Efm检出率与总体不同标本VR-Efm检出率一致。见图 2 C、D,表 1。
| 表 1 各临床科室不同标本中VR-Efm检出率[%,(VR-Efm株数/屎肠球菌株数)] Table 1 Detection rates of VR-Efm from different specimens from different clinical departments (%, [No. of VR-Efm /No. of Enterococcus faecium strains]) |

|
不同年龄组患者VR-Efm检出率比较,差异有统计学意义(P<0.05)。0~19岁年龄组VR-Efm检出率为4.4%(95%CI:3.4%~5.6%),低于20~39岁年龄组[7.9%(95%CI:6.7%~9.2%)]、40~59岁年龄组[9.6%(95%CI:8.9%~10.4%)]、60~79岁年龄组[9.4%(95%CI:8.9%~10.0%)]、≥80岁年龄组[9.6%(95%CI:8.9%~10.4%)],0~19岁年龄组患者VR-Efm检出率分别与不同年龄组比较,差异均有统计学意义(均P<0.05);20~39岁年龄组患者VR-Efm检出率低于40~59、60~79、≥80岁年龄组(均P<0.05)。见图 3。男性患者VR-Efm检出率为9.2%(95%CI:8.7%~9.7%),女性患者为9.1%(95%CI:8.6%~9.6%),两者VR-Efm检出率比较,差异无统计学意义(P>0.05)。
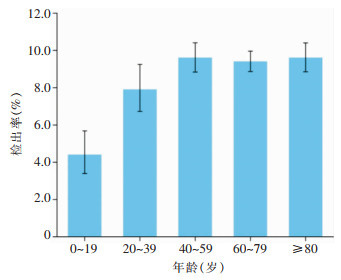 |
| 图 3 各年龄段患者VR-Efm检出率 Figure 3 Detection rates of VR-Efm from patients in different age groups |
本调查通过分析广东省38所医疗机构2019—2023年细菌耐药监测数据发现,该省临床VR-Efm检出率呈上升趋势,从2019年的1.4%上升至2023年的21.3%,与全国细菌耐药监测网的监测[3]结果一致。究其原因,可能与VR-Efm流行克隆在广东省传播有关。首先,从地理热图和时间进程可见2023年全广东4个区域VR-Efm检出率短时间同步快速上涨,可能与耐药克隆传播并导致暴发流行有关。经济发达的珠三角地区VR-Efm检出率位居广东省首位,也是检出率最早开始上升的区域。此可能与珠三角地区中广州、深圳是广东省医疗资源最丰富的城市有关,两地是周边地区重症患者最集中的区域,可能导致输入性的VR-Efm比例较高;而这些医疗机构多存在高选择性抗菌药物压力,更促成了VR-Efm发生和迅速在医院传播。从VR-Efm检出率上升的时间顺序看,无论是经济落后的粤北地区,还是距离较远的粤西和粤东地区,在2023年均达最高。这些区域收治社区性感染患者相对多于珠三角,而且与珠三角双向转诊机会较多。这种地理时空背景下的VR-Efm检出率增高,提示本地区可能存在优势克隆在社区和医院传播。其次,从VR-Efm检出科室、标本类型和人口学分布来看,提示可能存在社区和医院VR-Efm克隆同步传播。ICU是ESKAPE高检出率的场所,这些细菌常以污染、定植和感染的形式存在于ICU中,并通过多种方式传播,不断进化,形成生存力更强和传播范围广的优势克隆[6]。本研究中ICU VR-Efm检出率高于其他科室,而且在尿、血及引流液和下呼吸道等多种标本中检出率都较高。同时,分析各个科室多种标本中VR-Efm检出率也都较高,很难仅以抗菌药物选择压力下导致VR-Efm检出率增加来解释,更可能是患者从社区获得VR-Efm优势克隆,在医院内以多种方式传播,导致多个科室VR-Efm检出率同步上升。值得注意的是,进一步分析ESKAPE其他几种病原体的占比变迁,发现除CRKP检出率上升外,其他几种耐药菌比例呈下降趋势。在新型冠状病毒感染(COVID -19)疫情三年中,各医疗机构都加强了医院感染控制措施,其效果可以从MRSA、CRPA和CRAB检出率下降来解释,但CRKP和VR-Efm检出率不降反升,可能用优势克隆的不断进化能更好说明广东省整体VR-Efm上升的原因。已有多篇报道[7-9]产KPC的CRKP克隆株ST11,在全国几乎所有区域都居高不下,而且其耐药性和毒力仍在不断进化,给感染防控带来极大挑战。另一方面,本研究在门急诊和内科VR-Efm检出率也明显上升,达近10%,明显高出肠球菌属的VR-Efa检出率,提示VR-Efm在社区感染中可能也存在克隆传播。
本研究不包含VR-Efm菌株的分子流行性病学数据,对分析本地区VR-Efm明显上升的原因存在局限性。但已有报道[10-11]显示,VR-Efm国际流行克隆CC17的传播,是导致多个国家VR-Efm检出率居高不下的原因。迄今CC17在人、食源性动物、野生动物及患者都有检出,其可在宿主肠道或环境定植,在多种驱动因素下,导致VR-Efm从定植向感染演化,在社区和医院都易发生不同规模的暴发流行。我国前期对北方地区VR-Efm的分子流行研究也报道了CC17的传播流行[12]。本研究广东地区VR-Efm检出率短期内普遍上升,且在经济发达地区和经济欠发达区域几乎同步上升,并在多个临床科室和多种临床标本检出比例都相似,推测可能也与VR-Efm流行克隆传播有关。VR-Efm检出率上升是否与前期报道的CC17克隆传播有关,将是本研究下一步分子生物学研究的重点。
致谢: 感谢广东省细菌耐药监测网成员单位提供的数据信息。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis[J]. Lancet, 2022, 399(10325): 629-655. DOI:10.1016/S0140-6736(21)02724-0 |
| [2] |
European Centre for Disease Prevention and Control. Antimicrobial resistance in the EU/EEA (EARS-Net)-annual epidemiological report for 2022[EB/OL]. (2023-11-17)[2024-02-04]. https://www.ecdc.europa.eu/en/publications-data/surveillance-antimicrobial-resistance-europe-2022.
|
| [3] |
全国细菌耐药监测网. 全国细菌耐药监测网2014—2019年细菌耐药性监测报告[J]. 中国感染控制杂志, 2021, 20(1): 15-31. China Antimicrobial Resistance Surveillance System. Antimicrobial resistance of bacteria: surveillance report from China Antimicrobial Resistance Surveillance System in 2014-2019[J]. Chinese Journal of Infection Control, 2021, 20(1): 15-31. DOI:10.12138/j.issn.1671-9638.20216170 |
| [4] |
Clinical and Laboratory Standards Institute. Performance stan-dards for antimicrobial susceptibility testing: M100-S33[S]. Malvern, PA, USA: CLSI, 2023.
|
| [5] |
广东省统计局和国家统计局广东调查总队. 广东统计年鉴2023年[EB/OL]. (2023-10-31)[2024-02-04]. http://stats.gd.gov.cn/gdtjnj/content/post_4274608.html. Statistics Bureau of Guangdong Province & Survey Office of the National Bureau of Statistics in Guangdong. Guangdong statistical yearbook 2023[EB/OL]. (2023-10-31)[2024-02-04]. http://stats.gd.gov.cn/gdtjnj/content/post_4274608.html. |
| [6] |
De Oliveira DMP, Forde BM, Kidd TJ, et al. Antimicrobial resistance in ESKAPE pathogens[J]. Clin Microbiol Rev, 2020, 33(3): e00181-19. |
| [7] |
Zhou K, Xue CX, Xu TT, et al. A point mutation in recC associated with subclonal replacement of carbapenem-resistant Klebsiella pneumoniae ST11 in China[J]. Nat Commun, 2023, 14(1): 2464. DOI:10.1038/s41467-023-38061-z |
| [8] |
Hu F, Pan Y, Li H, et al. Carbapenem-resistant Klebsiella pneumoniae capsular types, antibiotic resistance and virulence factors in China: a longitudinal, multi-centre study[J]. Nat Microbiol, 2024, 9(3): 814-829. DOI:10.1038/s41564-024-01612-1 |
| [9] |
Li YT, Wang YC, Chen CM, et al. Distinct evolution of ST11 KL64 Klebsiella pneumoniae in Taiwan[J]. Front Microbiol, 2023, 14: 1291540. DOI:10.3389/fmicb.2023.1291540 |
| [10] |
Lee T, Pang S, Abraham S, et al. Antimicrobial-resistant CC17 Enterococcus faecium: the past, the present and the future[J]. J Glob Antimicrob Resist, 2019, 16: 36-47. DOI:10.1016/j.jgar.2018.08.016 |
| [11] |
Peng ZX, Yan L, Yang SR, et al. Antimicrobial-resistant evolution and global spread of Enterococcus faecium clonal complex (CC) 17: progressive change from gut colonization to hospital-adapted pathogen[J]. China CDC Wkly, 2022, 4(2): 17-21. DOI:10.46234/ccdcw2021.277 |
| [12] |
Kang M, Xie Y, He C, et al. Molecular characteristics of vancomycin-resistant Enterococcus faecium from a tertiary care hospital in Chengdu, China: molecular characteristics of VRE in China[J]. Eur J Clin Microbiol Infect Dis, 2014, 33(6): 933-939. |



