2. 蚌埠医学院病理生理教研室, 安徽 蚌埠 233000
2. Department of Pathophysiology, Bengbu Medical College, Bengbu 233000, China
脓毒症(sepsis)的发病率逐年上升,已成为主要的公众健康问题之一,也是全球重症监护病房(ICU)非冠脉性疾病危重和死亡的主要原因,免疫紊乱是其最显著特点,其中持续的免疫抑制更是成为当前新的研究热点[1]。在脓毒症住院患者中,病原体相关分子模式(PAMPs)及受损或坏死组织来源的损伤相关分子模式(DAMPs)被宿主模式识别受体(PRRs)识别,启动相应的免疫反应。而适应性免疫系统可以通过控制或局限化损伤过程来保持免疫平衡状态。这种促进和拮抗的调节异常时出现控制失衡,甚至引发“细胞因子风暴”(cytokine storm)[2],诱发过度炎症反应。虽然部分脓毒症患者可以度过最初的炎症风暴阶段,但若免疫抑制持续存在将进一步增加医院获得性感染和病原体再活化的风险。而这种脓毒症患者免疫抑制的重要机制就是程序性死亡受体1(programmed cell death protein-1, PD-1)与程序性死亡受体-配体1(programmed cell death ligand-1, PD-L1)途径,其与T细胞、B细胞、中性粒细胞、MPS的活化增殖受到抑制及调节性T细胞(Treg)和MDSC等数量的增加密切相关,PD-1/PD-L1对脓毒症患者免疫状态以及疾病发展中的作用引起学界高度关注,但对于PD-1/PD-L1检测作为免疫生物标志物和治疗靶点的临床价值并未能达成共识,尤其当免疫检查点阻断剂的相关抗体治疗试验及结果并未最终完成时[3-4]。
1 PD-1/PD-L1PD-1(CD279)是CD28/CTLA-4/ICOS共刺激受体家族中对T细胞和B细胞免疫的关键成员,负责传递负性调节信号。PD-1由PDCD1基因编码的单体I型跨膜糖蛋白,其结构包括胞外结构域——免疫球蛋白可变区(IgV)、跨膜结构域和胞质尾区,来共同执行细胞内信号传导。PD-1属于CD28家族成员[5-6],当胞外段与其配体PD-L1结合后,胞内段免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motif, ITIM)和转换基序(immunoreceptor tyrosine-based switch motif, ITSM)主要发挥免疫抑制作用。PD-1与PD-L1的结合可以导致PD-1胞质尾部酪氨酸磷酸化,募集酪氨酸磷酸酶(SHP-2)直接拮抗T细胞受体(TCR)和CD28活化信号[7]。在癌症免疫中发现,癌细胞表面PD-L1踩下“免疫刹车”,可以抑制免疫细胞活化,临床试验也发现该分子对于肿瘤具有逃避免疫攻击的作用[8-9]。由于PD-L1在T细胞、B细胞、树突状细胞(DCs)、巨噬细胞(Mø)及其他非造血细胞上广泛表达,而PD-L2表达受限,主要在DCs、Mø和B细胞上表达[10],因此PD-1/PD-L1作为免疫诊疗的潜在靶点得到了更多的研究。Herbst等[11]研究发现PD-1抗体在晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的二线治疗中优于化学治疗,且首次证实PD-L1表达水平可作为生物标志物预测PD-1抗体疗效;但与此同时,也会因释放自身反应性T细胞导致类风湿关节炎等自身免疫性疾病[12]。因此,PD-1/PD-L1在机体免疫中作用较复杂,了解其在脓毒症中的免疫机制尤其重要。
2 脓毒症与免疫免疫炎症紊乱是脓毒症发生发展的核心机制,相关认识正在不断深化。在正常情况下,所有活化的T细胞均表达PD-1,其作为一个“天然刹车”可以平衡T细胞的过度激活反应,参与免疫耐受。但在脓毒症发生发展过程中,PD-1/PD-L1通路会对固有免疫及适应性免疫产生损伤,总体上发挥免疫抑制作用,见图 1。PD-1/PD-L1使中性粒细胞、DCs、单核细胞、吞噬细胞等产生功能障碍,不仅直接破坏固有免疫系统功能,作为抗原提呈细胞进一步阻碍适应性免疫应答;PD-1/PD-L1表达水平的升高还可直接增加T细胞耗竭和凋亡,增加Treg细胞的数量和抑制性功能,负向调节适应性免疫反应。简言之,PD-1/PD-L1通路在脓毒症的免疫抑制机制中作用独特。
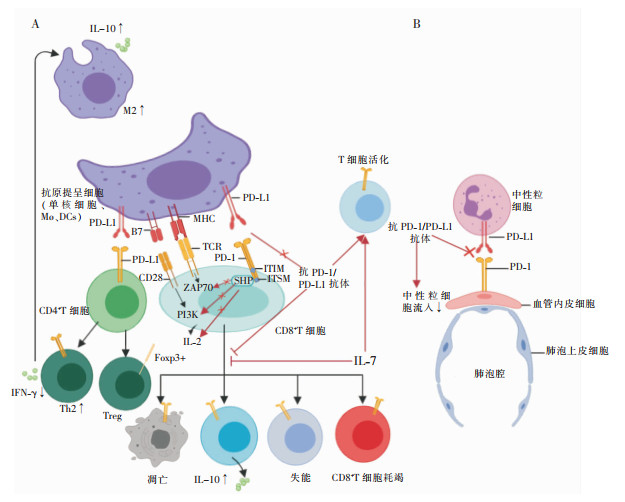 |
| PI3K:磷酸磷脂酰激酶-3羟激酶;ZAP70:ζ链相关蛋白激酶70;SHP:酪氨酸磷酸酶。A:PD-1与PD-L1连接,ITSM募集的SHP通过ZAP-70或PI3K通路去磷酸化,抑制下游信号传导,使CD4+T细胞向Treg、Th2分化增多,CD8+T细胞耗竭、失能及抗炎因子白介素(IL)-10增加,Mø向M2分化增多;PD-1/PD-L1抗体、IL-7可以抑制T细胞耗竭,增加T细胞活化、增殖。B:中性粒细胞表面PD-1与内皮细胞表面PD-L1结合促进中性粒细胞流入肺泡腔。 图 1 PD-1/PD-L1通路的抑制性信号传导示意图 |
PD-1与PD-L1结合可以引起脓毒症患者T细胞耗竭。T细胞活化需双重信号刺激:其一为APCs的MHC-抗原肽识别TCR,其二为APCs表面的共刺激分子与T细胞表面相应配体相结合。这种双重信号刺激实质上是一种故障-安全模式。CD28/B7相互作用传导T细胞活化信号,PD-L1、PD-L2与B7-1、B7-2在结构上高度同源,所以又分别被命名为B7-H1和B7-H2,PD-1:PD-Ls通路为抑制T细胞激活的协同刺激信号,一方面参与宿主免疫耐受对阻止自身免疫性疾病的发生起到保护作用;另一方面通过引起T细胞耗竭而产生免疫抑制。脓毒症T细胞耗竭主要表现为T细胞活化及增殖能力下降、凋亡增加和细胞因子减少:(1)调节性T细胞(Foxp3+ Treg)数量增加,PD-1表达上调,同时APCs表面CD80/86表达下调,共同抑制T细胞活化增殖[13],并且PD-1+Treg具有协助微生物逃避免疫监视的作用。Foxp3是Treg的关键转录调控因子,进入外周循环的原始CD4+T细胞可以通过TCR和PD-1与APCs上配体结合诱导其表达FoxP3,Francisco等[14]通过试验发现PD-L1表达缺陷的APCs诱导CD4+T细胞向Treg表型转变的能力最弱。(2)T淋巴细胞表面IL-7R减少,抑制性受体PD-1、CTLA-4、TIM-3、LAG-3等表达增加,IFN-γ等细胞因子分泌减少[15],PD-1及配体(PD-L1、PD-L2)在众多导致T细胞耗竭的机制中被认为发挥了关键作用[16-17]。此外,在TCR信号通路中,PD-1/PD-L1作用于中间分子如PI3K、Akt、ZAK-70和PKC-
脓毒症患者的中性粒细胞(PMNs)可通过PD-1/PD-L1通路抑制T细胞活化增殖。这一途径主要因为脓毒症急性期PD-L1+中性粒细胞即低密度中性粒细胞(low-density neutrophils, LDNs)大量增加。Huang等[22]根据免疫组化区分PMNs表面PD-1/PD-L1表达高(PD-L1high)低(PD-L1low)的亚群。Patera等[23]也发现PD-L1high PMNs表面CD168表达下降和TNF-α分泌减少,对于外来微生物的吞噬能力下降。Lomas-Neira等[24]在小鼠间接性急性呼吸窘迫综合征(ARDS)模型中发现中性粒细胞PD-1与内皮细胞表面PD-L1结合会破坏肺内皮细胞(EC)屏障,中性粒细胞流入肺泡增加,而PD-1/PD-L1基因敲除的小鼠EC屏障改善,支气管肺泡灌洗液蛋白减少。总之,中性粒细胞PD-1和PD-L1表达增加与脓毒症预后不良密切相关。
2.3 PD-1/PD-L1与单核巨噬细胞系统单核巨噬细胞系统(mononuclear phagocytic system, MPS)包括单核细胞、Mø和DCs,在脓毒症发展到晚期免疫抑制阶段时,PD-1/PD-L1轴会使MPS发生细胞功能障碍,细胞向抑炎表型转化。
2.3.1 PD-1/PD-L1与MøMø是一种具有可塑性和多能性的细胞群体,PD-1/PD-L1通路严重损伤Mø这一特性。Huang等[25]通过CLP(盲肠结扎和穿孔)模型发现从脓毒症小鼠获得的Mø分泌的抗炎因子IL-10显著增加,表型向M2型转化,CD4+T细胞向Th2型分化及CD8+T细胞失能;脓毒症组相比较于对照组PD-1+单核细胞数量明显增加,认为Mø和单核细胞PD-1表达上调与细胞本身功能下降相关,进而导致脓毒症免疫抑制。PD-1/PD-L1基因敲除后上述表现显著减弱,小鼠存活率升高。Wang等[26]试验发现PD-1在脓毒症小鼠的Kupffer细胞中表达上调,而且MHC-II和CD86表达水平在PD-1基因敲除的CLP小鼠中部分恢复,其kupffer细胞吞噬功能明显增强。众所周知,目前主流观点认为Mø表型分为M1、M2,M2可以细分为M2a、M2b、M2c等,不同的表型在炎症中发挥不同的作用且具有可塑性[27],上述试验证明PD-1/PD-L1通路可能与Mø表型分化相关,那么将会间接阻遏Mø将抗原提呈给T淋巴细胞,最终抑制T细胞的活化增殖。此外,Deng等[28]的研究阐述核心生物钟基因BMAL1缺失上调丙酮酸激酶M2(PKM2),PKM2是Mø PD-L1依赖STAT1途径表达所必需的,消除PKM2或者给予抗PD-L1抗体可以阻止T细胞凋亡,降低脓毒症病死率。
2.3.2 PD-1/PD-L1与单核细胞单核细胞是机体防御系统重要组成部分,感染时可以向Mø、DCs转化,而PD-1/PD-L1通路参与调控单核细胞的功能。单核细胞可以通过Shao等[29]研究发现脓毒症患者单核细胞PD-L1表达水平可以独立预测28天死亡率,说明这一指标与脓毒症疾病严重程度呈正相关。试验发现脓毒症晚期单核细胞通过缺氧诱导因子-1α(HIF-1α)信号通路抑制促炎因子的产生,并诱导单核细胞上PD-L1蛋白表达上调,从而发生免疫抑制[30-31];其中HIF-1α可以介导蛋白信号转导和转录激活因子3(STAT3)使单核细胞发生功能障碍[32]。但是,单核细胞和T细胞的信号沟通机制尚需进一步了解。
2.3.3 PD-1/PD-L1与DCsDCs是重要的抗原提呈细胞之一,该细胞功能障碍在脓毒症免疫抑制阶段起关键作用。TIPE1是肿瘤坏死因子α诱导蛋白8(TnFAIP8)家族的新成员,与细胞死亡有一定关系。Luan等[33]试验发现TIPE1负向调控DCs成熟和活化,TIPE1基因敲除的小鼠中DCs表面CD80、CD86、MHC-II表达上调,PD-1、PD-L1表达下调,这说明TIPE1基因可能通过PD-1/PD-L1通路发挥抑制DCs成熟活化及T细胞免疫反应的作用。DCs受到LPS和TNF-α刺激时细胞周期蛋白依赖性激酶5(CDK5)表达会增加,在肿瘤及慢性鼻窦炎中均发现CDK5参与调节免疫抑制基因,CDK5的增加可以上调DCs上PD-L1的表达水平[34-35],但CDK5和PD-L1在脓毒症中的联系尚无结论。总而言之,PD-1/PD-L1通路使MPS细胞功能障碍,直接或间接导致脓毒症发生免疫抑制。
3 抗PD-1/PD-L1疗法与脓毒症脓毒症初期机体受到抗原刺激,APCs表面的CD80/86、MHC-I/II分别与T细胞表面的CD28、TCR结合传递活化T细胞的第一及第二共刺激信号,T细胞活化增殖并消除外来微生物。但活化后的T细胞PD-1表达也会被激活,PD-1与PD-L1结合后会阻遏第二共刺激信号,诱导T细胞耗竭及凋亡,使机体发生免疫抑制。目前脓毒症动物试验大量展开,当下创建脓毒症模型的两种常用方法:LPS法和CLP法,动物模型通常采用成年大鼠。Huang等[25]研究发现PD-1基因敲除的大鼠较野生组存活率提高,试验组大鼠Mø功能正常,细菌清除率改善,促炎细胞因子产生减少。鼠的免疫反应能否模拟人类炎症性疾病(例如脓毒症)存在争议,Wakeley等[36]补充了有关人类患者的试验,通过分析脓毒症休克患者PD-1表达模式和细胞因子图谱发现免疫细胞PD-1表达水平升高与IFN-γ、IL-4等分泌增加呈正相关,而这些细胞因子与Th1、Th2反应及细胞因子风暴密切相关,同时,APACHE II评分>20分与PD-1过表达有关的结论提示抗PD-1抗体作为脓毒症的治疗策略的可能性。Hotchkiss等[4]针对31例患有脓毒症和总淋巴细胞减少症(定义为绝对淋巴细胞计数≤1.1×103/μL)的成年患者进行了抗PD-1单克隆抗体纳武单抗(nivolumab)的1b期平行组随机对照试验,虽然临床观察患者免疫力改善并不如肿瘤患者明显,但是鼓舞人心的是这次临床试验并没有发生严重不良事件(SAE)。同期24例成年脓毒症患者进行的抗PD-L1抗体(BMS-936559)试验已经结束,但结果尚未公布。虽然目前尚无SAE的相关报道,但是PD-1/PD-L1通路与脓毒症治疗的有效性和安全性还需更多试验进一步验证。
4 结语与展望脓毒症动物模型和临床试验提示在脓毒症免疫抑制阶段,PD-1/PD-Ls的过表达导致免疫细胞功能受到抑制,从而增加了脓毒症患者的病死率。PD-1/PD-Ls不仅作用于抗原提呈细胞与淋巴细胞,还作用于抗原提呈细胞之间、免疫细胞与非免疫细胞之间,可能通过影响抵抗微生物免疫防御与免疫介导的组织损伤之间的平衡来影响病原体感染的结局。大量试验发现免疫检查点抑制剂(ICI)在许多恶性肿瘤中有一定治疗效果,且抗PD-1、PD-L1抗体在治疗脓毒症的Ⅰb期临床试验已经开展,PD-1/PD-Ls及下游信号转导过程中的分子可能成为脓毒症新的诊断标志物和潜在治疗靶点。而PD-1/PD-Ls在脓毒症免疫抑制中的具体作用机制如PD-1/PD-Ls如何联系固有免疫和适应性免疫、如何作用于非免疫细胞、PD-1/PD-Ls下游信号转导途径等许多问题尚不清楚,有待于进一步思考和研究。
| [1] |
Reinhart K, Daniels R, Kissoon N, et al. Recognizing sepsis as a global health priority-A WHO resolution[J]. N Engl J Med, 2017, 377(5): 414-417. DOI:10.1056/NEJMp1707170 |
| [2] |
Chousterman BG, Swirski FK, Weber GF. Cytokine storm and sepsis disease pathogenesis[J]. Semin Immunopathol, 2017, 39(5): 517-528. DOI:10.1007/s00281-017-0639-8 |
| [3] |
Hotchkiss RS, Colston E, Yende S, et al. Immune checkpoint inhibition in sepsis: a phase 1b randomized, placebo-controlled, single ascending dose study of antiprogrammed cell death-ligand 1 antibody (BMS-936559)[J]. Crit Care Med, 2019, 47(5): 632-642. DOI:10.1097/CCM.0000000000003685 |
| [4] |
Hotchkiss RS, Colston E, Yende S, et al. Immune checkpoint inhibition in sepsis: a phase 1b randomized study to evaluate the safety, tolerability, pharmacokinetics, and pharmacodynamics of nivolumab[J]. Intensive Care Med, 2019, 45(10): 1360-1371. DOI:10.1007/s00134-019-05704-z |
| [5] |
Ishida Y, Agata Y, Shibahara K, et al. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death[J]. EMBO J, 1992, 11(11): 3887-3895. DOI:10.1002/j.1460-2075.1992.tb05481.x |
| [6] |
Shinohara T, Taniwaki M, Ishida Y, et al. Structure and chromosomal localization of the human PD-1 gene (PDCD1)[J]. Genomics, 1994, 23(3): 704-706. DOI:10.1006/geno.1994.1562 |
| [7] |
Sharpe AH, Pauken KE. The diverse functions of the PD1 inhibitory pathway[J]. Nat Rev Immunol, 2018, 18(3): 153-167. DOI:10.1038/nri.2017.108 |
| [8] |
Gordon SR, Maute RL, Dulken BW, et al. PD-1 expression by tumour-associated macrophages inhibits phagocytosis and tumour immunity[J]. Nature, 2017, 545(7655): 495-499. DOI:10.1038/nature22396 |
| [9] |
Forde PM, Chaft JE, Smith KN, et al. Neoadjuvant PD-1 blockade in resectable lung cancer[J]. N Engl J Med, 2018, 378(21): 1976-1986. DOI:10.1056/NEJMoa1716078 |
| [10] |
Dai SY, Jia R, Zhang X, et al. The PD-1/PD-Ls pathway and autoimmune diseases[J]. Cell Immunol, 2014, 290(1): 72-79. DOI:10.1016/j.cellimm.2014.05.006 |
| [11] |
Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial[J]. Lancet, 2016, 387(10027): 1540-1550. DOI:10.1016/S0140-6736(15)01281-7 |
| [12] |
Belkhir R, Burel SL, Dunogeant L, et al. Rheumatoid arthritis and polymyalgia rheumatica occurring after immune checkpoint inhibitor treatment[J]. Ann Rheum Dis, 2017, 76(10): 1747-1750. DOI:10.1136/annrheumdis-2017-211216 |
| [13] |
Bauer CA, Kim EY, Marangoni F, et al. Dynamic Treg interactions with intratumoral APCs promote local CTL dysfunction[J]. J Clin Invest, 2014, 124(6): 2425-2440. DOI:10.1172/JCI66375 |
| [14] |
Francisco LM, Salinas VH, Brown KE, et al. PD-L1 regulates the development, maintenance, and function of induced regulatory T cells[J]. J Exp Med, 2009, 206(13): 3015-3029. DOI:10.1084/jem.20090847 |
| [15] |
Venet F, Monneret G. Advances in the understanding and treatment of sepsis-induced immunosuppression[J]. Nat Rev Nephrol, 2018, 14(2): 121-137. DOI:10.1038/nrneph.2017.165 |
| [16] |
Pauken KE, Wherry EJ. Overcoming T cell exhaustion in infection and cancer[J]. Trends Immunol, 2015, 36(4): 265-276. DOI:10.1016/j.it.2015.02.008 |
| [17] |
Shindo Y, McDonough JS, Chang KC, et al. Anti-PD-L1 peptide improves survival in sepsis[J]. J Surg Res, 2017, 208: 33-39. DOI:10.1016/j.jss.2016.08.099 |
| [18] |
Fife BT, Pauken KE, Eagar TN, et al. Interactions between PD-1 and PD-L1 promote tolerance by blocking the TCR-induced stop signal[J]. Nat Immunol, 2009, 10(11): 1185-1192. DOI:10.1038/ni.1790 |
| [19] |
Wherry EJ, Kurachi M. Molecular and cellular insights into T cell exhaustion[J]. Nat Rev Immunol, 2015, 15(8): 486-499. DOI:10.1038/nri3862 |
| [20] |
Niu BL, Zhou FC, Su YX, et al. Different expression characteristics of LAG3 and PD-1 in sepsis and their synergistic effect on T cell exhaustion: a new strategy for immune checkpoint blockade[J]. Front Immunol, 2019, 10: 1888. DOI:10.3389/fimmu.2019.01888 |
| [21] |
孔令宇, 席錾, 马文婷, 等. 连续性肾替代治疗对脓毒症患者CD8+T淋巴细胞功能的影响[J]. 中国感染控制杂志, 2018, 17(11): 974-978. DOI:10.3969/j.issn.1671-9638.2018.11.006 |
| [22] |
Huang X, Chen YP, Chung CS, et al. Identification of B7-H1 as a novel mediator of the innate immune/proinflammatory response as well as a possible myeloid cell prognostic biomarker in sepsis[J]. J Immunol, 2014, 192(3): 1091-1099. DOI:10.4049/jimmunol.1302252 |
| [23] |
Patera AC, Drewry AM, Chang K, et al. Frontline science: defects in immune function in patients with sepsis are associated with PD-1 or PD-L1 expression and can be restored by antibodies targeting PD-1 or PD-L1[J]. J Leukoc Biol, 2016, 100(6): 1239-1254. DOI:10.1189/jlb.4HI0616-255R |
| [24] |
Lomas-Neira J, Monaghan SF, Huang X, et al. Novel role for PD-1:PD-L1 as mediator of pulmonary vascular endothelial cell functions in pathogenesis of indirect ARDS in mice[J]. Front Immunol, 2018, 9: 3030. DOI:10.3389/fimmu.2018.03030 |
| [25] |
Huang X, Venet F, Wang YL, et al. PD-1 expression by macrophages plays a pathologic role in altering microbial clea-rance and the innate inflammatory response to sepsis[J]. Proc Natl Acad Sci U S A, 2009, 106(15): 6303-6308. DOI:10.1073/pnas.0809422106 |
| [26] |
Wang F, Huang X, Chung CS, et al. Contribution of programmed cell death receptor (PD)-1 to Kupffer cell dysfunction in murine polymicrobial sepsis[J]. Am J Physiol Gastrointest Liver Physiol, 2016, 311(2): G237-G245. DOI:10.1152/ajpgi.00371.2015 |
| [27] |
Locati M, Curtale G, Mantovani A. Diversity, mechanisms, and significance of macrophage plasticity[J]. Annu Rev Pathol, 2020, 15: 123-147. DOI:10.1146/annurev-pathmechdis-012418-012718 |
| [28] |
Deng WJ, Zhu S, Zeng L, et al. The circadian clock controls immune checkpoint pathway in sepsis[J]. Cell Rep, 2018, 24(2): 366-378. DOI:10.1016/j.celrep.2018.06.026 |
| [29] |
Shao R, Fang YY, Yu H, et al. Monocyte programmed death ligand-1 expression after 3-4 days of sepsis is associated with risk stratification and mortality in septic patients: a prospective cohort study[J]. Crit Care, 2016, 20(1): 124. DOI:10.1186/s13054-016-1301-x |
| [30] |
Li LL, Dai B, Sun YH, et al. Monocytes undergo functional reprogramming to generate immunosuppression through HIF-1α signaling pathway in the late phase of sepsis[J]. Mediators Inflamm, 2020, 2020: 4235909. |
| [31] |
Avendaño-Ortiz J, Maroun-Eid C, Martín-Quirós A, et al. PD-L1 overexpression during endotoxin tolerance impairs the adaptive immune response in septic patients via HIF1α[J]. J Infect Dis, 2018, 217(3): 393-404. DOI:10.1093/infdis/jix279 |
| [32] |
Shalova IN, Lim JY, Chittezhath M, et al. Human monocytes undergo functional re-programming during sepsis mediated by hypoxia-inducible factor-1α[J]. Immunity, 2015, 42(3): 484-498. DOI:10.1016/j.immuni.2015.02.001 |
| [33] |
Luan YY, Zhang L, Zhu FJ, et al. Effect of TIPE1 on immune function of dendritic cells and its signaling pathway in septic mice[J]. J Infect Dis, 2019, 220(4): 699-709. DOI:10.1093/infdis/jiz158 |
| [34] |
Dorand RD, Nthale J, Myers JT, et al. Cdk5 disruption attenuates tumor PD-L1 expression and promotes antitumor immunity[J]. Science, 2016, 353(6297): 399-403. DOI:10.1126/science.aae0477 |
| [35] |
Liu CC, Zhang HL, Zhi LL, et al. CDK5 regulates PD-L1 expression and cell maturation in dendritic cells of CRSwNP[J]. Inflammation, 2019, 42(1): 135-144. DOI:10.1007/s10753-018-0879-3 |
| [36] |
Wakeley ME, Gray CC, Monaghan SF, et al. Check point inhibitors and their role in immunosuppression in sepsis[J]. Crit Care Clin, 2020, 36(1): 69-88. DOI:10.1016/j.ccc.2019.08.006 |



