2. 中南大学湘雅医院医院感染控制中心, 湖南 长沙 410008;
3. 中南大学湘雅医院重症医学科, 湖南 长沙 410008;
4. 中南大学湘雅三医院感染科, 湖南 长沙 410013;
5. 中南大学湘雅三医院医院感染控制中心, 湖南 长沙 410013
2. Center for Healthcare-associated Infection Control, Xiangya Hospital, Central South University, Changsha 410008, China;
3. Intensive Care Unit, Xiangya Hospital, Central South University, Changsha 410008, China;
4. Department of Infectious Diseases, The Third Xiangya Hospital, Central South University, Changsha 410013, China;
5. Center for Healthcare-associated Infection Control, The Third Xiangya Hospital, Central South University, Changsha 410013, China
体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)首先用于治疗成人呼吸窘迫综合征[1],目前作为危重患者的一种新型治疗手段,越来越多危及生命的呼吸系统疾病、心血管疾病和心肺衰竭患者从中获益,如危重型新冠肺炎患者常伴有呼吸衰竭和急性呼吸窘迫,ECMO作为重要的体外生命支持方式发挥了重要作用[2-5]。作为有创治疗,ECMO可发生大出血、血栓形成及其他严重并发症,感染是其最常见和致命的并发症之一[6-9]。接受ECMO治疗的患者病死率较高,原因纷繁复杂,其中医疗相关感染(healthcare-associated infection,HAI)日益引起医务人员的关注。文献[10]报道,约64%接受ECMO的心源性休克患者发生医院感染,病死率达36%。近年来,国外有研究[11-15]报道接受ECMO患者相关医院感染发病率较高,危险因素较多。因此,本研究旨在评估某院接受ECMO治疗的患者其ECMO相关医院感染的发病率,探讨其危险因素及对患者预后的影响,为ECMO相关医院感染的防控提供理论依据。
1 资料与方法 1.1 病例资料纳入2014年6月—2018年9月在中南大学湘雅医院接受ECMO治疗的患者,治疗时间超过48 h,且年龄>16岁。排除本次治疗前在其他医院接受过ECMO治疗的患者。
1.2 ECMO治疗由重症医学科专家决定是否实施ECMO治疗。患者由ECMO团队(重症医学专家和护士组成)管理,团队成员接受统一培训,24 h值班。ECMO技术主要有静脉-动脉(venoarterial ECMO,VA ECMO)、静脉-静脉(venovenous ECMO,VV ECMO)、静脉-静脉-动脉ECMO三种形式。VA ECMO用于心源性休克、心脏骤停或不可逆心力衰竭患者。VV ECMO仅限于急性可逆性呼吸衰竭患者。以下情况禁用ECMO:(1)心脏骤停前意识状态严重受损;(2)多器官功能障碍;(3)无法控制的外伤性出血、胃肠大出血、颅内活动性出血;(4)明确拒绝心肺复苏意愿;(5)左心室血栓形成;(6)主动脉瓣严重反流。所有患者的床旁护理均由经过培训的护士提供,护患比为1∶1。
1.3 ECMO相关感染的诊断标准医院感染的定义符合2018年美国疾病控制与预防中心及国家医疗安全网络监测的定义[12]。本研究ECMO相关医院感染的定义为:ECMO启动后24 h至停止ECMO后48 h内发生的感染被认为是与ECMO相关的医院感染,且排除在使用ECMO之前发生的感染。
1.4 资料收集与分组回顾性收集患者临床指标,主要包括:住院日期、急性生理和慢性健康(acute physiology and chronic health evalution,APACHE)Ⅱ评分、机械通气、气管插管、气管切开、留置导尿管、留置中央静脉导管、使用纤维支气管镜、血液净化治疗、全肠外营养、输血、使用免疫抑制剂,伴发疾病如慢性肺部疾病、心血管疾病、糖尿病、实体肿瘤、血液肿瘤、创伤、烧伤、肝硬化、慢性肾功能不全及实施ECMO之前48 h内的实验室检查结果(血清蛋白、血清肌酐、总胆红素、血糖、血红蛋白),以及住院费用和抗菌药物费用。
对于每例接受ECMO治疗的患者,选择2例未接受ECMO治疗的患者作为对照组(非ECMO组),对照组纳入标准要求患者性别相同、年龄(±3岁)、入院时间(±1个月),且无感染的患者。通过比较ECMO组和非ECMO组的流行病学和患者情况,了解ECMO组患者的临床特点。根据是否发生ECMO相关医院感染分为ECMO感染组、ECMO对照组(未发生医院感染者),以评估ECMO相关医院感染的危险因素、病死率和医疗费用。
1.5 统计学方法应用SPSS 26.0软件进行数据分析。计量资料符合正态分布以x±s表示,采用独立样本t检验进行比较。计数资料以率表示,采用χ2检验或Fisher确切概率检验进行比较。将单变量纳入logistic多因素回归分析,P ≤ 0.05为差异具有统计学意义。
2 结果 2.1 ECMO组和非ECMO组一般资料研究共纳入2014年6月—2018年9月在重症监护病房(ICU)接受ECMO治疗的患者30例,其中15例(50.0%)患者发生ECMO相关医院感染。30例患者中位年龄41.7岁,男性23例(76.7%),22例患者予以VV ECMO治疗(73.3%),使用ECMO最常见的原因为急性呼吸窘迫综合征,共计23例(76.7%)。ECMO组患者APACHE Ⅱ评分、ICU住院日数、总住院日数、病死率、抗菌药物费用及总住院费用均高于非ECMO组患者,差异均有统计学意义(均P < 0.001)。见表 1。
| 表 1 ECMO组与非ECMO组患者的住院情况及住院费用比较 Table 1 Comparison of hospitalization condition and hospitalization expense between ECMO group and non-ECMO group |
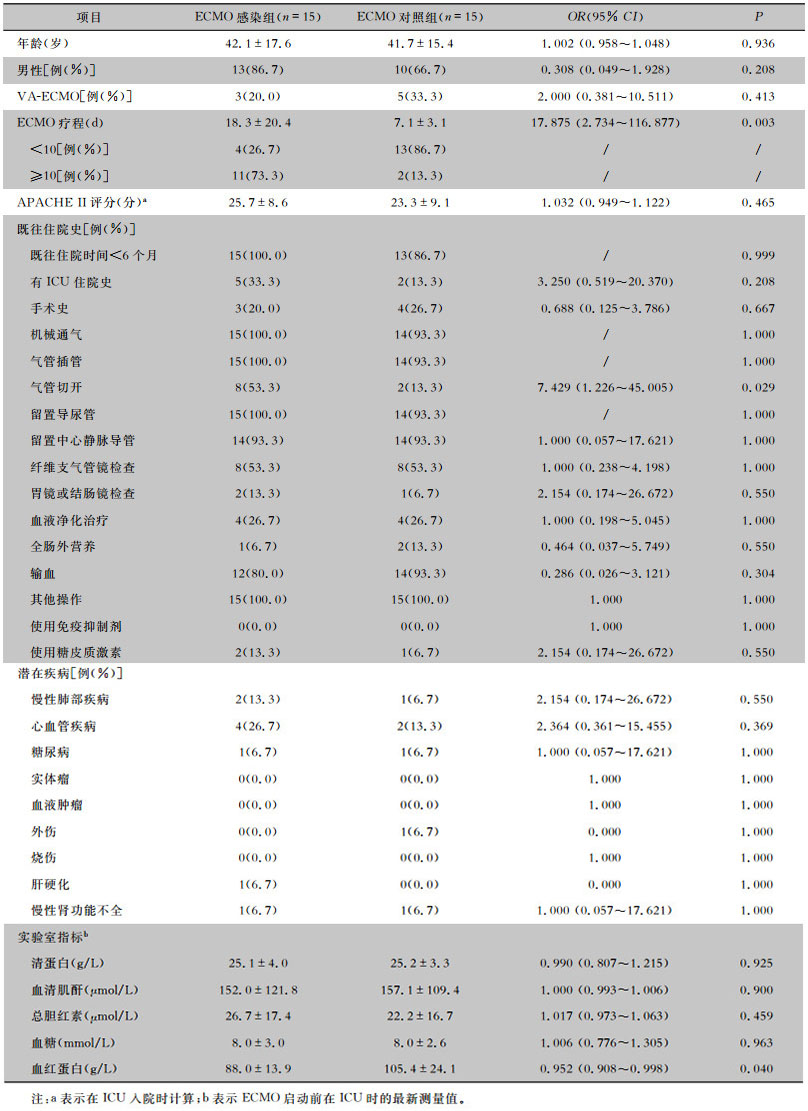
|
患者ICU住院日数ECMO感染组为3~85 d,平均(34.3±22.5)d,ECMO对照组为5~33 d,平均(13.9±7.7)d。患者总住院日数ECMO感染组为6~161 d,平均(44.5±39.6)d,ECMO对照组为7~52 d,平均(18.4±11.7)d。ECMO感染组患者ICU住院日数、总住院日数、抗菌药物费用、总住院费用均高于ECMO对照组,差异均有统计学意义(均P < 0.05)。两组患者病死率比较,差异无统计学意义(P>0.05)。见表 2。有4例患者在ECMO治疗后5 d内出现相关医院感染,3例患者在5~10 d出现,5例患者在10~20 d出现,3例患者超过20 d出现。
| 表 2 ECMO感染组与对照组患者的住院情况及住院费用比较 Table 2 Comparison of hospitalization condition and hospitalization expense between ECMO infection group and control group |
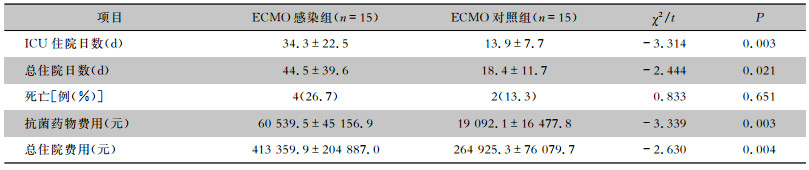
|
相较于对照组,ECMO感染组在ECMO启动前血红蛋白水平较低,行气管切开的患者较多,差异有统计学意义(均P < 0.05)。ECMO感染组患者疗程为2~84 d,ECMO对照组患者疗程为3~15 d。单因素分析结果显示,ECMO持续时间长、气管切开、血红蛋白偏低均为ECMO相关医院感染的危险因素。见表 3。logistic回归分析显示ECMO持续时间≥ 10 d[OR(95%CI):76.271(1.103~5 272.277),P=0.045]为发生ECMO相关医院感染的独立危险因素。
| 表 3 ECMO相关医院感染的临床特征及logistic单因素分析结果 Table 3 Clinical characteristics and logistic univariate analysis results of ECMO-related HAI |

|
15例发生ECMO相关医院感染的患者总共发生24例次感染,涉及感染包括:血流感染12例次、肺部感染9例次(其中呼吸机相关肺炎3例次)、尿路感染1例次、手术部位感染1例次、肠胃炎1例次。15例感染患者共培养出35株病原菌,标本来自痰、支气管灌洗液、血和伤口分泌物,其中检出较多的菌株为:肺炎克雷伯菌(8株)、鲍曼不动杆菌(6株)、铜绿假单胞菌(5株)、嗜麦芽窄食单胞菌(3株),真菌培养出近平滑念珠菌(2株)和热带念珠菌(1株),见表 4。手术部位感染和尿路感染各培养出1株肺炎克雷伯菌。ECMO启动后平均12.3 d(1~26 d)培养出鲍曼不动杆菌,12.8 d(3~26 d)培养出肺炎克雷伯菌,10.6 d(1~26 d)培养出铜绿假单胞菌。
| 表 4 ECMO相关血流、肺部医院感染病原菌分布 Table 4 Distribution of pathogens in ECMO-related bloodstream and pulmonary HAI |
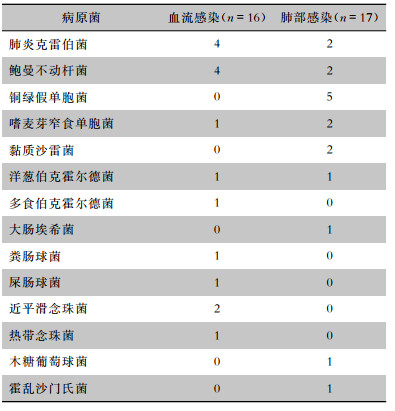
|
ECMO相关医院感染中血流感染发病率最高,单因素分析结果表明,ECMO疗程≥ 10 d、气管切开是ECMO患者发生血流医院感染的危险因素(均P < 0.05);多元logistic回归分析显示ECMO疗程≥ 10 d为ECMO患者发生血流医院感染的独立危险因素[OR (95% CI):25.000 (2.157~289.762),P=0.010]。
3 讨论ECMO作为危重患者的重要生命支持手段,越来越多应用于临床。研究[10-15]报道,ECMO相关医院感染发病率达50.0%,住院时间和总费用增加9.7%~64.0%。ECMO相关医院感染可加重患者病情,延长住院时间,增加社会经济负担[16-17]。因此,评估ECMO患者相关医院感染的发病率及危险因素对ECMO相关医院感染的防控具有重要意义。
本研究发现,接受ECMO治疗的患者病情更严重,APACHE Ⅱ评分更高,临床预后较差,住院时间长,医疗费用高。ECMO治疗期间发生相关医院感染的患者ICU入住时间更长,医疗费用更高。本研究显示,ECMO感染组的抗菌药物费用约是ECMO对照组的3倍。有研究[13, 18]显示,ECMO相关医院感染的患者病死率升高,年龄较大(>50岁)、急性呼吸窘迫综合征、APACHE Ⅱ评分较高、呼吸机相关肺炎及多重耐药菌感染等均与病死率增加相关。然而,本研究中ECMO感染组患者和ECMO对照组患者的病死率比较,差异无统计学意义,也未发现引起感染患者死亡的阳性结果。原因之一可能是对照组患者病情同样危重,反映在两组APACHE Ⅱ评分相似,且大多数患者在入院前或行ECMO前就有感染病史。另外,本研究病例数可能不足,仍需对更多样本进行研究。
ECMO支持时间与医院感染具有相关性[12, 14],本研究得到了相似结论,ECMO持续时间超过10 d,医院感染的发病率显著增加。然而,感染的存在可能导致ECMO支持时间增加,因此,感染和ECMO支持时间的相互影响仍尚不明确。接受ECMO的患者可能从中心静脉导管、多种留置导管、有创呼吸机和手术部位等获得医源性感染。ECMO感染组血红蛋白水平较对照组低,文献[19]报道,老年贫血患者更容易发生尿路感染,ICU的贫血患者更容易发生各种感染[20-22],然而,贫血是否真的会导致医院感染增加,或者只是炎症和营养不良的反应,仍需进一步的研究。ECMO感染组气管切开患者较多,气管切开可方便脱离机械通气,但也存在并发症的风险。切口感染是气管切开最常见的早期并发症[23-24],该院护理要求每日检查气管切开部位是否有炎症和感染的迹象。本研究表明ECMO患者血流感染发病率较高,是ECMO相关医院感染中最常见的类型,约40.0%(12/30)的ECMO患者发生血流感染,与其他文献[12-15]结果基本相符合。ECMO患者血流感染发病率高可能与下列因素有关:侵入性置入多种管道并进行体外循环,侵袭性操作导致物理屏障破坏,同时操作过程中无菌操作不严格存在管道的污染。本研究显示ECMO支持时间是血流感染的独立危险因素。已有文献表明ECMO相关血流感染的危险因素包括年龄、血清总胆红素水平、输血及胸腔积液等[14, 25],对于可控的因素,临床医务人员应尽快采取有效的防控措施,减少导管相关感染的发生,以避免增加患者的医疗成本及造成不良预后。
15例医院感染患者共检出35株病原菌,以革兰阴性菌为主,主要为肺炎克雷伯菌、鲍曼不动杆菌和铜绿假单胞菌。血流感染的常见致病菌为革兰阳性菌,本研究中ECMO相关血流感染以革兰阴性菌为主,这种革兰阳性菌向革兰阴性菌迁移可能是由于住院期间抗菌药物暴露增多和肠黏膜屏障受损所致[26-29]。此外,ECMO相关血流感染中分离出念珠菌,研究[30-31]表明感染念珠菌会显著增加ECMO患者的死亡风险。然而,抗真菌治疗的有效性尚未得到充分证实,故不推荐预防性使用抗真菌药物。革兰阴性菌是ECMO患者呼吸道感染和血流感染的主要致病菌,预防医院内医源性感染尤为重要。因此,在进行ECMO操作时需做好导管护理、严格无菌操作,特别是清洁、维护气道及中心静脉通路,条件允许时尽早拔管。一方面明确ECMO辅助气管插管的适应证,尽快停止呼吸和循环辅助;另一方面防止环境污染,包括清洁环境、使用无菌置管程序,保持管道、皮肤和头发清洁,每日使用含氯消毒剂擦拭。
综上所述,在接受ECMO治疗的患者中,相关医院感染的发病率高达50.0%,血流感染是最常见的感染部位,医疗费用和住院时间显著增加,ECMO持续时间长是接受ECMO患者发生相关医院感染的独立危险因素。
| [1] |
Raman L, Dalton HJ. Year in review 2015:extracorporeal membrane oxygenation[J]. Respir Care, 2016, 61(7): 986-991. DOI:10.4187/respcare.04985 |
| [2] |
Conrad SA, Broman LM, Taccone FS, et al. The extracorporeal life support organization maastricht treaty for nomenclature in extracorporeal life support. A position paper of the extracorporeal life support organization[J]. Am J Respir Crit Care Med, 2018, 198(4): 447-451. DOI:10.1164/rccm.201710-2130CP |
| [3] |
Keebler ME, Haddad EV, Choi CW, et al. Venoarterial extracorporeal membrane oxygenation in cardiogenic shock[J]. JACC Heart Fail, 2018, 6(6): 503-516. DOI:10.1016/j.jchf.2017.11.017 |
| [4] |
Munshi L, Walkey A, Goligher E, et al. Venovenous extracorporeal membrane oxygenation for acute respiratory distress syndrome: a systematic review and Meta-analysis[J]. Lancet Respir Med, 2019, 7(2): 163-172. DOI:10.1016/S2213-2600(18)30452-1 |
| [5] |
Huang LN, Zhang W, Yang Y, et al. Application of extracorporeal membrane oxygenation in patients with severe acute respiratory distress syndrome induced by avian influenza A (H7N9) viral pneumonia: national data from the Chinese multicentre collaboration[J]. BMC Infect Dis, 2018, 18(1): 23. DOI:10.1186/s12879-017-2903-x |
| [6] |
Murphy DA, Hockings LE, Andrews RK, et al. Extracorporeal membrane oxygenation-hemostatic complications[J]. Transfus Med Rev, 2015, 29(2): 90-101. DOI:10.1016/j.tmrv.2014.12.001 |
| [7] |
Thomas J, Kostousov V, Teruya J. Bleeding and thrombotic complications in the use of extracorporeal membrane oxygenation[J]. Semin Thromb Hemost, 2018, 44(1): 20-29. DOI:10.1055/s-0037-1606179 |
| [8] |
Le Guennec L, Cholet C, Huang F, et al. Ischemic and hemo-rrhagic brain injury during venoarterial-extracorporeal membrane oxygenation[J]. Ann Intensive Care, 2018, 8(1): 129. DOI:10.1186/s13613-018-0475-6 |
| [9] |
Biffi S, Di Bella S, Scaravilli V, et al. Infections during extracorporeal membrane oxygenation: epidemiology, risk factors, pathogenesis and prevention[J]. Int J Antimicrob Agents, 2017, 50(1): 9-16. DOI:10.1016/j.ijantimicag.2017.02.025 |
| [10] |
Schmidt M, Bréchot N, Hariri S, et al. Nosocomial infections in adult cardiogenic shock patients supported by venoarterial extracorporeal membrane oxygenation[J]. Clin Infect Dis, 2012, 55(12): 1633-1641. DOI:10.1093/cid/cis783 |
| [11] |
Sun HY, Ko WJ, Tsai PR, et al. Infections occurring during extracorporeal membrane oxygenation use in adult patients[J]. J Thorac Cardiovasc Surg, 2010, 140(5): 1125-1132. DOI:10.1016/j.jtcvs.2010.07.017 |
| [12] |
Aubron C, Cheng AC, Pilcher D, et al. Infections acquired by adults who receive extracorporeal membrane oxygenation: risk factors and outcome[J]. Infect Control Hosp Epidemiol, 2013, 34(1): 24-30. DOI:10.1086/668439 |
| [13] |
Grasselli G, Scaravilli V, Di Bella S, et al. Nosocomial infections during extracorporeal membrane oxygenation: incidence, etiology, and impact on patients' outcome[J]. Crit Care Med, 2017, 45(10): 1726-1733. DOI:10.1097/CCM.0000000000002652 |
| [14] |
Aubron C, Cheng AC, Pilcher D, et al. Factors associated with outcomes of patients on extracorporeal membrane oxygenation support: a 5-year cohort study[J]. Crit Care, 2013, 17(2): R73. DOI:10.1186/cc12681 |
| [15] |
Thomas G, Hraiech S, Cassir N, et al. Venovenous extracorporeal membrane oxygenation devices-related colonisations and infections[J]. Ann Intensive Care, 2017, 7(1): 111. DOI:10.1186/s13613-017-0335-9 |
| [16] |
Chung M, Zhao YS, Strom JB, et al. Extracorporeal membrane oxygenation use in cardiogenic shock: impact of age on in-hospital mortality, length of stay, and costs[J]. Crit Care Med, 2019, 47(3): e214-e221. DOI:10.1097/CCM.0000000000003631 |
| [17] |
Chiu R, Pillado E, Sareh S, et al. Financial and clinical outcomes of extracorporeal mechanical support[J]. J Card Surg, 2017, 32(3): 215-221. DOI:10.1111/jocs.13106 |
| [18] |
Cheng A, Sun HY, Tsai MS, et al. Predictors of survival in adults undergoing extracorporeal membrane oxygenation with severe infections[J]. J Thorac Cardiovasc Surg, 2016, 152(6): 1526-1536. DOI:10.1016/j.jtcvs.2016.08.038 |
| [19] |
Shih WY, Chang CC, Tsou MT, et al. Incidence and risk factors for urinary tract infection in an elder home care population in Taiwan: a retrospective cohort study[J]. Int J Environ Res Public Health, 2019, 16(4): 566. DOI:10.3390/ijerph16040566 |
| [20] |
Harris AD, Jackson SS, Robinson G, et al. Pseudomonas aeruginosa colonization in the intensive care unit: prevalence, risk factors, and clinical outcomes[J]. Infect Control Hosp Epidemiol, 2016, 37(5): 544-548. DOI:10.1017/ice.2015.346 |
| [21] |
Reade MC, Weissfeld L, Angus DC, et al. The prevalence of anemia and its association with 90-day mortality in hospita-lized community-acquired pneumonia[J]. BMC Pulm Med, 2010, 10: 15. DOI:10.1186/1471-2466-10-15 |
| [22] |
Fraenkel PG. Anemia of inflammation: a review[J]. Med Clin North Am, 2017, 101(2): 285-296. DOI:10.1016/j.mcna.2016.09.005 |
| [23] |
Fernandez-Bussy S, Mahajan B, Folch E, et al. Tracheostomy tube placement: early and late complications[J]. J Broncho-logy Interv Pulmonol, 2015, 22(4): 357-364. DOI:10.1097/LBR.0000000000000177 |
| [24] |
Yan Q, Zhou M, Zou M, et al. Hypervirulent Klebsiella pneumoniae induced ventilator-associated pneumonia in mechanically ventilated patients in China[J]. Eur J Clin Microbiol Infect Dis, 2016, 35(3): 387-396. DOI:10.1007/s10096-015-2551-2 |
| [25] |
Na SJ, Chung CR, Choi HJ, et al. Blood stream infection in patients on venovenous extracorporeal membrane oxygenation for respiratory failure[J]. Infect Control Hosp Epidemiol, 2018, 39(7): 871-874. DOI:10.1017/ice.2018.90 |
| [26] |
Liu HZ, Liu ZL, Zhao SP, et al. Effect of BML-111 on the intestinal mucosal barrier in sepsis and its mechanism of action[J]. Mol Med Rep, 2015, 12(2): 3101-3106. DOI:10.3892/mmr.2015.3746 |
| [27] |
Zhou JF, Qian CY, Zhao MY, et al. Epidemiology and outcome of severe sepsis and septic shock in intensive care units in mainland China[J]. PLoS One, 2014, 9(9): e107181. DOI:10.1371/journal.pone.0107181 |
| [28] |
Li CH, Ren N, Wen XM, et al. Changes in antimicrobial use prevalence in China: results from five point prevalence studies[J]. PLoS One, 2013, 8(12): e82785. DOI:10.1371/journal.pone.0082785 |
| [29] |
Ye QF, Ma Y, Wan QQ, et al. The distribution and resis-tance of pathogens causing blood stream infections following liver transplantation: a clinical analysis of 69 patients[J]. Hepatogastroenterology, 2014, 61(136): 2311-2314. |
| [30] |
Pluim T, Halasa N, Phillips SE, et al. The morbidity and mortality of patients with fungal infections before and during extracorporeal membrane oxygenation support[J]. Pediatr Crit Care Med, 2012, 13(5): e288-e293. DOI:10.1097/PCC.0b013e31824fbaf7 |
| [31] |
Cavayas YA, Yusuff H, Porter R. Fungal infections in adult patients on extracorporeal life support[J]. Crit Care, 2018, 22(1): 98. DOI:10.1186/s13054-018-2023-z |



