2. 南方医科大学附属小榄医院重症医学科, 广东 中山 528415;
3. 南方医科大学南方医院检验科, 广东 广州 510515
2. Department of Critical Care Medicine, Xiaolan Hospital, Southern Medical University, Zhongshan 528415, China;
3. Department of Laboratory Medicine, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
腹腔感染(intra-abdominal infection, IAI)是重症监护病房(intensive care unit,ICU)患者中居第2位的感染性疾病,仅次于肺部感染,比率达20%~30%[1],其发病率和病死率高[2],尽早开始适当的抗感染治疗对降低重症监护病房腹腔感染(ICU-IAI)患者的病死率至关重要[3]。而ICU-IAI患者的病原菌分布及耐药性与普通病房有着很大的区别[4],且随着时间的推移出现了变化趋势[5-6]。持续监测当地医院甚至专科病房中的病原菌流行病学及抗菌药物耐药性变化对于指导有效的经验性治疗至关重要。
在过去的近二十年中,世界范围内开展了大规模针对IAI病原菌的抗菌药物敏感性监测,但研究多局限于革兰阴性菌的分析报告[7-8],针对ICU群体的研究更是为数不多[9]。为此,本研究回顾性分析近8年某院ICU-IAI患者的病历资料,以了解ICU-IAI患者病原菌分布及耐药性的变化趋势。
1 对象与方法 1.1 研究对象选取2011年1月1日—2018年12月31日在南方医科大学南方医院ICU接受过治疗的IAI患者为研究对象。首先在南方医院大数据平台检索2011年1月1日—2018年12月31日出院诊断包含“腹腔感染”或“腹膜炎”或“肠瘘”或“吻合口瘘”或“消化道穿孔”且在ICU入住过的患者。入选标准:(1)年龄≥18岁;(2)符合2005年脓毒症论坛共识关于ICU感染定义中IAI的诊断标准[10]。排除标准:ICU住院时间<24 h的患者。
1.2 研究方法本研究是一项单中心回顾性观察研究,以前后4年划分为两个研究时期(2011—2014年和2015—2018年)分析ICU-IAI患者临床分离菌的流行特点及抗菌药物耐药性变化。
1.2.1 调查内容在病历系统查阅病历资料,采集如下资料:(1)人口学资料(年龄、性别);(2)疾病特征及共患病:感染类型、感染部位、腹膜炎类型、曼海姆腹膜炎评分(Mannheim peritonitis index,MPI)、急性生理与慢性健康评分-Ⅱ(acute physiology and chronic health evaluation-Ⅱ,APACHE-Ⅱ)、序贯性器官功能衰竭评分(sequential organ failure assessment scores,SOFA)、各种慢性基础疾病;(3)实验室检查结果;(4)微生物学培养结果及抗菌药物敏感测试数据;(5)预后指标:ICU住院时间、总住院时间、28天病死率、ICU病死率以及总病死率。
研究方案经南方医科大学南方医院伦理审查委员会批准(批件号:NFEC-2019-162),所有研究工作均符合《赫尔辛基宣言》和南方医科大学南方医院关于临床研究的细则。
1.2.2 定义和标准IAI的诊断标准依据2005年脓毒症论坛共识关于ICU患者感染的定义[10],存在以下情况之一时方可诊断IAI:(1)临床表现(包括腹痛及全身炎症反应如发热、心动过速、呼吸急促)符合IAI的表现,且腹腔内标本实验室检查符合感染的标准;(2)手术或腹腔内标本微生物培养证实的IAI。
社区获得性腹腔感染(community-acquired IAI, CA-IAI)和医疗保健相关性腹腔感染(healthcare-associated IAI, HA-IAI)的划分标准依据美国外科感染学会(Surgical Infection Society, SIS)发布的指南[11]。存在以下情况定义为HA-IAI:住院48 h后发生的IAI;住院时或住院48 h内诊断为IAI且之前30 d内有住院史的(包括居住在疗养院或康复机构),或30 d内接受过家庭输液、家庭伤口护理、透析治疗,或90 d内使用过广谱抗菌药物≥5 d的患者。其他情况者则判断为CA-IAI。
1.2.3 细菌培养与药敏试验腹腔内标本仅限于手术中获取的腹腔积液或脓液或组织物及转入ICU 24 h内从腹腔获得的积液或引流液。标本采集后送南方医科大学南方医院微生物实验室处理。细菌分离后,使用Vitek MS全自动快速微生物质谱检测仪(bioMérieux S.A,French)或者BD PhoenixTM-100全自动细菌鉴定/药敏仪(Becton, Dickinson and Company, USA)进行鉴定。抗菌药物敏感性采用琼脂稀释法和肉汤微量稀释法测定,药敏结果依据当年美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)推荐的最低抑菌浓度折点判断微生物是否耐药,根据CLSI的推荐,双盘协同试验用于测定大肠埃希菌和肺炎克雷伯菌分离株中是否产超广谱β-内酰胺酶(extended-spectrum β-lactamase,ESBLs)。剔除本次住院同一患者分离的重复分离株(同属、同种)。
1.3 统计学分析应用Stata/MP 15.0软件建立数据库并进行统计分析。对连续变量和分类变量进行描述性统计,符合正态分布的连续变量以x±s表示,非正态分布的连续变量以M(P25,P75)表示,分类变量采用频数及百分比表示。连续变量根据分布性质组间比较采用独立样本t检验或方差分析或Mann-Whitney U检验,分类变量组间比较采用χ2检验或Fisher’s精确检验。所有检验均采用双侧检验,以P≤0.05为差异有统计学意义。
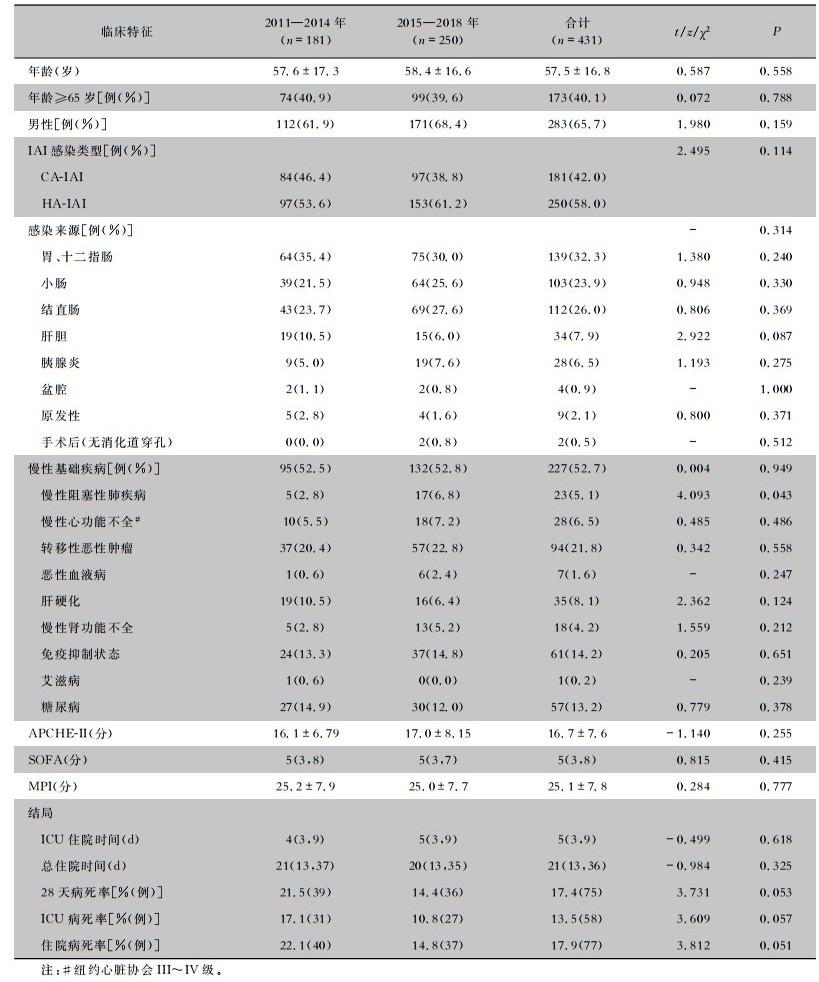
2 结果 2.1 基本资料在南方医院大数据平台检索出符合条件的患者共665例,剔除年龄<18岁的18例,不符合IAI诊断标准的112例,ICU住院期间未合并IAI的13例,符合入选标准的患者522例,占同期ICU收治患者数量的10.4%(522/5 036),排除ICU住院时间<24 h的46例后共有476例患者,CA-IAI和HA-IAI分别为209例(43.9%)、267例(56.1%),其中送检腹腔积液标本的患者共431例,前期(2011—2014年)和后期(2015—2018年)ICU-IAI患者分别为181、250例。前后时期患者临床特征、危重程度评分及结局指标比较,差异均无统计学意义(均P>0.05)。见表 1。
| 表 1 2011—2018年ICU-IAI患者临床特征 Table 1 Clinical characteristics of patients with IAI in ICU, 2011-2018 |
|
在整个研究期间,腹腔标本微生物送检率为90.5%(431/476),其中阳性培养率(分离出菌株)为68.9%(297/431),连续分离出527株无重复微生物。前后期腹腔标本微生物送检率分别为91.9%(181/197)和89.6%(250/279),分别分离出微生物242、285株。
2.2.2 病原菌菌株分布在总体分布上,革兰阴性菌、革兰阳性菌以及真菌的比率分别为48.2%、34.0%、17.8%。按研究分层,前后时期的微生物菌群整体分布情况见图 1,两者比较,差异无统计学意义(P=0.293)。前期检出居前5位的病原菌分别为大肠埃希菌、屎肠球菌、肺炎克雷伯菌、白假丝酵母菌、粪肠球菌,后期检出居前5位的病原菌分别为大肠埃希菌、粪肠球菌、屎肠球菌、白假丝酵母菌、肺炎克雷伯菌,分别占各自时期分离菌株的65.7%和60.7%,前后期基本一致,排序略有不同。以上5种微生物也是研究期间最常见的前五位微生物,占所有分离菌株的63.0%。
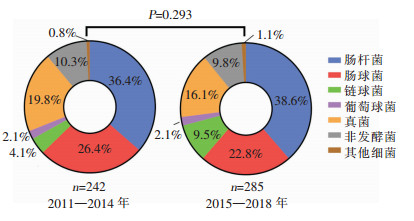 |
| 图 1 前后两个时期ICU-IAI的微生物菌群分布比较 Figure 1 Comparison of distribution of microbial flora causing IAI in ICU in the former and later periods |
前后期革兰阴性菌占比分别为46.7%和49.5%,前后期微生物分类构成比比较,差异无统计学意义(P=0.343)。整个研究时期,最常见的革兰阴性菌是大肠埃希菌,占20.5%,其次是肺炎克雷伯菌,占10.3%。鲍曼不动杆菌和铜绿假单胞菌是最常见的非发酵菌,均检出24株(占4.6%),为第3位革兰阴性菌。肠球菌属细菌是ICU-IAI最常见的革兰阳性菌,占革兰阳性菌的72.1%,占所有菌株的24.5%。最常见的肠球菌是屎肠球菌(64株,占12.2%)和粪肠球菌(52株,占9.9%),是居前2位的革兰阳性菌,前后期比较,前期以屎肠球菌为主,后期粪肠球菌比率更高,差异有统计学意义(P=0.018)。链球菌属是仅次于肠球菌属居第2位的一大类革兰阳性菌,占革兰阳性菌的20.7%,占所有菌株的7.0%。前后期比较,后期链球菌在革兰阳性菌中分离率更高(12.3% VS 27.6%),差异有统计学意义(P=0.009)。葡萄球菌属比率较小,仅占革兰阳性菌的6.2%。整体上,真菌所占比率为17.8%,前后时期基本一致。最常见的真菌是白假丝酵母菌,比率为57.4%,占所有分离菌株的10.3%。见表 2。
| 表 2 2011—2018年ICU-IAI腹腔标本微生物分离菌株构成 Table 2 Constituent of microbial isolates from IAI specimens in ICU, 2011-2018 |

|
大肠埃希菌和肺炎克雷伯菌是最常见的肠杆菌目细菌,两者合计占比81.8%,前后期比较(85.2% VS 79.1%),差异无统计学意义(P=0.266)。总体上的大肠埃希菌和肺炎克雷伯菌产ESBLs菌株检出率分别为55.6%(60/108)、33.3%(18/54),耐碳青霉烯类(对亚胺培南和/或美罗培南耐药)的大肠埃希菌和肺炎克雷伯菌的比率分别为4.6%(5/108)、27.8%(15/54)。前后期比较,后期大肠埃希菌产ESBLs菌株检出率较前期降低,差异有统计学意义(P=0.021),而肺炎克雷伯菌产ESBLs菌株检出率虽有下降,但差异无统计学意义(P=0.645)。耐碳青霉烯类大肠埃希菌基本保持在相对低的水平(3.3%~6.4%),而后期耐碳青霉烯类肺炎克雷伯菌的比率较前期升高,差异有统计学意义(P=0.043)。见图 2。
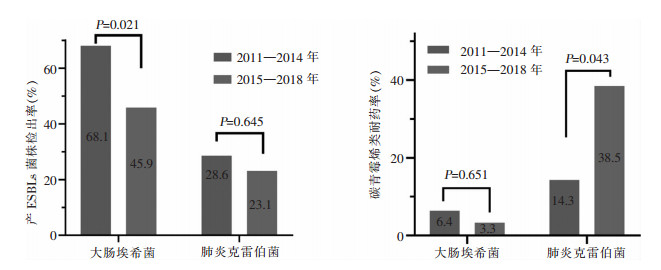 |
| 图 2 前后期大肠埃希菌和肺炎克雷伯菌产ESBLs菌株分离率和碳青霉烯类耐药率比较 Figure 2 Comparison of isolation rates of ESBLs-producing strains and carbapenem resistance rates of Escherichia coli and Klebsiella pneumoniae in the former and later periods |
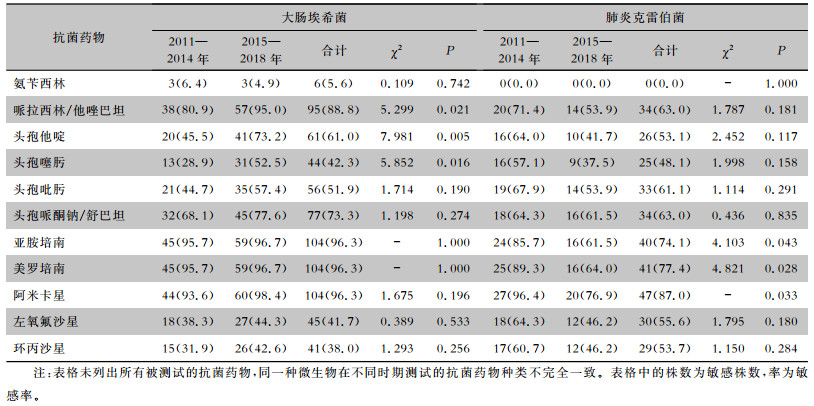
抗菌药物体外敏感性方面,前后期比较,后期大肠埃希菌对头孢噻肟、头孢他啶以及哌拉西林/他唑巴坦的敏感率均提高,差异有统计学意义(均P<0.05),而对包括碳青霉烯类在内其他抗菌药物的敏感率基本一致。除外阿米卡星及碳青霉烯类抗生素,后期肺炎克雷伯菌对其他抗菌药物的敏感率均<70.0%;前后期比较,后期普遍呈下降趋势,其中后期对阿米卡星、亚胺培南和美罗培南的敏感率均下降,差异有统计学意义(均P<0.05)。总体而言,大肠埃希菌和肺炎克雷伯菌对阿米卡星、亚胺培南及美罗培南保持较高敏感性,敏感率>70.0%,而大肠埃希菌对头孢哌酮/舒巴坦和哌拉西林/他唑巴坦也保持较高的活性,但无一种抗生素可以同时对大肠埃希菌和肺炎克雷伯菌的敏感率>90.0%。见表 3。
| 表 3 前后期ICU-IAI患者分离大肠埃希菌、肺炎克雷伯菌对抗菌药物的敏感情况[株(%)] Table 3 Antimicrobial susceptibility of Escherichia coli and Klebsiella pneumoniae isolated from patients with IAI in ICU in the former and later periods (No. of isolates[%]) |
|
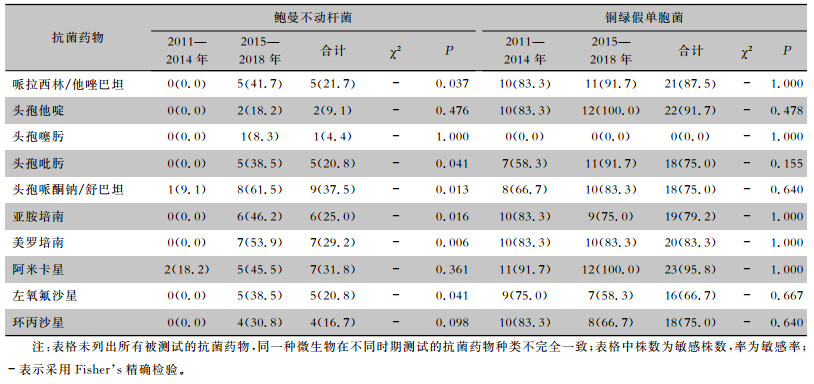
鲍曼不动杆菌和铜绿假单胞菌是ICU-IAI常见的革兰阴性菌,仅次于大肠埃希菌和肺炎克雷伯菌,两者在革兰阴性菌中均占9.4%,前后时期比较基本一致。鲍曼不动杆菌的耐药率在前期较高,其对头孢菌素、喹诺酮类、碳青霉烯类抗菌药物及哌拉西林/他唑巴坦的耐药率高达100%,但后期对亚胺培南和美罗培南的敏感率上升至50%左右。铜绿假单胞菌对头孢他啶、头孢吡肟、β-内酰胺酶抑制剂复合制剂及碳青霉烯类抗生素的耐药率均<30%,前后期对测试抗菌药物的敏感率无显著变化。见表 4。
| 表 4 前后期ICU-IAI患者分离鲍曼不动杆菌和铜绿假单胞菌对抗菌药物的敏感情况[株(%)] Table 4 Antimicrobial susceptibility of Acinetobacter baumannii and Pseudomonas aeruginosa isolated from patients with IAI in ICU in the former and later periods (No. of isolates[%]) |
|
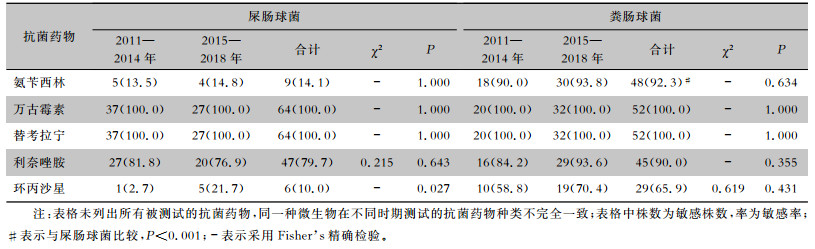
肠球菌是ICU-IAI患者分离最常见的革兰阳性菌。除外1株酪黄/母鸡肠球菌对万古霉素天然耐药,其他肠球菌均对糖肽类抗生素敏感。前后期肠球菌对万古霉素、替考拉宁和利奈唑胺的敏感率无明显变化。屎肠球菌对氨苄西林的敏感率低于粪肠球菌,差异有统计学意义(P<0.001)。见表 5。
| 表 5 前后期ICU-IAI患者分离肠球菌对抗菌药物的敏感情况[株(%)] Table 5 Antimicrobial susceptibility of Enterococcus isolated from patients with IAI in ICU in the former and later periods (No. of isolates[%]) |
|
ICU-IAI患者分离真菌对氟康唑、伊曲康唑和两性霉素B的敏感率分别为74.5%(70/94)、79.8%(75/94)和100.00%(94/94),且敏感率随时间无变化。假丝酵母菌菌对氟康唑、伊曲康唑和两性霉素B的敏感率分别为75.8%(69/91)、81.3%(74/91)和100.00%,且敏感率随时间无明显变化。
3 讨论本研究中ICU-IAI与ICU获得的IAI或重症IAI存在概念上的区别,ICU获得的IAI指患者入住ICU时无IAI,在入住48 h后发生IAI的情况,属于医院感染范畴,均为HA-IAI;重症IAI是指IAI引起全身炎症反应导致脓毒症或脓毒症休克,不包括轻症IAI合并其他危重病的情况;而ICU-IAI既包括ICU获得的IAI,也包括因IAI并发或合并危重情况入住ICU者,IAI可能是CA-IAI或HA-IAI,ICU-IAI与ICU获得的IAI或重症IAI三者间的病原微生物可能存在差异。关于ICU-IAI的临床特征和微生物学的数据很少且缺乏近些年数据[9, 12],因此,有必要研究ICU-IAI临床分离菌的流行特点及耐药性,以便于临床重症医学科医生了解其变化趋势,为管理IAI及优化起始经验性抗感染治疗提供参考。
消化道是人体最大的细菌库,IAI病原菌常来源于胃肠道内定植菌群。本研究中,IAI分离病原微生物以革兰阴性菌为主,其次是革兰阳性菌、真菌,前后期比较病原微生物菌群分布,差异无统计学意义(P=0.293)。大肠埃希菌、屎肠球菌、肺炎克雷伯菌、白假丝酵母菌和粪肠球菌是居于前5位的最常见分离菌,比率为63.0%,与De等[9]研究结果基本一致,但在De等研究中铜绿假单胞菌更加常见,其原因可能是两者标本采集的时间点不同,De等[9]研究中在采集时间点上有相当比例的患者已经在ICU住院超过2 d,而在本研究中腹腔标本均来自手术中或入住ICU 24 h内,受微生物在引流管上定植的影响小,这可能是导致差别的原因。
在世界范围内,尤其是亚太地区,产ESBLs的肠杆菌目细菌越来越常见,其中以大肠埃希菌和肺炎克雷伯菌最为流行[5, 7, 13]。在本研究中,大肠埃希菌和肺炎克雷伯菌产ESBLs菌株检出率为55.6%和33.3%,两者对头孢菌素和氟喹诺酮类抗生素的敏感率均低于70%。产ESBLs肠杆菌目细菌的广泛流行,使头孢菌素和氟喹诺酮类抗生素耐药率攀升,已不再适合用于IAI的经验性抗感染治疗。但随着时间的推移,大肠埃希菌产ESBLs菌株检出率下降(68.1% VS 45.9%,P=0.021),大肠埃希菌对头孢菌素和哌拉西林/他唑巴坦的敏感率呈现不同程度的上升,由中国多所大型医院参与的研究报告显示,大肠埃希菌产ESBLs菌株检出率由2012年的67.5%下降至2014年的58.9%[6],2016—2017年这一数值下降至48.2%[14]。而肺炎克雷伯菌的产ESBLs菌株检出率在研究期间也有所下降(28.6% VS 23.1%),但差异无统计学意义(P=0.645),SMART更新报告显示中国大陆地区肺炎克雷伯菌产ESBLs菌株检出率由2012—2014年的35.3%[6]下降至2016—2017年的26.4%[14]。但肺炎克雷伯菌对头孢菌素、喹诺酮类和碳青霉烯类抗生素的耐药率却呈现不同程度的上升,说明可能存在其他耐药机制。
碳青霉烯类抗生素被认为是抗肠杆菌目细菌感染最有效的药物,在既往的研究[5, 15]中显示碳青霉烯类抗生素对肠杆菌目有很高的敏感性。然而,随着此类抗生素在临床上的广泛应用及不合理使用,肠杆菌目对碳青霉烯类药物敏感性降低的报道越来越多[16],其中以耐碳青霉烯类肺炎克雷伯菌最为常见,在耐碳青霉烯类肠杆菌感染病例中占70%~90%[17-18]。本研究表明,随时间推移,耐碳青霉烯类肺炎克雷伯菌比率保持快速上升趋势,由14.3%上升至38.5%。CHINET细菌耐药监测也证实,肺炎克雷伯菌对亚胺培南和美罗培南的耐药率呈逐年升高趋势,其耐药率分别由2005年的2.9%、3.0%上升至2017年的20.9%、24.0%,上升幅度高达8倍[19]。产碳青霉烯酶是肠杆菌目细菌对碳青霉烯类抗生素耐药的最常见机制[20],在抗菌药物的选择性压力下,碳青霉烯酶耐药基因的发生水平转移是细菌耐药性迅速产生及扩散的主要原因。有研究证实,耐碳青霉烯类肺炎克雷伯菌的出现和扩散与碳青霉烯类药物使用密切相关[21]。鉴于肺炎克雷伯菌的高毒力特性[22],耐碳青霉烯类肺炎克雷伯菌已成为病房尤其是ICU抗感染治疗的难题。本研究结果显示,哌拉西林/他唑巴坦对大肠埃希菌和肺炎克雷伯菌的敏感率与碳青霉烯类相似,对非发酵菌的敏感率也基本一致,可考虑作为ICU-IAI抗感染治疗的一线经验性用药,以减少碳青霉烯类药物的使用,遏制碳青霉烯类耐药率快速上升。合理使用抗菌药物,加强对碳青霉烯类药物的管控,严格把握碳青霉烯类药物使用适应证,防止耐药菌株在抗菌药物压力下的筛选仍然是当下的主要防控措施。
鲍曼不动杆菌是ICU感染中十分常见的非发酵菌[1]。耐碳青霉烯类鲍曼不动杆菌的产生已成为一个严重的临床问题,这与碳青霉烯类抗生素在临床中的广泛使用有密切关系,在本研究的前一时期,碳青霉烯类耐药率高达100.0%,与国内另一家区域中心医院研究[23]相似,但并非所有的区域都存在如此严重的耐药现象,耐碳青霉烯类鲍曼不动杆菌在不同省份存在很大差异,来自中国细菌耐药监测网的数据显示,2016年各省的耐药率为25%~81%[24],可能与抗菌药物使用情况及管控措施相关。随着细菌耐药监测的持续进行及抗菌药物管理的不断加强,此现象得到控制,在本研究后期,鲍曼不动杆菌对碳青霉烯类、β-内酰胺酶抑制剂复合制剂的耐药率均有显著改善,此现象为持续进行抗菌药物耐药性监测与抗菌药物管控增强了信心。
在革兰阳性菌中,肠球菌在IAI中占比较大。在本研究中,ICU-IAI分离的革兰阳性菌以肠球菌最常见(占72.1%),屎肠球菌和粪肠球菌合计约占肠球菌属的90.0%,是引起ICU-IAI最常见的两种肠球菌,与De等[9]研究结果一致。两者前后期的耐药性无明显变化,未发现耐万古霉素的屎肠球菌或粪肠球菌。
综上所述,本研究结果显示ICU-IAI分离菌株以革兰阴性菌为主,产ESBLs的大肠埃希菌及肺炎克雷伯菌流行形势仍严峻,但近些年来这一形势趋于缓解,产ESBLs的大肠埃希菌比例显著下降,但耐碳青霉烯类肺炎克雷伯菌却逐渐增多,因此,细菌耐药性监测及严格的抗菌药物管控仍需持续进行,同时应制定更完善的措施以控制细菌耐药的进一步扩散。鲍曼不动杆菌是ICU最常见的非发酵革兰阴性菌之一,泛耐药情况严重,回顾近些年的病历资料,耐药情况也得到一定控制,包括碳青霉烯类抗生素在内的部分药物敏感性处于恢复中。
本研究项目有一些局限性。首先,本研究为单中心回顾性观察研究,研究中的IAI患者不能完全代表其他地域的情况。其次,ICU-IAI在概念上存在一定歧义,容易理解为ICU获得性IAI或者是重症IAI,本研究的研究对象既包括CA-IAI,也包括HA-IAI,有危重的IAI,也有IAI合并其他危重症的情况,能更全面地代表ICU内IAI的分离菌群及其耐药性情况。第三,项目未对细菌耐药的分子机制进行确定。第四,微生物的敏感性测试药物的品种并不齐全,如头孢西丁、替加环素等,存在缺失或部分缺失。
| [1] |
Vincent JL, Rello J, Marshall J, et al. International study of the prevalence and outcomes of infection in intensive care units[J]. JAMA, 2009, 302(21): 2323-2329. DOI:10.1001/jama.2009.1754 |
| [2] |
Evans HL, Raymond DP, Pelletier SJ, et al. Diagnosis of intra-abdominal infection in the critically ill patient[J]. Curr Opin Crit Care, 2001, 7(2): 117-121. DOI:10.1097/00075198-200104000-00010 |
| [3] |
Sartelli M, Catena F, Abu-Zidan FM, et al. Management of intra-abdominal infections: recommendations by the WSES 2016 consensus conference[J]. World J Emerg Surg, 2017, 12: 22. DOI:10.1186/s13017-017-0132-7 |
| [4] |
Zhang JG, Zhao CJ, Chen HB, et al. A multicenter epidemiology study on the risk factors and clinical outcomes of nosocomial intra-abdominal infections in China: results from the Chinese Antimicrobial Resistance Surveillance of Nosocomial Infections (CARES) 2007-2016[J]. Infect Drug Resist, 2018, 11: 2311-2319. DOI:10.2147/IDR.S182180 |
| [5] |
Yang QW, Zhang H, Wang Y, et al. A 10 year surveillance for antimicrobial susceptibility of Escherichia coli and Klebsiella pneumoniae in community- and hospital-associated intra-abdominal infections in China[J]. J Med Microbiol, 2013, 62(Pt 9): 1343-1349. |
| [6] |
Zhang H, Yang QW, Liao K, et al. Update of incidence and antimicrobial susceptibility trends of Escherichia coli and Klebsiella pneumoniae isolates from Chinese intra-abdominal infection patients[J]. BMC Infect Dis, 2017, 17(1): 776. DOI:10.1186/s12879-017-2873-z |
| [7] |
Morrissey I, Hackel M, Badal R, et al. A review of ten years of the study for monitoring antimicrobial resistance trends (SMART) from 2002 to 2011[J]. Pharmaceuticals (Basel), 2013, 6(11): 1335-1346. DOI:10.3390/ph6111335 |
| [8] |
Karlowsky JA, Hoban DJ, Hackel MA, et al. Antimicrobial susceptibility of Gram-negative ESKAPE pathogens isolated from hospitalized patients with intra-abdominal and urinary tract infections in Asia-Pacific countries: SMART 2013-2015[J]. J Med Microbiol, 2017, 66(1): 61-69. DOI:10.1099/jmm.0.000421 |
| [9] |
De Waele J, Lipman J, Sakr Y, et al. Abdominal infections in the intensive care unit: characteristics, treatment and determinants of outcome[J]. BMC Infect Dis, 2014, 14: 420. DOI:10.1186/1471-2334-14-420 |
| [10] |
Calandra T, Cohen J, International Sepsis Forum Definition of Infection in the ICU Consensus Conference. The international sepsis forum consensus conference on definitions of infection in the intensive care unit[J]. Crit Care Med, 2005, 33(7): 1538-1548. DOI:10.1097/01.CCM.0000168253.91200.83 |
| [11] |
Mazuski JE, Tessier JM, May AK, et al. The surgical infection society revised guidelines on the management of intra-abdominal infection[J]. Surg Infect (Larchmt), 2017, 18(1): 1-76. DOI:10.1089/sur.2016.261 |
| [12] |
Lob SH, Biedenbach DJ, Badal RE, et al. Antimicrobial resistance and resistance mechanisms of Enterobacteriaceae in ICU and non-ICU wards in Europe and North America: SMART 2011-2013[J]. J Glob Antimicrob Resist, 2015, 3(3): 190-197. DOI:10.1016/j.jgar.2015.05.005 |
| [13] |
Chang YT, Coombs G, Ling T, et al. Epidemiology and trends in the antibiotic susceptibilities of Gram-negative bacilli isolated from patients with intra-abdominal infections in the Asia-Pacific region, 2010-2013[J]. Int J Antimicrob Agents, 2017, 49(6): 734-739. DOI:10.1016/j.ijantimicag.2017.01.030 |
| [14] |
Zhang H, Johnson A, Zhang G, et al. Susceptibilities of Gram-negative bacilli from hospital- and community-acquired intra-abdominal and urinary tract infections: a 2016-2017 update of the Chinese SMART study[J]. Infect Drug Resist, 2019, 12: 905-914. DOI:10.2147/IDR.S203572 |
| [15] |
Hawser SP, Bouchillon SK, Hoban DJ, et al. In vitro susceptibilities of aerobic and facultative anaerobic Gram-negative bacilli from patients with intra-abdominal infections worldwide from 2005-2007:results from the SMART study[J]. Int J Antimicrob Agents, 2009, 34(6): 585-588. DOI:10.1016/j.ijantimicag.2009.07.013 |
| [16] |
Nordmann P, Naas T, Poirel L. Global spread of carbapenemase-producing Enterobacteriaceae[J]. Emerg Infect Dis, 2011, 17(10): 1791-1798. DOI:10.3201/eid1710.110655 |
| [17] |
Zhang R, Liu LZ, Zhou HW, et al. Nationwide surveillance of clinical carbapenem-resistant Enterobacteriaceae (CRE) strains in China[J]. EBioMedicine, 2017, 19: 98-106. DOI:10.1016/j.ebiom.2017.04.032 |
| [18] |
Grundmann H, Glasner C, Albiger B, et al. Occurrence of carbapenemase-producing Klebsiella pneumoniae and Escherichia coli in the European survey of carbapenemase-producing Enterobacteriaceae (EuSCAPE): a prospective, multinational study[J]. Lancet Infect Dis, 2017, 17(2): 153-163. DOI:10.1016/S1473-3099(16)30257-2 |
| [19] |
胡付品, 郭燕, 朱德妹, 等. 2017年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2018, 18(3): 241-251. |
| [20] |
孙康德, 陈旭, 虞中敏, 等. 碳青霉烯类耐药克雷伯菌属细菌的药物敏感性及同源性分析[J]. 检验医学, 2014, 29(11): 1136-1140. DOI:10.3969/j.issn.1673-8640.2014.11.014 |
| [21] |
张国兵, 毛小红, 吴志强, 等. 肺炎克雷伯菌耐药与抗菌药物使用强度的相关性分析[J]. 中华医院感染学杂志, 2017, 27(11): 2427-2429, 2452. |
| [22] |
Gu DX, Dong N, Zheng ZW, et al. A fatal outbreak of ST11 carbapenem-resistant hypervirulent Klebsiella pneumoniae in a Chinese hospital: a molecular epidemiological study[J]. Lancet Infect Dis, 2018, 18(1): 37-46. DOI:10.1016/S1473-3099(17)30489-9 |
| [23] |
Liu QJ, Ren JN, Wu XW, et al. Shifting trends in bacteriology and antimicrobial resistance among gastrointestinal fistula patients in China: an eight-year review in a tertiary-care hospital[J]. BMC Infect Dis, 2017, 17(1): 637. DOI:10.1186/s12879-017-2744-7 |
| [24] |
Hu FP, Zhu DM, Wang F, et al. Current status and trends of antibacterial resistance in China[J]. Clin Infect Dis, 2018, 67(Suppl 2): S128-S134. |



