血流感染(bloodstream infection,BSI)是由各种病原微生物和/或毒素侵入血流所引起的血液感染,可引起病死率较高的严重的全身感染性疾病[1],尤其是多重耐药菌如耐碳青霉烯类革兰阴性杆菌等感染,病死率高,患者负担重[2],动态监测血流感染病原菌的分布及耐药趋势具有十分重要的临床意义。研究2014—2019年全国细菌耐药性监测网(China Antimicrobial Resistance Surveillance System, CARSS)血标本来源病原菌的分布和耐药性变化,可为临床治疗血流感染提供合理用药参考。
1 资料与方法 1.1 资料来源2014年1月—2019年9月CARSS临床血标本分离病原菌资料,所有菌株均为患者血标本分离的非重复菌株。经系统自动审核和人工审核后,CARSS不同年度最终纳入数据分析的医院数分别为1 110、1 143、1 273、1 307、1 353、1 375所。
1.2 细菌鉴定及药敏试验采用VITEK等系统鉴定细菌至种。采用纸片扩散法或仪器(包括VITEK和ATB等系统)法进行药物敏感性试验,药敏纸片使用BBL或Oxoid等公司产品,培养基采用MH琼脂。检测抗菌药物为亚胺培南、美罗培南、厄他培南、左氧氟沙星、头孢哌酮/舒巴坦、氨曲南、哌拉西林、哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、阿米卡星、庆大霉素、妥布霉素、环丙沙星、多粘菌素B、替卡西林/克拉维酸、氯霉素、米诺环素、复方磺胺甲
按照CLSI要求进行质量控制,在试验条件稳定下每周施行一次常规质量控制程序。质控菌株包括大肠埃希菌ATCC 25922、金黄色葡萄球菌ATCC 29213、金黄色葡萄球菌ATCC 25923、肺炎克雷伯菌ATCC 700603、阴沟肠杆菌ATCC 700323、铜绿假单胞菌ATCC 27853、肺炎链球菌ATCC 49619。
1.4 数据分析应用WHONET软件进行数据分析,采用株数、百分率对数据进行描述。
2 结果 2.1 病原菌构成2014—2019年血标本分离细菌1 599 273株,革兰阴性菌828 846株(51.8%),革兰阳性菌770 427株(48.2%)。病原菌分离率居首位的为大肠埃希菌(402 818株,25.2%),其次分别为表皮葡萄球菌(193 968株,12.1%)、肺炎克雷伯菌(162 613株,10.2%)、人葡萄球菌(136 396株,8.5%)和金黄色葡萄球菌(106 915株,6.7%)。非发酵菌中铜绿假单胞菌(43 565株,2.7%)和鲍曼不动杆菌(37 244株,2.3%)所占比例最高,但呈逐年下降趋势。革兰阳性球菌以表皮葡萄球菌和人葡萄球菌为主。血标本细菌分离居前10位的细菌见图 1和表 1。
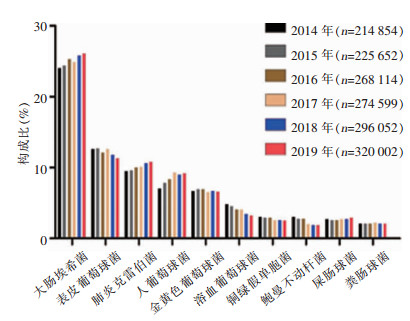 |
| 图 1 2014—2019年CARSS血标本分离居前10位的细菌及构成比 Figure 1 The top 10 bacteria and constituent ratios of bacteria isolated from blood specimens, CARSS, 2014-2019 |
| 表 1 2014—2019年CARSS血培养分离居前10位的菌种分布 Table 1 Distribution of the top 10 bacteria from blood culture, CARSS, 2014-2019 |
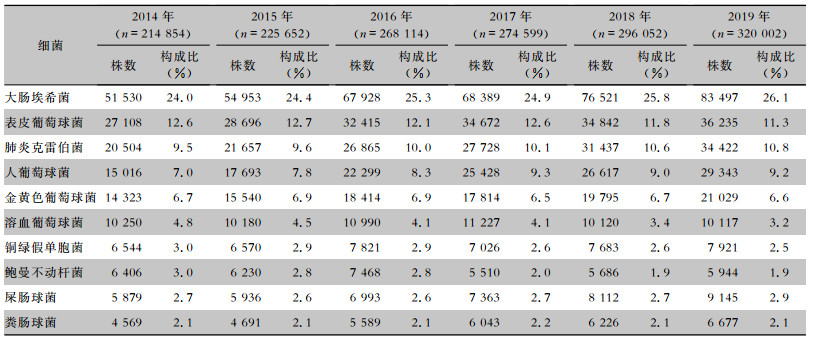
|
血流感染中分离的大肠埃希菌对碳青霉烯类、阿米卡星、哌拉西林/他唑巴坦及2019年开始检测的替加环素持较高的体外抗菌活性,敏感率约90%;对亚胺培南的耐药率有所增高,对美罗培南的耐药率为0.8%~1.3%。肺炎克雷伯菌对碳青霉烯类、阿米卡星持较高的体外抗菌活性,敏感率约90%,但对亚胺培南、美罗培南的耐药率有所增高,耐药率为6.6%~11.7%。肺炎克雷伯菌整体耐药性高于大肠埃希菌。2014—2019年铜绿假单胞菌对亚胺培南、美罗培南的耐药率分别为13.0%~19.2%、10.8%~16.9%,对β-内酰胺类复合制剂、氨基糖苷类药物和喹诺酮类药物耐药率均为10%左右,且对氨基糖苷类药物和喹诺酮类药物耐药率呈逐年下降趋势,其中对阿米卡星耐药率由7.1%降至2.6%。鲍曼不动杆菌对亚胺培南、美罗培南的耐药率分别为45.9%~60.9%、46.8%~61.7%,对米诺环素的耐药率分别为14.6%~22.0%。见表 2~5。
| 表 2 2014—2019年CARSS血培养分离的大肠埃希菌对抗菌药物的药敏结果 Table 2 Antimicrobial susceptibility testing results of Escherichia coli isolated from blood culture, CARSS, 2014-2019 |
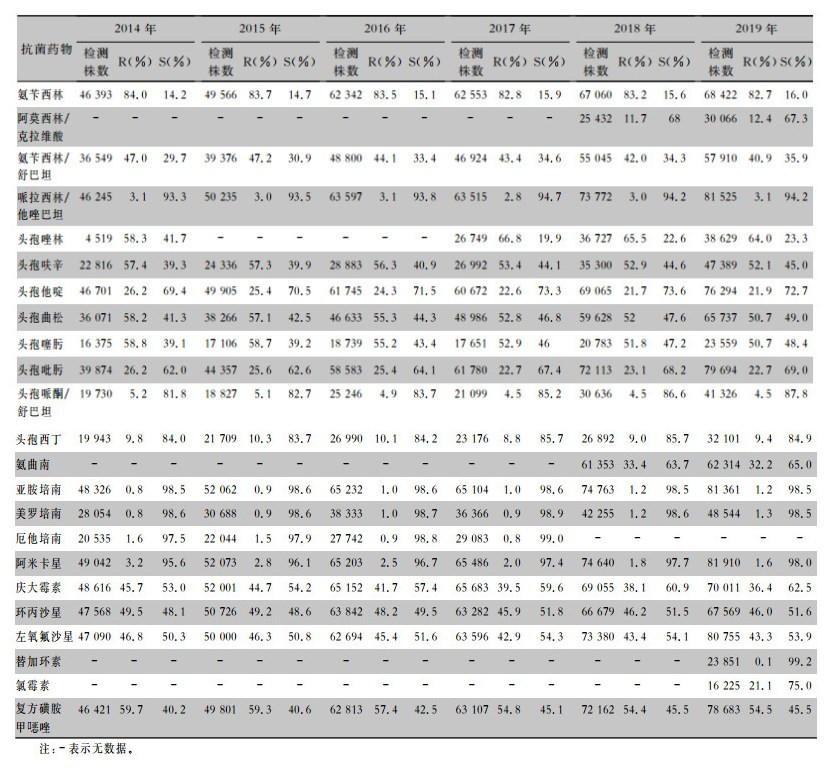
|
| 表 3 2014—2019年CARSS血培养分离肺炎克雷伯菌对抗菌药物的药敏结果 Table 3 Antimicrobial susceptibility testing results of Klebsiella pneumoniae isolated from blood culture, CARSS, 2014-2019 |
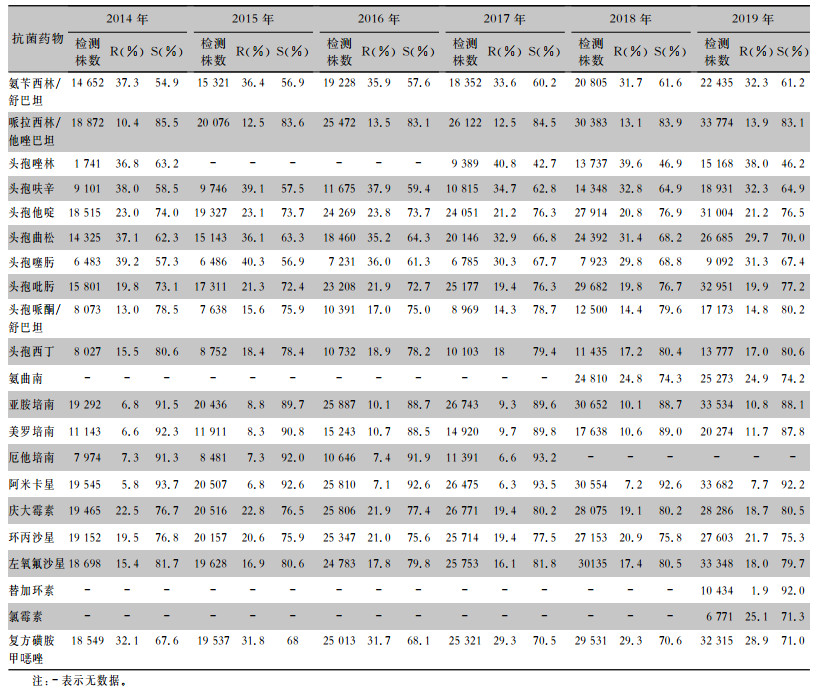
|
| 表 4 2014—2019年CARSS血培养分离铜绿假单胞菌对抗菌药物的药敏结果 Table 4 Antimicrobial susceptibility testing results of Pseudomonas aeruginosa isolated from blood culture, CARSS, 2014-2019 |
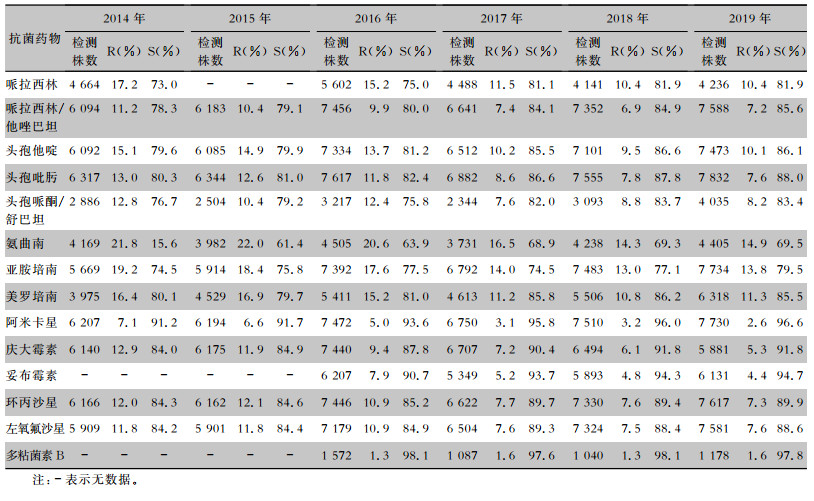
|
| 表 5 2014—2019年CARSS血培养分离鲍曼不动杆菌对抗菌药物的药敏结果 Table 5 Antimicrobial susceptibility testing results of Acinetobacter baumannii isolated from blood culture, CARSS, 2014-2019 |
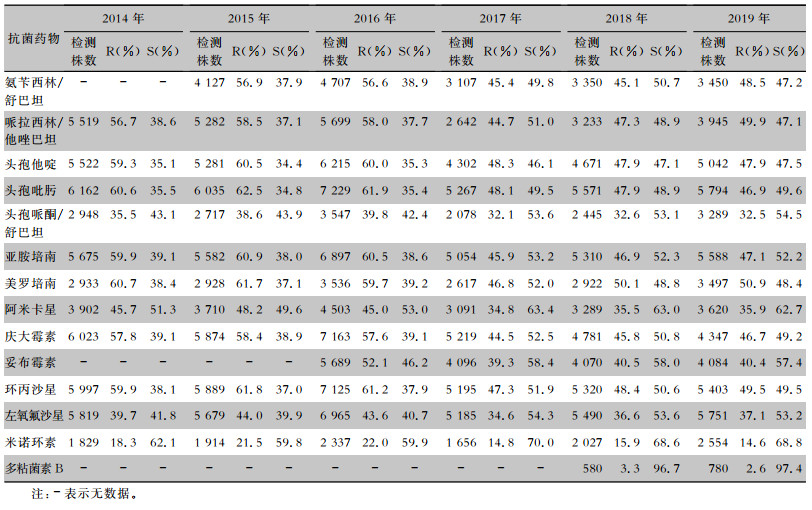
|
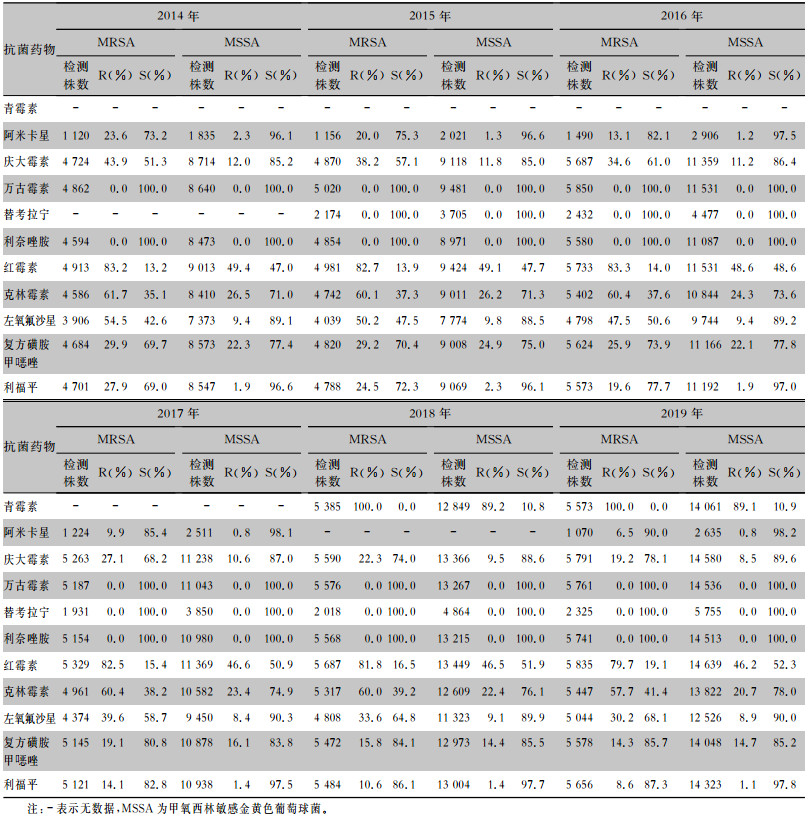
106 915株金黄色葡萄球菌中耐甲氧西林金黄色葡萄球菌(MRSA)33 350株(31.2%),未发现对万古霉素、利奈唑胺和替考拉宁耐药的金黄色葡萄球菌,也未检出对万古霉素、替考拉宁、利奈唑胺的非敏感株。MRSA的分离率呈逐年下降趋势,由2014年的35.4%(5 068/14 323)下降至2019年的28.5%(5 890/20 695),且随着MRSA检出率下降,MRSA对阿米卡星、庆大霉素、利福平、左氧氟沙星、复方磺胺甲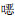
| 表 6 2014—2019年CARSS血培养分离金黄色葡萄球菌对抗菌药物的药敏结果 Table 6 Antimicrobial susceptibility testing results of Staphylococcus aureus isolated from blood culture, CARSS, 2014-2019 |
|
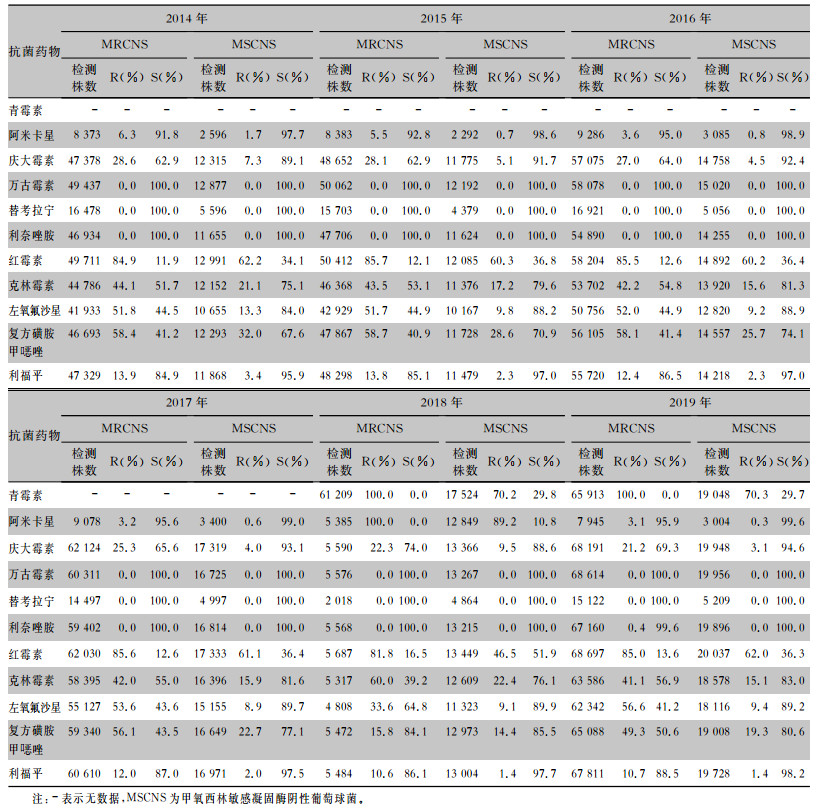
| 表 7 2014—2019年CARSS血培养分离的凝固酶阴性葡萄球菌对抗菌药物的药敏结果 Table 7 Antimicrobial susceptibility testing results of coagulase negative Staphylococcus isolated from blood culture, CARSS, 2014-2019 |
|
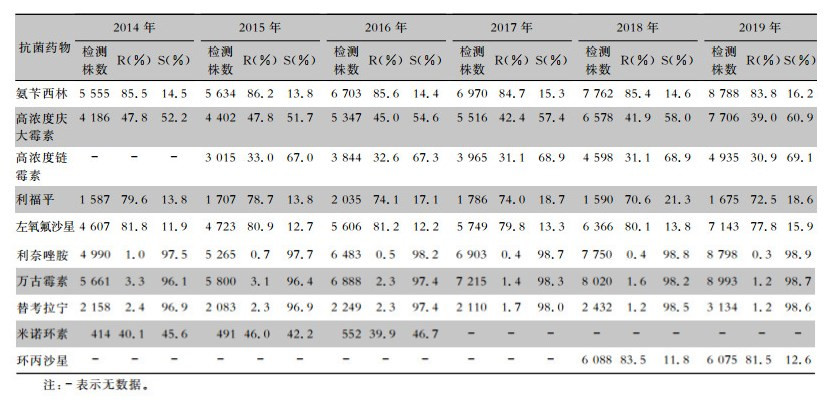
| 表 8 2014—2019年CARSS血培养分离的屎肠球菌对抗菌药物的药敏结果 Table 8 Antimicrobial susceptibility testing results of Enterococcus faecium isolated from blood culture, CARSS, 2014-2019 |
|
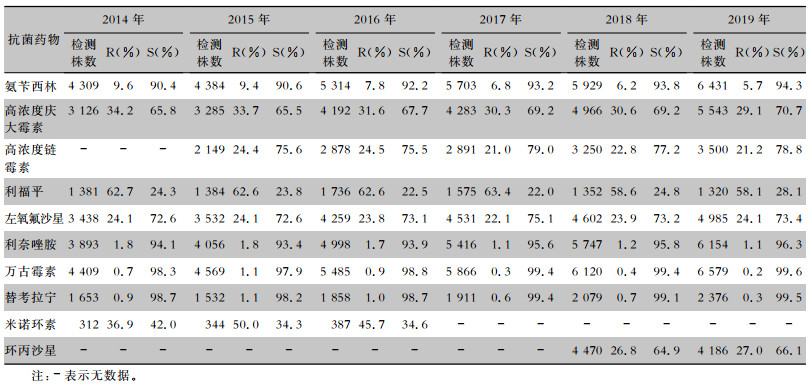
| 表 9 2014—2019年CARSS血培养分离的粪肠球菌对抗菌药物的药敏结果 Table 9 Antimicrobial susceptibility testing results of Enterococcus faecalis isolated from blood culture, CARSS, 2014-2019 |
|
本研究结果显示,我国2014—2019年血标本分离病原菌菌种构成无明显变化,大肠埃希菌、表皮葡萄球菌和肺炎克雷伯菌一直是居前3位的病原菌,与2013—2016年覆盖45个国家200多个医疗中心的SENTRY耐药监测项目[3](无我国数据)略有不同,其血标本病原菌分离居前3位的为大肠埃希菌、金黄色葡萄球菌和肺炎克雷伯菌。血标本病原菌中革兰阴性杆菌所占构成比一直高于革兰阳性球菌,其主要病原菌大肠埃希菌和肺炎克雷伯菌,对第一、二、三代头孢菌素具有较高的耐药率,且可通过质粒水平传播耐药性,临床治疗效果有限,致死率较高,已成为重大的公共卫生问题。
碳青霉烯类抗生素是治疗产超广谱β-内酰胺酶(ESBLs)多重耐药革兰阴性杆菌的一线用药,本研究中大肠埃希菌对碳青霉烯类抗生素耐药率为0.8%~1.6%,肺炎克雷伯菌对亚胺培南、美罗培南耐药率在6.6%~11.7%,均呈逐年上升趋势。全球耐碳青霉烯类肠杆菌目细菌(CRE)的主要耐药机制之一为产碳青霉烯酶(carbapenemase-producing Enterobacteriales, CPE),且易水平传播[4-5],提示临床一旦发生CRE感染,应上报医院感染并采取医院感染防控措施[6]。Yoon等[7]报道,韩国细菌耐药监测系统数据中血标本分离的CPE大肠埃希菌占0.2%,肺炎克雷伯菌占3.1%。我国CPE以KPC-2型酶为主要流行基因型,其次为NDM基因型,不同基因型其临床治疗策略及预后有所不同[8-9],推荐必要时检测CPE的基因型或酶型。头孢他啶/阿维巴坦、替加环素、粘菌素以及联合用药是治疗CRE等多重耐药菌的最后一道防线[10-13]。虽然本研究中没有替加环素完整的药敏结果,但已有多篇研究[8, 14-16]报道分离出替加环素不敏感的肺炎克雷伯菌和大肠埃希菌,其耐药机制与RND外排泵表达上调相关。已分离出耐粘菌素的肠杆菌目细菌,并检测到可水平转移的粘菌素耐药基因mcr-1[17],以及同时携带碳青霉烯酶NDM基因和mcr-1基因的临床菌株[18],并且有越来越多的粘菌素耐药基因被检测出,如mcr-2、mcr-3、mcr-4、mcr-5、mcr-6、mcr-7、mcr-8、mcr-9[19-21],这将加剧当前临床抗菌药物使用窘迫的局面,同时也给抗菌药物使用管理提出了更高的要求。
血标本来源的非发酵菌以铜绿假单胞菌和鲍曼不动杆菌为主,连续6年CARSS监测数据显示,铜绿假单胞菌对各类抗菌药物的敏感性优于鲍曼不动杆菌,且6年来铜绿假单胞菌和鲍曼不动杆菌对临床常用抗菌药物的敏感性总体呈上升趋势,但由铜绿假单胞菌引起的血流感染其病死率及进展速度高于其他革兰阴性杆菌和金黄色葡萄球菌所致的血流感染[22-23],可能与铜绿假单胞菌毒力、药敏变化快及易形成生物膜有关。鲍曼不动杆菌的敏感性虽然总体呈上升趋势,但呈现多重耐药,仅多粘菌素B(2018—2019年数据)的敏感率大于95%,米诺环素的敏感率不超过70%,其余大多常见抗菌药物的敏感率低于60%,与2005—2014年CHINET不动杆菌属细菌耐药性监测数据基本一致[24]。尽管多粘菌素B的敏感率大于95%,但其毒副作用大,为临床抗感染治疗带来困难。为遏制我国鲍曼不动杆菌耐药性和感染的快速增长,2012年我国完成了《中国鲍曼不动杆菌感染诊治与防控专家共识》[25],推荐以替加环素为基础的联合用药治疗鲍曼不动杆菌引起的严重感染。
本研究结果显示,MRSA的分离率呈逐年下降趋势,由2014年的35.4%降至2019年的28.5%;而MRCNS的分离率一直处于较高水平(高于70%)。本研究血流感染分离的病原菌中表皮葡萄球菌居第二位,人葡萄球菌居第四位,溶血葡萄球菌居第六位,总体CNS的构成比较高。随着MRSA检出率逐年下降,MRSA对阿米卡星、庆大霉素、利福平、左氧氟沙星、复方磺胺甲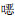
综上所述,我国2014—2019年血标本来源病原菌菌种构成无明显变化,大肠埃希菌、表皮葡萄球菌、肺炎克雷伯菌仍是血流感染最主要的病原菌。虽然本次纳入的均为血标本来源的病原菌,但并不一定都为病原菌,部分可能为污染菌,尤其是分离率居第二位的表皮葡萄球菌,提示应重视葡萄球菌感染,并不断提高血培养送检率和合格率。另外,常用抗菌药物的体外敏感率上下浮动幅度较小。但仍需对多重耐药菌,尤其是可以水平转移耐药性的菌株进行医院感染防控,减缓耐药性的发生,为临床合理用药保驾护航。
| [1] |
Cecconi M, Evans L, Levy M, et al. Sepsis and septic shock[J]. Lancet, 2018, 392(10141): 75-87. DOI:10.1016/S0140-6736(18)30696-2 |
| [2] |
Munang M, Chaudhri S, Himayakanthan M, et al. Defining sepsis:inspiring proposals meet practical realities[J]. Lancet Infect Dis, 2017, 17(6): 577-578. |
| [3] |
Diekema DJ, Hsueh PR, Mendes RE, et al. The microbiology of bloodstream infection:20-year trends from the SENTRY antimicrobial surveillance program[J]. Antimicrob Agents Chemother, 2019, 63(7): e00355-19. |
| [4] |
Yigit H, Queenan AM, Anderson GJ, et al. Novel carbape-nem-hydrolyzing β-lactamase, KPC-1, from a carbapenem-resistant strain of Klebsiella pneumoniae[J]. Antimicrob Agents Chemother, 2001, 45(4): 1151-1161. DOI:10.1128/AAC.45.4.1151-1161.2001 |
| [5] |
Queenan AM, Bush K. Carbapenemases:the versatile β-lactamases[J]. Clin Microbiol Rev, 2007, 20(3): 440-458. DOI:10.1128/CMR.00001-07 |
| [6] |
World Health Organization, Guidelines for the prevention and control of carbapenem-resistant Enterobacteriaceae, Acinetobacter baumannii and Pseudomonas aeruginosa in health care facilities[EB/OL].[2020-06-18]. https://www.who.int/infection-prevention/publications/guidelines-cre/en/.
|
| [7] |
Yoon EJ, Kim D, Jeong SH. Bloodstream infections and carbapenem-resistant Enterobacteriaceae in South Korea[J]. Lancet Infect Dis, 2019, 19(9): 931-932. DOI:10.1016/S1473-3099(19)30431-1 |
| [8] |
张晓慧, 张加玲, 戎建荣, 等. 耐碳青霉烯肠杆菌目细菌的耐药基因研究[J]. 中国药物与临床, 2018, 18(4): 627-630. |
| [9] |
徐红云, 刘春林, 陈弟, 等. 2010-2016年耐碳青霉烯类肺炎克雷伯菌及大肠埃希菌临床分布及其耐药特征[J]. 中国感染控制杂志, 2018, 17(8): 688-692. DOI:10.3969/j.issn.1671-9638.2018.08.007 |
| [10] |
林迪, 孙长贵. 碳青霉烯类耐药肠杆菌目细菌的研究进展[J]. 传染病信息, 2017, 30(5): 257-261, 271. DOI:10.3969/j.issn.1007-8134.2017.05.003 |
| [11] |
刘金花. 某医院老年肺部感染患者痰标本的多重耐药菌分析[J]. 实用医药杂志, 2018, 35(5): 448-452. |
| [12] |
Teo JQ, Chang CW, Leck H, et al. Risk factors and outcomes associated with the isolation of polymyxin B and carbapenem-resistant Enterobacteriaceae spp.:a case-control study[J]. Int J Antimicrob Agents, 2019, 53(5): 657-662. DOI:10.1016/j.ijantimicag.2019.03.011 |
| [13] |
van Duin D, Lok JJ, Earley M, et al. Colistin versus ceftazidime-avibactam in the treatment of infections due to carbapenem- resistant Enterobacteriaceae[J]. Clin Infect Dis, 2018, 66(2): 163-171. DOI:10.1093/cid/cix783 |
| [14] |
许晓娜, 王志盛, 张小倩, 等. 耐碳青霉烯类肺炎克雷伯菌耐药机制的研究进展[J]. 河南医学研究, 2018, 27(17): 3125-3126. DOI:10.3969/j.issn.1004-437X.2018.17.019 |
| [15] |
Choi MJ, Kim S, Ko KS. Pathways regulating the pbgP ope-ron and colistin resistance in Klebsiella pneumoniae strains[J]. J Microbiol Biotechnol, 2016, 26(9): 1620-1628. DOI:10.4014/jmb.1604.04016 |
| [16] |
Poirel L, Jayol A, Bontron S, et al. The mgrB gene as a key target for acquired resistance to colistin in Klebsiella pneumo-niae[J]. J Antimicrob Chemother, 2015, 70(1): 75-80. DOI:10.1093/jac/dku323 |
| [17] |
Zhang HC, Zhao DD, Shi QC, et al. mcr-1 gene has no effect on colistin resistance when it coexists with inactivated mgrB gene in Klebsiella pneumoniae[J]. Microb Drug Resist, 2018, 24(8): 1117-1120. DOI:10.1089/mdr.2017.0291 |
| [18] |
Li X, Mu XL, Zhang P, et al. Detection and characterization of a clinical Escherichia coli ST3204 strain coproducing NDM-16 and MCR-1[J]. Infect Drug Resist, 2018, 11: 1189-1195. DOI:10.2147/IDR.S175041 |
| [19] |
Wang XM, Wang Y, Zhou Y, et al. Emergence of a novel mobile colistin resistance gene, mcr-8, in NDM-producing Klebsiella pneumoniae[J]. Emerg Microbes Infect, 2018, 7(1): 122. |
| [20] |
Yuan Y, Li Y, Wang GX, et al. Coproduction of MCR-9 and NDM-1 by colistin-resistant Enterobacter hormaechei isolated from bloodstream infection[J]. Infect Drug Resist, 2019, 12: 2979-2985. DOI:10.2147/IDR.S217168 |
| [21] |
Rebelo AR, Bortolaia V, Kjeldgaard JS, et al. Multiplex PCR for detection of plasmid-mediated colistin resistance determinants, mcr-1, mcr-2, mcr-3, mcr-4 and mcr-5 for surveillance purposes[J]. Euro Surveill, 2018, 23(6): 17-00672. |
| [22] |
丁艳苓, 姚婉贞, 宁永忠. 铜绿假单胞菌血流感染27例临床分析[J]. 中国感染与化疗杂志, 2013, 13(2): 81-85. DOI:10.3969/j.issn.1009-7708.2013.02.001 |
| [23] |
Bassetti M, Vena A, Croxatto A, et al. How to manage Pseudomonas aeruginosa infections[J]. Drugs Context, 2018, 7: 212527. |
| [24] |
张辉, 张小江, 徐英春, 等. 2005-2014年CHINET不动杆菌属细菌耐药性监测[J]. 中国感染与化疗杂志, 2016, 16(4): 429-436. |
| [25] |
陈佰义, 何礼贤, 胡必杰, 等. 中国鲍曼不动杆菌感染诊治与防控专家共识[J]. 中国医药科学, 2012, 2(8): 3-8. |
| [26] |
王晓娟, 赵春江, 李荷楠, 等. 2011年、2013年和2016年医院内获得性血流感染常见病原菌分布及其耐药性分析[J]. 生物工程学报, 2018, 34(8): 1205-1217. |
| [27] |
Noguchi T, Nagao M, Yamamoto M, et al. Staphylococcus epidermidis meningitis in the absence of a neurosurgical device secondary to catheter-related bloodstream infection:a case report and review of the literature[J]. J Med Case Rep, 2018, 12(1): 106. DOI:10.1186/s13256-018-1646-7 |
| [28] |
Kleinschmidt S, Huygens F, Faoagali J, et al. Staphylococcus epidermidis as a cause of bacteremia[J]. Future Microbiol, 2015, 10(11): 1859-1879. DOI:10.2217/fmb.15.98 |
| [29] |
Deplano A, Vandendriessche S, Nonhoff C, et al. National surveillance of Staphylococcus epidermidis recovered from bloodstream infections in Belgian hospitals[J]. J Antimicrob Chemother, 2016, 71(7): 1815-1819. DOI:10.1093/jac/dkw086 |
| [30] |
Holland TL, Chambers HF, Boucher HW, et al. Considerations for clinical trials of Staphylococcus aureus bloodstream infection in adults[J]. Clin Infect Dis, 2019, 68(5): 865-872. DOI:10.1093/cid/ciy774 |
| [31] |
Paharik AE, Horswill AR. The staphylococcal biofilm:adhesins, regulation, and host response[J]. Microbiol Spectr, 2016, 4(2). |


