2. 复旦大学附属中山医院医院感染管理科, 上海 200032
2. Department of Healthcare-associated Infection Management, Zhongshan Hospital, Fudan University, Shanghai 200032, China
医疗机构中的大部分诊疗活动都需要用水,有学者对医院内的供水进行卫生学检测,指出医院的供水存在不同程度的污染[1-2]。下水道、水槽与水龙头为病原微生物最常见的定植区域[3],水路中检出的常见微生物包括军团菌属、铜绿假单胞菌、嗜水气单孢菌、假丝酵母菌属等[4-5],这些微生物可通过直接或间接的方式污染环境,从而引起医院感染暴发。水源性感染暴发来源包括饮用水、水龙头、透析用水等[6-8]。预防与控制水源性病原微生物引起的医院感染,越来越受到国内外医院感染监控学者们的重视。为进一步研究水龙头污染情况及其污染的喷溅距离,以便更好的制定感染防控措施,本研究对某院重症监护病房(ICU)诊疗区的水龙头进行采样分析,利用三种不同的检测技术,探讨水龙头周围的污染情况及合理布局,以防止ICU内的水源性感染。
1 材料与方法 1.1 试验地点选取某三级综合医院ICU两处水龙头进行取样,水龙头A位于单间病房外,水龙头B位于配药间内。
1.2 材料与试剂3M ATP荧光检测仪,TIANamp Micro DNA Kit(DP316,天根生物),Illumina Hiseq 2500测序仪,血平板,灭菌棉签,PBS缓冲液。
1.3 试验方法根据病区环境布局,试验人员分别在水龙头垂直和水平各方向测试水龙头污染及喷溅范围的污染情况。按照《医院消毒卫生标准(GB 15982—2012)》要求,以水龙头为中心,取出水口四周样本送检,标本编号分别为S0—S14,共15份标本,取样示意图见图 1、2。
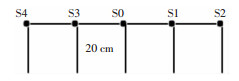 |
| S0:水龙头出水口;S1:水龙头右侧20 cm处;S2:水龙头右侧40 cm处;S3:水龙头左侧20 cm处;S4:水龙头左侧40 cm处 图 1 病房前水龙头A取样点示意图 Figure 1 Diagram of sampling points of faucet A in front of ward |
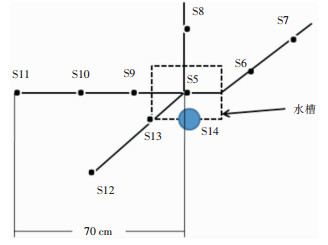 |
| S5:水龙头出水口;S6:水龙头斜上方墙壁,距出水口30 cm;S7:水龙头斜上方墙壁,距出水口50 cm;S8:水槽上方玻璃,距出水口50 cm;S9:水龙头左侧20 cm处;S10:水龙头左侧40 cm处;S11:水龙头左侧70 cm处;S12:水龙头左下方40 cm处;S13:水槽左下角边缘;S14:水槽边缘擦布(吸水用) 图 2 配药室水龙头B取样点示意图 Figure 2 Diagram of sampling points of faucet B in dispensing room |
同一个取样点,用三种检测方法同步进行检测。由于环境限制,采样面积取25 cm2。ATP检测:用灭菌棉拭子来回涂擦两次,使用手持ATP荧光检测仪进行检测。测试值≤200 RLU/件为合格。微生物检测:用浸有PBS的灭菌棉拭子取样,来回涂抹5次,在血平板分区划线,37℃恒温箱培养16~24 h,读取菌落数。参照《医院消毒卫生标准(GB 15982—2012)》中Ⅱ类环境要求:物体表面细菌菌落总数≤5 CFU/cm2。二代测序技术(next-generation sequencing technology,NGS):用灭菌棉拭子涂抹采样,标本DNA按照产品说明书进行提取,构建DNA文库[9],去除长度<35 bp或低质量读数,并与National CenterBiotechnology Information(ftp://ftp.ncbi.nlm.nih.gov/genomes/)进行比对。将测序覆盖率超过一般细菌10倍的结果判定为阳性[10]。统计各标本的严格比对序列数(SMRN)、每1M序列中的比对序列数(RPN)及涉及基因组长度的值(RPKM)、覆盖度、相对丰度等参考值。根据覆盖度、种丰度确定可能的病原体。
1.5 统计分析应用SPSS 13.0统计软件进行数据的分析。
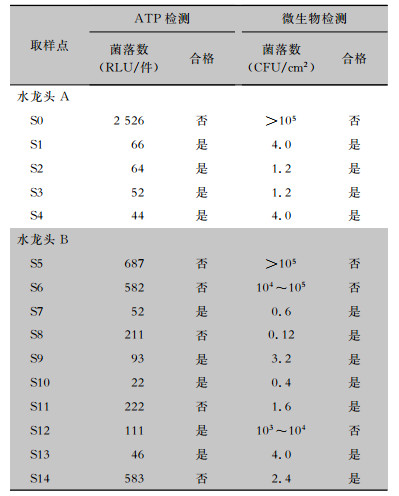
2 结果 2.1 不同取样点ATP检测结果及平板读数结果ATP检测合格率为60.0%,常规微生物检测合格率为73.3%,经卡方检验,差异无统计学意义(χ2=2.784,P=0.235)。以水龙头A为中心,随着距离的增加,菌落值逐渐减少。水龙头B除出水口以外,在水龙头斜上方的墙壁(S6)、上方玻璃(S8)、水槽边缘均读取到较多的菌落数值。在离水龙头70 cm处菌落数检测仍然超标。各取样点ATP检测结果和平板读数结果见表 1。部分血平板涂布结果见图 3。
 |
| A:水龙头A出水口(S0);B:水龙头B出水口(S5);C:配药台距离出水口70 cm处(S11);D:水槽吸水抹布(S14) 图 3 部分采样点拭子直接血平板涂布平板生长结果 Figure 3 Microbial growth on blood agar plates smeared by swabs of partial sampling points |
| 表 1 水龙头A、B取样点ATP检测及微生物培养结果 Table 1 ATP detection and microbial culture results of sampling points of faucets A and B |
|
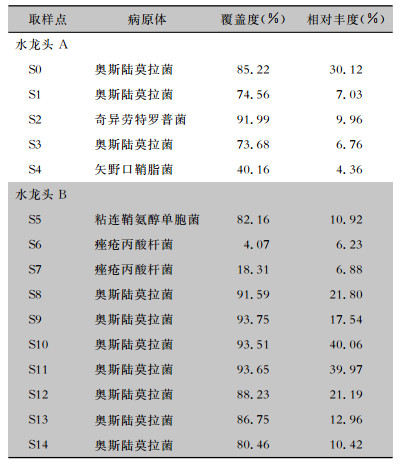
15份标本中,水龙头A和B周围均以奥斯陆莫拉菌为主要病原菌。水龙头出水口和周围物体表面,呈现高度一致性。见表 2。
| 表 2 水龙头A、B取样点NGS检测结果 Table 2 NGS detection results of sampling points of faucets A and B |
|
长期使用的水龙头表面存在大量致病菌,如军团菌、非结核分枝杆菌等致病菌,且容易滋生生物膜,是医院感染的重要来源[11-12]。微生物可通过雾化吸入、摄入和接触等途径影响患者安全[13]。周昭彦等[14]指出,目前医院的水源性感染研究仍只关注耐药菌定植而忽视水传播途径,缺乏有效、便捷的预防和控制措施。本研究通过对水龙头和周围环境的卫生学调查和微生物检测,阐明了水龙头周围的污染程度,为干预措施的制定提供了依据。
本研究中,NGS结果提示水龙头及其周围被奥斯陆莫拉菌严重污染,该菌为条件致病菌,可以引发败血症等医院感染,在免疫力低下人群聚集的科室如ICU、新生儿科等应特别重视。
水龙头是环境污染的重要来源[11],应重视水龙头本身的清洁。在ICU常规清洁的情况下,水龙头出水口以棉拭子取样,ATP结果与平板涂抹结果均检出大量的病原菌,即使在配药间这种洁净的区域内,仍然污染严重。NGS检测结果表明,水龙头周围的病原菌,与水龙头出水口病原菌一致。病房前的水龙头较配药室水龙头污染更严重,读取到的菌落数更多。因病房前的水龙头使用频率高,医务人员、患者和家属均在使用,应加强此类潜在污染区域水龙头的清洁消毒频次。有学者[15]指出,病区的水龙头同时存在病原菌交叉定植的现象,在污染不能消除的情况下,必要时应停用。
水龙头飞溅的水可导致水槽周围的污染。有研究[16-18]显示,水槽中定植的细菌可以通过气溶胶的方式,传播至更广泛的环境中。同时,洗手池旁边放置清洁物品,也会导致清洁物品污染引发患者感染暴发。本研究中,以水龙头为圆心,随着距离的增加,菌落数递减。从水龙头出水口到水龙头周围,均不同程度的发现同一种病原菌,即使在远离水龙头70 cm的区域(S11),仍然发现与水龙头出水口相同的病原菌,提示病区内除采用有效消毒剂消毒水龙头本身外,还应加强水龙头周围环境的清洁消毒工作。医务人员在使用水龙头时,应采取措施尽量避免水滴的飞溅,必要时与周围物品加物理隔断。
取样点S14是水槽边吸水用的抹布,菌落值也较高。在水槽边应避免放置太多物品,尤其是无菌物品不应出现在水槽周围。对于配药台上的物品,医务人员普遍认为相对洁净,容易忽视,而成为静脉配药过程中的一个潜在污染源。由于采样距离的限制,仅采集了70 cm范围内的环境,鉴于仍有可检出水源所致的污染,因此,将范围扩大,建议水龙头周围1 m以内,不应放置无菌物品等可造成交叉感染的物品。
本研究采取三种不同的检测方法,ATP检测和常规微生物检测结果显示出高度一致性。相比较而言,ATP技术在快速性和便捷性上更有优势。但因其受有机物、脱落细胞和食物残渣等众多因素的影响,无法对污染情况做出定性的测量,无法判断污染物是否为微生物污染[19]。因此,ATP较适用于环境消毒效果的实时监控和紧急情况下的卫生学检测。
环境微生物种类多样、复杂,99%的细菌无法用实验室培养方法检测出来,医院环境微生物的监测也开始广泛的使用分子生物学技术,NGS检测技术作为一种新型DNA/RNA测序方法,通过随机引物扩增标本中的所有核酸序列,理论上能无偏倚地检测出所有潜在病原体[20]。且对于一些难以培养的病原菌,在检测技术上更有优势,可为临床的感染来源调查提供很好的线索。本研究15份标本中,均发现不同程度的含有覆盖度很高的奥斯陆莫拉菌,该病原菌为条件致病菌,是ICU中潜在的感染源。
病区的水龙头是环境污染的重要来源,我国关于水污染引起医院感染的报道较少见,仅有少部分肠道感染的报道。本研究结果表明,病区应制定有针对性的政策来加强水龙头及其周围环境的清洁消毒频次,特别是水槽和出水口应定时清洁,水龙头起泡器定期更换。对于环境卫生学监测,应采取多种方式,多管齐下,保障病区环境的清洁。
| [1] |
王晓蕾, 陈越英, 吴晓松, 等. 江苏省医院手术室外科洗手用水及水源水微生物污染情况调查[J]. 中国消毒学杂志, 2016, 33(10): 977-979. |
| [2] |
刘保彦, 杜天慧, 赵青, 等. 新生儿洗浴游泳中心医院感染危险因素与预防控制措施[J]. 中华医院感染学杂志, 2016, 26(18): 4242-4244. |
| [3] |
Kizny Gordon AE, Mathers AJ, Cheong EYL, et al. The hospital water environment as a reservoir for carbapenem-resistant organisms causing hospital-acquired infections-a systematic review of the literature[J]. Clin Infect Dis, 2017, 64(10): 1435-1444. DOI:10.1093/cid/cix132 |
| [4] |
鲍容, 胡必杰, 周昭彦, 等. 医院供水系统快速生长分枝杆菌污染的调查[J]. 中华医院感染学杂志, 2014, 24(10): 2402-2404. |
| [5] |
周昭彦, 胡必杰, 鲍容, 等. 上海市14所医院自来水中潜在病原菌检测及相关因素分析[J]. 中华医院感染学杂志, 2013, 23(8): 1860-1862. |
| [6] |
Brown-Elliott BA, Wallace RJ Jr, Tichindelean C, et al. Five-year outbreak of community-and hospital-acquired Mycobacterium porcinum infections related to public water supplies[J]. J Clin Microbiol, 2011, 49(12): 4231-4238. DOI:10.1128/JCM.05122-11 |
| [7] |
Iroh Tam PY, Kline S, Wagner JE, et al. Rapidly growing mycobacteria among pediatric hematopoietic cell transplant patients traced to the hospital water supply[J]. Pediatr Infect Dis J, 2014, 33(10): 1043-1046. DOI:10.1097/INF.0000000000000391 |
| [8] |
Yapicioglu H, GokmenTG, Yildizdas D, et al. Pseudomonas aeruginosa infections due to electronic faucets in a neonatal intensive care unit[J]. J Paediatr Child Health, 2012, 48(5): 430-434. DOI:10.1111/jpc.2012.48.issue-5 |
| [9] |
Miao Q, Ma Y, Wang Q, et al. Microbiological diagnostic performance of metagenomic next-generation sequencing when applied to clinical practice[J]. Clin Infect Dis, 2018, 67(Suppl 2): S231-S240. |
| [10] |
Langelier C, Zinter MS, Kalantar K, et al. Metagenomic sequencing detects respiratory pathogens in hematopoietic cellular transplant patients[J]. Am J Respir Crit Care Med, 2018, 197(4): 524-528. DOI:10.1164/rccm.201706-1097LE |
| [11] |
梁艳芳, 谭昆, 谭莉, 等. 某大型医院医疗区水龙头内壁生物膜形成情况调查与分析[J]. 公共卫生与预防医学, 2017, 28(1): 87-88,95. |
| [12] |
Garvey MI, Bradley CW, Wilkinson MAC, et al. Engineering water borne Pseudomonas aeruginosa out of a critical care unit[J]. Int J Hyg Environ Health, 2017, 220(6): 1014-1019. DOI:10.1016/j.ijheh.2017.05.011 |
| [13] |
World Health Organization.Guidelines of drinking water qua-lity[M].WHO, 4th ed, 2011.
|
| [14] |
周昭彦, 高晓东, 胡必杰. 医院水源性感染的预防与控制[J]. 中华医院感染学杂志, 2014, 27(7): 1818-1820. |
| [15] |
Cohen R, Babushkin F, Shimoni Z, et al. Water faucets as a source of Pseudomonas aeruginosa infection and colonization in neonatal and adult intensive care unit patients[J]. Am J Infect Control, 2017, 45(2): 206-209. DOI:10.1016/j.ajic.2016.05.029 |
| [16] |
Kouda S, Fujiue Y, Watanabe Y, et al. Sporadic isolations of a multi-drug resistant Pseudomonas aeruginosa clone during a 14-month epidemic in a general hospital in Hiroshima[J]. Infection, 2011, 39(3): 247-253. DOI:10.1007/s15010-011-0111-y |
| [17] |
Wendel AF, Kolbe-Busch S, Ressina S, et al. Detection and termination of an extended low-frequency hospital outbreak of GIM-1-producing Pseudomonas aeruginosa ST111 in Germany[J]. Am J Infect Control, 2015, 43(6): 635-639. DOI:10.1016/j.ajic.2015.02.024 |
| [18] |
Song X, Soghier L, Floyd TT, et al. Reassessing the need for active surveillance of extended-spectrum beta-lactamase-producing Enterobacteriaceae in the neonatal intensive care population[J]. Infect Control Hosp Epidemiol, 2018, 39(12): 1436-1441. DOI:10.1017/ice.2018.260 |
| [19] |
唐毅, 糜琛蓉, 何景雄, 等. ATP检测系统在临床清洁消毒效果评价中的应用[J]. 中华医院感染学杂志, 2011, 21(12): 2523-2525. |
| [20] |
缪青, 马玉燕, 胡必杰. 基于宏基因二代测序技术检测呼吸道病毒的临床应用[J]. 中华医院感染学杂志, 2018, 28(12): 1908-1912. |



