2. 深圳市计量质量检测研究院食品检测所
胆碱是一种天然叔胺类物质,在人体内可氧化为甜菜碱[1],也可由肠道菌群转化为三甲胺(trimethylamine,TMA),TMA被吸收后被肝脏的黄素单加氧酶3(flavin-containing monooxygenase,FMO3)氧化为氧化三甲胺(trimethylamine N-oxide,TMAO)[2]。近年研究表明,血清中的游离胆碱、甜菜碱、TMA和TMAO在心血管疾病、慢性病中发挥着不同的作用[3 – 4]。本课题组前期建立的高效液相色谱法串联质谱法(high-performance liquid chromatography tandem mass spectrometry,HPLC-MS/MS)可对血清游离胆碱、甜菜碱以及TMAO进行测定[5 – 7],但未建立同时检测血清中游离胆碱、甜菜碱、TMAO和TMA的方法,国内亦未见报道。为快速、灵敏并准确的检测血循环中4种物质的浓度,本研究在国外研究[8]的基础上,采用超高效液相色谱串联质谱法(ultra-performance liquid chromatography tandem mass spectrometry,UPLC-MS/MS)同时检测上述4种物质,并对方法的分离度及测量线性范围进行优化,对精密度、准确度和稳定性进行验证,以期为心血管疾病、慢性病的防控策略开辟新途径,为临床和人群研究的检测提供参考依据。
1 材料与方法 1.1 仪器Ultimate 3000 超高效液相色谱仪(美国ThermoFisher Scientific公司),TSQ Quautis三重四级杆质谱仪(美国ThermoFisher Scientific公司),SartoriusG-16C大容量离心机(德国赛多利斯公司),Sartorius万分之一电子天平(德国赛多利斯公司)。Poreshell 120亲水相互作用色谱(hydrop interaction liquid chromatography,HILIC)柱(2.1 × 150 mm,1.9 μm,美国Agilent公司)。
1.2 试剂与标准品 1.2.1 标准品酒石酸氢胆碱(cholinebitartrate,≥ 98 %),甜菜碱(betaine,≥ 98 %),TMAO(98 %),TMA盐酸盐(TMA·HCl,98 %),d9 – 氯化胆碱(Isotec,98 %),d9-TMAO(Isotec,98 %)均购自美国Sigma-Aldrich公司;d9-TMA·HCl(加拿大CDN Isotopes公司,98 %)。
1.2.2 试剂乙腈(德国Merck公司,色谱纯),甲酸(上海aladdin公司,色谱纯),甲酸铵(上海Alfa Aesar公司,色谱纯),溴乙酸叔丁酯(tert-butyl bromoacetate,TBA,美国Sigma-Aldrich公司,98 %)。氨水(上海凌峰化学试剂有限公司,分析纯),去离子水(香港A. S. Watson Group公司)。
1.3 样品采集与酸化将甲酸与去离子水混合(1:99,v:v)成1 %甲酸水溶液,抽取健康志愿者清晨空腹静脉全血5 mL,30 min内在 4 ℃、3 000 r/min离心15 min分离出血清,立即用等体积的1 %甲酸水溶液酸化后以EP管分装,于不同温度下存储待测。
1.4 溶液配制 1.4.1 单一标准储备液精密称取0.034 5 g酒石酸氢胆碱,0.118 0 g甜菜碱,0.019 0 g TMA·HCl和0.023 9 g TMAO标准品,用1 %甲酸水溶液定容至终浓度分别为1 mmol/L,2 mmol/L,25 μmol/L及1 mmol/L的单标储备液,4 ℃储存。
1.4.2 混合标准工作液(表1)| 表 1 混合标准工作液中游离胆碱、甜菜碱、TMA和TMAO的浓度(μmol/L) |
将胆碱、甜菜碱、TMA、TMAO单标储备液混合至终浓度分别为100、200、2.5和100 μmol/L的混合标准工作液,使用时以1 %甲酸溶液2倍逐级稀释成9个浓度梯度的标准系列工作液,各浓度标记为S1~S9。
1.4.3 内标应用液精密称取d9 – 氯化胆碱、d9-TMA·HCl和d9-TMAO用1 %甲酸水溶液配制浓度均为100 μmol/L单一内标储备液,于 – 20 ℃存储。使用时将各内标储备液混合并以用1 %的甲酸水溶液稀释至浓度为20 μmol/L的混合内标应用液。
1.4.4 衍生试剂准确吸取435 mL的TBA,用乙腈配制成浓度为50 mmol/L的TBA乙腈溶液,转移至棕色试剂瓶以备用。将浓氨水滤膜过滤后用去离子水混合(3 : 7,v : v)配制成70 %的氨水溶液。
1.4.5 流动相配制A相准确称取0.63 g甲酸铵溶于去离子水中,过滤膜后用超纯水稀释,加入1 mL甲酸定容至1 000 mL,得到浓度为10 mmol/L甲酸铵 – 0.1 %甲酸水溶液;B相:向乙腈中加入1 mL甲酸,并定容至1 000 mL,得到0.1 %甲酸乙腈混合溶液。
1.5 色谱与质谱条件 1.5.1 液相色谱以流动相A和流动相B进行梯度洗脱,洗脱条件:0~0.15 min为5 % A相;0.15~1.2 min变化为15 % A相;1.2~3 min变化为20 % A相;3~6 min变化为30 % A相;6~7 min变化为45 % A相;7~11 min维持在45 % A相;11~12 min变化为5 % A相,最后12~15 min维持于5 % A相。流速0.2 mL/min;进样量:2 μL;柱温:40 ℃。
1.5.2 质谱(表2)| 表 2 质谱仪器设定参数 |
离子源电喷雾电离源(ESI),正离子模式;离子传输管温度:300 ℃;雾化温度:300 ℃;载气(N2)流速:10 L/min;鞘气流速:40 L/min;扫描方式:单反应监测模式(single reaction monitor,SRM)。选择响应最大母粒子(子离子)为定性(量)离子对,碰撞能量(collision energy,CE)、离子源喷雾电压等质谱参数见表2。
1.6 样品前处理50 μL酸化血清或标准系列工作液与10 μL内标应用液混合后,再加入75 μL的TBA乙腈溶液和10 μL的70 %氨水溶液进行衍生,室温反应30 min后加入50 μL的1 %甲酸乙腈,涡旋混匀后,以4 ℃、15 100 r/min离心7 min。取上清液(约120 μL)至密封的进样瓶中,待测。
1.7 方法学实验依照“Guidance for Industry Bioanalytical Method Validation”[9]进行。
1.7.1 标准曲线、最低定量限和检测限按“样品前处理”步骤处理后以标准品峰面积与内标峰面积比值为纵坐标,标准品浓度为横坐标绘制标准曲线。以信噪比(S/N)等于3为检测限(limit of detection,LOD),S/N等于10为最低定量限(the lower limit of quantitation,LLOQ)。
1.7.2 日内和日间精密度样品前处理后,取各物质S3、S5、S7浓度的标准工作液,各浓度每天重复测定5次,连续测定5 d,计算日间、日内精密度,用相对标准差(relative standard deviation,RSD)表示。
1.7.3 准确度样品前处理后,于混合体系中加入等体积胆碱、甜菜碱、TMA和TMAO的S3、S7浓度标准工作液,连续测定3 d,计算加标回收率。
1.8 稳定性定义 ≤ 15 %浓度变化为可接受稳定性。
1.8.1 保存时间与温度取室温(25 ℃)和冰箱4 ℃储存的血清各9管,于0、2、4、8、24 h进行样品处理和测定。浓度变化 % = (各时点样品浓度0时点样品浓度)/0时点样品浓度 × 100 %。
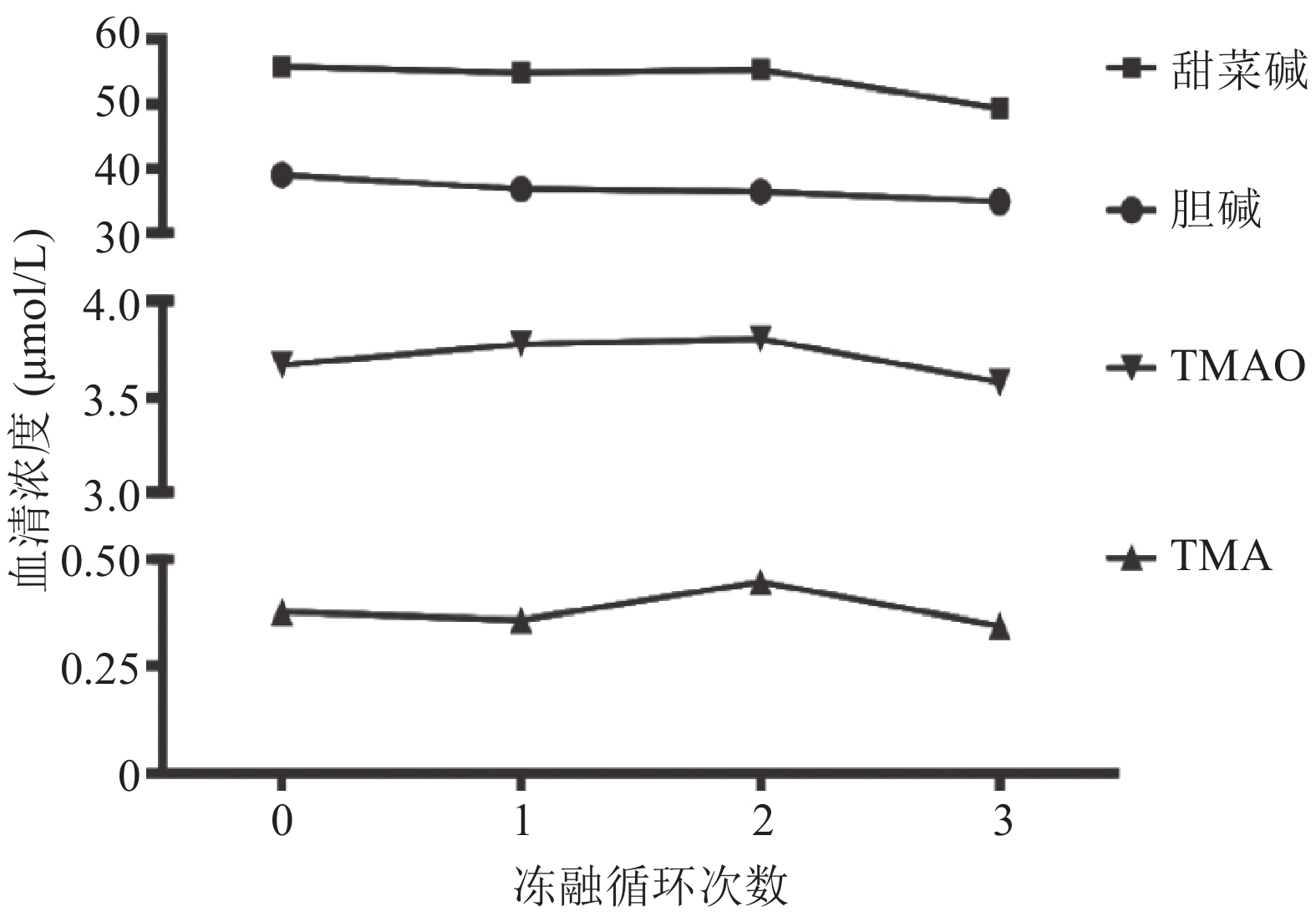
1.8.2 反复冻融血清样品9管,按“ – 80 ℃冷冻24 h→室温(25 ℃) 解冻30 min→漩涡混匀→样本处理并测定→放回 – 80 ℃冷冻24 h”反复冻融3个循环,考察反复冻融对血清中游离胆碱、甜菜碱、TMA和TMAO水平的影响。浓度变化 % = (各循环次数浓度 – 循环0次浓度)/循环0次浓度 × 100 %。
1.8.3 样品稳定性取血清样品9管,前处理并上机检测后置于室温,24 h后重复测定,比较测定浓度的变化百分比。浓度变化 % = (24 h样品浓度 – 初始样品浓度)/初始样品浓度 × 100 %。
2 结 果 2.1 血清样品色谱图(图1~4)

|
图 1 血清中游离胆碱、甜菜碱、TMA、TMAO总离子色谱图 |
|
图 4 不同保存时间和温度对各物质浓度的影响 |
对游离胆碱、甜菜碱、TMA和TMAO进行同时检测,获得了较满意的分离效果:峰高较高,无杂峰干扰,峰形对称。游离胆碱、甜菜碱、TMA和TMAO的保留时间分别为8.76、9.79、6.88和8.97 min,每个样品的检测时间为12.00 min。

|
图 2 血清中游离胆碱、甜菜碱、TMA、TMAO提取离子色谱图 |
2.2 方法学评价 2.2.1 游离胆碱、甜菜碱、TMA和TMAO
4种物质的线性范围(表3) 4种物质的线性范围分别为0.391~100、0.781~200、0.009~2.50和0.391~100 μmol/L;各物质检测限、定量限、线性方程和相关系数见表3。
| 表 3 游离胆碱、甜菜碱、TMA和TMAO检测限、定量限、线性方程和相关系数 |
2.2.2 日内及日间精密度(表4)
| 表 4 血清中游离胆碱、甜菜碱、TMA、TMAO日间和日内精密度 |
对于胆碱、甜菜碱、TMA和TMAO中S3、S5、S7 3个浓度的日内精密度在6 %以内,日间精密度在10 %以内,精密度良好。
2.2.3 准确度(表5)| 表 5 血清中游离胆碱、甜菜碱、TMA、TMAO的准确度 |
本法检测血清中游离胆碱、甜菜碱、TMA和TMAO的加标回收率范围分别在93.10 %~105.30 %,99.87 %~103.12 %,100.20 %~108.29 %,111.55 %~113.83 %,准确度较高。
2.3 稳定性 2.3.1 保存时间和温度对各物质浓度的影响(图3)

|
图 3 不同保存时间和温度对各物质浓度的影响 |
随着保存时间的增加,各物质的血清浓度先上升而后下降。保存温度为4 ℃时各物质的浓度变化范围为1.9 %~12.6 %,变化在可接受范围内;在保存温度为25 ℃时,胆碱和甜菜碱的浓度在4 h均超过15 %。
2.3.2 反复冻融的影响(图4)游离胆碱、甜菜碱和TMAO的血清浓度在3个冻融循环内相对稳定,浓度的变化范围分别为2 %~4 %、6 %~11 %和1 %~12 %;TMA在第2个冻融循环内浓度变化为18 %,> 15 %。
2.3.3 样品稳定性前处理完毕的样品上机检测后置于室温,24 h后重复测量,游离胆碱、甜菜碱、TMA、TMAO浓度变化分别为6.7 %、11.4 %、11.4 %和10.5 %。
2.4 方法应用取10名健康志愿者新鲜血清,用上述方法测定血清中游离胆碱、甜菜碱、TMA和TMAO的水平。其中游离胆碱浓度最小值为6.30 μmol/L,最大值为21.43 μmol/L,平均值为13.78 μmol/L;甜菜碱浓度最小值为11.27 μmol/L,最大值为52.60 μmol/L,平均值为25.99 μmol/L;TMA浓度最小值为0.26 μmol/L,最大值为0.41 μmol/L,平均值为0.292 μmol/L;TMAO浓度最小值为1.06 μmol/L,最大值为5.83 μmol/L,平均值为2.66 μmol/L。
3 讨 论本研究建立的超高效液相色谱串联质谱检测法可同时检测游离胆碱、甜菜碱、TMA和TMAO的血清浓度,使得提取、衍生和反应能够在室温下一步完成[10 – 11],保证各物质在较短的时间内前处理完毕,提高了大人群的血清学检测效率。
本研究选用长度为150 mm的HILIC色谱柱,延长了色谱柱的平衡时间,同时通过亲水相互作用,对强极性的待测物及其衍生物有较好的选择性和保留能力[12],有利于优化分离效果,故本研究中的待测物或其衍生物均可获得良好分离。虽然单个样品的检测时间稍长于Zhao[8],但该方法的仪器单日自动连续最大进样量为96,样品消耗量为50 μL,仍然能够满足大人群检测、低样品消耗的需求。本方法以同位素化合物作为内标,受到的基质干扰与待测物质相似,质谱检测亦可区分内标物和待测物,因此内标法对四种待测物进行定量可以较好的减小基质效应的干扰。本方法测定的线性方程相关系数、日内和日间精密度、加标回收率数值均在合理范围,综合说明该方法的精密度和准确度良好,可满足临床测定和科研分析的需求。稳定性研究发现,随着保存时间增加,游离胆碱、甜菜碱和TMAO浓度先上升,而后逐渐下降。此浓度波动可能是由于在前4 h内,胆碱脂类在酶的作用下分解成游离胆碱再氧化成甜菜碱,或是TMA氧化成TMAO[13]所致。保存温度的稳定性研究结果提示样品收集完毕后应及时放入低温环境储存,不宜在室温中放置过长时间。冻融循环实验的结果则提示,在检测过程中,应尽量避免因样品反复冻融导致的样品中相应酶活性变化以及待测物损耗而造成的检测误差。样品前处理后,室温放置24 h的浓度变化 < 15 %,能满足单批进样(96个)时检测结果的稳定性。
综上所述,超高效液相色谱串联质谱检测方法能够实现快速准确的同时检测血清中游离胆碱、甜菜碱、TMA和TMAO,可应用于临床和流行病学的人群研究。
| [1] | West AA, Shih Y, Wang W, et al. Egg n-3 fatty acid composition modulates biomarkers of choline metabolism in free-living lacto-ovo-vegetarian women of reproductive age[J]. Journal of the Academy of Nutrition and Dietetics, 2014, 114(10): 1594–1600. DOI:10.1016/j.jand.2014.02.012 |
| [2] | Fennema D, Phillips IR, Shephard EA. Trimethylamine and trimethylamine N-oxide, a flavin-containing monooxygenase 3 (FMO3)-mediated host-microbiome metabolic axis implicated in health and disease[J]. Drug Metabolism and Disposition: the Biological Fate of Chemicals, 2016, 44(11): 1839–1850. DOI:10.1124/dmd.116.070615 |
| [3] | Roe AJ, Zhang S, Bhadelia RA, et al. Choline and its metabolites are differently associated with cardiometabolic risk factors, history of cardiovascular disease, and MRI-documented cerebrovascular disease in older adults[J]. The American Journal of Clinical Nutrition, 2017, 105(6): 1283–1290. |
| [4] | 肖云军, 黄海雄, 吴小敏, 等. 甜菜碱对高SAH诱导动脉粥样硬化保护作用[J]. 中国公共卫生, 2017, 33(3): 478–481. |
| [5] | 刘燕, 谭栩颖, 许斌, 等. 血清中氧化三甲胺的高效液相色谱串联质谱法测定研究[J]. 华南预防医学, 2015, 41(3): 207–212. |
| [6] | 王佳佳, 张伟, 谭炳炎, 等. 血清中游离胆碱和甜菜碱的高效液相色谱串联质谱法测定及稳定性研究[J]. 营养学报, 2011, 33(6): 607–611. |
| [7] | 常颖, 谭炳炎, 郑琳, 等. 高效液相色谱法测定人血清甜菜碱方法的建立[J]. 中华检验医学杂志, 2010, 33(5): 405–408. DOI:10.3760/cma.j.issn.1009-9158.2010.05.005 |
| [8] | Zhao X, Zeisel SH, Zhang S. Rapid LC-MRM-MS assay for simultaneous quantification of choline, betaine, trimethylamine, trimethylamine N-oxide, and creatinine in human plasma and urine[J]. Electrophoresis, 2015(36): 2207–2214. |
| [9] | US Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), Center for Veterinary Medicine (CVM). Guidance for industry bioanalytical method validation[S]. Maryland: Food and Drug Administration, 2013. |
| [10] | Craciun S, Balskus EP. Microbial conversion of choline to trimethylamine requires a glycyl radical enzyme[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(52): 21307–21312. DOI:10.1073/pnas.1215689109 |
| [11] | Johnson DW. A flow injection electrospray ionization tandem mass spectrometric method for the simultaneous measurement of trimethylamine and trimethylamine N-oxide in urine[J]. Journal of Mass Spectrometry : JMS, 2008, 43(4): 495–499. DOI:10.1002/(ISSN)1096-9888 |
| [12] | Tang DQ, Zou L, Yin XX, et al. HILIC-MS for metabolomics: an attractive and complementary approach to RPLC-MS[J]. Mass Spectrometry Reviews, 2016, 35(5): 574–600. DOI:10.1002/mas.v35.5 |
| [13] | Kühn T, Rohrmann S, Sookthai D, et al. Intra-individual variation of plasma trimethylamine-N-oxide (TMAO), betaine and choline over 1 year[J]. Clinical Chemistry and Laboratory Medicine, 2017, 55(2): 261–268. |
 2019, Vol. 35
2019, Vol. 35


