糖尿病肾病(diabetic kidney disease,DKD)是糖尿病(diabetes mellitus,DM)引起的严重并发症,也是糖尿病致残和死亡重要原因,发病机制比较复杂[1 – 2],至今仍未完全阐明,遗传因素、糖代谢紊乱、血流动力学改变、氧化应激、细胞及炎症因子[3]等多种因素均可能参与其发生发展过程。研究发现使用糖原合成酶激酶 – 3β(glycogen synthase kinase-3β,GSK-3β)抑制剂后,核转录因子(nuclear factor kappa B,NF-κB)的mRNA与蛋白表达显著下降,NF-κB通路活性降低,相关炎性因子减少,可缓解DKD肾脏的病理病变 [4]。在破骨细胞中骨保护素(osteoprotegerin,OPG)作为一种可溶性诱导受体,可与核因子 κB受体活化因子(receptor activator of nuclear factor-kappa B,RANK)竞争性结合RANK配体(receptor activator of nuclear factor-kappa B ligand,RANKL),阻断RANKL与RANK的结合,抑制其生理效应的发挥,在破骨细胞分化、发育和成熟过程中起关键作用[5 – 7]。研究表明氯化锂可以调节糖代谢、影响上皮 – 间质转分、参与胰岛素抵抗从而预防糖尿病肾脏病发生 [8]。因此,本研究使用GSK-3β 抑制剂氯化锂抑制GSK-3β 活性,观察DKD大鼠肾组织中 β-catenin和OPG表达水平变化,旨在探讨GSK-3β 对糖尿病肾脏病大鼠肾组织中OPG相关通路的调控作用及意义。
1 材料与方法 1.1 主要仪器与试剂722E型可见分光光度计(上海光谱仪器有限公司),LDIS-2型低温离心机(北京医用离心机厂),血糖分析仪(深圳市鑫台欣公司),Gel Doc EQ型DNA成像分析仪(美国BIO-RAD公司),TC-512型梯度PCR扩增仪(英国TECHNE公司),光学显微镜(日本OLYMPUS公司),梯度PCR扩增仪(德国Eppendorf公司),DYY-Ⅲ-5型稳流电泳仪及电泳槽(北京六一仪器厂),病理摄像及分析系统(JD-801计算机图像分析系统)、BX41图像采集系统(日本OLYMPUS公司)。链脲佐菌素(streptozocin,STZ)(美国Sigma公司),OPG抗体(美国BioVision生物试剂公司),β-catenin抗体(加拿大Sigma-Aldrich有限公司),RT-qPCR试剂盒(加拿大Qiagen有限公司),PCR引物设计及合成(上海捷瑞生物工程有限公司)。
1.2 动物模型建立45只健康SD大鼠(体重200~250 g),由贵州省实验动物工程技术中心提供,生产许可证号:SYXK(黔)2012 – 0001,给予普通饲料适应性喂养2周后,随机选择15只,作为对照组,其余30只禁食后,按55 mg/kg腹腔一次性注射STZ溶液制备糖尿病模型,对照组大鼠腹腔注射相同体积溶剂(柠檬酸 – 柠檬酸三钠缓冲液)。3 d后静脉取血,血糖 > 16.7 mmol/L者确定为糖尿病模型 [9]成功。各组大鼠继续喂养10周,每周称重、测血糖。10周后禁食(不禁水)24 h,测定24 h尿蛋白含量,24h尿蛋白 ≥ 30 mg或超过对照组尿蛋白10倍,作为糖尿病大鼠早期DKD标准[10]。
1.3 分组与处理将30只DKD造模成功大鼠随机分为模型组(15只)和氯化锂干预组(15只)。氯化锂干预组大鼠腹腔注射氯化锂(LiCl)15 mg/kg,隔天1次,连续10 d;模型组和对照组大鼠给予同等体积生理盐水腹腔注射。腹腔注射12 d后处死大鼠,处死大鼠前1天代谢笼收集24 h尿样本,肾脏按常规制成3 μm病理切片行苏木精 – 伊红(hematoxylin-eosin staining,HE)染色、免疫组化检测。
1.4 指标与方法 1.4.1 生化指标检测采用考马斯亮蓝法测定大鼠24 h尿蛋白浓度,采用血糖仪检测大鼠血糖水平。
1.4.2 肾组织病理学观察颈椎脱臼法处死大鼠,解剖、分离双侧肾脏,去除包膜,右肾用生理盐水冲洗后,固定,4 ℃保存,用于HE染色及免疫组化检测。左肾置于冰盒中,– 80 ℃低温冰箱保存,用于实时荧光定量PCR检测。3 μm肾组织石蜡切片,5 ℃烤箱内烤片10 min,脱蜡,切片置于二甲苯中浸泡10 min,更换二甲苯后再浸泡10 min,水洗,放入1 %苏木素染液中染色5 min,自来水冲洗反蓝及1 %的盐酸酒精分色,再放入0.5 %伊红染色液中染色2~3 min,自来水冲洗后放入双蒸水,脱水,中性胶封片。显微镜观察大鼠肾组织肾小球、肾小管、间质等的形态结构变化。
1.4.3 肾组织 β-catenin和OPG蛋白表达检测采用免疫组化法,肾组织石蜡切片,烤片、脱水,磷酸盐缓冲液(phosphate-buffered saline,PBS)洗后,0.01 mol/L柠檬酸修复液(pH 6.0)微波修复10 min,冷却至室温,PBS洗后用3 %过氧化氢室温下孵育20 min,PBS洗后滴加1 : 100稀释的一抗摇床50 min,PBS洗后滴加过氧化物酶标记二抗,20~37 ℃孵育60 min,PBS冲洗后二氨基联苯胺(diaminobenzidine,DAB)显色,冲洗,苏木素复染2 min,盐酸酒精分化,脱水、透明、封片,镜检。采用全自动图像分析系统分析免疫组化结果,光学显微镜200倍视野下,每张切片随机选择8个视野,测定肾小管/球阳性免疫组化染色的灰度值,计算相对表达量。
1.4.4 肾组织中OPG和RANKL mRNA表达检测采用实时荧光定量PCR(reverse transcription quantitative real-time polymerase chain reaction,RT-qPCR)法,用Trizol试剂盒抽提各组大鼠肾组织总RNA,进行逆转录。OPG F:5′-ATAAAGGCATGCAAACCCAG-3′,R:5′-GCCTCAAGTGCCTGAGAAAC-3′,扩增片段长度341 bp;RANKL F:5′-GCTCACCTCACCATCAATGCT-3′,R:5′-GGTACCAAGAGGACAGACTGACTTTA-3′,片段长度497 bp;β-actin F:5′-GGAGATTACTGCCCTGGCTCCTA-3′,R:5′-GACTCATCGTACTCCTGCTTGCTG-3′,片段长度186 bp。Real-time PCR循环条件为:93 ℃ 3 min, 92.5 ℃ 48 s,55 ℃ 1 min,40个循环。以Applied Biosystems SDS 14.0软件进行荧光收集和数据分析。
1.5 统计分析计量数据以
|
表 1 氯化锂干预对DKD大鼠体重、血糖、24h尿蛋白水平影响(
|
糖尿病造模后(第4周末),模型组大鼠出现不同程度多尿、多饮、多食、消瘦,活动减少;DKD造模后(第10周末),与对照组比较,模型组、氯化锂干预组大鼠体重降低,差异有统计学意义(P < 0.05);与模型组比较,氯化锂干预组大鼠体重升高,差异有统计学意义( P < 0.05)。与对照组比较,模型组大鼠血糖与24 h尿蛋白水平明显升高( P均 < 0.05);与模型组比较,氯化锂干预组大鼠血糖与24 h尿蛋白水平下降( P均 < 0.05)。
2.2 氯化锂对DKD大鼠肾脏组织病理学影响(图1)
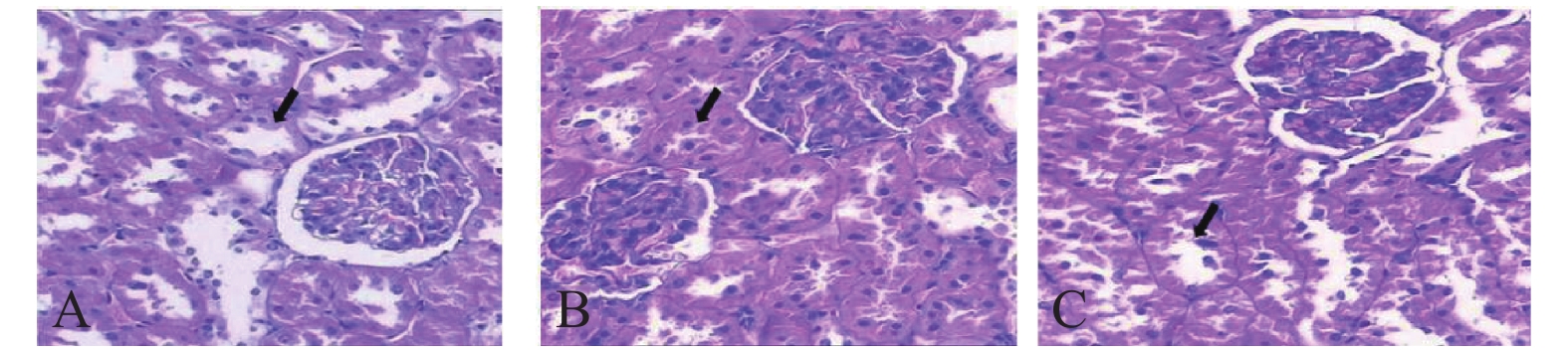
|
注:A对照组;B模型组;C氯化锂干预组。 图 1 氯化锂对DKD大鼠肾组织病理学影响(HE,× 400) |
结果显示,对照组大鼠肾小球大小均一,小管上皮细胞完整,基底膜薄,管周无纤维化及明显的间质水肿(图1A);模型组大鼠肾组织中肾小球肥大,系膜基质增多,毛细血管基底膜增厚;肾小管基底膜增厚,管腔狭窄(图1B);氯化锂干预组大鼠肾小球体积稍增大、毛细血管基底膜轻度增厚、系膜基质增生、肾小管上皮细胞变性程度较模型组有所减轻(图1C)。
2.3 氯化锂对DKD大鼠肾组织中 β-catenin和OPG表达影响(图2、表2)
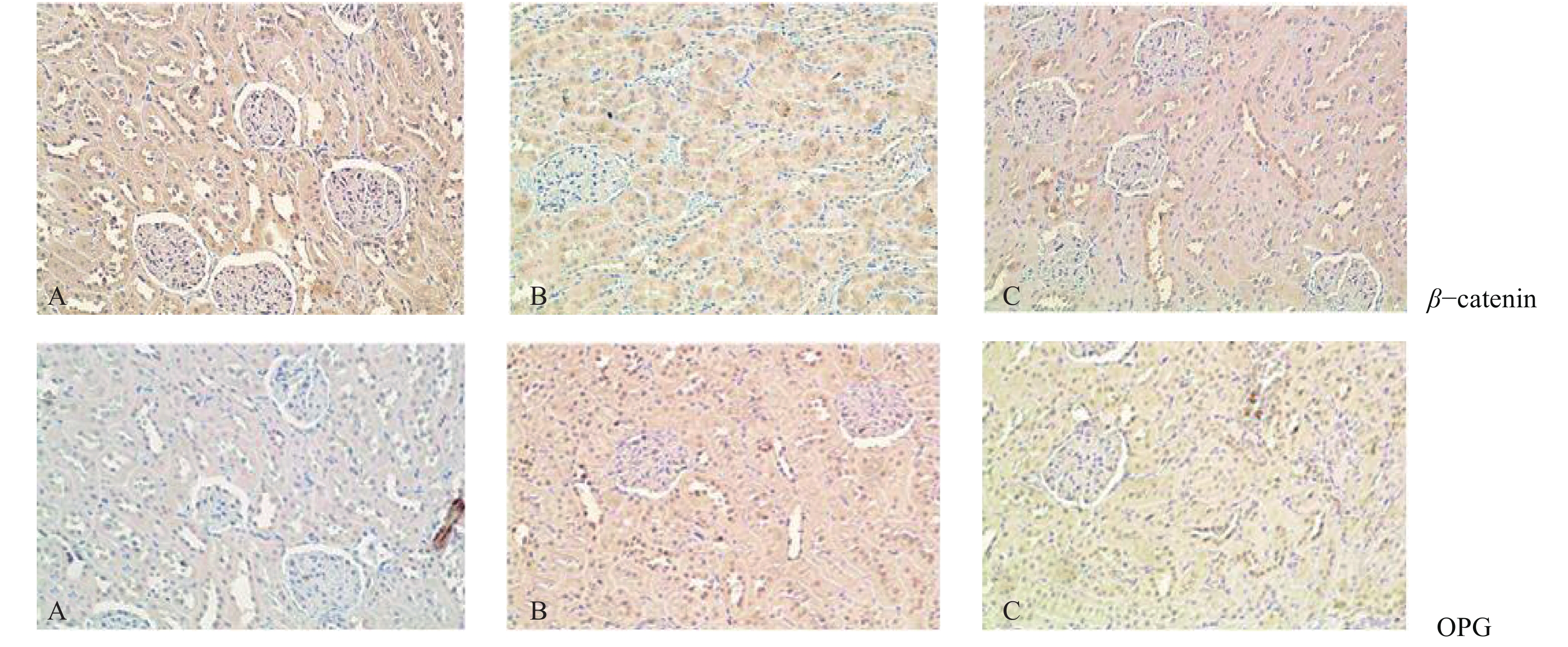
|
注:A对照组;B模型组;C氯化锂组。 图 2 氯化锂对DKD大鼠肾组织 β-catenin、OPG表达影响(免疫组化,× 200) |
|
表 2 氯化锂对DKD大鼠肾组织 β-catenin、OPG表达影响(
|
β-catenin阳性表达部位在肾小管和肾小球的胞浆及胞核,呈黄染颗粒状。对照组大鼠肾小管上皮细胞胞浆内 β-catenin呈中度表达,胞核内未见表达(图2A);模型组大鼠肾小管上皮细胞胞浆内 β-catenin有部分表达,但胞核内未见表达(图2B);氯化锂干预组大鼠肾组织细胞胞浆内 β-catenin有表达,且核浆可见表达(图2C)。OPG阳性部位在肾小球和肾小管胞浆及胞核,呈黄染颗粒状。对照组胞浆及胞核可见少量阳性表达(图2A);与对照组比较,模型组与氯化锂干预组大鼠肾小管上皮细胞胞浆内OPG表达均有增强(P < 0.05)( 图2B、C)。
2.4 氯化锂对DKD大鼠肾组织中OPG/RANKL mRNA表达影响与对照组(1.00 ± 0.00)比较,模型组大鼠肾组织OPG/RANKL mRNA表达(0.6 ± 0.06)明显降低,差异有统计学意义(P < 0.05):与模型组比较,氯化锂干预组大鼠肾组织中OPG/RANKL mRNA表达(1.6 ± 0.12)明显升高,差异有统计学意义( P < 0.05)。
3 讨 论糖尿病患者中约有30 %~40 %的比例会出现肾脏损害,即糖尿病肾病(DKD),是导致终末期肾病和死亡的主要原因。目前,认为是多因素如糖代谢紊乱[11]、血流动力学改变[12],炎症因子[13 – 14]等综合作用下的结果。研究发现,GSK-3β 可促进高糖及胰岛素诱导的肾上皮细胞外基质蛋白合成,在DKD肾脏肥大及细胞外基质聚集中发挥着重要作用,GSK-Wnt信号通路在DKD肾小管损伤中发挥重要作用[15]。Wnt信号通路与细胞生长、分化、行使功能、凋亡等有关,该通路可通过OPG/RANKL/RANK信号通路的Cross-Talk来调节骨重建过程[16]。通过增加OPG/RANKL比例,β-catenin可抑制破骨细胞的合成[17]。NF-κB是一种广泛存在于各种细胞中的转录因子,在鼠破骨细胞中,NF-κB信号通路上关键细胞因子RANKL刺激能活化NF-κB信号通路[18],RANKL信号经过RANK传递给肿瘤坏死因子受体相关因子6(TNFR-associated factors 6,TRAF6),TRAF6可通过NIK(NF-κB可诱导性激酶)和IKK(NF-κB激酶诱导剂)活化NF-κB[19 – 20],活化的NF-κB转位到核内与其相关的DNA序列结合以诱导多种前炎性细胞因子的转录,是炎症发生发展的重要因子。前期研究发现DKD与NF-κB信号通路的炎症反应具有一定关系[4],同时发现DKD大鼠肾组织中RANK表达显著上升。提示,RANK参与了DKD疾病进程。
本研究结果显示,糖尿病肾病模型组大鼠血糖及尿蛋白水平均高于对照组,OPG/RANKL mRNA比值减小,模型组大鼠肾组织病理变化明显;与模型组比较,氯化锂干预组(GSK-3β 抑制剂)大鼠血糖及尿蛋白水平均明显降低,肾组织中OPG/RANKL mRNA比值增大,大鼠肾组织病理改变减轻。其机制可能与下列过程有关:DKD大鼠肾组织中,虽然OPG呈保护性上升,但RANKL活化表达上升幅度更大,相对下调了OPG/RANKL mRNA比值;而在NF-κB信号通路中,过量上游因子RANKL的刺激活化下游NF-κB,促进DKD病程;而GSK-3β 抑制剂氯化锂在不同程度上激活了wnt/β-catenin信号通路,引起 β-catenin不同程度活化,上调了OPG/RANKL mRNA比值,即OPG表达相对上升,OPG作为RANK的竞争性因子,与RANKL结合,抑制了RANK/RANKL引起的NF-κB活化,一定程度上缓解了DKD的疾病进程。
综上所述,OPG可通过OPG/RANKL/RANK信号通路减缓糖尿病肾病的发生发展。因此,OPG可作为一个潜在的细胞因子治疗靶点,发挥对DKD大鼠肾脏的保护作用。
| [1] | Gluhovschi GH, Gluhovschi C, Vlad A, et al. Diabetic nephropathy and multiorgan protection. Part I[J]. Rom J Intern Med, 2011, 49(3): 163–177. |
| [2] | Gluhovschi GH, Gluhovschi C, Vlad A, et al. Diabetic nephropathy and multiorgan protection. Part II[J]. Rom J Intern Med, 2011, 49(4): 237–249. |
| [3] | Mora C, Navarro JF. The role of inflammation as pathogenic factor in the development of renal disease in diabetes[J]. Curr Diab Rep, 2005, 5: 399–401. DOI:10.1007/s11892-005-0044-x |
| [4] | 周谊霞, 李龙, 于燕妮, 等. 糖原合酶激酶-3β抑制剂对糖尿病肾病大鼠Wnt和核因子-κB信号通路的影响[J]. 中华病理学杂志, 2015, 11: 783–787. DOI:10.3760/cma.j.issn.0529-5807.2015.11.005 |
| [5] | Tanaka S. Signaling axis in osteoclast biology and therapeutic targeting in the RANKL/RANK/OPG system[J]. Am J Nephrol, 2007, 27(5): 466–478. DOI:10.1159/000106484 |
| [6] | Daisuke K, Masakazu H, Hiroko N, et al. Amelioration of accelerated diabetic mesangial expansion by treatment with a PKC beta inhibitor in diabetic db/db mice, a rodent model for type 2 diabetes[J]. Faseb J, 2000, 14(3): 439–447. DOI:10.1096/fasebj.14.3.439 |
| [7] | Akira M. Glomerular-specific protein kinase C-beta-induced insulin receptor substrate-1 dysfunction and insulin resistance in rat models of diabetes and obesity[J]. Kidney Int, 2011, 79(8): 883–896. DOI:10.1038/ki.2010.526 |
| [8] | Gao C, Hölscher C, Liu Y, et al. GSK3: a key target for the development of novel treatments for type 2 diabetes mellitus and Alzheimer disease[J]. Rev Neurosci, 2012, 23(1): 1–11. DOI:10.1515/rns.2011.061 |
| [9] | Nam JS, Cheong YS, Karm MH, et al. Effects of nefopam on streptozotocin-induced diabetic neuropathic pain in rats[J]. Korean J Pain, 2014, 27(4): 326–333. DOI:10.3344/kjp.2014.27.4.326 |
| [10] | Flyvbjerg A, Denner L, Schrijvers BF, et al. Long-term renal effects of a neutralizing RAGE antibody in obese type 2 diabetic mice[J]. Diabetes, 2004, 53(1): 166–172. |
| [11] | McDonald SD, Pesarchuk E, Don-Wauchope A. Adverse metabolic effects of a hypercaloric, high-fat diet in rodents precede observable changes in body weight[J]. Nutr Res, 2011, 31(9): 707–714. DOI:10.1016/j.nutres.2011.08.009 |
| [12] | Chirinos JA, Segers P, Gillebert TC, et al. Central pulse pressure and its hemodynamic determinants in middle-aged adults with impaired fasting glucose and diabetes: the Asklepios Study[J]. Diabetes Care, 2013, 36(8): 2359–2365. DOI:10.2337/dc12-1463 |
| [13] | Matia-García I, Muñoz-Valle JF, Parra-Rojas I. Macrophage migration inhibitory factor and its relationship with obesity and diabetes[J]. Invest Clin, 2014, 55(3): 266–277. |
| [14] | 苏毅. 糖尿病肾脏疾病发病机制研究进展[J]. 中国实用医药, 2009, 4: 231–234. |
| [15] | 唐杰, 郝丽荣. GSK3-Wnt信号通路与糖尿病肾病的关系[J]. 医学综述, 2012, 18(3): 421–423. DOI:10.3969/j.issn.1006-2084.2012.03.035 |
| [16] | 陈锡山, 于燕妮. Wnt经典信号通路与氟骨症[J]. 中华地方病学杂志, 2014, 33(1): 113–115. DOI:10.3760/cma.j.issn.2095-4255.2014.01.036 |
| [17] | 刘晓青, 崔燎. 防治骨质疏松症的药物研究进展[J]. 中国骨质疏松杂志, 2009, 15(2): 153–157. DOI:10.3969/j.issn.1006-7108.2009.02.017 |
| [18] | Otero JE, Chen T, Zhang K, et al. Constitutively active canonical NF-kappa B pathway induces severe bone loss in mice[J]. PLoS One, 2012, 7(6): e38694. DOI:10.1371/journal.pone.0038694 |
| [19] | Darnay BG, Ni J, Moore PA, et al. Activation of NF-kappa B by RANK requires tumor necrosis factor receptor-associated factor (TRAF) 6 and NF-kappa B-inducing kinase. Identification of a novel TRAF6 interaction motif[J]. J Biol Chem, 1999, 274(12): 7724–7731. DOI:10.1074/jbc.274.12.7724 |
| [20] | Ruocco MG, Maeda S, Park JM, et al. I{kappa}B kinase (IKK){beta}, but not IKK{alpha}, is a critical mediator of osteoclast survival and is required for inflammation-induced bone loss[J]. J Exp Med, 2005, 201(10): 1677–1687. DOI:10.1084/jem.20042081 |
 2019, Vol. 35
2019, Vol. 35
