2. 宁波市南门街道社区卫生服务中心全科医学;
3. 中国疾病预防控制中心传染病预防控制所
宫颈癌是全球女性常见的恶性肿瘤之一,是发展中国家肿瘤发病率和死亡率的重要组成部分,据报道,宫颈癌在亚洲女性中每年约有28万例患者新发、14万例患者死亡[1 – 2]。人乳头瘤病毒(human papillomavirus,HPV)持续感染是宫颈癌和其他生殖器癌发生的主要危险因素[3 – 4],而预防性HPV疫苗为控制HPV感染提供了广阔前景。目前二价HPV(16、18型)疫苗与四价HPV(6、11、16、18型)疫苗已在世界100多个国家广泛使用,其疾病预防效果得到多个研究的印证[5 – 7]。九价HPV疫苗,因其含有HPV6、11、16、18、31、32、45、52、58等9种基因型,可以预防90 % 的宫颈癌[8 – 9]。自2014年12月经美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市以来,受到人们广泛地关注。为评价九价HPV疫苗接种后保护效果、免疫原性及安全性, 为中国HPV免疫策略制定提供循证依据,本研究通过收集2018年8月31日之前公开发表的关于HPV疫苗接种后保护效果、免疫原性及安全性的相关文献,对九价HPV疫苗接种后的保护效果、免疫原性及安全性进行了meta 分析。结果报告如下。
1 资料与方法 1.1 文献检索策略在中国知网数据库(China National Knowledge Infrastructure, CNKI)、万方数据知识服务平台、维普期刊资源整合服务平台(Chinese Sci-Tech Journals Database, VIP)、Medline/PubMed数据库、EMBASE数据库、Cochrane Library数据库和clinicaltrials.gov数据库中检索2018年8月31日之前公开发表的相关中、英文文献。中文和英文检索主题词分别为:“人乳头瘤病毒疫苗”、“HPV 疫苗”、“九价/9价”和“human papillomavirus vaccine”、“HPV vaccine”、“9-valent/nonavalent”。
1.2 纳入与排除标准纳入标准:(1)研究类型:随机对照试验(random control trial,RCT)。(2)研究对象:健康女性或男性,年龄9~26岁。①符合方案(per-protocol,PP)人群:注册时对相关亚型HPV呈血清反应阴性和PCR阴性直至3剂接种后1个月(7个月内)仍对相关亚型HPV呈聚合酶链反应(polymerase chain reaction, PCR)阴性,与研究预案无主要偏差;②意向性分析(intent-to-treat,ITT)人群:至少接受1剂疫苗/安慰剂,即使与研究方案有偏差。实验组的干预措施是使用九价HPV疫苗,对照组使用四价HPV疫苗或安慰剂。(3)结局指标:①免疫原性:比较实验组和对照组3剂次接种满1个月后HPV6、11、16、18基因型抗体滴度及HPV31、33、45、52、58基因型抗体阳性率,HPV31、33、45、52、58基因型抗体阳性指血清抗体浓度分别不低于10、8、8、8、8 mMU/mL;②疫苗安全性指标:比较实验组和对照组之间接种疫苗7 d内的不良反应发生率,包括局部反应、全身反应、严重不良反应、因疫苗反应而终止四类情况;③宫颈上皮内瘤样病变(cervical intraepithelial neoplasia,CIN)Ⅱ+(CINⅡ、CINⅢ)、原位癌、宫颈癌发生率及外阴上皮内瘤样病变(vulvar intraepithelial neoplasia,VIN)Ⅱ、Ⅲ级和阴道上皮内瘤样病变(vaginal intraepithelial neoplasia,VaIN)Ⅱ、Ⅲ级发生率,HPV 持续性感染发生率 ≥ 6个月。排除标准:(1)信息不完整、不清晰或出现错误的文献。(2)内容数据重复发表的文献。
1.3 数据提取和质量控制收集文献资料,内容包括第一作者、发表年份、研究现场、样本量、研究对象特征、干预措施、对照组、评估结果等。由2名研究者分别对每篇文献质量进行评估,当2人对同篇文献意见有分歧时,通过协商寻得共同标准并达成一致,如找不到共同标准可加入第3位研究者进行协商讨论。采用Cochrane 系统评价员手册5.0的质量评价标准[10]对纳入的文献进行方法学质量评价,从随机、分配隐藏、盲法、报道失访情况、意向性分析、其他偏倚来源6个部分进行评分,每部分低风险计1分,总分6分为最高。
1.4 统计分析应用Stata 12.0软件进行统计分析,计数资料采用RR值、疫苗保护率(1 – RR)及其95 % CI进行描述,计量资料采用抗体滴度(mMU/mL)标准化均数差值SMD及其95 % CI进行描述。采用I2和Q检验评估纳入研究间的异质性,当各研究间无统计学异质性时采用固定效应模型做合并分析绘制森林图;如研究间存在统计学异质性则采用随机效应模型计算合并效应量,当I2 > 50 % 时尝试找出异质性来源,进行亚组分析;如异质性过于明显,则放弃meta分析,仅做定性描述。若试验过程中有退出和/或失访病例,则按ITT原则处理。采用Begg′s检验发表偏倚,检验水准为双侧检验 α = 0.05。
2 结 果 2.1 文献基本情况(图1、表1)
|
图 1 文献筛选流程图 |
| 表 1 纳入meta分析文献一般特征 |
共检索到189篇中、英文文献,经阅读摘要、全文,最终纳入5篇英文文献,涉及4个随机对照试验,累计研究对象16 239人。
2.2 疫苗接种的预防效力(表2)| 表 2 九价HPV疫苗组与四价HPV 疫苗组接种后不同随访期PP人群疫苗保护率 |
共有Joura等[11]和Huh等[14]2篇文献报告了疫苗接种对HPV相关疾病的预防效力,分别为同一个随机对照试验不同随访期的研究结果。在PP人群中,九价HPV疫苗组较四价HPV疫苗组在预防HPV31、33、45、52、58基因型相关疾病方面表现出较强的保护效果,疫苗接种42个月后实验组和对照组发病密度分别为1/10 000人年和16/10 000人年,随访60个月后实验组和对照组发病密度分别为0.5/10 000人年和19/10 000人年;而HPV6、11、16、18基因型相关疾病2组人群预防效果差异无统计学意义(P > 0.05)。在ITT人群中,接种前实验组未发生HPV感染的接种者HPV31、33、45、52、58型疾病发生率低于对照组,保护率为100 %(70.7 %~100 %);接种前已发生HPV感染的接种者2组发病率差异无统计学意义( P > 0.05)。
2.3 免疫原性 2.3.1 抗体阳性率(图2)
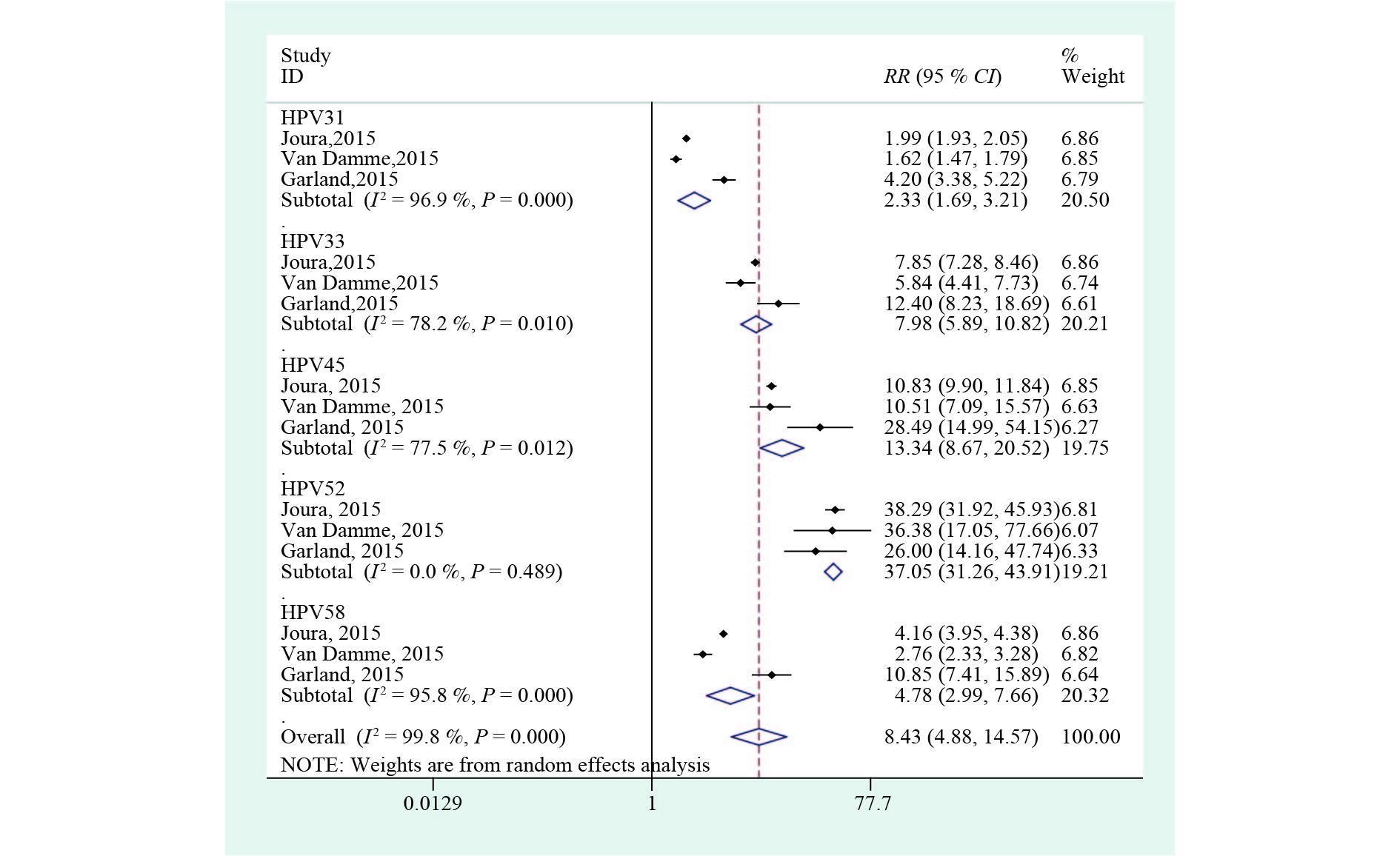
|
图 2 九价HPV疫苗组与四价HPV 疫苗组接种满3剂次1个月后抗体阳性率差异 |
共有Joura等[11]、Van Damme等[13]和Garland 等[15] 3篇文献报告了接种九价HPV疫苗与四价HPV疫苗或安慰剂后HPV31、33、45、52、58基因型抗体阳性率的差异。对纳入的3篇文献进行异质性检验,文献间存在显著异质性(I2 = 99.8 %,P < 0.05),故采用随机效应模型合并效应统计量,九价HPV疫苗组HPV31、33、45、52、58基因型抗体阳性率均高于四价HPV疫苗组,总体合并效应值为 RR = 8.43(95 % CI = 4.88~14.57)。因研究数据有限,未进一步进行亚组分析。
2.3.2 抗体滴度(表3)| 表 3 接种九价HPV疫苗与四价HPV疫苗3剂后1个月HPV6、11、16、18型抗体滴度比值 |
共有Vesikari等[12]、Van Damme等[13]和Huh等[14]3篇文献报告了接种九价HPV疫苗与四价HPV疫苗后HPV6、11、16、18基因型抗体滴度及其95 % CI,并进行了非劣效性(noninferiority,NI)检验。因各研究间统计学异质性过大,因此放弃合并效应量SMD,仅对各研究结果进行定性描述。各研究抗体滴度比值的95 % CI下限值均大于非劣效性界值0.67,九价HPV疫苗组HPV6、11、16、18基因型别的免疫学效果不劣于四价HPV疫苗组。
2.4 疫苗的安全性(图3)

|
图 3 九价HPV疫苗组与四价HPV 疫苗组接种后不良反应比较 |
共有Vesikari等[12]、Van Damme等[13]和Huh等[14]3篇文献报告了接种九价HPV疫苗与四价HPV疫苗后不良反应的发生率差异。对纳入的3篇文献进行异质性检验,文献间不存在显著异质性(I2 = 46.7 %,P > 0.05),故采用固定效应模型合并效应统计量。九价HPV疫苗组注射部位局部反应发生率高于四价HPV疫苗组,合并效应值为 RR = 1.07(95 % CI = 1.05~1.08);全身不良反应的发生率2组差异无统计学意义(P > 0.05);严重不良反应发生率九价HPV疫苗组高于四价HPV疫苗组,合并效应值为 RR = 1.27(95 % CI = 1.05~1.54),但其中经证实的与疫苗相关的严重不良反应发生情况较少(< 0.1 %),且差异无统计学意义(P > 0.05)。
2.5 发表偏倚计算以上合并率,同时进行Begg′s检验,发现接种3剂次1个月后HPV31、33、45、52、58基因型抗体阳性率合并效应值计算中不存在发表偏倚(P > 0.05),接种九价HPV疫苗与四价HPV疫苗后不良反应的发生率合并效应值也不存在发表偏倚( P > 0.05)。
3 讨 论九价HPV疫苗的预防效力和安全性已经得到证实,于2015年2月被美国免疫实践咨询委员会(Advisory Committee on Immunization Practices,ACIP)推荐为可用于常规免疫的3种HPV疫苗之一[16],并规定自2017年5月起成为美国唯一可用于接种的HPV疫苗[17]。本研究发现,与四价HPV疫苗相比,九价HPV疫苗明显降低了HPV31、33、45、52、58基因型相关高级别宫颈、外阴、阴道疾病和HPV的持续感染,并产生针对HPV6、11、16、18基因型的非劣效性抗体反应,这对宫颈癌的防治产生了重要意义。有研究表明,九价HPV疫苗可预防亚洲人群92 % 的宫颈癌[18 – 19],因HPV52和58基因型在亚洲人群有较高的感染率[20],中国也有多位学者证实了这一结论[21 – 22]。Joura等[11]进行的调查人群意向性分析发现,几乎所有发生HPV持续感染和宫颈细胞学异常的接种者均在疫苗接种前已经感染了病毒,强调了暴露前接种的必要性。目前九价HPV疫苗的免疫持续时间尚未明确,Huh等[14]对PP人群随访了60个月,其中 > 77.5 % 的接种者仍然保持了血清抗体阳性,且具有良好的免疫记忆 [23],这是迄今为止随访时间最长的RCT研究。四价HPV疫苗免疫效力已被证实可持续 ≥ 10年[24],说明九价HPV疫苗的免疫持续时间也是可以期待的,更确切的数据有待日后的进一步研究结果。
因为伦理学考虑等原因,无法对青少年人群进行临床保护效力试验。为此,Van Damme等[25]设计了九价HPV疫苗的免疫桥接试验,证实了9~15岁青少年人群可以通过免疫原性桥接其16~26岁的效力试验结果。同时因9~15岁青少年人群具有良好的免疫应答力[26],美国ACIP已推荐9~14岁人群使用2剂次九价HPV疫苗接种程序。另有临床研究发现,接种九价HPV疫苗后产生的抗体滴度不受同时接种的脑膜炎疫苗 + 百白破疫苗或脊髓灰质炎疫苗 + 百白破疫苗的影响,且每种疫苗的免疫应答也不会相互影响[27 – 28]。
九价HPV疫苗具有良好的安全性。九价疫苗组最常出现的局部反应为接种部位疼痛、肿胀、发红,全身不良反应常表现为头痛或瞳孔缩小。Wilkin等[29]曾开展男性艾滋病病毒感染者接种四价HPV疫苗的研究,未发现接种者有与疫苗相关的严重不良事件的发生以及CD4细胞数的减少,提示四价HPV疫苗安全有效。本研究发现,与四价HPV疫苗组相比,九价HPV疫苗组局部反应发生频率稍高,全身不良反应无明显差别,两者疫苗相关的严重不良反应均很少发生,从而间接证明了九价HPV疫苗的安全性,这与Moreira等[30]的研究结果相同。Garland等[20]综述发现相对于研究中的世界其他人群,亚洲人群(中国香港地区、中国台湾地区、日本和韩国)疫苗相关的全身反应发生率较低,疫苗耐受性良好。现有的证据表明九价HPV疫苗是安全有效的,与二价疫苗或四价疫苗相比具有更好的卫生经济学意义[31 – 33]和公共卫生价值。目前九价HPV疫苗已在欧洲、加拿大、澳大利亚、韩国、日本等多个国家注册使用,但在亚洲疫苗覆盖率仍然较低,中国也仅有中国香港、海南、北京、浙江杭州等少数地区批准上市。有多项研究表明,中国大陆人群对宫颈癌防治及疫苗认知有限[34 – 35]但接种意愿较强[36],因此在经济发达的地区可以针对人群特点加强宣传教育,考虑推行九价HPV疫苗接种计划。
综上所述,九价HPV疫苗在HPV6、11、16、18基因型可以产生与四价HPV相似的免疫效果,对HPV31、33、45、52、58基因型疫苗株的抗体阳性率远大于四价HPV疫苗组。九价HPV疫苗安全性良好,在适龄人群中推广接种,可以有效预防相关类型HPV所致宫颈及外生殖器病变。但本研究可纳入meta分析的研究数据有限,无法对某些效应指标合并效应统计量,且各研究随访时间有限及由于道德因素限制,不能发现九价HPV疫苗降低宫颈癌发病率与死亡率的确切证据。因此更精准的结论有待日后进行更多研究的证实,包括横断面调查证据。
| [1] | Bruni L, Barrinuevo-Rosas L, Albero G, et al. Human papillo-mavirus and related diseases report: Asia. summary report[EB/OL]. [2017 – 08 – 02]. http://www.hpvcentre.net/statistics/reports/XSX.pdf. |
| [2] | de Martel C, Plummer M, Vignat J, et al. Worldwide burden of cancer attributable to HPV by site, country and HPV type[J]. Int J Cancer, 2017, 141(4): 664–670. DOI:10.1002/ijc.v141.4 |
| [3] | Walboomers JM, Jacobs MV, Manos MM, et al. Human papillo-mavirus is a necessary cause of invasive cervical cancer world-wide[J]. J Pathol, 1999, 189(1): 12–19. DOI:10.1002/(ISSN)1096-9896 |
| [4] | Severini A, Jiang Y, Brassard P, et al. Type-specific prevalence of human papillomavirus in women screened forcevical cancer in Labrador, Canada[J]. Int J Circumpolar Health, 2013, 72(1): 1–3. |
| [5] | Baldur-Felskow B, Dehlendorff C, Munk C, et al. Early impact of human papillomavirus vaccination on cervical neoplasia-nationwide follow-up of young Danish women[J]. J Natl Cancer Inst, 2014, 106(3): djt460. DOI:10.1093/jnci/djt460 |
| [6] | Powell SE, Hariri S, Steinau M, et al. Impact of human papillo-mavirus (HPV) vaccination on HPV 16/18-related prevalence in precancerous cervical lesions[J]. Vaccine, 2012, 31(1): 109–113. DOI:10.1016/j.vaccine.2012.10.092 |
| [7] | Malagón T, Drolet M, Boily MC, et al. Cross-protective efficacy of two human papillomavirus vaccine: a systematic review and meta-analysis[J]. Lancet Infect Dis, 2012, 12(10): 781–789. DOI:10.1016/S1473-3099(12)70187-1 |
| [8] | Serrano B, Alemany L, Tous S, et al. Potential impact of nine-valent vaccine in human papillomavirus related cervical disease[J]. Infect Agent Cancer, 2012, 7(1): 38. DOI:10.1186/1750-9378-7-38 |
| [9] | Largenron N, Tetry K, Jacob JA, et al. Estimating the public health impact of a vaccination programme with a nonavalent HPV vaccine in Germany[J]. Value in Health, 2015, 18(7): A462–463. |
| [10] | Cochrane Collaboration. Cochrane handbook for systematic reviews of interventions[R]. Chichester: The Cochrane Collaboration and John Wiley and Sons Ltd, 2008. |
| [11] | Joura EA, Giuliano AR, Iversen OE, et al. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women[J]. N EngL J Med, 2015, 372(8): 711–723. DOI:10.1056/NEJMoa1405044 |
| [12] | Vesikari T, Brodszki N, Van Damme P, et al. A randomized, double-blind, phase Ⅲ study of the immunogenicity and safety of a 9-valent human papillomavirus L1 virus-like particle vaccine (V503) versus Gardasil® in 9 – 15 - year-old girls [J]. Pediatr Infect Dis J, 2015, 34(9): 992–998. DOI:10.1097/INF.0000000000000773 |
| [13] | Van Damme P, Meijer CJLM, Kieninger D, et al. A phase Ⅲ clinical study to compare the immunogenicity and safety of the 9-valent and quadrivalent HPV vaccines in men[J]. Vaccine, 2016, 34(35): 4205–4212. DOI:10.1016/j.vaccine.2016.06.056 |
| [14] | Huh WK, Joura EA, Giuliano AR, et al. Final efficacy, immuno-genicity, and safety analyses of a nine-valent human papillomavirus vaccine in women aged 16 – 26 years: a randomised, double-blind trial[J]. Lancet, 2017, 390(10108): 2143–2159. DOI:10.1016/S0140-6736(17)31821-4 |
| [15] | Garland SM, Cheung TH, Neill SM, et al. Safety and immuno-genicity of a 9-valent HPV vaccine in females12 – 26 years of age who previously received the quadrivalent HPV vaccine[J]. Vaccine, 2015, 33(48): 6855–6864. DOI:10.1016/j.vaccine.2015.08.059 |
| [16] | Petrosky E, Bocchini JA Jr, Harri S, et al. Use of 9-valent human papillomavirus (HPV) vaccine: updated HPV vaccination recommen-dation of the Advisory Committee on Immunization Practices[J]. MMWR Morb Mortal Wky Rep, 2015, 64(11): 300–304. |
| [17] | Centers for Disease Control and Prevention. HPV (human papillo-mavirus) VIS[EB/OL]. [2017 – 01 – 13]. http://www.cdc.gov/vaccines/hcp/viv/vis-statements/hpv.html. |
| [18] | de Sanjose S, Quint WG, Alemany L, et al. Human papillomavirus genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldwide study[J]. Lancet Oncol, 2010, 11(3): 1048–1056. |
| [19] | Joura EA, Ault Ka, Bosch FX, et al. Attribution of 12 high-risk human papillomavirus genotypes to infection and cervical disease[J]. Cancer Epidemiology Biomarkers Prev, 2014, 23(10): 1997–2008. DOI:10.1158/1055-9965.EPI-14-0410 |
| [20] | Garland SM, Pitisuttithum P, Ngan HYS, et al. Efficacy, immuno-genicity, and safety of a 9-valent human papillomavirus vaccine: subgroup analysis of participants from Asian countries[J]. J Infect Dis, 2018, 218(1): 95–108. DOI:10.1093/infdis/jiy133 |
| [21] | 鲍彦平, 李霓, 王鹤, 等. 中国妇女子宫颈人乳头瘤病毒型别分布的meta分析[J]. 中华流行病学杂志, 2007, 28(10): 941–946. DOI:10.3760/j.issn:0254-6450.2007.10.002 |
| [22] | 吴昕, 赵骏, 崔雪莲, 等. 广西壮族自治区柳州市18~45岁社区女性人乳头瘤病毒感染及型别分布的横断面调查[J]. 中华流行病学杂志, 2017, 38(4): 467–471. DOI:10.3760/cma.j.issn.0254-6450.2017.04.011 |
| [23] | Guevara A, Robinson C, Linn W, et al. Antibody persistence and evidence of immune memory at 5 years following administration of the 9-valent HPV vaccine[J]. Vaccine, 2017, 35(37): 5050–5057. DOI:10.1016/j.vaccine.2017.07.017 |
| [24] | Kjaer SK, Nyard M, Dillner J, et al. A 12-year follow-up on the long-term effectiveness of the quadrivalent human papillomavirus vaccine in Nordic countries[J]. ClinInfec Dis, 2018, 66(3): 339–345. |
| [25] | Van Damme P, Olsson SE, Block S, et al. Immunogenicity and safety of a 9-valent HPV vaccine[J]. Pediatrics, 2015, 136(1): e28–39. DOI:10.1542/peds.2014-3745 |
| [26] | Iversen OE, Miranda MJ, Ulied A, et al. Immunogenicity of the 9-valent HPV vaccine using 2-dose regimens in girls and boys vs 3-dose regimen in women[J]. JAMA, 2016, 316(22): 2411–2421. DOI:10.1001/jama.2016.17615 |
| [27] | Schilling A, Parra MM, Gutierrez M, et al. Coadministration of a 9-valent human papillomavirus vaccine with meningococcal and Tdap vaccines[J]. Pediatrics, 2015, 136(3): e563–572. DOI:10.1542/peds.2014-4199 |
| [28] | Kosalaraksa P, Mehlsen J, Vesikari T, et al. An open-label, randomized study of a 9-valent human papillomavirus vaccine given concomitantly with diphtheria, tetanus, pertussis and polio-myelitis vaccines to healthy adolescents 11 – 15 years of age[J]. Pediatr Infect Dis J, 2015, 34(6): 627–634. DOI:10.1097/INF.0000000000000694 |
| [29] | Wilkin T, Lee JY, Lensing SY, et al. Safety and immunogenicity of the quadrivalent human papillomavirus vaccine in HIV-1-infected men[J]. J Infect Dis, 2010, 202(8): 1246–1253. DOI:10.1086/653020 |
| [30] | Moreira ED, Block SL, Ferris D, et al. Safety profile of the 9-valent HPV vaccine: a combined analysis of 7 phase Ⅲ clinical trials[J]. Pediatrics, 2016, 138(2): e20154387. DOI:10.1542/peds.2015-4387 |
| [31] | Chesson HW, Markowitz LE, Hariri S, et al. The impact and cost-effectiveness of nonavalent HPV vaccination in the United States: estimates from a simplified transmission model[J]. Hum Vaccine Immunother, 2016, 12(6): 1363–1372. DOI:10.1080/21645515.2016.1140288 |
| [32] | Boiron L, Joura E, Largeron N, et al. Estimating the cost-effec-tiveness profile of a universal vaccination programme with a nine-valent HPV vaccine in Austria[J]. BMC Infect Dis, 2016, 16(1): 153. DOI:10.1186/s12879-016-1483-5 |
| [33] | Durham DP, Ndeffo-Mbah ML, Skrip LA, et al. National- and state-level impact and cost-effectiveness of nonavalent HPV vaccine in the United States[J]. Proc Natl Asad Sci USA, 2016, 113(18): 5107–5112. DOI:10.1073/pnas.1515528113 |
| [34] | 王雪敏, 冯向先, 翟艳丽, 等. 某市妇女子宫颈癌筛查及HPV疫苗认知调查[J]. 中国公共卫生, 2012, 28(5): 650–651. |
| [35] | 高莉, 邵英, 杨沧江, 等. 云南省农村妇女宫颈癌防治知识及影响因素分析[J]. 中国公共卫生, 2012, 28(3): 288–290. |
| [36] | 于兆佳, 陈禹存, 张丹丹, 等. 我国人乳头瘤病毒疫苗认知率与接受率的meta分析[J]. 中国卫生统计, 2017, 34(4): 578–582. |
 2019, Vol. 35
2019, Vol. 35


